香蒲浮床有机物去除能力及根表微生物群落结构
2017-06-13陈志远种云霄程冰冰张美玲吴学深
陈志远, 种云霄, 程冰冰, 张美玲, 吴学深, 林 硕
华南农业大学资源环境学院环境科学与工程系, 广东高校污水生态处理与水体修复工程技术研究中心, 广东 广州 510642
香蒲浮床有机物去除能力及根表微生物群落结构
陈志远, 种云霄*, 程冰冰, 张美玲, 吴学深, 林 硕
华南农业大学资源环境学院环境科学与工程系, 广东高校污水生态处理与水体修复工程技术研究中心, 广东 广州 510642
为探讨植物浮床有机物去除能力和根表细菌群落组成特点,选择香蒲为研究对象,通过对根系诱导扩增,构建根系覆盖度(遮光率)分别为50%、70%和90%的香蒲浮床系统,并对其CODCr去除能力及根系微生物群落结构开展系统研究. 结果表明,3个覆盖度系统的根系体积分别达到1.74、3.48、4.30 Lm2. 经过适应驯化,3个系统都可以有效地对人工模拟生活污水有机物进行去除,CODCr的单位面积负荷平均去除速率分别为8.28、8.78、13.46 g(m2·d);系统根系体积增加或加入一定体积的软性纤维填料都可以提高有机物去除能力. 基于各系统根系和填料表面微生物样品高通量测序结果显示,根系与填料表面细菌多样性及组成都有较大差异,根系细菌丰度及多样性均小于填料. 但在门水平上,根系和填料表面细菌优势类群相同,前2个优势菌门为变形菌门(Proteobacteria)和厚壁菌门(Firmicutes). 根系表面细菌群落优势菌种类(OTUs)较单一,各系统根表微生物仅由1~3个相对丰度在10%以上种类构成了优势种群,并且根系和填料优势种类具有较大的不同. 根系优势种类为Enterobacter、Acinetobacter、Clostridium属,代表序列OTUs2、OTUs4、和OTUs8,分别与Enterobacterludwigii、Acinetobactersoli、Clostridiumdiolis有着100%的匹配度;填料优势种为Bacillus、Pseudomonas属,代表序列OTUs3和OTUs11分别与BacillusfuniculusNAF001、Pseudomonasargentinensis具有非常高的相似度. 研究显示,根系经过诱导扩增的植物浮床系统对有机物具有较高的去除能力,与常规颗粒填料人工湿地相当,但根表微生物群落多样性较低,优势菌较单一,抗冲击负荷潜在能力较低.
植物浮床; 香蒲; CODCr; 细菌多样性; 高通量测序
植物浮床,也被称为悬浮人工湿地(floating constructed wetland),是将湿地植物悬浮栽培于水中形成的污水处理系统,植物根或根状茎部分淹没于水下,茎叶挺立在水面以上,通过人工固定措施使整个植株悬浮生长于水中[1]. 相比使用颗粒填料的传统人工湿地,这种系统构建使用更加灵活,在污水处理及污染水体修复中被广泛研究应用[2-3].
因为浮床植物快速生长可以大量吸收利用水中氮磷,所以氮磷的去除被认为是植物浮床主要的污水处理功能[1-2]. 与氮磷不同,有机物基本上不能被植物吸收利用,因此,有机物的去除在植物浮床中较少被关注. 实际上,通过植物根表附着的微生物代谢转化,植物浮床对污水有机物也具有去除能力[3-4],这种能力与根系生物量和附着微生物群落组成关系密切. 除了为微生物提供附着空间外,植物根系还可以通过分泌氧及次生代谢物等辅助微生物的代谢[5-6],因此根系生物量的多少将会影响附着微生物的量,进而影响有机物去除能力,是衡量植物浮床有机物去除能力的关键指标. 此外,作为微生物的附着载体,具有代谢活性的根系也不同于污水处理生物膜技术常用的无机填料,其上附着的微生物群落结构可能具有独特之处. 但目前,对于植物浮床,无论是根系生物量与有机物去除的关系还是其微生物组成特点都还缺少系统的研究.
该研究以具有庞大根系的典型湿地植物——宽叶香蒲(Typhalatifolia)为研究对象,通过对其根系诱导扩增,构建不同根系生物量的香蒲浮床系统,首先分析探讨根系生物量对其有机物去除能力影响,在此基础上进一步分析其微生物群落结构组成特性,以期为深入揭示植物浮床有机物去除机制提供参考.
1 材料与方法
1.1 试验材料与装置
试验用宽叶香蒲采自华南农业大学校园湿地,采回后将根部底泥清洗干净,放入Hoagland培养液[7]中进行生物量扩增.
试验装置由9个高45 cm左右、面积0.46 m2的大塑料箱和带竹竿的水泥桩组成(起固定作用),箱子分3组,每组用于培养不同根系生物量的系统. 香蒲直立茎通过纤维绳绑缚在水泥桩的竹竿上,横走根茎及上面分生的毛根悬浮在水中(见图1),进而形成悬浮生长的香蒲浮床系统.

图1 香蒲浮床示意Fig.1 The Schematic diagram of cattail aquaculture system
1.2 试验方法
1.2.1 根系扩增
在各箱中均匀固定10株生长较一致的香蒲,参考植物无土栽培中经典的根系诱导方法[7],加入低磷〔ρ(TP)低于0.01 mgL〕诱导营养液(配方见表1),水位控制在根系与水面刚接触为止,根系下保持1~2 cm的水深,扩增根系生物量不同的香蒲浮床系统.

表1 香蒲根系诱导培养的营养液组成
扩增过程中,为避免频繁测定对根的损伤,根系生物量变化用覆盖度来反映. 覆盖度用照度计快速测量,即测定根系下部靠近箱底的光照强度,将无植物系统的光照强度定为100%,则覆盖度为0,由于根系生长,覆盖度上升,透光度降低,如光照强度变为无植物系统的70%,则覆盖度为30%. 将3组系统的根系生物量扩增目标分别设定为50%、70%、90%三个覆盖度系统,达到目标后,利用排水法测算不同覆盖度根系的体积. 同时记录测量每个箱植物生物量总体湿质量和水面以上株数.
1.2.2 污水处理能力
试验用的污水模拟生活污水组成,采用化学试剂人工配制,ρ(CODCr)为100~120 mg/L,ρ(NH3-N)为10~15 mg/L,ρ(TP)为3~5 mg/L,ρ(TN)为20 mg/L,加入少量(约100 mL)污水处理厂污泥提供微生物种源.
污水处理采用序批式,每个系统一次性泵入15 L污水,各系统同时加入,水位控制在30~40 cm,刚好淹没根系,零散裸露的水面覆盖遮阳网,遮光避免藻类生长. 试验初期几批污水,系统微生物处于增长过程中,CODCr去除较慢,处理时间控制为48 h,并分别在0、5、10、24、36、48 h抽取根系下部20 mL水样测定ρ(CODCr),期间ρ(CODCr)降至50 mg/L后,停止该批污水处理,并更换新一批污水. 处理过6批水以后,各系统在24 h内的CODCr去除率已比较稳定,因此以24 h内CODCr的去除率和单位面积负荷平均去除速率〔即单位时间单位面积CODCr去除量,g/(m2·d)〕作为各系统有机物去除能力的指标;以每个系统统计连续4批污水的CODCr去除数率平均值作为该系统有机物去除率,在此基础上再统计计算每个覆盖度下3个重复系统的平均去除率. 每批污水处理过程中,水样采集同时利用便携式水质测定仪(上海雷磁)测定ρ(DO)、pH和Eh(氧化还原电位),测定仪探头深入根系下部,取10 min后的稳定数值.
此外,各系统CODCr去除率稳定后,向50%、70%覆盖度系统加入不同体积的软性塑料纤维填料(见图2),添加量分别为50%、70%覆盖度系统根系体积与90%覆盖度系统中根系体积差值,即在这两个系统中利用同等体积的无机填料替代根系作为微生物附着载体,然后继续进行污水序批式处理,直至加入填料后系统CODCr去除24 h内也达到稳定,同样采集连续四批污水处理数据进行统计处理.

图2 软性纤维填料Fig.2 The photo of soft fiber filler
浮床根系体积扩增和污水处理均在华南农业大学校内试验基地的网室(带顶棚四周通风)内进行,光照温度均为自然条件,试验季节为7—10月.
1.3 微生物群落结构组成分析
在污水处理结束后,在各覆盖度系统的3个重复组随机选取植物根系与填料各15~20 mL样品〔分别记为R50(50%覆盖系统根系样品)、R70(70%覆盖系统根系样品)、R90(90%覆盖系统根系样品)、P50(50%覆盖系统填料样品)、P70(70%覆盖系统填料样品)〕,混合后称量,放入50 mL无菌水中,振荡分离表面附着的细菌,获得菌液用于微生物群落结构组成分析.
微生物群落结构组成通过高通量测序进行分析,主要过程:商业试剂盒PowerSoilTM, MO BIO提取样品总DNA后,采用可对细菌16S rRNA V4区扩增的515F和806R引物进行PCR扩增,PCR产物采用IIluminaMiseq PE(paired end)250 bp进行多次测序,各样品测序数量达到接近饱和后,对所获得测序序列进行组装处理拼成完整片段,按97%序列相似度水平上划分OTUs(operational taxonomic units),每个OTUs代表序列和已知的16S rRNA通过与细菌分类基因数据库(RDP,EzTaxon等)[8]比对,进行OTUs分类注释,尽可能将其注释到种属水平,并计算不同分类等级的相对丰度. 每个样品序列被随机挑取用来计算Alpha多样性,不同样品间OUTs序列利用主成分分析进行群落结构多样性差异.
PCR、测序及序列前处理委托华大基因公司完成.
1.4 统计分析
使用IBM SPSS 19软件进行数据的统计分析,采用Duncan多重比较方法分析各组数据之间的差异性,其中P<0.05表明具有显著性差异.
2 结果与分析
2.1 扩增到不同覆盖度的根系体积
通过人工诱导,各系统新生的根生物量以纤细的毛根为主,粗大的根状茎较少,覆盖度由低到高(50%、70%、90%),单位面积根系生物量平均值分别为1.74、3.48、4.30 L/m2(见表2);50%覆盖度系统与其他两组相差较大,主要是由于纤细毛根遮光效应较低,高的覆盖度(遮光率)需要形成非常密集的根系,相应增加的根系体积量较多所致. 伴随根系生物量增加,各香蒲系统总鲜质量也相应增加;此外水面上株数也有增加, 但3个系统相差不大,无显著差异.

表2 不同香蒲根系覆盖度系统的香蒲株数、总鲜重与根系体积
注:a、b相同字母代表无显著性差异,不同字母代表代表存在显著性差异(P<0.05). 下同.
2.2 污水CODCr去除特点
由表3可见,各系统在24 h内都可以实现对CODCr的大幅去除(CODCr去除率70%以上),表明香蒲浮床的悬浮根系作为微生物生长载体,形成的处理系统可以有效地对污水有机物进行去除. 随着覆盖度由低到高,CODCr平均去除率和单位面积负荷平均去除速率都逐渐增大,其中90%覆盖度系统面积负荷去除速率显著高于其他两个系统,表明根系体积增加可以促进香蒲浮床系统对有机物去除. 而50%和70%覆盖度系统加入填料后,CODCr面积负荷去除速率也有显著增加,与90%根系系统接近. 可见,对于香蒲浮床系统,除了自身根系体积增加可以促进有机物的去除外,加入外源填料也有助于提高系统的有机物去除能力.
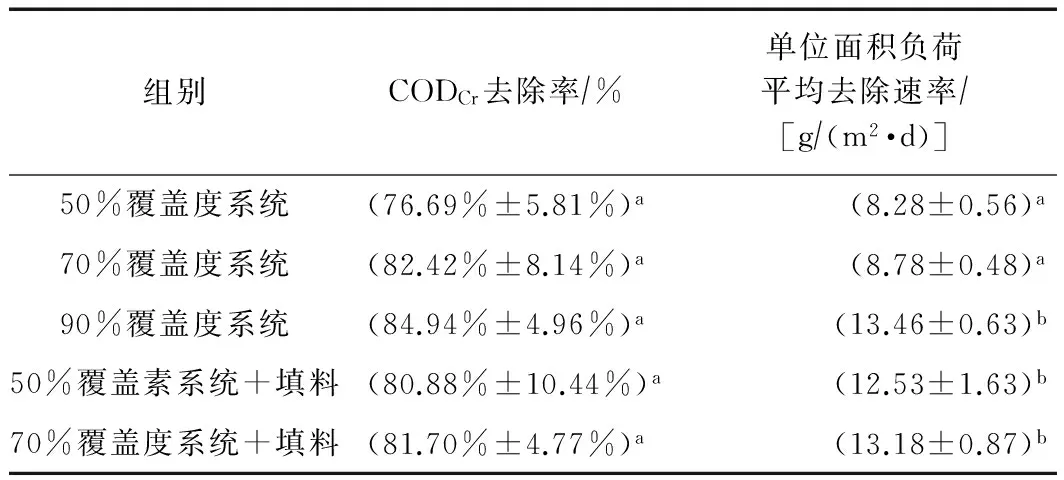
表3 不同根系覆盖度的香蒲水培根系24 h对污水CODCr去除效果
由图3可见,前10 h内各系统ρ(DO)逐渐下降,其中90%覆盖度系统下降最多,达到0.9 mg/L;但到24 h各系统ρ(DO)又回升至3.0 mg/L以上. 系统中DO补充有2个途径:大气复氧和香蒲根系释放,消耗则主要是微生物对有机物等的好氧降解. 前10 h是污水ρ(CODCr)快速下降的时期,去除率接近60%,此时ρ(DO)相应快速下降,应该是污水有机物被好氧微生物降解引起的DO的消耗,而后期,由于有机物浓度减少,DO消耗减少,从而ρ(DO)出现回升;总体来看,该研究各系统中随有机物的去除,ρ(DO)都维持在0 mg/L以上,表明在该研究设置的ρ(CODCr)(100 mg/L)下,依靠大气复氧和根系释放供应的DO可以满足有机物好氧降解所需,因此对有机物的去除主要以微生物的好氧降解为主.

图3 各系统污水处理过程中ρ(DO)随时间的变化Fig.3 Change of dissolved oxygen (DO)with time in cattail aquaculture systems with different root coverage
2.3 根系及填料表面细菌多样性
基于高通量测序的结果,各样品中细菌的OTUs数量以及基于OTUs数量和相对丰度的4个Alpha多样性指数如表4所示. 从表4可见,根系样品的OTUs数量、丰度指数、多样性指数均与填料样品存在较大差异. Chao和Ace是丰度指数,可以看出这2个指数在不同样品间变化与OTUs数量变化规律完全一致,都可以很好地反映样品的丰度;从数值比较可以看出,填料样品表面细菌丰度是根系样品的2倍以上,表明根系细菌丰度远低于填料,即填料表面附着的细菌群落有更多的微生物量. Shannon-Wiener多样性指数和Simpson指数主要反映细菌的多样性,是丰富度和均匀度的综合指标,前者数值越高,后者数值越低,表明样品物种多样性越高[9]. 从表4还可以看出,二者的值在填料和根系样品间变化具有一致性,填料样品Shannon-Wiener多样指数高于根系,Simpson指数低于根系,表明填料表面微生物组成多样性高于根系.
2.3.1 各样品间细菌组成的总体差异
基于各样品β多样性的bray_curtis指数进行主成分分析(见图4)表明,在贡献率最大的第一主成分(PC1)上,3个根系样品和2个填料样品间被明显分开,表明这2类样品细菌组成具有较大差异. 而2个填料样品在第一主成分上也有一定的距离,表明这2个样品间细菌组成也具有一定的差异. 3个根系样品在第一主成分上距离接近,表明细菌组成比较一致,差异性不大.

表4 不同根系覆盖度香蒲系统根际与填料表面细菌多样性

图4 基于OTUs丰度的PCA分析Fig.4 PCA analysis based on OTUs abundance
2.3.2 细菌群落结构组成
2.3.2.1 细菌门组成特点
从较高的分类等级门水平上来看,P50、P70、R50、R70、R90中OTUs所属细菌门的数量分别为22、19、14、13、10,填料样品高于根系,表明填料细菌门的多样性高于根系,与表4结果一致. 图5列出了各样品OTUs所属的主要细菌门(相对丰度1%以上)及相对丰度. 由图5可见,各样品相对丰度较高的优势菌门都是比较一致的,最高的都是变形菌门(Proteobacteria),其次是厚壁菌门(Firmicutes),这2个门相对丰度之和在各样品中都占60%以上,在根系样品中甚至达到90%以上,是绝对的优势菌门;此外,在填料样品中放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)也占有一定比例.
研究表明,包括人工湿地、活性污泥法等污水生物处理工艺中,细菌组成的优势菌门大部分是变形菌门和厚壁菌门[9-11],因此该研究中的香蒲浮床系统,根系表面微生物在门水平上组成与其他污水生物处理工艺具有相似性.

图5 不同系统填料和植物根系样品表面的优势细菌的相对丰度(门水平)Fig.5 Relative abundances of bacterial phyla on root surface and artificial carrier in cattail aquaculture systems with different root coverage
2.3.2.2 细菌种的组成特点
将各样品中每个OUTs的序列数与该样品总的序列数进行比较,可以得到每个OTUs即细菌种类的相对丰度. 分析计算结果表明,各样品中相对丰度在2%以上的细菌种类在总细菌种类中占比均在3%以下,但其序列数(反映细菌数量)之和占了总量的40%以上,在根系样品中甚至高达80%以上. 表5列出了各样品相对丰度在2%以上的OTUs的组成及可能对应的细菌种类. 由表5可见,每个样品都由相对丰度在10%以上的1~3个优势种占据了主体,这表明其中细菌群落的优势种比较单一. 此外,填料和根系样品优势种也不同.
2个填料样品的优势种具有相似性,第一大优势种为OTUs3,其在P50和P70上的相对丰度分别达到25.6%和13.9%,代表序列在Eztaxon数据库中与芽孢杆菌属(BacillusfuniculusNAF001)具有较高的序列匹配度,应该属于芽孢杆菌属Bacillus种类,该属种类多分布于土壤和植物根际,对有机物特别是纤维素类具有较强的分解能力[12]. P70上OTUs11相对丰度也在10%以上,代表序列在Eztaxon数据库中与假单胞菌属(Pseudomonasargentinensis)具有非常高的匹配度,应该是属于Pseudomonas,该属是一个在土壤、植物根际、河流底泥、污水处理厂活性污泥等多种环境中广泛存在的细菌类群,对于有机物特别是某些难降解有机物具有分解能力[12-13]. 可见填料样品中这2大优势种类,都是土壤、根际等环境中常见细菌种类.
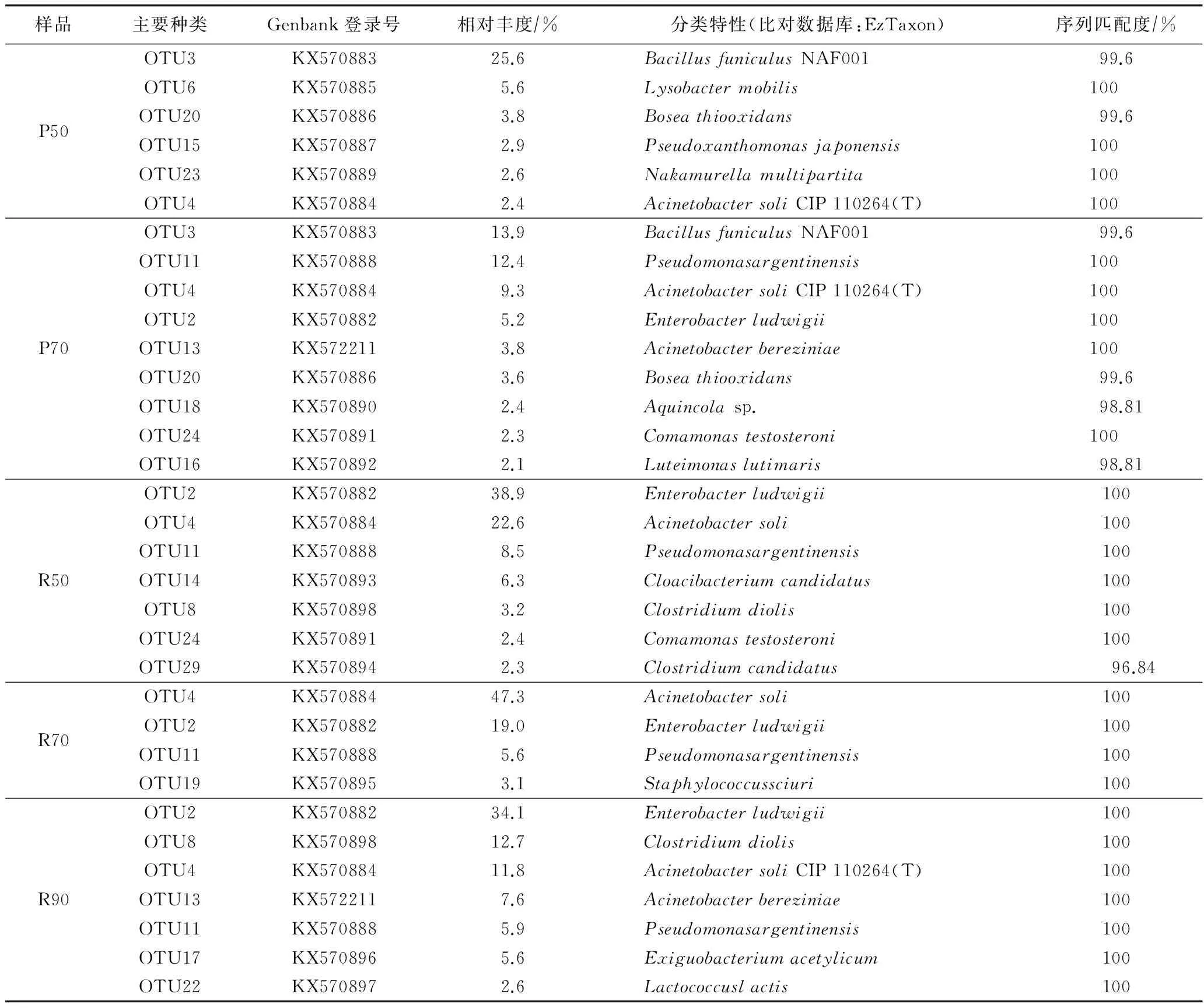
表5 各样品中主要细菌种类(相对丰度2%以上OTU)的组成
3个根系样品优势种也具有相似性,分别为OTUs2、OTUs4、和OTUs8,在Eztaxon数据库中它们分别与Enterobacterludwigii、Acinetobactersoli、Clostridiumdiolis有着100%的匹配度,前2个种类在R50和R70中占据了细菌总量的60%以上,而在R90中则是这3个之和占据了细菌总数的55%以上,可见这3个种是香蒲根系表面对有机物降解转化具有主导作用细菌种类. 这3种菌所在的属,也都是土壤、植物根际、活性污泥等环境中常见的细菌类群[13-16],特别是Acinetobacter属,很多种类被发现是植物根系内生菌重要组成,在香蒲根系内生菌中也被发现[11].
尽管根系和填料表面细菌占比较高的优势种不同,但各自的优势种在对方的微生物群落中也占有一定的比重,如填料表面的优势种OTUs11在3个根系样品中均有出现且相对丰度都高于5%;而根系表面的优势菌OTUs4在2个填料表面样品中相对丰度都比较高,表明这些优势种是整个香蒲浮床系统中有机物降解的主要种类.
3 讨论
3.1 香蒲浮床系统有机物去除能力
在传统颗粒基质床人工湿地中,植物根在颗粒空隙中生长,空间较小,根生物量的扩增受限制,相应也会影响根系表面微生物附着量,但颗粒表面可以为微生物生长提供空间,附着生长较多的微生物,因此具有较高的有机物去除能力[17,24-25]. 而植物浮床的根悬浮于水中,根生长不受空间限制,通常可以发育出密集的根系[1,4],相比于传统人工湿地植物根系,可以附着生长更多的微生物,具备有机物去除能力. 该研究中通过诱导形成的根系覆盖度为50%、70%、90%的香蒲浮床系统,都能够有效地去除水中的有机物,其CODCr面积负荷去除速率分别为(8.28±0.56)(8.78±0.48)(13.46±0.63)g/(m2·d). 为了评估其有机物去除能力,通过查阅传统人工湿地污水处理相关文献,总结了多个使用颗粒填料的传统人工湿地系统CODCr面积负荷去除速率[18-45],并绘制了带正态分布曲线的直方图(见图6),从图6可见,CODCr面积负荷去除率在10 g/(m2·d)左右的系统占了大部分,只有少部分系统能够达到更高. 从这些数据可以看出,该研究香蒲浮床系统对污水有机物的去除能力与大部分使用填料的传统人工湿地相当,表明具有密集根系的植物浮床系统同样具有较高的有机物去除能力,可以承担污水有机物的去除.
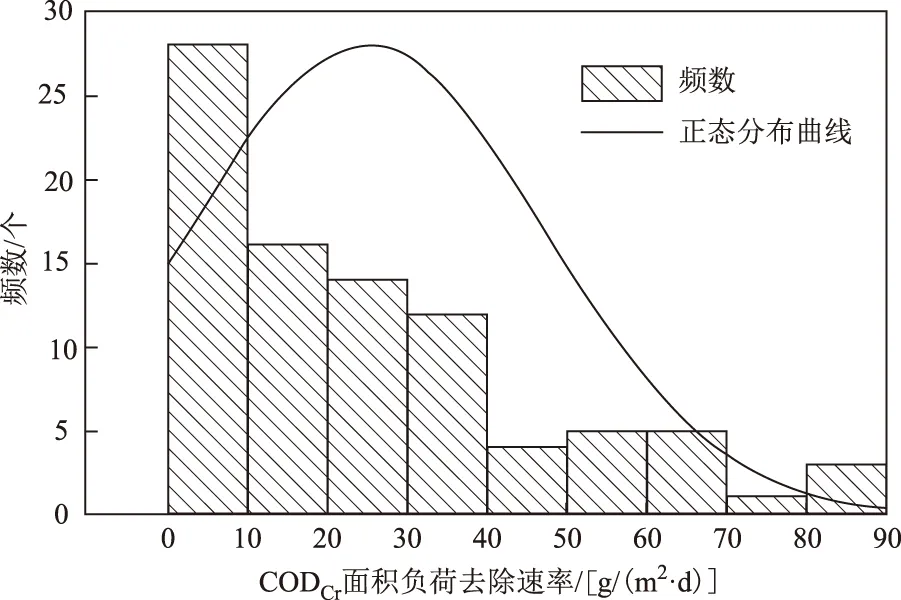
注:数据来源于文献[17-45].图6 人工湿地系统CODCr面积负荷去除速率的带正态分布曲线的直方图Fig.6 Histogram of normal distribution curve of CODCrunitload removal rate in constructed wetland system
3.2 香蒲浮床系统根系微生物群落特点
3.2.1 根系表面细菌多样性较低
高通量测序结果表明,香蒲浮床系统根系表面细菌多样性低于填料表面,这应该与微生物附着的表面环境特点有关. 对于根系来说,植物茎叶光合作用产生氧气能够向根部传输,并且会从根内部向外释放,因此植物根系表面细菌生长空间范围内应该呈较强的好氧状态[46],环境条件较单一,微生物组成也相对单一;而无机填料本身不释放氧,表面微生物代谢所需的氧来自水中,氧是从外层微生物向内扩散,越接近内部氧浓度越低,可能为厌氧状态,使得填料表面微生物附着空间内环境条件多样[47],因此,细菌组成上也会比较多样.
总体来看,香蒲浮床系统根系或填料表面细菌多样性也远远低于活性污泥. ZHANG等[13]利用454焦磷酸测序技术对15个城市污水处理厂污泥的细菌多样性分析发现,获得的序列可划分出OTUs数量处于1 183~3 567之间;曾妮[9]同样利用高通量IIlumina Miseq测序对重庆某A2/O工艺的污水处理厂好氧池污泥细菌多样性进行分析,获得序列可以划分为2 947个OTUs;而该研究中,根系和填料样品高通量测序,所获得序列划分OTUs数量在268~601之间,远低于文献[9,13]的研究结果. OTUs在一定程度上可以看作是不同的细菌种类,这表明,该研究香蒲浮床系统根系或填料表面细菌多样性远远低于活性污泥. 除了根系表面环境条件较单一的原因外,可能也跟根系自身的生理代谢活性有关,根系作为植物生长重要的器官,承担着吸收氮磷营养物质的功能,同时也通过呼吸代谢作用维持自身的生长,这些过程中可能会释放一些次生代谢物质到周围环境中,如小分子有机酸等,会对微生物类群产生一定的选择作用[48]. 该研究中,人工配制污水采用的是广州大坦沙污水处理厂(A2/O工艺)好氧池污泥作为微生物种源,根系表面的环境条件和代谢活动可能导致种源中细菌仅有部分可以适应,因此多样性降低.
3.2.2 根系表面微生物群落优势菌种类较单一
香蒲浮床根系表面细菌群落中优势菌种类较单一. 该研究中,香蒲浮床系统根系少数菌(1~3个)具有非常高的相对丰度,这意味着污水有机物的降解主要依靠这几个优势菌完成. 但是,优势菌较单一的微生物群落通常对于不利环境条件的抵抗能力比较差,对于污水处理系统,意味着其不能有效地缓冲污水处理过程中的冲击负荷,一旦这些优势菌生长代谢受到污水中某些毒害性物质的抑制,整个处理系统则会出现崩溃. 此外,植物本身对毒害性物质也比较敏感,因此植物浮床系统应避免用于包含较多毒害性污染物的工业废水等有机物的处理. 而加入的软性纤维填料尽管其优势菌相对丰度也比较高,但多样性还是高于根系,因此抗冲击能力潜力应该也高于根系,可以考虑作为植物浮床系统有机物去除的增效措施.
4 结论
a) 经过诱导后,覆盖度(遮光度)分别为50%、70%和90%的香蒲浮床系统根系体积分别达到1.74、3.48、4.3 L/m2. 经过适应驯化,3个系统都可以有效地对人工模拟生活污水有机物进行去除,CODCr的单位面积负荷平均去除速率分别为8.28、8.78、13.46 g/(m2·d);系统根系体积增加或加入一定体积的软性纤维填料都可以提高有机物去除能力.
b) 高通量测序所获得OTUs数量及分类注释结果表明,香蒲浮床系统根系与加入软性填料表面细菌多样性及组成都有较大差异,根系细菌丰度及多样性指数均小于填料. 但在门水平上看,根系和填料表面细菌组成的优势菌类群相同,第一优势菌门是变形菌门(Proteobacteria),其次是厚壁菌门(Firmicutes).
c) 系统根表细菌群落优势菌种类(OTUs)较单一,各系统根表微生物仅由1~3个相对丰度在10%以上种类构成了优势种群. 根系和填料优势种类具有较大的不同,根系优势种类分别为Enterobacter、Acinetobacter、Clostridium属的种类;填料优势种为Bacillus、Pseudomonas属.
[1] WHITE S A,COUSINS M M.Floating treatment wetland aided remediation of nitrogen and phosphorus from simulated storm water runoff[J].Ecological Engineering,2013,61:207- 215.
[2] 范洁群,邹国燕,宋祥甫,等.不同类型生态浮床对富营养河水脱氮效果及微生物菌群的影响[J].环境科学研究,2011,28(8):850- 856. FAN Jiequn,ZOU Guoyan,SONG Xiangfu,etal.Effects of FCEFB and TFB on the nitrogen removal and nitrogen cycling microbial community in a eutrophic river[J].Research of Environmental Sciences,2011,28(8):850- 856.
[3] 宋海亮.水生植物滤床技术改善富营养化水体水质的研究[D].南京:东南大学,2005:14- 57.
[4] SAEED T,PAUL B,AFRIN R,etal.Floating constructed wetland for the treatment of polluted river water: a pilot scale study on seasonal variation and shock load[J].Chemical Engineering Journal,2016,287:62- 73.
[5] IJAZ A,SHABIR G,KHAN Q M,etal.Enhanced remediation of sewage effluent by endophyte-assisted floating treatment wetlands[J].Ecological Engineering,2015,84:58- 66.
[6] LADISLA S,GERENTE C,CHAZARENC F,etal.Floating treatment wetlands for heavy metal removal in highway storm water ponds[J].Ecological Engineering,2015,80:85- 91.
[7] 连兆煌.无土栽培原理与技术[M].北京:中国农业出版社,1994:15- 30.
[8] KIMO S,CHOY J,LEE K,etal.Introducing EzTaxon: a prokaryotic 16S rRNA Gene sequence database with phylotypes that represent uncultured species[J].International Journal of Systematic and Evolutionary Microbiology,2012,62:716- 721.
[9] 曾妮.污水处理厂微生物群落机构组成及胞外聚合物组成成分分析[D].重庆:重庆大学,2015:15- 17.
[10] 熊薇,郭逍宇,赵霏.湿地芦苇根结合好气细菌群落时空分布及其与水质因子的关系[J].生态学报,2013,33(5):1443- 1455. XIONG Wei,GUO Xiaoyao,ZHAO Fei.Spatialtemporal variation of root-associated aerobic bacterial communities of Phragmites australis and the linkage of water quality factors in constructed wetland[J].Acta Ecologica Sinica,2013,33(5):1443- 1455.
[11] 张瑞杰,张琼琼,黄兴如,等.再生水湿地香蒲根内生细菌群落多样性及其水质特征分析[J].中国环境科学,2016,36(3):875- 886. ZHANG Ruijie,ZHANG Qiongqiong,HUANG Xingru,etal.Endophytic bacterial diversity in roots of typha and the relationship of water quality factors in reclaimed water replenishment constructed wetland.[J].China Environmental Science,2016,36(3):875- 886.
[12] MIZUKI E,MAEDA M,TANAK R,etal.Bacillus thuringiensis: a common member of microflora in activated sludges of a sewage treatment plant[J].Current Microbiology,2001,42:422- 425.
[13] ZHANG T,SHAO M F,LIN Y.454 pyrosequencing reveals bacterial diversity of activated sludge from 14 sewage treatment plants[J].The ISME Journal,2012,6:1137- 1147.
[14] KIM D,BAIK K S,MI S K,etal.Acinetobactersoli sp.nov.,isolated from forest soil[J].Journal of Microbiology,2008,46(4):396- 401.
[15] POLETO L,SOUZA P,MAGRINI F E,etal.Selection and identification of microorganisms present in the treatment of wastewater and activated sludge to produce biohydrogen from glycerol[J].International Journal of Hydrogen Energy,2016,41:4374- 4381.
[16] SANTOS L A,FERREIRA V,NETO M M,etal.Study of 16 Portuguese activated sludge systems based on filamentous bacteria populations and their relationships with environmental parameters[J].Applied Microbiology and Biotechnology,2015,99:5307- 5316.
[17] COLEMAN J,HENCH K,GARBUTT K,etal.Treatment of domestic wastewater by three plant species in constructed wetlands[J].Water, Air,& Soil Pollution,2001,128(3):283- 295.
[18] HURTT D O,MORRIS S G,SMITH G,etal.Nitrogen and phosphorus removal from plant nursery runoff in vegetated and unvegetated subsurface flow wetlands[J].Water Research,2005,39(14):3259- 3272.
[19] PAULDANIEL S,CHRISTIAN W,REINHARD R.Constructed wetlands as a treatment method for effluents from intensive trout farms[J].Aquaculture,2008,277(3):179- 184.
[20] 任拥政,章北平,海本增.局部充氧提高波形潜流人工湿地除污效能的研究[J].中国给水排水,2007,23(11):28- 46. REN Yongzhen,HANG Beiping,HAI Benzeng.Study on improvement of pollutants removal efficient by partial aeration wavy subsurface-flow constructed wetland[J].China Water and Wastewater,2007,23(11):28- 46.
[21] 聂志丹,年跃刚,金相灿,等.3种类型人工湿地处理富营养化水体中试比较研究[J].环境科学,2007,28(8):1675- 1680. NIE Zhidan,NIAN Yuegang,JIN Xiangcan,etal.Pilot-scale comparison research of different constructed wetland types to treateutrophic lake water[J].Environmental Science,2007,28(8):1675- 1680.
[22] 项学敏,杨洪涛,周集体,等.人工湿地对城市生活污水的深度净化效果研究:冬季和夏季对比[J].环境科学,2009,30(3):713- 719. XIANG Xuemin,YANG Hongtao,ZHOU Jiti,etal.Performance of constructed wetland for municipal wastewater tertiary treatment: winter and summer comparison[J].Environmental Science,2009,30(3):713- 719.
[23] RIZZOA A,LANGERGRABER G.Novel insights on the response of horizontal flow constructed wetlands to sudden changes of influent organic load: a modeling study[J].Ecological Engineering,2016,93:242- 249.
[24] HENRICHS M,LANGERGRABER G,UHL M,etal.Modelling of organic matter degradation in constructed wetlands for treatment of combined sewer overflow[J].Ecological Engineering,2007,380:196- 209.
[25] FAN Jinlin,ZHANG Jian,GUO Wenshan.Enhanced long-term organics and nitrogen removal and associated microbial community in intermittently aerated subsurface flow constructed wetlands[J].Bioresource Technology,2016,214:871- 875.
[26] LU Shibao,ZHANG Xiaoling,WANG Jianhua,etal.Impacts of different media on constructed wetlands for rural household sewage treatment[J].Journal of Cleaner Production,2016,127:325- 330.
[27] WU Qing,HU Yue,LI Shuqun,etal.Microbial mechanisms of using enhanced ecological floating beds for eutrophic water improvement[J].Bioresource Technology,2016,211:451- 456.
[28] LI Jiake,LIANG Zheng,GAO Zhixin,etal.Experiment and simulation of the purification effects of multi-level series constructed wetlands on urban surface runoff[J].Ecological Engineering,2016,91:74- 84.
[29] CARBALLEIRA T,RUIZ I,SOTO M.Effect of plants and surface loading rate on the treatment efficiency of shallow subsurface constructed wetlands[J].Ecological Engineering,2016,90:203- 214.
[30] CAKIR R,GIDIRISLIOGLU A,CEBI U.A study on the effects of different hydraulic loading rates (HLR) on pollutant removal efficiency of subsurface horizontal-flow constructed wetlands used for treatment of domestic wastewaters[J].Journal of Environmental Management,2015,164:121- 128.
[31] VERGELES Y,VYSTAVNA Y,ISHCHENKO A,etal.Assessment of treatment efficiency of constructed wetlands in East Ukraine[J].Ecological Engineering,2015,83:159- 168.
[32] SEHAR S,SUMERA,NAEEM S,etal.A comparative study of macrophytes influence on wastewater treatment through subsurface flow hybrid constructed wetland[J].Ecological Engineering,2015,81:62- 69.
[33] SHIH P K,CHANGW L.The effect of water purification by oyster shell contact bed[J].Ecological Engineering,2015,77:382- 390.
[34] FOLADRI P,RUABEN J,ORTIGARA A R C.Batch feed and intermittent recirculationto increase removed loads in a vertical subsurface flow filter[J].Ecological Engineering,2014,70:124- 132.
[35] BILHIN M,SIMSEK I,TULUN S.Treatment of domestic wastewater using a lab-scale activated sludgevertical flow subsurface constructed wetlands by usingCyperusalternifolius[J].Ecological Engineering,2014,70:362- 365.
[36] HE G,YI F,ZHOU S,etal.Microbial activity and community structure in two terrace-type wetlands constructed for the treatment of domestic wastewater[J].Ecological Engineering,2014,67:198- 205.
[37] WU Haiming,FAN Jinling,ZHANG Jian,etal.Intensified organics and nitrogen removal in the intermittent-aerated constructed wetland using a novel sludge-ceramsite as substrate[J].Bioresource Technology,2016,210:101- 107.
[38] HE Yuan,WANG Yuhui,SONG Xinshan.High-effective denitrification of low CN wastewater by combined constructed wetland and biofilm-electrode reactor (CW-BER)[J].Bioresource Technology,2016,203:245- 251.
[39] UGGETTI E,HUGHLES-RILEY T,MORRIS R H,etal.Intermittent aeration to improve wastewater treatment efficiency in pilot-scale constructed wetland[J].Science of the Total Environment,2016,559:212- 217.
[40] 陈进军,郑翀,郑少奎.表面流人工湿地中水生植被的净化效应与组合系统净化效果[J].环境科学学报,2008,28(10):2029- 2035. CHEN Jinjun,ZHENG Chong,ZHENG Shaokui.Pollutant purification performance of a surface flow constructed wetland with different aquatic macrophytes[J].Acta Scientiae Circumstantiae,2008,28(10):2029- 2035.
[41] 史鹏博,朱洪涛,孙德智.人工湿地不同填料组合去除典型污染物的研究[J].环境科学学报,2014,34(3):704- 711. SHI Pengbo,ZHU Hongtao,SUN Dezhi.Removal efficiency of typical pollutants by different substrate combinations for constructed wetlands[J].Acta Scientiae Circumstantiae,2014,34(3):704- 711.
[42] 叶捷,彭剑峰,高红杰,等.低温下潮汐流人工湿地系统对污水净化效果[J].环境科学研究,2011,24(3):294- 300. YE Jie,PENG Jianfeng,GAO Hongjie,etal.Wastewater purification efficiency by tidalflow constructed wetland system in low temperature seasons[J].Research of Environmental Sciences,2011,24(3):294- 300.
[43] 张建,何苗,邵文生,等.人工湿地处理污染河水的持续性运行研究[J].环境科学,2006,27(9):1760- 1764. ZHANG Jian,HE Miao,SHAO Wensheng,etal.Sustainable operation of subsurface constructed wetland treating polluted river water[J].Environmental Science,2006,27(9):1760- 1764.
[44] 丁晔,韩志英,吴坚阳,等.不同基质垂直流人工湿地对猪场污水季节性处理效果的研究[J].环境科学学报,2006,26(7):1093- 1100. DING Ye,HAN Zhiying,WU Jianyang,etal.Seasonal performances of three vertical-flow constructed wetlands filled with different packing materials for piggery wastewater treatment[J].Acta Scientiae Circumstantiae,2006,26(7):1093- 1100.
[45] 刘超翔,胡洪营,张建,等.不同深度人工复合生态床处理农村生活污水的比较[J].环境科学,2003,24(5):92- 96. LIU Chaoxiang,HU Hongying,ZHANG Jian,etal.Rural sewage treatment performance of constructed wetlands with different depths[J].Environmental Science,2003,24(5):92- 96.
[46] 王文林,韩睿明,王国祥,等.湿地植物根系泌氧及其在自然基质中的扩散效应研究进展[J].生态学报,2015,35(22):7286- 7297. WANG Wenlin,HAN Ruiming,WANG Guoxiang,etal.Research advancements on the radial oxygen loss in wetland plants and its diffusion effect in natural sediments[J].Acta Ecologica Sinica,2015,35(22):7286- 7297.
[47] 周律,李哿,SHIN Hangsik,等.污水生物处理中生物膜传质特性的研究进展[J].环境科学学报,2011,31(8):1580- 1586 . ZHOU Lü,LI Ge,SHIN Hangsik,etal.Research progresson mass transfer in biofilms for wastewater treatment[J].Acta Scientiae Circumstantiae,2011,31(8):1580- 1586.
[48] 吴林坤,林向民,林文雄.根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J].植物生态学报2014,38(3):298- 310. WU Linkun,LIN Xiangmin,LIN Wenxiong.Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates[J].Chinese Journal of Plant Ecology,2014,38(3):298- 310.
CODCrRemoval and Rhizoplane Bacterial Diversity in the Cattail Aquaculture Systems
CHEN Zhiyuan, CHONG Yunxiao*, CHENG Bingbing, ZHANG Meiling, WU Xueshen, LIN Shuo
Engineering Research Center for Wastewater Ecological Treatment and Water Body Remediation of Guangdong Higher Education Institutes, College of Natural Resources and Environment of South China Agricultural University, Guangzhou 510642, China
Cattail aquaculture systems with three different root coverages (shading rates) of 50%, 70% and 90% were constructed by root induced amplification, and the CODCrremoval capacity and bacteria diversity on root surface of the cattail roots were investigated. The results showed that the root volumes were 1.74, 3.48 and 4.30 L/m2, which corresponded to the 50%, 70% and 90% root coverage systems, respectively. Moreover, the three systems all performed effectively in removing organic compounds in artificial sewage, with CODCrremoval rates of 8.28, 8.78 and 13.46 g/(m2·d) in the 50%, 70% and 90% root coverage systems, respectively. This indicated that organic removal capacity could be enhanced by increasing the root volume or adding fiber packing. In addition, the analysis of IIluminaMiseq PE sequencing data found that the diversity and composition of bacteria on the root surface and packing surface significantly differed among the three different systems. Though the dominated bacteria in phylum level were similar, among which Proteobacteria and Firmicutes were the most abundant phylum, the richness of bacteria in the root samples was lower than that in the packing samples. The constitution of dominate bacteria (OTUs) on the root surface was quite simple, which was composed by 1-3 top abundant OTUs with relative abundance over 10%. Furthermore, the types of dominate species differed between samples from root and parking.Enterobacter,AcinetobacterandClostridiumwere dominate genera in root samples, in which OTUs2, OTUs4 and OTUs8 were representative sequencing with 100% similarity toEnterobacterludwigii,AcinetobactersoliandClostridiumdiolis, respectively. By contrast,BacillusandPseudomonaswere dominant genera in packing samples, in which OTUs3 and OTUs11 were representative sequencing with fairly high similarity toBacillusfuniculusNAF001 andPseudomonasargentinensis.
floating constructed wetland; cattail; CODCr; bacteria diversity; IIluminaMiseq PE sequencing
2016-08-05
2017-03-02
国家自然科学基金项目(51378226);华南农业大学大学生创新创业训练计划项目(201410564064)
陈志远(1995-),男,河南驻马店人,chenqianzhiyuan@163.com.
*责任作者,种云霄(1974-),女,河北衡水人,副教授,博士,主要从事水污染防治生态技术研究,cyx04@scau.edu.cn
X703
1001- 6929(2017)06- 0943- 10
A
10.13198/j.issn.1001- 6929.2017.02.13
陈志远,种云霄,程冰冰,等.香蒲浮床有机物去除能力及根表微生物群落结构[J].环境科学研究,2017,30(6):943- 952.
CHEN Zhiyuan,CHONG Yunxiao,CHENG Bingbing,etal.CODCrremoval and rhizoplane bacterial diversity in the cattail aquaculture systems[J].Research of Environmental Sciences,2017,30(6):943- 952.