基于菌藻对比培养方法的洱海沉积物溶解性有机氮生物有效性评价
2017-06-13许可宸王圣瑞王曙光钱伟斌李文章史玲珑
许可宸, 张 莉, 王圣瑞*, 王曙光, 钱伟斌, 李文章, 史玲珑
1.北京化工大学, 北京 100029 2.中国环境科学研究院, 环境基准与风险评估国家重点实验室, 北京 100012 3.中国环境科学研究院, 国家环境保护湖泊污染控制重点实验室, 湖泊生态环境创新基地, 北京 100012
基于菌藻对比培养方法的洱海沉积物溶解性有机氮生物有效性评价
许可宸1,2,3, 张 莉2,3, 王圣瑞2,3*, 王曙光1, 钱伟斌2,3, 李文章2,3, 史玲珑2,3
1.北京化工大学, 北京 100029 2.中国环境科学研究院, 环境基准与风险评估国家重点实验室, 北京 100012 3.中国环境科学研究院, 国家环境保护湖泊污染控制重点实验室, 湖泊生态环境创新基地, 北京 100012
为了深入探究DON(溶解性有机氮)在湖泊水生生态系统中的重要营养作用和生态效应,寻找科学的DON生物有效性评价方法,选择洱海不同湖区表层沉积物样品,通过室内接种细菌和铜绿微囊藻进行对比培养,运用三维荧光-平行医疗法(3D EEM-PARAFAC)研究菌藻对比培养条件下湖泊沉积物DON生物有效性及各DON荧光组分生物有效性差异. 结果表明:①藻类培养条件下洱海表层沉积物DON生物有效性(8.49%~42.5%)略低于细菌培养条件下的生物有效性(10.5%~45.3%). ②藻培养条件下,DON生物利用率与藻细胞密度增长量呈显著正相关,即藻细胞密度的增长量可作为反映沉积物DON生物有效性的指标. ③菌类培养过程中DON光谱学特征参数〔如SUVA254(254 nm处紫外吸收光谱系数)、SR(275~295 nm处吸收光谱系数与350~400 nm处吸收光谱系数比值)等〕与DON含量相关性总体较细菌培养好;培养液中SUVA254有不同程度下降,SR指数均有上升,大分子DON和高芳香性DON可被微生物降解. 相比于陆源荧光组分,内源荧光组分的生物有效性较差. ④相比而言,藻类培养方法能更直观地反映沉积物DON对藻类生长的影响,可在一定程度上作为衡量湖泊沉积物DON生物有效性的指标,即藻类培养方法更适合评价洱海沉积物DON生物有效性.
溶解性有机氮; 沉积物; 生物有效性; 菌藻对比培养; EEM-PARAFAC
DON(溶解性有机氮)是湖泊沉积物氮的重要组成部分[1],对湖泊富营养化具有重要影响[2]. DON生物有效性是指生物对DON的可利用程度,可用DON的可利用量占DON总量的百分比来表示[3]. 因此,认识、评价湖泊沉积物DON生物有效性,是评估沉积物内负荷对湖泊富营养化贡献的重要内容之一. 目前关于水体DON的生物有效性已有大量报道,但沉积物DON生物有效性的研究尚处于起步阶段[4-5]. 与上覆水相比,沉积物成分复杂,且沉积环境千差万别,目前尚无标准的生物有效性评价方法. 生物培养法由于其具有直观且可量度等优点,是常被用来评价某一物质生物有效性的方法. 目前关于DON生物有效性的研究多采用接种微生物和淡水藻类的方法评价DON生物有效性[6],而对于两种评价方法的效果及差异方面的研究较为缺乏.
通过PARAFAC(平行因子分析法)来解析三维荧光光谱的组分最初是由Stedmon等[7]提出并应用到自然界DOM(溶解性有机物)的研究中. 之后国内外众多学者应用该方法研究水体以及沉积物中DOM的三维荧光光谱特征. YAO等[8-9]利用EEM-PARAFAC手段对鄱阳湖以及太湖的水体中DOM的来源及演变进行了解析;Osburn等[10]利用该方法研究Neuse River Estuary区域风暴前后DOM的变化情况. 相比传统的荧光峰分类方法,PARAFAC可以更准确的确定样本中DOM的种类、来源等性质. DON作为DOM的重要组成部分,成分非常复杂,传统的研究手段只能定义DON中约30%的成分[11]. 荧光光谱法之所以能够对之前未定义的DON成分进行分析,是因为大部分的DON会和腐殖质物质或类蛋白物质结合在一起[12]. 已经有大量研究[13-15]利用荧光光谱法这种简单高效的手段对DON进行全面分析,并广泛应用对DON的结构及来源研究中. 该研究中利用荧光光谱结合PARAFAC法,对不同的菌藻比对培养阶段提取的样本中的DON组分进行表征分析,探究不同组分的种类、来源以及它们在培养过程中的变化情况.
洱海位于中国云南西部大理白族自治州境内(25°25′N~26°16′N、99°32′E~100°27′E),地处澜沧江、金沙江和元江三大水系分水岭地带,流域面积2 565 km2,是云贵高原第二大淡水湖. 洱海水质介于GB 3838—2002《地表水环境质量标准》要求的Ⅱ类水质到Ⅲ类水质之间,但沉积物氮磷污染严重,其w(TN)为2 354~6 174 mgkg,并且不同湖区差异较大[16]. 程杰等[17]研究发现洱海南部水深较浅,有水生植物分布;中部处于环流下缘,水深较深,无水生植物;北部是入湖口,沉水植物丰富,受农业面源污染影响较为严重.洱海沉积物DON主要由大分子物质组成,芳香性及腐殖化程度相对较高,对维持洱海较好水质具有一定的积极作用. 但近年来洱海营养盐含量不断升高,沉积物内源释放对水体ρ(TN)的影响加剧[16]. 因此,为深入评估洱海沉积物DON对富营养化的贡献,有必要通过接种微生物培养定量分析洱海沉积物DON生物有效性.
该研究拟通过室内接种细菌和接种铜绿微囊藻,对比研究两种培养条件下沉积物DON降解利用差异,通过三维荧光光谱和紫外-可见光吸收光谱两种手段结合平行因子法,综合表征培养过程中沉积物DON结构变化特征,以期深入理解DON在湖泊水生生态系统中重要营养作用和生态效应,为进一步揭示洱海富营养化机理提供科学依据.
1 材料与方法
1.1 研究区域概况及样品采集
根据洱海地理位置、湖底地形及环境条件,将其分为北、中、南三个湖区(见图1),选取表层沉积物为研究对象,即北部46#采样点、中部105#采样点、南部142#采样点,具体位置见图1. 142#采样点w(DOC)(DOC为溶解性有机碳)和w(DON)为最高,分别达670.5和59.1 mgkg,46#采样点次之,其值分别为602.3和53.3 mgkg,二者的w(TDN)(TDN为总溶解性氮)基本持平(123.0~124.0 mgkg). 105#采样点的基本理化指标为最低,w(DOC)、w(TDN)和w(DON)分别为395.9、85.8和30.8 mgkg. 于2014年9月利用彼得森采泥器采集表层(0~10 cm)沉积物样品,将采集的样品现场装入塑料袋中密封,在恒温箱中4 ℃下避光保存,部分沉积物鲜样带回实验室经冷冻干燥、研磨、过150 μm筛、并用超高压灭菌技术[18]再次灭菌后用于配备生物培养液. 另取部分沉积物鲜泥用于细菌培养试验.

注:图中数值代表水深,单位为m.图1 洱海沉积物采样点Fig.1 Sediment sampling sites in Erhai Lake
1.2 研究方法
1.2.1ρ(DOC)、ρ(DON)的测定
将过筛沉积物样品与无菌Milli-Q超纯水按V(水)∶V(土)为10∶1的比例充分混合后,置于恒温摇床中在20 ℃、220 rmin条件下振荡16 h,以10 000 rmin离心10 min,上清液过玻璃纤维滤膜(GFF,Whatman,450 ℃下灼烧4 h),一部分滤液用于DON培养试验,一部分用于测定ρ(TDN)、ρ(NH4+-N)与ρ(NO3-N),分别采用文献[19]中的碱性过硫酸钾氧化法、纳氏试剂分光光度法和盐酸-氨基磺酸紫外分光光度法测定.ρ(DON)为ρ(TDN)与ρ(溶解性无机氮)〔ρ(NH4-N)与ρ(NO3-N)之和〕的差值.ρ(DOC) 采用TOC分析仪(Shimadzu,Japan)高温催化氧化法测定.
1.2.2 光谱结构测定
紫外吸收特征使用Agilent 8453紫外-可见分光光度计(美国)分析,光谱采集范围为200~700 nm,扫描间隔为1 nm,使用1 cm石英比色皿在室温下完成紫外-可见光谱的采集. 在254、280 nm处分别测定各溶液的吸光度值(分别记为SUVA254、SUVA280),分别计算SUVA254值和SUVA280值.
三维荧光光谱(3DEEM)采用Hitachi F-7000型荧光光谱分析仪测定,λEx(激发波长)范围为200~450 nm,λEm(发射波长)范围为250~600 nm,λEx和λEm的带宽均为5 nm,扫描速率为2 400 nmmin,响应时间为“自动”,扫描光谱进行仪器自动校正,室温下使用1 cm石英荧光样品吸收池完成三维荧光光谱的采集.
1.3 试验处理
细菌培养试验所用的细菌接种液:将各采样点对应的沉积物鲜样置于离心管以V(水)∶V(土)为10∶1的比例加入无菌水,在20 ℃、200 rmin下恒温振荡1 h,沉积物-水溶液为细菌接种液.
藻培养试验使用的藻:产毒的单细胞铜绿微囊藻(Microcystisaeruginosa),由中国环境科学研究院湖泊生态环境创新基地藻种库提供,在人工气候室中培养至指数生长期后用于接种.
培养条件与取样:取100 mL滤液置于150 mL锥形瓶中,作为生物培养基,分别以1%和2.5%体积比接入细菌接种液和微囊藻,设2组平行和1组空白. 将接种后的微生物培养液放置于人工气候室中在(25±1)℃避光培养. 接种后的藻培养液放置于人工气候室中,光照强度为3 000 lx;明暗周期12 h∶12 h;温度(25±1)℃. 试验中使用的所有玻璃仪器经HCl浸泡24 h,洗净后高温灭菌(121 ℃,1 h). 分别在0、2、4、7、10、14、19、25 d取样,测定ρ(DON)和ρ(DOC). 另取藻培养液,利用血球计数板在光学显微镜下进行细胞计数,观察微囊藻生长情况[20-21].
1.4 数据处理
数据图表绘制采用Origin 9.0,数据处理采用Excel 2016和SPSS 17.0进行. 关于DON的三维荧光光谱平行因子分析,每个培养阶段的菌藻试验样品分别取多次平行样,通过荧光测样得到荧光矩阵分别组合,构成一个新的多维矩阵组. 运用Matlab 2010a PARAFAC工具箱对于这个矩阵组进行平行因子处理,整个分析过程包括扣除空白、去除瑞利和拉曼散射、平行因子分析、绘制等高线及其相应的平行因子图谱. 根据处理后的核一致性结果,选择需要因子个数. 由于试验时间跨度较长,不同样本取样时间有差异,荧光强度的测定结果因荧光机器的状态差异会有不同的机器误差,为消除这种误差,每次测样的同时配置硫酸奎宁标准溶液,在λExλEm为350 nm450 nm的条件下测定得到其最大荧光强度,最终样品的荧光强度由测定强度和标准硫酸奎宁溶液的最大荧光强度比值(QSU)来表示. 试验最终确定组分,并且得到各样品的浓度矩阵、最大激发波长和最大发射波长,以及各个组分荧光强度.
2 结果与分析
2.1 细菌与藻类培养条件下洱海沉积物ρ(DON)变化特征
2.1.1 细菌培养条件下ρ(DON)变化特征
由图2可见,46#采样点沉积物ρ(DON)在培养前4 d显著下降,在后6 d有所上升,后期持续下降. 142#采样点沉积物DON降解变幅较大,总体呈下降趋势. 与其他采样点不同,105#采样点沉积物ρ(DON) 在培养的前期呈波动上升趋势,在培养的第10天达到峰值后持续降低. 3个采样点对应的DON最佳降解时间为培养的第19天.

图2 细菌培养条件下沉积物ρ(DON)的变化Fig.2 DON content variation under bacterial incubation
2.1.2 藻培养条件下ρ(DON)变化及藻密度变化特征
由图3可见,藻培养条件下,46#采样点142#采样点沉积物ρ(DON)呈直线趋势下降,在培养的第14天降解量接近最大,并在之后的培养过程中逐渐稳定于3.88和3.83 mgL. 而105#采样点沉积物DON在培养的第7天接近降解的峰值,并在之后的培养过程中逐渐稳定于2.59 mgL. 46#和105#采样点沉积物DON均在培养的第2天达到最大降解速率,分别为0.137和0.048 mg(L·d),142#采样点沉积物DON在培养的第4天达到最大降解速率,为0.240 mg(L·d).

图3 藻培养条件下沉积物ρ(DON)与藻密度的变化Fig.3 Variation of DON content and algae density under algae incubation
藻类生长呈“S”型曲线上升趋势,至培养结束时,46#采样点藻密度增至7.13×106mL-1,与DON降解情况不同,105#采样点藻密度增至4.70×106mL-1,低于46#采样点. 142#采样点藻生长相对平缓,在培养第14天基本达到生长的平台期,到培养结束时,藻密度为6.98×106mL-1.
2.2 基于细菌与藻类培养条件下洱海沉积物DON结构特征
2.2.1 细菌、藻类培养过程中沉积物DON三维荧光光谱变化特征
以105#采样点为例,湖泊沉积物初始培养液EEM-PARAFAC组分如图4~6所示,分析得到3种荧光组分. 根据各组分的激发发射峰波长可以判断其余2个采样点样本中所含有的为相同的3种DON荧光组分(见表1),分别为一种陆源类腐殖质物质(命名为S1)、内源类色氨酸物质(命名为S2),以及另一种陆源类腐殖质物质(命名为S3). 同样以105#采样点为例,对应的S1、S2和S3荧光组分,总体的荧光强度呈先增强后下降的趋势,并且细菌培养液中各组分荧光峰强拐点均出现在7~10 d之间,而藻类培养液中则出现在4~7 d(见表2). 其余各采样点的各组分荧光强度变化呈现相同的特性,但处于北部湖区的46#采样点和南部湖区的142#采样点外源组分S1、S3的初始荧光强度(46#采样点分别为3.084、4.204 QSU,142#采样点分别为3.338和4.676 QSU)明显强于中部湖区(105#采样点中该2种组分的荧光强度).

表1 菌藻培养前各荧光组分特性
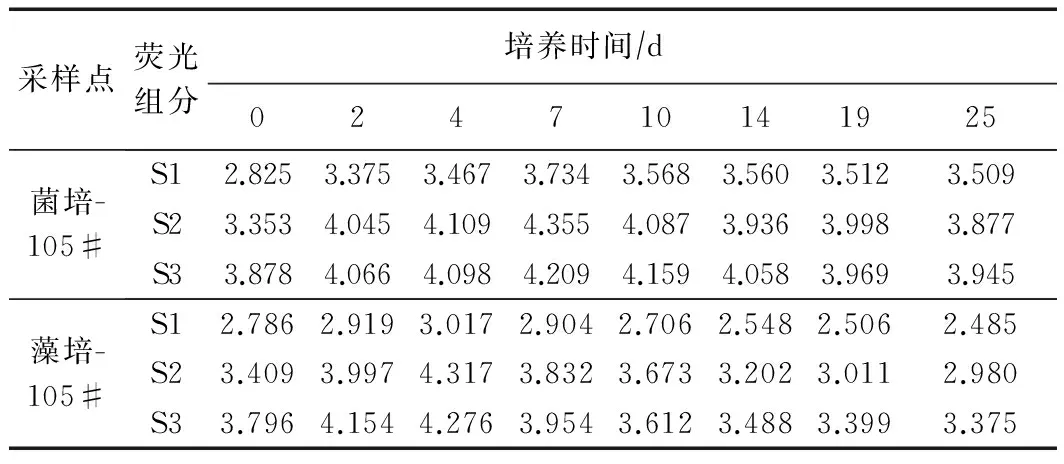
表2 菌藻培养过程中PARAFAC组分荧光强度(QSU)变化特征
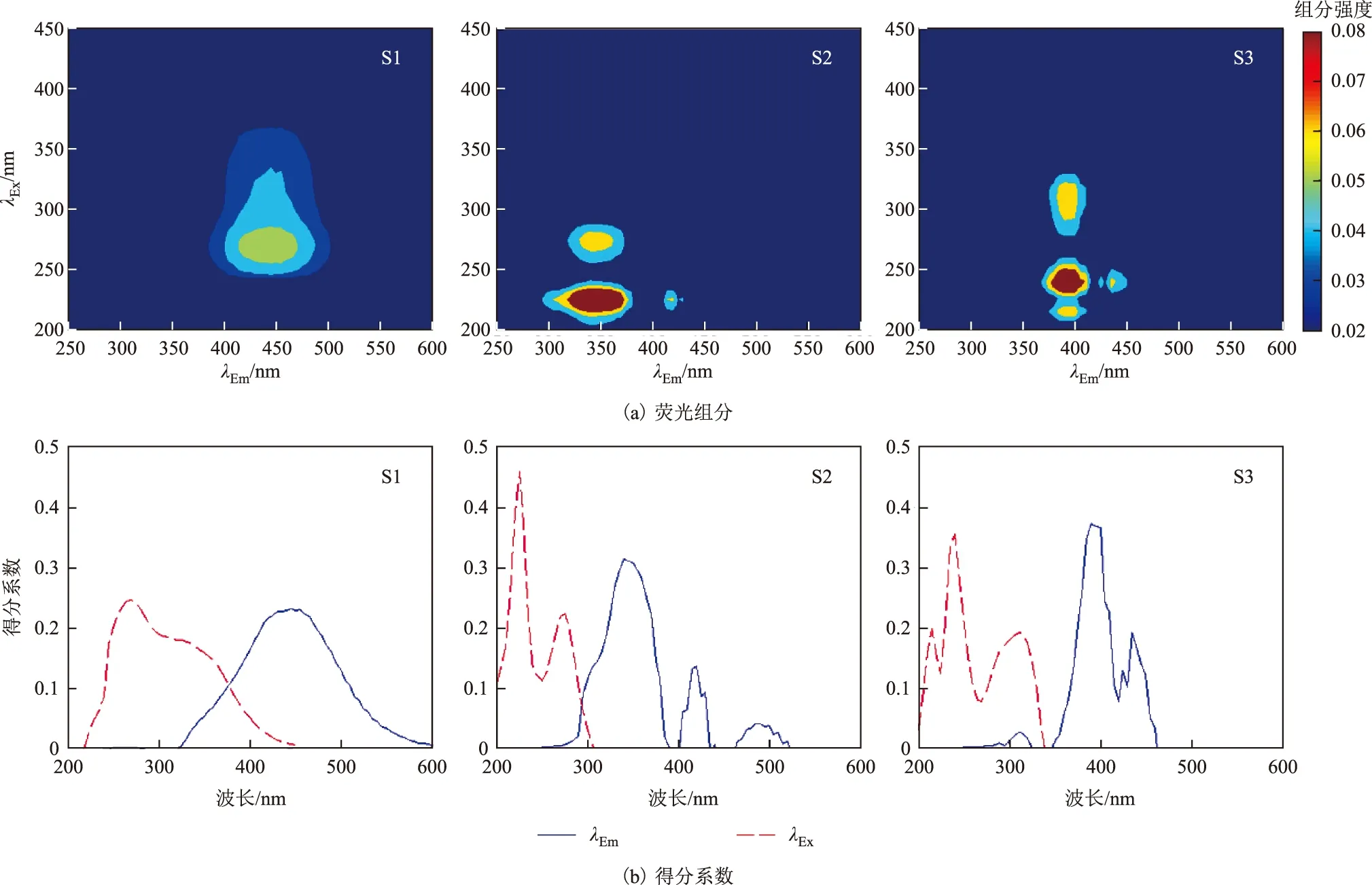
图4 105#采样点初始EEM-PARAFAC组分Fig.4 EEM-PARAFAC components of 105# before incubation
2.2.2 细菌、藻类培养过程中沉积物DON紫外-可见光吸收光谱变化特征
DON存在多种含氮官能团,通过全波长紫外扫描可以表征其官能团结构. SUVA254可以间接用于反映腐殖质的芳香性,其值越大则芳香性越大[22]. ZHANG等[11]研究指出,SR指数与溶解性有机物平均分子量具有显著负相关性,并且当SR>1时沉积物中DON组分以内源组分为主,SR<1时以外源组分为主.
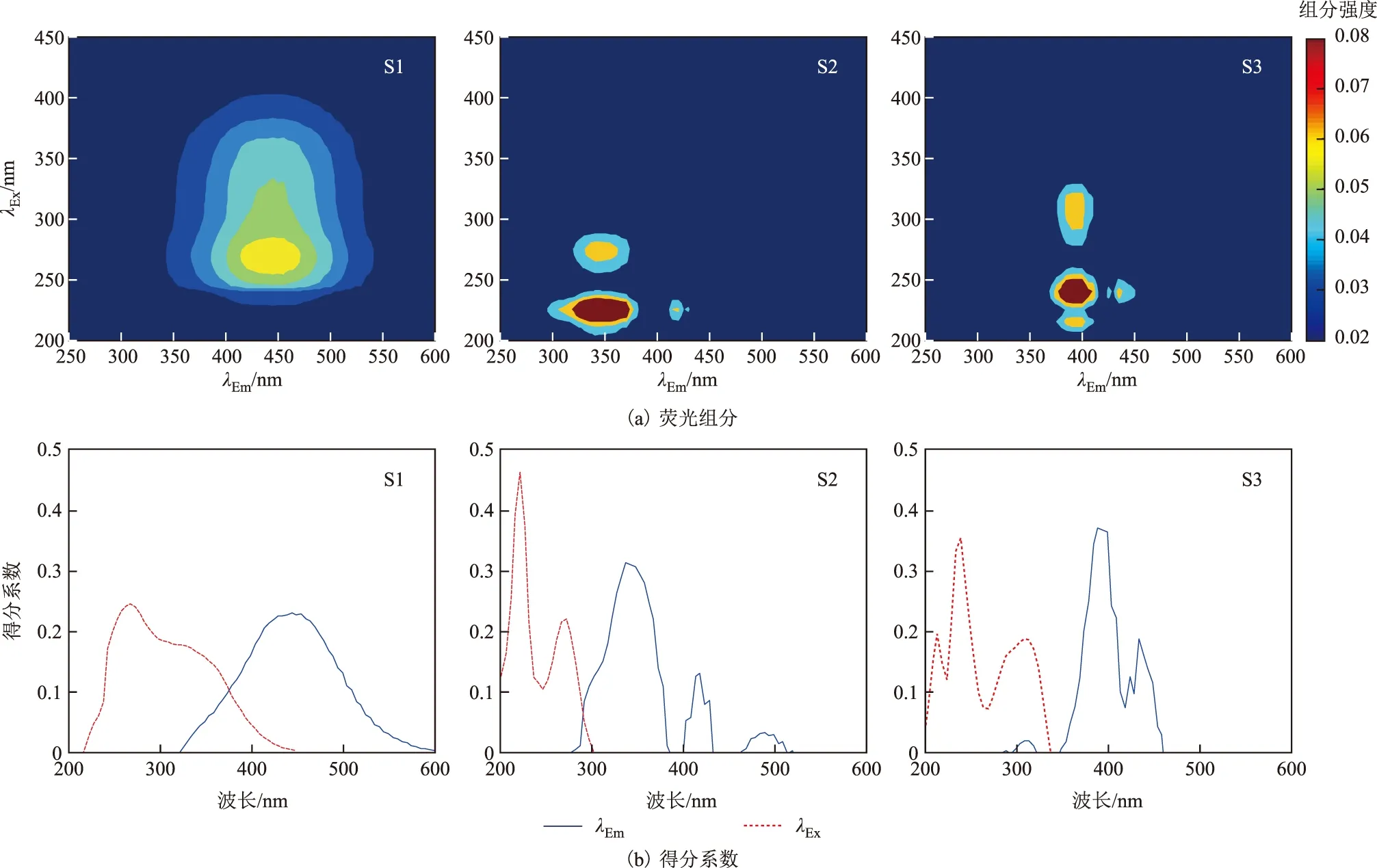
图5 105#采样点位菌类培养至第14天EEM-PARAFAC组分Fig.5 EEM-PARAFAC components of 105# on day 14 under incubation by bacteria

图6 105#采样点位藻类培养至第14天EEM-PARAFAC组分Fig.6 EEM-PARAFAC components of 105# on day 14 under incubation by algae
如图7所示,藻培养过程中46#采样点和142#采样点培养液SUVA254指数随培养时间增长而下降,并且46#采样点培养液SUVA254指数下降趋势较142#采样点显著,105#采样点培养液SUVA254指数变化并不明显. 而在细菌培养试验中,3个采样点培养液SUVA254指数均呈下降趋势,并且降幅大于藻培养条件下;3个采样点菌藻培养过程中SR指数均呈现增长趋势. 菌类培养在0~7 d保持快速增长,10 d之后增长速度减缓,藻类培养0~4 d 保持快速增长7 d以后增长速度减缓. 趋于稳定之后,藻类培养液SR值高于菌类培养液SR值.

图7 细菌、藻培养条件下SUVA254指数和SR指数的变化Fig.7 Changes of SUVA254 and SR value during incubation by bacteria and algae
3 讨论
3.1 细菌、藻类对比培养下洱海沉积物DON生物有效性
细菌和藻类培养条件下三个采样点沉积物ρ(DON) 均呈下降趋势,其生物有效性依次为142#采样点>105#采样点>46#采样点(见表3). 究其原因,主要与3个采样点所在湖区环境特征有关. 46#采样点和142#采样点分别位于入湖河口和人类活动频繁区域,受外源污染严重,其可被微生物利用的ρ(DON) 较大,生物有效性较高. 105#采样点位于全湖中部区域,水体较深,外源污染对其影响较小,不利于沉积物积累高生物有效性的DON,沉积物DON生物有效性较低. 该研究中,细菌培养条件下,由于生物固氮作用较强[23],ρ(DON)呈波动变化. 同时,试验是在有氧环境下进行,适宜硝化菌等好氧菌的生长,对沉积物DON降解能力较藻类强,这就导致细菌培养条件下的DON生物有效性高于藻培养条件下的生物有效性,且达到最佳降解时间较长. DON对藻类生长具有直接或间接的作用[24],藻培养条件下,DON下降的量〔Δ(DON)〕与藻细胞密度的增长量呈显著正相关(见表4),说明藻类在生长过程中消耗可利用的DON,DON除满足藻类自身生长需要外,还促进其分裂繁殖,同时,藻细胞密度提高会促进DON消耗,因此藻类生长的同时伴随着ρ(DON)的下降,藻细胞密度增长量能反映DON的降解情况.

表3 洱海表层沉积物DON生物有效性及生物可利用量
3.2 菌藻培养对洱海沉积物DON结构的影响
3个采样点初始培养液的EEM-PARAFAC组分峰强和紫外-可见光吸收光谱存在差异,这与洱海不同湖区环境条件有关. 位于洱海南部的142#采样点,水深较浅,2003年后沉水植物大面积退化,植物残体沉积造成有机质积累,加上人类活动较为频繁,导致该区域类腐殖物质和类蛋白物质较多,腐殖化程度和DON相对分子量较高. 46#采样点位于洱海北部,弥苴河和罗时江的注入,带来大量的陆源溶解性有机质,造成该区域类腐殖物质和类蛋白较丰富,微生物较为活跃,DON相对分子量和芳香性较高. 处于中部的105#采样点由于水体较深,并无植物分布,加之湖泊环流等作用,陆源输入对其影响较少,不利于类蛋白物质积累.
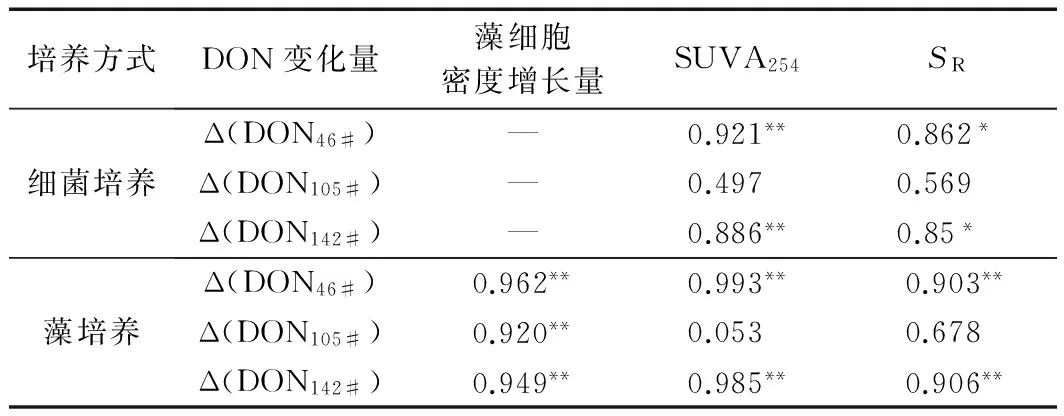
表4 培养过程中DON变化量与各参数相关性分析
注: —为无测定;*为显著差异;** 为极显著差异.
任保卫等[25]研究表明,荧光强度与藻生长具有一定相关性,Saadi等[26]发现荧光峰强度在微生物培养过程初期会有不同程度的增强,该研究也得到了相同结论. 究其原因,微生物将大分子DON分解为小分子后,分子结构重排使得具有刚性和共平面性的结构增加,有机分子与溶剂或其他溶质分子的相互作用减少,减少了外转移能量,强化了荧光的发射强度,某些具有荧光淬灭或无荧光活性的分子可能被选择性地分解;另一原因是生物生长过程中,胞外所分泌的酶溶解在溶液中,增强荧光信号[26-28]. 在培养中后期,细菌培养液类蛋白荧光峰消失或者强度有所降低,与细菌的吸收降解有关. 在藻培养试验中,培养前期也出现了大分子DON分解为小分子的现象,但受藻类自身吸收和光降解作用的影响,三个采样点的培养液S1、S2、S3各荧光组分的峰强在试验进行4~7 d即出现下降趋势,比菌类更快速的完成将大分子DON降解为小分子DON的过程,并且外源组分S1和S3的强度下降速率更大,这是因为外源组分中可生物利用部分占比更大,可更明显的被藻类所吸收利用[25,29]. 通过紫外-可见光吸收光谱看出,SR指数的变化情况也进一步证明上述结论,培养前期各采样点SR指数均呈迅速增加趋势,这是由于培养液中的DON分子量减小,且DON被菌类和藻类吸收利用,其中生物有效性更高的陆源组分S1、S3消耗量更大,内源组分在DON中所占比重不断上升,导致SR指数增加. 之后SR指数增加趋势逐渐减缓,表明分子量不再减小,而菌藻的吸收作用还在保持. 在培养液起始SR指数相近的情况下,菌藻培养液的状态趋于稳定之后,藻类培养液的SR指数更高,这说明藻类培养对外源组分的吸收效果更强,培养之后的藻类培养液中外源组分含量更低. 除105#采样点培养液外,其他培养液的SUVA254指数均随培养的进行而降低,且与Δ(DON)呈显著正相关(见表4),这印证了荧光光谱的结果. 而藻培养试验105#采样点培养液SUVA254指数变化不大,这是因为中部湖区水体相对较深,水流缓慢,适合微生物生长,同时,该区域受污染程度较低,大部分易降解的大分子DON和高芳香性DON在湖体中已被微生物分解和利用,难被藻类降解的部分在沉积物中累积,所以藻类培养条件下藻类对该区域沉积物DON的分子量和芳香性作用不明显.
3.3 菌藻对比培养条件下洱海沉积物DON生物有效性及环境指示意义
富营养化是由于藻类异常繁殖而引起的[30],利用藻类培养的方法能直观地反映沉积物DON对藻类生长的影响. 通过笔者研究发现,与细菌培养方法相比,藻类培养方法在培养前对接种液的处理较为简单;降解的趋势较明显,培养达到最佳降解时间用时较短,对于洱海沉积物DON降解效果相当;DON在培养过程中的变化与DON光谱学特征参数(荧光组分峰强度、SUVA254和SR)和藻细胞密度相关性较强,可以通过EEM-PARAFAC和紫外-可见光吸收光谱表达藻类培养过程中DON的结构变化特征以及来源特征,利用藻细胞密度反映藻类对DON的吸收降解情况. 因此藻类培养方法更适合作为评价洱海沉积物DON的生物有效性的方法.
DON是湖泊沉积物影响上覆水氮浓度的重要因素[6,31],并且极易发生衰减变化[29],不同环境条件下沉积物DON释放量和释放强度存在明显差异[33-34]. 不同研究区域样品和不同的生物培养手段反映的DON生物有效性也存在较大差异. 乌梁素海地处蒙新高原湖区,受农田退水、工业废水和生活污水等外源污染严重,为我国中型湖泊富营养化水平较为严重的湖泊之一[35]. 冯伟莹等[21]通过藻类培养方法研究发现,乌梁素海沉积物样品的DON生物有效性为62.83% ~69.83%,远高于笔者研究得到的洱海沉积物(8.46%~45.31%). Petrone等[36]对河口流域细菌培养条件下的DON生物有效性研究结果为4%~44%,与笔者研究细菌培养和藻类培养条件下的结果接近. 牧场和混合阔叶林径流的DON中则含有较多腐殖质类物质,结构相对复杂,腐殖化程度较高,较难被生物利用,在微生物培养条件下,生物有效性分别为25%和20%[23],低于该研究的结果. 以上结果表明,洱海沉积物尚处于较为稳定的状态,其DON生物有效性低于正处于富营养化的高原湖泊,但洱海生态系统演变中,分别在1996年、2003年、2013年暴发了3次较为严重的水华,因此仍需要重视其沉积物DON对洱海富营养化的影响,特别是加强对受污染较为严重的南部和北部区域沉积物DON生物有效性的关注.
沉积物中的有机质,在腐殖化程度较高情况下,能较好地维持其释放转化平衡,避免向水体中释放过多营养盐而产生富营养化的风险. 研究[37]发现,经过土著细菌作用,DON可被分解而产生藻类易利用的NH4+-N或尿素,可能促进藻类的生长. 当细菌的活性增强,矿化作用提高,洱海沉积物有机氮的释放转化平衡改变的可能性增强,沉积物营养盐含量较高而水质较好的状况会改变,引起沉积物释放至水体中的DON增大,进而促进浮游植物的吸收. 该研究发现,藻类对洱海沉积物DON的利用率与细菌相当,说明在缺少细菌的作用下,洱海沉积物营养盐特别是其中的DON对藻类生长有较大促进作用,潜在的富营养化风险较高.
藻菌之间可能存在竞争以及互生等复杂的相互作用[38],该研究的细菌和藻类均在独立体系中进行培养,为进一步评估洱海污染程度和富营养化风险,在后续的研究中,有必要在细菌与藻类混合培养条件下对洱海沉积物DON的生物有效性进行研究.
4 结论
a) EEM-PARAFAC和紫外-可见光吸收光谱两种分析手段可高效、快速地表达藻培养过程中DON组分结构及来源特征. 对于洱海,由于外源组分S1、S2生物有效性较高,内源组分S3较低,DON生物有效性表现为含外源组分S1、S2较多的南部,北部较高,含内源组分S3较多的中部最低. DON生物有效性较高的南、北部湖区的潜在富营养化风险较高,需要高度重视.
b) 藻类培养条件下洱海表层沉积物DON生物有效性(8.46%~42.46%)略低于细菌培养条件(10.51%~45.31%),藻培养过程中,DON光谱学特征参数(SUVA254、SR)与ρ(DON)均有显著相关关系,相关性较细菌培养条件好. 菌藻培养过程中均有将各DON组分由大分子转化为小分子后进行吸收的现象,藻类的DON降解过程更迅速,对陆源DON的吸收效果更好.
c) DON生物利用率与藻细胞密度呈显著正相关,藻生长情况可以作为一种反映DON生物有效性的辅助手段. 综合比较发现,藻类培养方法比细菌培养方法更适用于评价洱海沉积物DON的生物有效性.
[1] BERMAN T,BRONK D A.Dissolved organic nitrogen:a dynamic participant in aquatic ecosystems[J].Aquatic Microbial Ecology,2003,31(3):279- 305.
[2] ENGELAND T V,SOETAERT K,KNUIJT A,etal.Dissolved organic nitrogen dynamics in the North Sea:a time series analysis(1995-2005)[J].Estuarine Coastal and Shelf Science,2010,89(1):31- 42.
[3] SCHMIDT B H M,KALBITZ K,BRAUN S,etal.Microbial immobilization and mineralization of dissolved organic nitrogen from forest floors[J].Soil Biology and Biochemistry,2011,43(8):1742- 1745.
[4] ANSSI V, MARKO J.Photochemically produced bioavailable nitrogen from biologically recalcitrant dissolved organic matter stimulates production of a nitrogen-limited microbial food web in the Baltic Sea[J].Limnology and Oceanography,2007,52(52):132- 143.
[5] JIN Xiangcan,WANG Shengrui,ZHAO Haichao,etal.Effect of organic matter on DOM sorption on lake sediments[J].Environmental Geology,2008,56(2):391- 398.
[6] WANG Shengrui,JIN Xiangcan,NIU Dalin,etal.Potentially mineralizable nitrogen in sediments of the shallow lakes in the middle and lower reaches of the Yangtze River area in China[J].Water and Environment Journal,2012,24(4):1788- 1792.
[7] STEDMON C A,MARKAGER S.Resolving the variability in dissolved organic matter fluorescence in a temperate estuary and its catchment using PARAFAC analysis[J].Limnology and Oceanography,2005,50(2):686- 697.
[8] YAO Xin,ZHANG Yunling,ZHU Guangwei,etal.Resolving the variability of CDOM fluorescence to differentiate the sources and fate of DOM in Lake Taihu and its tributaries[J].Chemosphere,2010,82(2):145- 155.
[9] YAO Xin,WANG Shengrui,NI Zhaokui,etal.The response of water quality variation in Poyang Lake(Jiangxi,People′s Republic of China)to hydrological changes using historical data and DOM fluorescence[J].Environmental Science and Pollution Research,2015,22(4):3032- 3042.
[10] OSBURN C L,HANDSEL L T,MIKAN M P,etal.Fluorescence tracking of dissolved and particulate organic matter quality in a river-dominated estuary[J].Environmental Science & Technology,2012,46(16):8628- 8636.
[11] ZHANG Li,WANG Shengrui,ZHAO Haichao,etal.Using multiple combined analytical techniques to characterize water extractable organic nitrogen from Lake Erhai sediment[J].Science of the Total Environment,2016,542(Pt A):344- 353.
[12] SEDLAK D L.Wastewater-derived dissolved organic nitrogen:analytical methods,characterization,and effects:a review[J].Critical Reviews in Environmental Science and Technology,2006,36(3):261- 285.
[13] ZHANG Jingtian,SU Mingzhou,XI Beidou,etal.Algal uptake of dissolved organic nitrogen in wastewater treatment plants[J].Journal of Environmental Sciences,2016,50(12):56- 64.
[14] YU Guanghui,LUO Yihong,WU Minjie,etal.PARAFAC modeling of fluorescence excitation-emission spectra for rapid assessment of compost maturity[J].Bioresource Technology,2010,101(21):8244- 8251.
[15] 钱伟斌,张莉,王圣瑞,等.湖泊沉积物溶解性有机氮组分特征及其与水体营养水平的关系[J].光谱学与光谱分析,2016,36(11):65- 70. QIAN Weibin,ZHANG Li,WANG Shengruietal.Compositional characteristics of sediment dissolved organic nitrogen in typical lakes and its relationship on water trophic status[J].Spectroscopy and Spectral Analysis,2016,36(11):65- 70.
[16] 赵海超,王圣瑞,焦立新,等.洱海沉积物中不同形态氮的时空分布特征[J].环境科学研究,2013,26(3):235- 242. ZHAO Haichao,WANG Shengrui,JIAO Lixin,etal.Characteristics of temporal and spatial distribution of the nitrogen forms in the sediments of Erhai Lake[J].Research of Environmental Sciences,2013,26(3):235- 242.
[17] 程杰,张莉,王圣瑞,等.洱海沉积物不同分子量溶解性有机氮空间分布及光谱特征[J].环境化学,2014,33(11):1848- 1856. CHENG Jie,ZHANG Li,WANG Shengrui,etal.Spatial distribution and spectral characteristics of dissolved organic nitrogen with different molecular weight in Erhai sediment[J].Environmental Chemistry,2014,33(11):1848- 1856.
[18] 国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[19] CONSIDINE K M,KELLY A L,FITZGERALD G F,etal.High-pressure processing:effects on microbial food safety and food quality[J].FEMS Microbiology Letters,2008,281(1):1- 9.
[20] LUSK M G,TOOR G S.Dissolved organic nitrogen in urban streams:Biodegradability and molecular composition studies[J].Water Research,2016,96:225- 235.
[21] 冯伟莹,张生,焦立新,等.湖泊沉积物溶解性有机氮组分的藻类可利用性[J].环境科学,2013,34(6):2176- 2183. FENG Weiying,ZHANG Sheng,JIAO Lixin,etal.Bioavailability of dissolved organic nitrogen components in the lake sediment to alage[J].Environmental Science,2013,34(6):2176- 2183.
[22] WEISHAAR J L,AIKEN G R,BERGAMASCHI B A,etal.Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon[J].Environmental Science & Technology,2003,37(20):4702- 4708.
[23] 赵亚丽,焦立新,王圣瑞,等.洱海表层沉积物溶解性有机氮生物有效性[J].环境科学研究,2013,26(3):262- 268. ZHAO Yali,JIAO Lixin,WANG Shengrui,etal.Bioavailability of dissolved organic nitrogen in the surface sediments of Erhai Lake[J].Research of Environmental Sciences,2013,26(3):262- 268.
[24] 罗专溪,魏群山,王振红,等.淡水水体溶解有机氮对有毒藻种的生物有效性[J].生态环境学报,2010,19(1):45- 50. LUO Zhuanxi,WEI Qunshan,WANG Zhenhong,etal.Bioavailability of dissolved organic nitrogen in freshwaters to toxic algae[J].Ecology and Environment,2010,19(1):45- 50.
[25] 任保卫,赵卫红,王江涛,等.海洋微藻生长过程藻液三维荧光特征[J].光谱学与光谱分析,2008,28(5):1130- 1134. REN Baowei,ZHAO Weihong,WANG Jiangtao,etal.Three dimensional fluorescence excitation-emission matrix spectrum of dissolved organic substance in marinemicroalgaes growth process[J].Spectroscopy and Spectral Analysis,2008,28(5):1130- 1134.
[26] SAADI I,BORISOVER M,ARMON R,etal.Monitoring of effluent DOM biodegradation using fluorescence,UV and DOC measurements[J].Chemosphere,2006,63(3):530- 539.
[27] WIEGNER T N,SEITZINGER S P.Photochemical and microbial degradation of external dissolved organic matter inputs to rivers[J].Aquatic Microbial Ecology,2000,24(1):27- 40.
[28] SHENG G P,YU H Q.Characterization of extracellular polymeric substances of aerobic and anaerobic sludge using three-dimensional excitation and emission matrix fluorescence spectroscopy[J].Water Research,2006,40(6):1233- 1239.
[29] SPENCER R G M,ARON S,HERNES P J,etal.Photochemical degradation of dissolved organic matter and dissolved lignin phenols from the Congo River[J].Journal of Geophysical Research Atmospheres,2009,114(G3):560- 562.
[30] 金相灿,屠清瑛.湖泊富营养化调查规范[M].2版.北京:中国环境科学出版社,1991.
[31] 王圣瑞,金相灿,焦立新.不同污染程度湖泊沉积物不同粒级可转化态氮分布[J].环境科学研究,2007,20(3):52- 57. WANG Shengrui,JING Xiangcan,JIAO Lixin.Distribution of transferable nitrogen in different grain size from the different trophic level lake sediments[J].Research of Environmental Sciences,2007,20(3):52- 57.
[32] JOHANNES R,DAVEYL J.Loss of low molecular weight dissolved organic carbon(DOC)and nitrogen(DON)in H2O and 1.5 M K2SO4soil extracts[J].Soil Biology & Biochemistry,2011,42(12):2331-2335.
[33] TAPPIN A D,MILLWARD G E,FITZSIMONS M F.Distributions,cycling and recovery of amino acids in estuarine waters and sediments[J].Environmental Chemistry Letters,2007,5(3):161- 167.
[34] BADR E S A,TAPPIN A D,ACHTERBERG E P.Distributions and seasonal variability of dissolved organic nitrogen in two estuaries in SW England[J].Marine Chemistry,2008,110(34):153- 164.
[35] 金相灿,稻森悠平,朴俊大,等.湖泊和湿地水环境生态修复技术与管理指南[M].北京:科学出版社,2007:70- 98.
[36] PETRONE K C,RICHARDS J S,GRIERSON P F.Bioavailability and composition of dissolved organic carbon and nitrogen in a near coastal catchment of south-western Australia[J].Biogeochemistry,2009,92(1):27- 40.
[37] BERMAN T,BÉCHEMIN C,MAESTRINI S Y.Release of ammonium and urea from dissolved organic nitrogen in aquatic ecosystems[J].Aquatic Microbial Ecology,1999,16(3):295- 302.
[38] 左新宇,梁运祥.微囊藻与硝化细菌在不同种群密度条件下的相互作用[J].环境科学与技术,2013,36(12):65- 70. ZUO Xinyu,LIANG Yunxiang.Interactions betweenMicrocystissp.and nitrifying bacteria with different population densities[J].Environmental Science & Technology(China),2013,36(12):65- 70.
Bioavailability of Dissolved Organic Nitrogen in Sediment from Erhai Lake: A Comparative Study on Bacterial and Algae Incubation
XU Kechen1,2,3, ZHANG Li2,3, WANG Shengrui2,3*, WANG Shuguang1, QIAN Weibin2,3, LI Wenzhang2,3, SHI Linglong2,3
1.Beijing University of Chemical Technology, Beijing 100029, China 2.State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China 3.State Environmental Protection Key Laboratory for Lake Pollution Control, Research Center of Lake Eco-Environment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China
This study aimed to explore the importance of dissolved organic nitrogen (DON) in the aquatic ecosystem and its ecological effects, and to find a scientific method to evaluate the bioavailability of DON and to provide a basis for further revealing the mechanism of lake eutrophication. Three-dimensional fluorescence excitation-emission matrix (3DEEM-PARAFAC) was used to estimate sediment DON bioavailability. Various components were identified by PARAFAC model according to the fluorescence excitation emission spectra. Surface sediment samples from different regions of Erhai Lake were selected to study the difference of DON content variation by comparing the cultures inoculated with bacteria and algae under room conditions. The variation characteristics for DON structures during incubation were characterized by UV-visible absorption and 3DEEM spectra. The results showed that: (1) Bioavailability of sediment DON incubated by algae (8.49%-42.5%) was slightly lower than that by bacteria (10.5%-45.3%). (2) Under algae incubation, the DON bioavailability had significant positive correlation with the growth of algae cell density, indicating algae growth could reflect sediment DON bioavailability. (3) The correlation between DON content and its spectroscopy characteristic parameters of 3DEEM, SUVA254andSRduring the incubation by bacteria was better than that by algae. SUVA254had different declining degree, andSRshowed different increasing degree, indicating DON with high molecular weight and aromaticity could be degraded by microorganisms. Compared with terrestrial PARAFAC components, autochthonous components showed higher bioavailability. (4) Compared with bacteria incubation, algae incubation method could reflect the influence of sediment DON on algae growth more directly. It could be used as a method to measure the DON bioavailability of lake sediments to some extent. In conclusion, it is more suitable to evaluate the Erhai sediment DON bioavailability by algae incubation.
dissolved organic nitrogen; sediment; bioavailability; bacteria incubation; algae incubation; EEM-PARAFAC
2016-11-14
2017-01-02
国家自然科学基金项目(U1202235,41503113);环境基准与风险评估国家重点实验室自由探索项目(2014-GOT-042-N-06)
许可宸(1993-),男,安徽芜湖人,crossxkc@163.com.
*责任作者,王圣瑞(1972-),男,内蒙古呼和浩特人,研究员,博士,博导,主要从事水环境科学研究,wangshengruia@126.com
X826
1001- 6929(2017)06- 0874- 10
A
11.13198/j.issn.1001- 6929.2017.01.83
许可宸,张莉,王圣瑞,等.基于菌藻对比培养方法的洱海沉积物溶解性有机氮生物有效性评价[J].环境科学研究,2017,30(6):874- 883.
XU Kechen,ZHANG Li,WANG Shengrui,etal.Bioavailability of dissolved organic nitrogen in sediment from Erhai Lake: a comparative study on bacterial and algae incubation[J].Research of Environmental Sciences,2017,30(6):874- 883.