小黄花石斛的无菌播种与快速繁殖
2017-06-12李宏杨刘扬陈冠铭杨志娟
李宏杨+刘扬+陈冠铭+杨志娟

摘 要 为保护与利用小黄花石斛野生资源,采用种子无菌播种、试验不同培养基、不同激素配比以及添加天然有机复合物等方法,探究小黄花石斛的组培快繁技术。研究结果表明:小黄花石斛种子在1/2 MS培养基上培养10 d后形成原球茎团,萌发率超过80%,再培养30 d后出芽整齐;单芽转接到MS+KT 1.0 mg/L+NAA 0.2 mg/L+土豆粉100 g/L培养基上培养60 d后形成丛生芽,增殖系数达到8.58;幼苗转接到MS+NAA 0.5 mg/L+IBA 0.05 mg/L+香蕉粉100 g/L+CA 1.0 g/L培养基上培养80 d后可形成完整植株,小苗移栽60 d后,成活率达到71.45%。
关键词 小黄花石斛 ;无菌播种 ;组织培养 ;快速繁殖
中图分类号 S567.23 文献标识码 A Doi:10.12008/j.issn.1009-2196.2017.05.005
Aseptic Seeding and Rapid Propagation of Dendrobium jenkinsii
LI Hongyang LIU Yang CHEN Guanming YANG Zhijuan
(Sanya Science &Technology Academy of Crop Winter Multiplication, Sanya, Hainan 572000)
Abstract In order to protect and utilize the wild plant resources of Dendrobium jenkinsii, the techniques of tissue culture and rapid propagation of D. jenkinsii were explored by using aseptic seed sowing, different media, different hormone ratio and natural organic compound. The results showed that the seeds of D. jenkinsii formed protocorms 10 days after cultured in 1/2MS medium with a germination rate of more than 80% and were all germinated after another 30 days. Each single bud was transferred to a culture medium containing MS+KT 1.0 mg/L+NAA 0.2 mg/L+potato powder 100 g/L and produced clusters 60 days after cultured, and the multiplication coefficient was upto 8.58. The plantlets derived from the clusters were transferred to a medium containing MS+NAA 0.5 mg/L+IBA 0.05 mg/L+banana powder 100 g/L+activated carbon 1.0 g/L and formed strong rooted plants 80 d after cultured. The rooted plants had a survival rate of 71.45% 60 days after transplanted.
Keywords Dendrobium jenkinsii ; aseptic seeding; tissue culture ; rapid propagation
小黃花石斛(Dendrobium jenkinsii)与聚石斛十分相似,植物体各部分较小,茎长1~2.5 cm,具4个棱,叶椭圆形,总状花序,具1~3朵黄花。小黄花石斛常生于海拔700~1 300 m的疏林中,鳞片状附生于树干或石头上,分布于锡金、不丹、印度东北部、缅甸、泰国、老挝等地及我国云南南部[1]。《中国植物志》上将小黄花石斛和鼓槌石斛、密花石斛、聚石斛、具槽石斛、球花石斛聚为一组,而现代分子生物学的研究结果与形态分类不一致。武荣花[2]采用石斛叶绿体DNA trnL-trnF间隔区序列比较和采用ISSR分子标记对我国的部分石斛属植物资源进行亲缘关系分析发现,小黄花石斛自成一组,与翅梗石斛亲缘关系较近。金剑峰等[3]对24种石斛属植物的rDNA ITS序列进行克隆分析,小黄花石斛和景洪石斛、剑叶石斛、球花石斛、短棒石斛聚为一组。小黄花石斛属于矮小型原生种,花色夺目,形态高雅,是热带石斛兰矮化育种的优良亲本,可通过属内杂交或参考亲缘关系分类培育新品种,但有关研究报道很少,至今未见品种登录(RHS)。小黄花石斛自然结实率高,但和其它兰科植物一样,种子萌发率极低,主要靠无性繁殖连片生长。近年来,小黄花石斛野生资源受人类掠夺性盗采,公开售卖,已濒临灭绝。因此,有必要研究小黄花石斛的离体快繁育苗技术,为其资源保存与开发利用提供技术支持。
1 材料与方法
1.1 材料
小黄花石斛(Dendrobium jenkinsii Lindl.)为云南野生种,保存于三亚市南繁科学技术研究院石斛资源圃,人工异花授粉后其蒴果在140 d左右开始变黄成熟,采摘备用。
1.2 方法
1.2.1 材料处理
将小黄花石斛蒴果经自来水洗净,用75%酒精浸泡消毒20 s,0.1%升汞溶液消毒15 min,无菌水冲洗6次。风干水分,切开蒴果,将种子均匀散落到培养基上。
1.2.2 培养基与培养条件
种子萌发培养基:(1) MS;(2) 1/2 MS(大量元素减半);(3) 1/2 MS+土豆粉80 g/L。丛生芽增殖培养基:(4) MS+KT 0.5~1.5 mg/L+NAA 0.2 mg/L+土豆粉100 g/L。壮苗生根培养基:(5) MS+NAA 0.5 mg/L+CA(活性炭)1.0 g/L;(6) MS+NAA 0.5 mg/L+土豆粉100 g/L+CA 1.0 g/L;(7) MS+NAA 0.5 mg/L+IBA 0.05 mg/L+土豆粉100 g/L+CA 1.0 g/L;(8) MS+NAA 0.5 mg/L+IBA 0.05 mg/L+香蕉粉100 g/L+CA 1.0 g/L。以上培养基均添加蔗糖25 g/L,卡拉胶7 g/L,pH调为 5.8,培养温度25℃,光照强度1 500~2 000 lx,光照时间每天12 h。
1.2.3 种子萌发培养
将种子播种到培养基(1)~(4)上,每个培养基接种10瓶,每天观察种子萌发情况,记录初始萌发时间(原球茎开始出现的时间),观察记录萌发率。
1.2.4 丛生芽增殖培养
待原球茎出芽后,切取长势基本一致的单芽转接到培养基(5)上,每个处理接种15瓶,每瓶接种5个。持续观察丛生芽生长情况,培养60 d后统计增殖率,每瓶丛生芽增殖系数=出芽数/5。
1.2.5 壮苗与生根培养
选取0.5 cm左右的单芽(幼苗),转接到壮苗与生根培养基(6)~(8)上,每个处理接种20瓶,每瓶转接6株。转接后持续观察小苗的生长发育状况,80 d后抽样统计小苗的茎长、茎粗、根数、根长、叶片等指标。
1.2.6 炼苗移栽
将培养瓶放置于兰花设施大棚内,1周后取出生根苗,洗净培养基,用0.1%高锰酸钾溶液浸泡10 min,取出晾干。挑选大小基本一致的小苗种植于水苔基质中,并喷洒1 000倍的多菌灵消毒液,置于阴凉通风处培养,保持基质湿度,60 d后统计小苗的存活率。
1.2.7 数据分析
数据使用SPSS 17.0软件进行统计分析。
2 结果与分析
2.1 不同培养基对种子萌发的影响
小黄花石斛种子在MS培养基上萌发很少且时间长,30 d后基本褐化死亡。在1/2 MS培养基上萌发时间最快,萌发率最高,原球茎长势好,培养7 d即有种子由黄转绿,20 d后大多数原球茎变绿出芽,40 d后可转接增殖培养。在添加了土豆粉的1/2 MS培养基上萌发率也较高,但萌发时间较长,原球茎生长慢且弱小,不利于增殖培养。
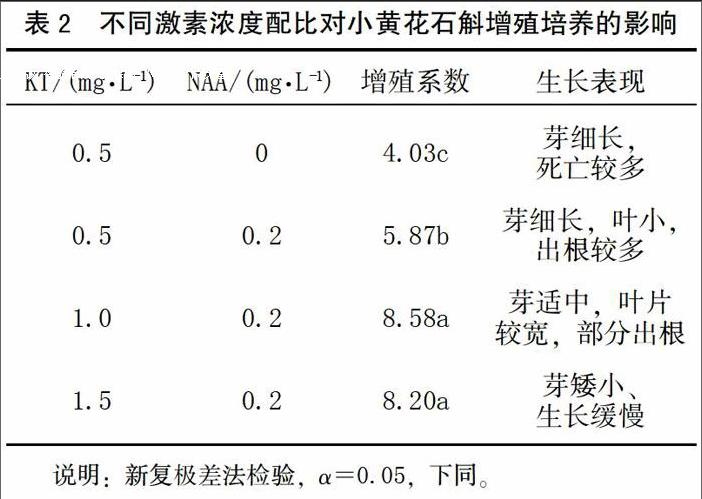
2.2 不同激素浓度配比对增殖培养的影响
将单芽转接到增殖培养基上,30 d后即形成明显的丛生芽,可切分丛芽增殖。结果见表2,以MS为基本培养基,如不添加NAA,嫩芽大部分死亡。在添加了NAA 0.2 mg/L的前提下,随着细胞分裂素KT浓度的增加,小芽的增殖系数增加,但KT的浓度提高到1.5 mg/L时增殖系数不再增加。KT 0.5 mg/L与NAA组合中,NAA起主导作用,增殖的丛生芽表现为根多芽小,芽细长,叶小;KT 1.5 mg/L与NAA组合中,KT则抑制了小芽的生长,增殖的丛生芽较矮小、生长缓慢。KT 1.0 mg/L与NAA组合的增殖系数达到8.58,丛生芽的单芽较为粗壮,且有根发生,有利于继代培养或生根壮苗培养。
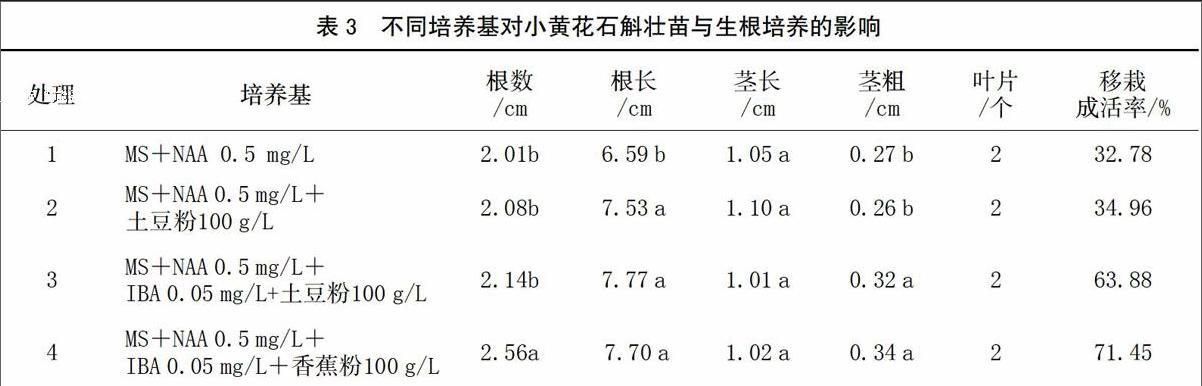
2.3 不同培养基对壮苗与生根培养的影响
丛生芽经分化生长培养即可单苗转接进行壮苗与生根培养,以MS为基本培养基,研究了生长素和天然有机复合物对幼苗生长的影响,并统计了幼苗移栽成活率(表3)。第4种培养基中添加了NAA、低浓度的IBA和香蕉粉汁,培养效果最好,幼苗生根数最多,移栽成活率达到71.45%,根长、茎长和茎粗均表现优异。研究发现,所有幼苗均在茎的顶端着生2个叶片,而且不同培养基对幼苗茎长的影响不大;幼苗虽然植株矮小,生长慢,但根系发达,生根多,根系长,一般成苗时已布满整个培养基,这是由小黄花石斛的遗传特性决定的。
3 讨论
培养基中的无机营养成分(大量元素和微量元素)是植物生长必须的,而植物不同发育阶段对元素的种类和需求量各不相同。1/2 MS培养基可使小黄花石斛种子提早萌发并提高萌发率,可见较低的无机营养成分更适合石斛种子初期的生长发育,同样的研究结果出现在石斛属其它植物的组织培养中,如金钗石斛[4]、铁皮石斛[5]。
激素对植物组培快繁起着至关重要的作用,组织培养中的技术难点之一就是控制各种激素在培养基中的浓度。控制所添加的细胞分裂素和生长素的浓度,可以控制芽或根的分化,细胞分裂素/生长素的比值大时有利于芽的形成,比值小时则有利于生根[6]。本研究结果也证实了上述观点,增殖培养中NAA 0.2 mg/L浓度保持不变,KT浓度在0.5 mg/L时芽少根多,NAA浓度在1.0 mg/L时显著提高了增殖率,达到最大的8.58倍,而KT浓度提高到1.5 mg/L时则抑制芽的生长。在壮苗与生根培养时,向NAA 0.5 mg/L +土豆粉100 g/L培养基中添加低浓度的IBA 0.05 mg/L,幼苗的茎粗即显著增大,移栽成活率大幅提高,说明2种生长素配合使用比单一激素效果要好。
在兰科植物的组织培养时,常用到椰乳、香蕉粉、土豆粉等天然有机复合物,其主要作用可能是为植物生长提供某些生理活性物质或补充某些未知的微量成分,而在不同培养阶段,则表现为促进或抑制生长效果[7-11]。试验研究表明,土豆粉明显抑制了种子萌发生长,种子萌发变慢且发芽较少,这可能是土豆粉中含有的植物激素、酶、无机盐等某种成分干扰了其正常发育过程。土豆粉对根系诱导与壮苗没有明显的促进效果,香蕉粉比土豆粉更好诱导生根,幼苗健壮,利于移栽成活,移栽成活率达到71.45%。有研究表明,香蕉粉提取物可促进植株根系发达,促进茎叶生长;能促进试管苗酶的活性,有效增强幼苗的抗逆性;还对维持培养基的pH值有缓冲作用[12]。本研究初步建立了小黄花石斛组培快繁技术,但该物种株小苗弱,组培苗移栽成活率偏低,丛生芽增殖、分化及生根壮苗阶段,还有待进一步研究。
综上,本研究以小黄花石斛的种子为外植体,种子萌发诱导、丛生芽增殖、壮苗与生根培养, 形成完整植株,经炼苗移栽后,得到表型一致的健壯种苗。本技术具有操作简单、污染率低、繁殖系数高等优点,可应用于种质资源保存、遗传育种及规模化育苗等。
参考文献
[1] 中国科学院中国植物志编辑委员会.中国植物志(第19卷)[M]. 北京:科学出版社,1999:79.
[2] 武荣花.我国石斛属植物种质资源及其亲缘关系研究[D]. 北京:中国林业科学研究院,2007.
[3] 金剑峰,朱思眉,蒋 明,等.石斛属植物rDNA ITS序列的克隆与分析[J].浙江农业学报,2014,26(3):685-692.
[4] 唐金刚,卢文芸,乙 引,等.药用金钗石斛快速繁殖的研究[J]. 贵州科学,2007,25(1):59-62.
[5] 罗吉凤,程治英,龙春林.铁皮石斛快速繁殖和离体种质保存的研究[J]. 广西植物,2006,26(1):69-73.
[6] 洪森荣,肖波,江 静. KT和NAA对铁皮石斛带芽茎段生长发育的影响[J]. 江苏农业科学,2012,40(1):55-56.
[7] 朱 桥. 血叶兰的组织培养与快速繁殖[J]. 植物生理学报,2014,50(6):805-809.
[8] 黎建玲,黄肇宇,詹源庆,等.金钗石斛试管苗生根研究[J].广西科学院学报,2006,22(2):87-89.
[9] 杜 刚,来天超,杨海英.兜唇石斛的组织培养研究[J].北方园艺,2012(8):140-141.
[10] 陈春满,何蜜丽,蒋雄辉,等.不同基本培养基及有机添加物对3个朵丽蝶兰品种组培苗生长的影响[J].亚热带植物科学,2008,37(4):32-34.
[11] 宋智琴,杨平飞,罗 鸣,等.不同添加物对白及组培壮苗培养的影响[J].贵州农业科学, 2016,44(3):138-140.
[12] 李 亮,张冬敏,雷华辉,等.植物组织培养中有机添加物应用研究[J].宁夏农林科技,2012,53(2):28-30,34.
