胶质细胞源性神经营养因子修饰的骨髓间充质干细胞移植治疗脊髓损伤的效果
2017-06-09冯新民毕松超杨建东
吴 朗, 黄 成, 冯新民, 毕松超, 陈 涛, 王 鹏, 杨建东
(扬州大学临床医学院, 江苏 扬州, 225000)
胶质细胞源性神经营养因子修饰的骨髓间充质干细胞移植治疗脊髓损伤的效果
吴 朗, 黄 成, 冯新民, 毕松超, 陈 涛, 王 鹏, 杨建东
(扬州大学临床医学院, 江苏 扬州, 225000)
目的 观察胶质细胞源性神经营养因子(GDNF)修饰的骨髓间充质干细胞( BMSCs)分化为神经元样细胞对大鼠脊髓损伤的修复作用。方法 以载GDNF基因的重组腺病毒转染BMSCs以诱导其分化。选取36只SD大鼠制成脊髓损伤模型,随机分成3组。对36只大鼠于造模后1、2、3、4周行BBB评分,并于造模后第4周取材行HE染色及免疫组化染色,观察脊髓损伤修复情况。结果 载GDNF基因重组腺病毒转染后, BMSCs可持续、稳定表达较高水平的GDNF, 并能成功诱导BMSCs向神经元样细胞分化。术后1~4周, C组BBB评分均明显高于其他2组, A组最低且无明显变化; 术后4周HE染色结果显示, A组脊髓空洞面积最大, C组空洞面积最小; 术后4周, A组脊髓损伤部位出现少量NF200、GFAP阳性细胞, C组较B组和A组则明显增多。结论 GDNF基因修饰的BMSCs能成功分化为神经元样细胞,移植后对大鼠脊髓损伤具有一定的修复作用。
脊髓损伤; 骨髓间充质干细胞; 胶质细胞源性神经营养因子
脊髓损伤是一种严重的神经系统疾病,可引起轴突损伤以及大量的神经细胞死亡[1], 造成患者感觉和运动功能的丧失[2]。传统的手术、药物、物理疗法虽然可以在短期内提高患者的生活质量,但并不能促进损伤神经的修复及其功能的恢复[3]。随着组织工程的不断发展,细胞移植为治疗脊髓损伤提供了一条新的途径,其中骨髓间充质干细胞是理想的种子细胞。已有研究[4-5]证实,骨髓间充质干细胞可以通过分化成为神经细胞替代受损组织、分泌神经保护性营养因子、减轻炎症反应、促进轴突再生及重建神经通路等途径促进脊髓损伤动物模型神经功能的恢复。但由于受损伤后炎症、氧自由基等的影响,移植后的细胞分化并不理想,直接应用骨髓间充质干细胞移植治疗脊髓损伤的效果是有限的[6]。因此,体外促进BMSCs向神经样细胞分化在脊髓损伤的治疗中有重要的研究价值。本实验以GDNF基因修饰BMSCs, 于体外诱导其分化为神经元样细胞后移植治疗脊髓损伤大鼠,对其疗效进行观察并对比研究局部移植和静脉移植两种移植途径的疗效,现报告如下。
1 材料与方法
1.1 主要试剂和仪器
实验动物: 180 g Wister大鼠,购自扬州大学实验动物中心; 病毒,载胶质细胞源性神经营养因子和绿色荧光蛋白基因重组腺病毒(AD-rGDNF-GF)由扬州大学医学院生化实验室进行构建和扩增; DMEM培养基; 超净工作台; CO2培养箱; 石蜡切片机; 荧光显微镜。
1.2 BMSCs的分离与培养
收集实验大鼠股骨骨髓于离心管中,以1 000 r/min离心10 min, 取沉淀,以含10%胎牛血清、1%青霉素/链霉素的DMED重悬后于5%CO2、37 ℃培养箱中孵育48 h。之后每3~4 d更换1/2体积培养液,显微镜观察当细胞达80%融合后,以胰酶消化贴璧细胞并传代培养。取第3代细胞检测CD34、CD44、CD45、CD90分子的表达情况,行BMSCs鉴定。
1.3 体外转染
将BMSCs以5×104/孔的密度种植于6孔板中,置于37 ℃、5%CO2培养箱中培养。待细胞贴壁后用胰酶消化细胞。向各孔中加入无血清DMEM和重组腺病毒悬液,共2 mL, 使感染复数MOI为100。于恒温培养箱中孵育2 h后更换培养液为含10%胎牛血清的DMEM培养液继续培养。转染后应用倒置荧光显微镜观察转染情况, Western Blot法检测GDNF的表达,免疫荧光鉴定Neun、Nfl的表达。
1.4 动物分组及大鼠脊髓损伤模型的制备
将48只大鼠随机分为实验分为3组, A组为模型组, B组为静脉移植组, C组为局部移植组。采用改良Allen′s打击法[7]制作动物脊髓损伤模型。以0.3%戊巴比妥钠腹腔注射麻醉大鼠。以T12棘突为中心,从背部正中切开皮肤,逐层暴露皮下组织,分离椎旁组织、显露T11~L1棘突和椎板。去除T12椎板和棘突,显露脊髓。以10 gcf致伤能量打击脊髓,造成脊髓损伤。以大鼠躯体抖动、双后肢回缩样扑动以及尾巴痉挛性摆动为造模成功标准。
1.5 运动功能评分
参照BBB评分标准,分别于术后当天及术后1、2、3、4周对各组大鼠行运动功能评分。
1.6 免疫荧光
制作细胞爬片,置于5%CO2、37 ℃培养箱培养。取细胞爬片,用4%多聚甲醛固定10 min, PBS漂洗5 min; 0.5%Triton穿孔15 min, PBS漂洗2次,每次5 min; 1%胎牛血清封闭30 min; 加入稀释的一抗,置于4 ℃冰箱过夜; PBS漂洗2次,每次5 min; 加入稀释的二抗,置于室温杂交2 h; PBS漂洗2次,每次5 min; 5 μg/mL DAPI染色2 min; 抗淬灭封片剂封片备用。
1.7 HE染色
取实验动物损伤区脊髓制成切片备用。苏木素染色5 min, 自来水冲洗去除残留染色液; 盐酸酒精分化30 s, 冲洗; 返蓝液返蓝5 min, 冲洗; 伊红水溶液浸染5 min; 梯度乙醇脱水,每级1 min。切片入二甲苯2次,每次约1 min; 滴加适量树胶封片。
1.8 免疫组化
取实验大鼠损伤区脊髓制成冰冻切片固定。PBS清洗3次,每次3 min; 加入3%双氧水室温孵育10 min; PBS清洗3次,每次3 min; 加入5%山羊血清,室温孵育20 min; 加入1∶200稀释的NSE、NF-200抗体, 4 ℃过夜; PBS清洗3次,每次1 min; 加入二抗,37 ℃孵育30 min; PBS清洗3次,每次3 min; DBA染色3~10 min; 蒸馏水清洗2次,每次1 min; 封片。
2 结 果
2.1 转染结果
载GDNF基因重组腺病毒转染BMSCs 24 h后,在荧光显微镜下可观察到绿色荧光蛋白GFP的表达,随着时间的延长荧光蛋白GFP的荧光强度渐增强,转染7 d后荧光蛋白GFP的表达最强, 14 d后荧光明显减弱。见图1。

图1 荧光显微镜下观察AD-rGDNF-GFP转染BMSCs后第1、3、7、14天绿色荧光蛋白GFP的表达情况(300倍)
2.2 GDNF蛋白情况
分别于转染后第1、3、7、14天使用Western Blot法检测,发现BMSCs可以持续、稳定表达GDNF蛋白。见图2。
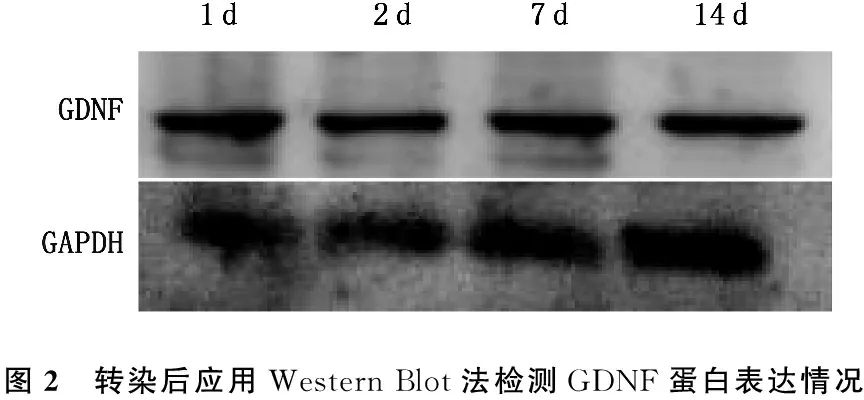
图2 转染后应用WesternBlot法检测GDNF蛋白表达情况
2.3 神经元样细胞的免疫荧光鉴定
于荧光显微镜下鉴定BMSCs向神经元样细胞分化的结果显示,转染3 d后免疫荧光显微镜下可观察到神经元特异性标志物神经元蛋白NeuN的表达,呈红色。7 d后可观察到神经丝蛋白NF-L的表达,呈红色,且细胞呈现典型的神经细胞突触结构。见图3。
2.4 BBB评分结果
造模后大鼠双下肢立即瘫痪, BBB评分为0。术后1~4周,A、B、C组BBB评分均有不同程度的提高,但B、C组较A组显著明显(P<0.05)。术后1周,局部移植组C组与静脉移植组B组BBB评分比较无显著差异(P>0.05); 术后2~4周, B、C组评分出现逐渐增高趋势, C组评分增高较B组显著(P<0.05)。见表1。
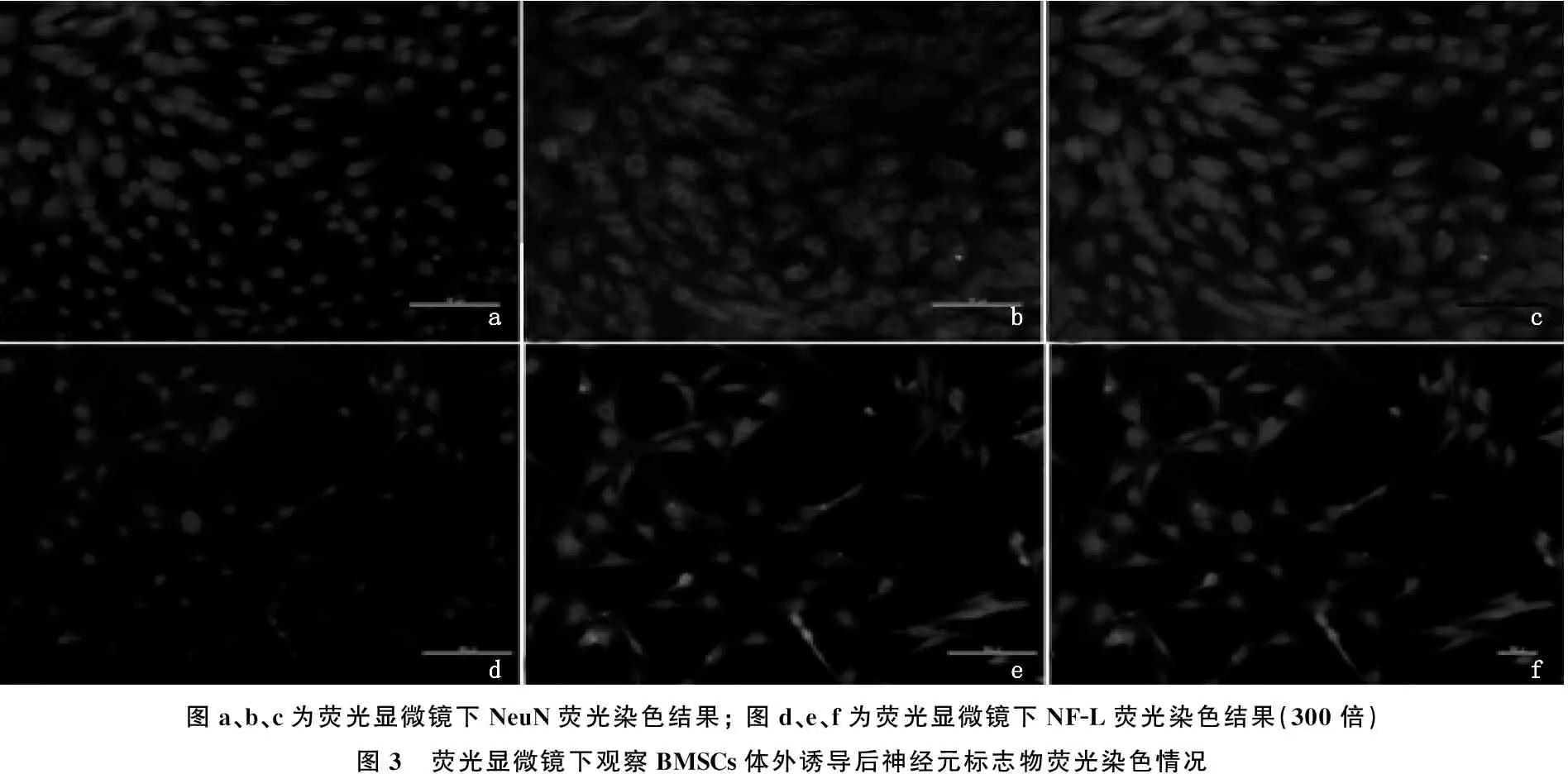
图a、b、c为荧光显微镜下NeuN荧光染色结果;图d、e、f为荧光显微镜下NF-L荧光染色结果(300倍)图3 荧光显微镜下观察BMSCs体外诱导后神经元标志物荧光染色情况
2.5 脊髓HE染色结果
术后4周脊髓组织HE染色显示, A、B、C组均有不同程度的脊髓损伤。A组脊髓空洞面积最大, C组脊髓空洞面积明显小于B组。见图4。

图a为A组脊髓HE染色结果;图b为B组脊髓HE染色结果;图c为C组脊髓HE染色结果(60倍)图4 显微镜下观察移植后4周脊髓HE染色结果
2.6 脊髓免疫组化结果
术后4周免疫组化显示, 3组脊髓均有不同程度的NF-200、GFAP阳性细胞形成,其中A组最少,C组脊髓损伤局部NF-200、GFAP阳性细胞明显多于A、B组。见图5。

图a、b、c分别为A、B、C组NF-200脊髓免疫组化结果;图d、e、f分别为A、B、C组GFAP脊髓免疫组化结果(600倍)图5 显微镜下观察移植后4周脊髓GFAP免疫组化结果

表1 各组大鼠不同时间点BBB评分比较
与A、B组比较, *P<0.05; 与A组比较, #P<0.05。
3 讨 论
骨髓间充质干细胞是一类具有多向分化潜能和自我更新能力的干细胞,在特定的条件下,可以分化为骨细胞、软骨细胞、脂肪细胞、神经元样细胞等[8]。其由于具有易于分离、培养且移植不受伦理道德的约束等有点,被广泛应用于脊髓损伤模型的研究。Woodbury等[9]在体外用二甲基亚砜和丁基羟基茴香醚成功诱导骨髓间充质干细胞分化为神经元样细胞,并表达神经元特异性烯醇化酶(NSE),这表明BMSCs可以向神经元样细胞分化。已有研究[10]证实, BMSCs分化的神经元样细胞有利于促进脊髓损伤的修复,而移植神经元样细胞治疗脊髓损伤的关键在于促进移植细胞在受损局部的存活及神经通路的重建。
作者的前期研究[11]发现, BMSCs在GDNF的诱导下可以向神经样细胞分化,并能稳定表达神经元特异性标志物,但依靠外源性GDNF诱导分化的作用不稳定,难以持续且成本较高。本研究通过载以GDNF基因的重组腺病毒载体转染BMSCs, 以期通过BMSCs自身持续、稳定表达的GDNF蛋白诱导其分化。于构建AD-rGDNF-GFP载体转染BMSCs 3 d后通过倒置荧光显微镜可观察到BMSCs中绿色荧光蛋白GFP高效表达,提示有较高的转染效率。通过Western blot法检测发现,转染后的BMSCs可以持续、稳定表达GDNF蛋白,并能维持其较高的浓度。应用免疫荧光检测发现神经元标志物NeuN、NF-L均有表达,表明BMSCs已成功分化为神经元样细胞。作者还通过RT-PCR检测发现,GDNF诱导后BMSCs中的神经营养因子BDNF、NT-3等表达显著增加,而这些神经营养因子在脊髓损伤后的神经再生中起着重要的作用[12]。
GDNF属于TGF-β超家族,是一种生物活性很强的细胞因子,在体内分布广泛,它能促进神经细胞存活、神经细胞轴突再生以及突触形成,并对神经元有着重要的保护作用[13]。有研究[14]发现, GDNF可以通过改善局部缺血以及减少少突细胞的细胞凋亡等途径提升脊髓损伤大鼠的后肢运动功能,对脊髓损伤的修复具有一定的作用。
本实验通过病毒转染的方法将载有GDNF基因的腺病毒载体导入BMSCs中,诱导其向神经元样细胞分化,并将分化后的BMSCs移植入脊髓损伤的大鼠体内来研究其对脊髓损伤的修复作用。运动功能评分是评价脊髓损伤神经功能恢复的重要指标[15]。本研究分别于造模后1、2、3、4周对实验大鼠进行BBB评分,结果显示术后1~4周, A、B、C组BBB评分均有不同程度的提高,但B、C组较A组显著提高(P<0.05)。术后1周,局部移植组C组与静脉移植组B组BBB评分比较无显著差异(P>0.05); 术后2~4周, B、C组评分出现逐渐增高趋势, C组评分增高较B组显著(P<0.05)。NF-200主要存在于轴突中,它的表达增高表示神经元以及轴突的再生和生长,有利于大鼠神经功能的恢复[16]。GFAP被认为是胶质细胞的标志性蛋白,其表达量的增加表明胶质细胞的形成。研究[17-18]认为,在脊髓损伤前期其表达量的增加有利于脊髓损伤的修复,这可能与其分泌的神经营养因子有关; 在脊髓损伤后期其表达量的增加会阻碍神经轴突形成,不利于脊髓损伤的修复。术后4周脊髓组织免疫组化3组脊髓均有不同程度的NF-200、GFAP阳性细胞形成,其中A组最少, C组脊髓损伤局部NF-200、GFAP阳性细胞明显多于A、B组。本实验在大鼠脊髓损伤模型的治疗上取得了一定的疗效,推测其机制可能为: ① 分化后的BMSCs细胞通过替代已损伤的神经细胞发挥修复脊髓损伤的作用; ② 6BMSCs细胞分泌的神经营养因子促进了脊髓损伤修复; ③ 持续表达的GDNF对损伤的脊髓具有一定的修复作用。
目前,研究移植BMSCs治疗脊髓损伤常用的方法主要有局部注射移植、经静脉移植、经蛛网膜下腔移植等。本实验选取局部移植和经静脉移植两种方法进行比较研究,发现局部移植组的BBB评分明显高于静脉移植组,这可能与到达损伤部位的细胞数量有关[19]。虽然在脊髓损伤时BMSCs具有一定的向损伤部位迁移的特性[20], 但是由于脾、肺、肝等器官的“首关效应”,使得通过静脉移植的细胞大量死亡,达到损伤部位的细胞很少[21]。本实验结果显示局部移植组的疗效优于静脉移植组,但有学者[22]认为局部移植本身具有一定的创伤性,会加重局部组织的损伤。比较而言,静脉移植是一种无创的治疗方法,不会造成损伤部位的二次损伤,但是由于首关效应造成了大量移植细胞的死亡,其对脊髓损伤的修复效果并不理想。
[1] Wu S, Cui G, Shao H, et al. The Cotransplantation of Olfactory Ensheathing Cells with Bone Marrow Mesenchymal Stem Cells ExertsAntiapoptotic Effects in Adult Rats after Spinal Cord Injury[J]. Stem cells International, 2015: 1201-1205.
[2] Wang L J, Zhang R P, Li J D. Transplantation of neurotrophin-3-expressing bone mesenchymal stem cells improves recovery in a rat model of spinal cord injury[J]. Acta Neurochir, 2014, 156: 1409-1418.
[3] Bryukhovetskiy A S, Bryukhovetskiy I S. Effectiveness of repeated transplantations of hematopoietic stem cells in spinal cord injury[J]. World J Transplantation, 2015, 5(3): 110-128.
[4] Lin W P, Chen X W, Zhang L Q, et al. Effect of Neuroglobin Genetically Modified Bone Marrow Mesenchymal Stem Cells Transplantation on Spinal Cord Injury in Rabbits[J]. PLoS One, 2013, 8(5): e63444.
[5] 王郦, 王倩, 张晓明. 骨髓间充质干细胞治疗脊髓损伤的研究进展[J]. 中国骨伤, 2014, 27(5): 437-440.
[6] Jia Y, Wu D, Zhang R, et al. Bone marrow-derived mesenchymal stem cells expressing the Shh transgene promotes functional recovery after spinal cord injury in rats[J]. Neurosci Lett, 2014, 573: 46-51.
[7] Allen A R. Surgery of experimental lesion of spinal cord equivalent to crush injury of fracture disloeaion of spinal colum[J]. Jama, 1991, 4: 878-880.
[8] Yang Q, Mu J, Li Q, et al. Asimple and efficient method for derving neurospheres from bone marrow stromal cells[J]. Biochem Biophys Res Commun, 2008, 372(4): 520-524.
[9] Woodbury D, Schwarz EJ, Prockop DJ, et al. Adult rat and human bone marrow stromal cells differentiate into neurons[J]. Neurosci Res, 2000, 61(4): 364-370.
[10] 高平, 孙占胜, 王伯珉, 等. 骨髓间充质干细胞诱导成神经元样细胞移植治疗脊髓损伤[J]. 中国组织工程研究, 2013, 17(23): 4256-4263.
[11] Jian-Dong Yang, Cheng-Huang, Jing-Cheng Wang, et al. The isolation and cultivation of bone marrow stem cells and evaluation of differences for neural-like cells differentiation under the induction with neurotrophic factors[J]. Cytotechnology, 2014, 66(6): 1007-19.
[12] Zhang R P, Wang L J, He S, et al. Effects of Magnetically Guided, SPIO-Labeled, and Neurotrophin-3 Gene-Modified Bone Mesenchymal Stem Cells in a Rat Model of Spinal Cord Injury[J]. Stem Cells International, 2016: 321-326.
[13] Deng L X, Deng P, R Y W, et al. A Novel Growth-Promoting Pathway Formed by GDNF Overexpressing Schwann Cells Promotes Propriospinal Axonal Regeneration, Synapse formation, and Partial Recovery of Function after Spinal Cord Injury[J]. J Neurosci, 2013, 33(13): 5655-5667.
[14] CH Kao, SH Chen, CC Chio, et al. Exogenous administration of glial cell line-derived neurotrophic factor improves recovery after spinal cord injury[J]. Resuscitation, 2008(77) 395-400.
[15] Wen Ping Lin, Xuan Wei Chen, Li Quan Zhang, et al. Effect of Neuroglobin Genetically Modified Bone Marrow Mesenchymal Stem Cells Transplantation on Spinal Cord Injury in Rabbits[J]. Plos One, 2013, 8(5): 127-129.
[16] 赵学正, 唐开. 骨髓间充质干细胞治疗大鼠脊髓损伤移植途径的实验[J]. 中华骨与关节外科杂志, 2015, 8(3): 246-252.
[17] Nagamoto-Combs K, Morecraft RJ, Darling WG, et al. Long-term gliosis and molecular changes in the cervical spinal cord of the rhesus monkey after traumatic brain injury[J]. J Neurotrauma, 2010, 27(3): 565-585.
[18] Li Z W, Tang R H, Zhang J P, et al. Inhibiting epidermal growth factor receptor attenuates reactive astrogliosis and improves functional outcome after spinal cord injury in rats[J]. Neurochem Int, 2011, 58(7): 812-819.
[19] Dong Ah Shin, Jin-Myung Kim, Hyoung-Ihl Kim, et al. Comparison of functional andhistological outcomes after intralesional, intracisternal, and intravenous transplantation of human bone marrow-derived mesenchymal stromal cells in a rat model of spinal cord injury[J]. Acta Neurochir, 2013(155): 1943-1950.
[20] Svetlana M S, Parvin S, Richard F K, et al. Monocyte chemoattractant protein-1 regulation of blood-brain barrier permeability[J]. J Cereb Blood Flow Metab, 2005, 25( 5): 593-606.
[21] Takahashi Y, Tsuji O, Kumagai G, et al. Comparative study of methods for administering neural stem/progenitor cells to treat spinal cord injury in mice[J]. Cell Transplant, 2010, 20(2): 727-739.
[22] Sasaki H, Tanaka N, Nakanishi K, et al. Therapeutic effects with magnetic targeting of bone marrow stromal cells in a rat spinal cord injury model[J]. Spine(Phila Pa 1976),2011: 36: 933-938.
Effect of bone marrow mesenchymal stem cells modified by GDNF in transplantation treatment of patients with spinal cord injury
WU Lang, HUANG Cheng, FENG Xinming, BI Songchao, CHEN Tao, WANG Peng, YANG Jiandong
(ClinicalMedicalCollegeofYangzhouUniversity,Yangzhou,Jiangsu, 225000)
Objective To observe the effectiveness of transplantation of neuron-like cells induced by GDNF from BMSCs on treatment of spinal cord injury in rats. Methods Transfected BMSCs by recombinant adenovirus containing the gene of rGDNF and GFP. 36 SD rats with spinal cord injury were randomly divided into three groups. All the 36 SD rats with spinal cord injury were scored by the Basso, Beattle, Bresnahan locomotor rating scale at different time points (1、2、3、4 weeks after operation). In the 4thweek after operation, tissue from the injury section was prepared to observe repair of spinal cord injury. Results BMSCs was able to secrete GDNF continuously after transfected by recombinant adenovirus containing the gene of rGDNF and GFP. After operation, BBB scores in intralesional treatment group significantly increased when compared with that of intravenous treatment group and injury control group. In the 4thweek after operation, HEmatoxylin-eosin staing results showed that cavitation in intravenous treatment group was larger than that in intralesional treatment group with the one of injury control group being the biggest. Immunohistochemical method showed that there were more NF200+cells and GFAP+cells in intralesional treatment group than in the other two groups, and injury control group had the least NF200+cells and GFAP+cells. Conclusion After induced into nuron-like cells, BMSCs can treat spinal cord injury effectively.
spinal cord injury; bone marrow mesenchymal stem cells; Gial cell line-derived neurotrophic factor
2016-12-14
国家自然科学基金面上项目资助项目(81071466); 江苏省六大人才高峰资助项目(2014-WSN-076)
杨建东, E-mail: yangjiandong69@sohu.com
R 744
A
1672-2353(2017)09-094-05
10.7619/jcmp.201709024
