脱氧紫色杆菌素抑制结肠癌TH29细胞增殖及诱导凋亡作用与机制
2017-06-09张海燕王少康邢新会孙桂菊
张海燕,孙 勇,夏 惠,王 锋,王少康,邢新会,孙桂菊*,彭 景
(1.扬州大学食品科学与工程学院,江苏 扬州 225000;2.东南大学公共卫生学院营养与食品卫生系,教育部环境医学工程重点实验室,南京 210009;3.清华大学化学工程系,工业生物催化教育部重点实验室,北京 100084;4.中国肉类食品综合研究中心,北京 100068)
研究报告
脱氧紫色杆菌素抑制结肠癌TH29细胞增殖及诱导凋亡作用与机制
张海燕1,2,孙 勇3,4,夏 惠2,王 锋2,王少康2,邢新会3,孙桂菊2*,彭 景1*
(1.扬州大学食品科学与工程学院,江苏 扬州 225000;2.东南大学公共卫生学院营养与食品卫生系,教育部环境医学工程重点实验室,南京 210009;3.清华大学化学工程系,工业生物催化教育部重点实验室,北京 100084;4.中国肉类食品综合研究中心,北京 100068)
目的 探讨脱氧紫色杆菌素(Deoxyviolacein)对人结肠癌HT29细胞增殖抑制和诱导凋亡及其可能机制。方法 用不同浓度的脱氧紫色杆菌素处理HT29细胞,采用四甲基偶氮唑蓝(MTT)比色法,检测脱氧紫色杆菌素对HT29细胞的抑制率;流式细胞术检测细胞周期和凋亡;Western Blot法检测凋亡相关蛋白Bax、Bcl-2和Caspase9表达的变化。结果 脱氧紫色杆菌素对HT29细胞有明显的增殖抑制作用;可提高G0/G1期细胞比例,降低S期细胞比例;细胞凋亡率升高,Bax和Caspase9蛋白表达升高,Bcl-2蛋白的表达降低。结论 脱氧紫色杆菌素抑制结肠癌HT29细胞增殖并诱导凋亡,其凋亡机制可能作用于线粒体介导的内源性通路。
脱氧紫色杆菌素;HT29细胞;凋亡
结直肠癌是最常见的恶性肿瘤之一,近年来发病率和死亡率总体呈上升趋势[1],位列全球女性和男性常见恶性肿瘤的第二位和第三位[2]。目前,针对结肠癌的主要治疗手段为手术切除,辅以放化疗及生物治疗等,但治疗效果通常不理想,辅助治疗产生的副作用大,预后较差[3]。脱氧紫色杆菌素作为一种蓝紫色的微生物代谢产物,兼具抗肿瘤[4]、抗革兰氏阳性菌[5]和抗植物致病菌[6]等活性,属于低基因毒性物质[7],在医药行业具有广泛的应用前景。已有文献报道,紫色杆菌素和脱氧紫色杆菌素的混合物可以抑制人肿瘤细胞增殖[8, 9],但对于脱氧紫色杆菌素单独作用肿瘤细胞的研究很少,其抗肿瘤作用机制尚不明确。本实验旨在研究脱氧紫色杆菌素对人结肠癌HT29细胞的抑制增殖与凋亡诱导作用,并进一步探索脱氧紫色杆菌素影响HT29细胞凋亡的可能分子机制。脱氧紫色杆菌素结构式如图1所示。

图1 脱氧紫色杆菌素的化学结构Fig.1 Structure of deoxyviolacein
1 材料和方法
1.1 主要试剂和仪器
Centrifude 5424R小型台式高速冷冻离心机(德国Eppendorf公司);TDL-4台式离心机(上海安亭科学仪器厂);IX51倒置显微镜(日本OLYMPUS公司);RT-6000酶标分析仪(美国雷杜公司);FACSCantoⅡ流式细胞仪(美国BD (Becton, Dickinson)公司);电泳仪、电泳槽、水平摇床(北京六一厂);旋涡混匀器(江苏海门其林贝尔公司);半干转膜仪(美国Bio-rad公司);Image Master VDS凝胶自动成像仪(瑞典Pharmacia公司)。
1.2 实验方法
1.2.1 细胞培养
结肠癌HT29细胞复苏后于37 ℃、5% CO2细胞培养箱中,用含10%胎牛血清的McCoy’s 5A培养基(含100 U/mL青霉素、100 U/mL链霉素)培养。
实验分组:对照组:用McCoy’s 5A培养基常规培养细胞;实验组:分别用含脱氧紫色杆菌素浓度为1.2、2.4、4.8、9.6、19.2、38.4 μmol/L的McCoy’s 5A培养基培养细胞。
1.2.2 细胞增殖抑制率检测
采用MTT比色法。取对数生长期HT29细胞,以2×104/L浓度接种于96孔板,每孔接种150 μL,不同组别均设不加细胞、只加培养液的调零孔,培养24 h后吸弃上清,按照不同组别处理加入培养基,每孔150 μL,以培养12、24、36、48 h为检测点,每孔加入MTT溶液20 μL继续培养4 h后吸弃上清,加DMSO溶液150 μL,振荡10 min。以对应的调零孔数值调零,在酶标仪上读取每孔490 nm处的OD值,根据以下公式计算细胞增殖抑制率。
Progress and application of sub-step in vitro testing methods for skin whitening materials 1 1
增殖抑制率=(1-OD实验/OD对照)×100%
1.2.3 细胞周期和凋亡检测
采用流式细胞术。取对数生长期HT29细胞,以1×105/L浓度接种于6孔板,每孔接种2 mL,培养24 h后吸弃上清,加入脱氧紫色杆菌素浓度为0、2.4、9.6、38.4 μmol/L的培养基,培养48 h,收集细胞,按照试剂盒操作、染色,流式细胞仪检测。
1.2.4 凋亡蛋白检测
采用蛋白免疫印迹(Western-Blot)法。细胞培养处理同1.2.3,每孔加200 μL RIPA裂解液,提取蛋白,行SDS-PAGE凝胶电泳,转膜,室温下用含5%脱脂奶粉的TBS封闭2 h。加一抗4 ℃摇床孵育过夜,次日用TBS洗3次,每次10 min,加辣根过氧化物酶标记的羊抗兔IgG抗体,室温孵育1 h,TBS洗膜3次,每次10 min,ECL显色,凝胶成像系统检测杂交信号,以条带灰度值比间接代表各蛋白表达量。
1.3 统计学方法

图2 脱氧紫色杆菌素对HT29细胞增殖的抑制率Fig.2 Inhibition rate of deoxyviolacein on proliferation of HT29 cells
2 结果
2.1 脱氧紫色杆菌素对HT29细胞的增殖抑制作用
脱氧紫色杆菌素对结肠癌HT29细胞的增殖抑制作用与浓度及作用时间呈相关性,随着脱氧紫色杆菌素浓度的增加、作用时间的延长,脱氧紫色杆菌素对HT29细胞的生长抑制作用增强(图2)。当浓度为9.6 μmol/L的脱氧紫色杆菌素作用HT29细胞24 h后,抑制率可达26.0%,在作用时间不变的情况下,抑制率不再随药物浓度的增加而升高;浓度为38.4 μmol/L的脱氧紫色杆菌素作用HT29细胞48 h后,抑制率可高达到56.3%(图2)。以上结果表明,脱氧紫色杆菌素在体外具有较好的抑制肿瘤细胞增殖的效果。
2.2 脱氧紫色杆菌素对HT29细胞周期的影响
流式细胞仪结果显示,随着脱氧紫色杆菌素浓度的增加,处于G0/G1期的细胞比例增加,处于S期细胞的比例减少。与对照组相比,2.4 μmol/L和38.4 μmol/L的脱氧紫色杆菌素作用HT29细胞48 h后,G0/G1期细胞比例显著性增加(P< 0.05);2.4~38.4 μmol/L的脱氧紫色杆菌素作用48 h后,可使处于S期的HT29细胞比例显著降低(P< 0.05)(图3)。以上结果说明,脱氧紫色杆菌素可使结肠癌HT29细胞发生G0/G1期阻滞,使DNA复制受阻,从而抑制肿瘤细胞增殖。
2.3 脱氧紫色杆菌素对HT29细胞凋亡率的影响
通过Annexin V/PI双染色检测HT29细胞的凋亡程度,结果见图4。与对照组相比,脱氧紫色杆菌素可显著增加HT29细胞的凋亡率(P< 0.05),且呈明显的剂量相关性;浓度为38.4 μmol/L的脱氧紫色杆菌素作用48 h后,HT29细胞的凋亡率高达34.7%。以上结果表明,脱氧紫色杆菌素可以增加HT29细胞凋亡比例,诱导HT29细胞发生程序性死亡。
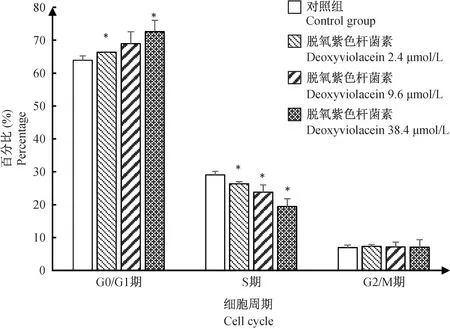
注:与对照组相比,*P < 0.05。图3 脱氧紫色杆菌素作用HT29细胞48h后对周期的影响Note. Compared with the control group,*P < 0.05.Fig.3 Effect of deoxyviolacein on cell cycle of HT29 cells
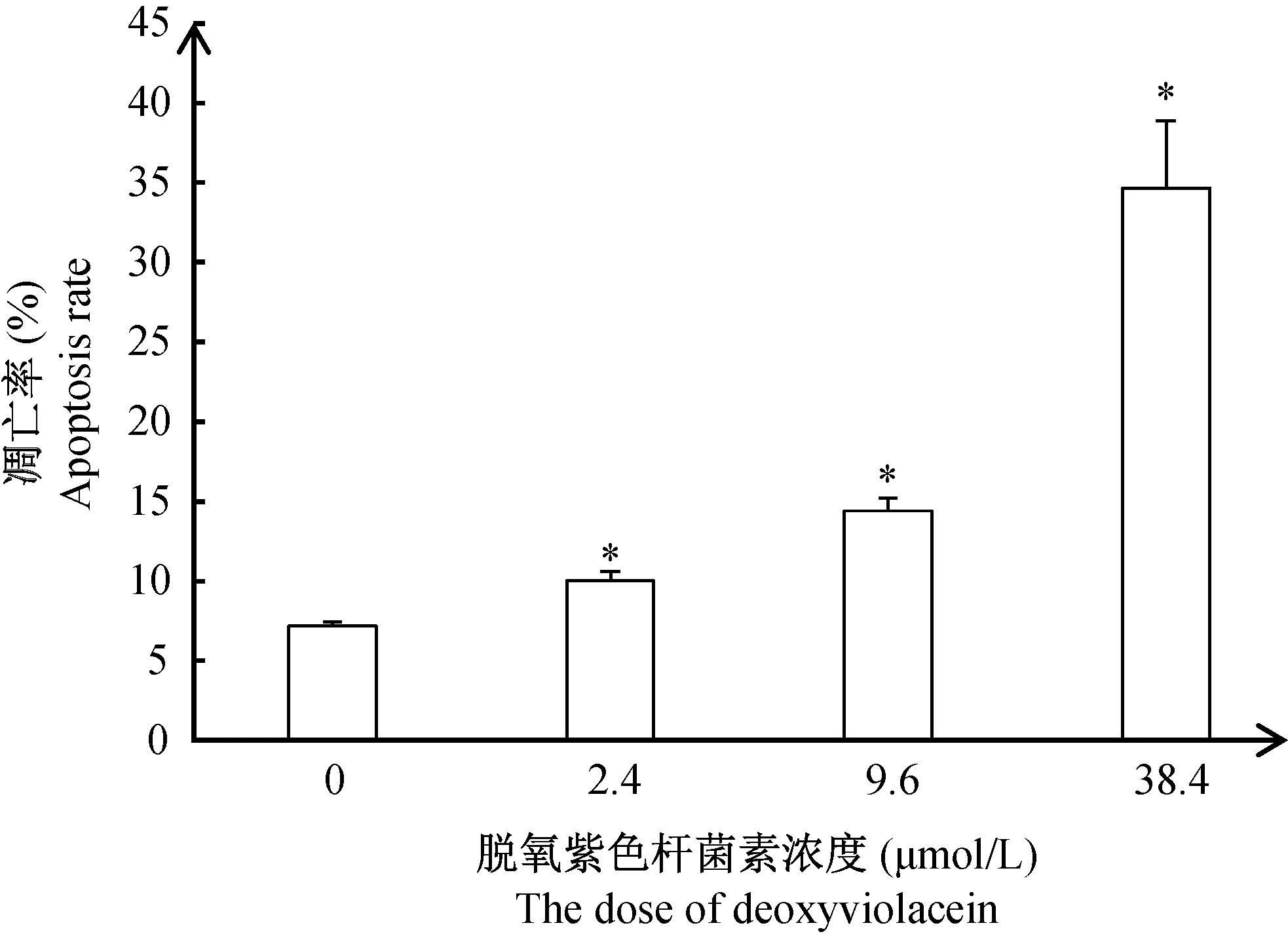
注:与对照组相比,*P < 0.05。图4 脱氧紫色杆菌素对HT29细胞的凋亡的影响Note. Compared with the control group,*P < 0.05.Fig.4 Effect of deoxyviolacein on apoptosis of HT29 cells
2.4 脱氧紫色杆菌素对HT29细胞凋亡相关蛋白表达的影响
经Western-Blot对HT29细胞内相关凋亡蛋白的表达水平分析,结果发现,随着脱氧紫色杆菌素浓度的增加,Bax和Caspase9蛋白表达升高,Bcl-2蛋白表达降低。与对照组相比,浓度为38.4 μmol/L的脱氧紫色杆菌素可明显增加凋亡蛋白Bax和Caspase9的表达水平(P< 0.05);浓度为9.6 μmol/L和38.4 μmol/L的脱氧紫色杆菌素可显著降低Bcl-2蛋白的表达水平(P< 0.05),详见表1。从上述结果可知,脱氧紫色杆菌素可以上调促凋亡蛋白Caspase9和Bax的表达,下调细胞存活促进因子Bcl-2的表达,从而促进HT29细胞的凋亡。
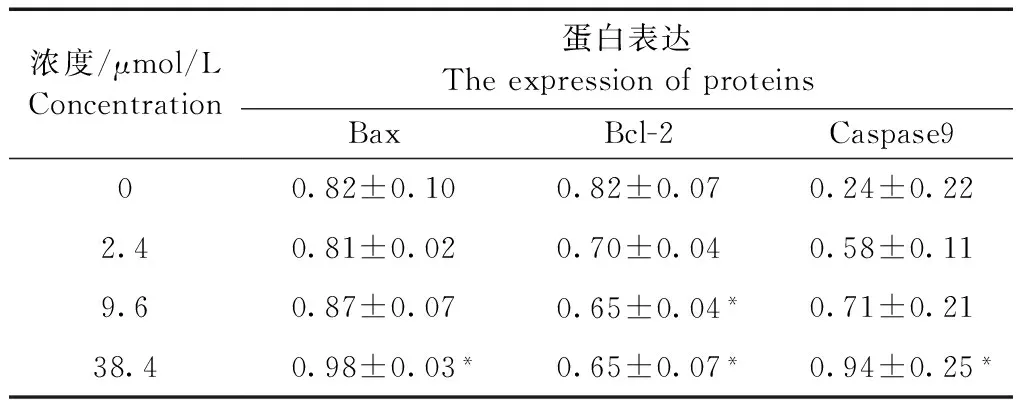
表1 脱氧紫色杆菌素对HT29细胞蛋白表达的影响
注:与对照组相比,*P< 0.05。
Note. Compared with the control group,*P< 0.05.
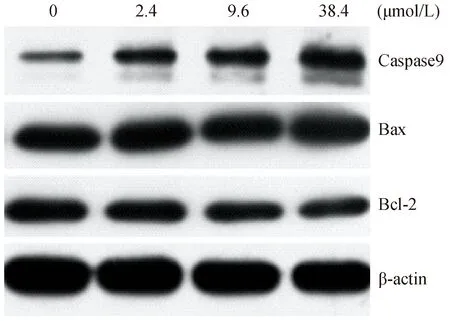
图5 不同浓度脱氧紫色杆菌素Caspase9、Bax、Bcl-2蛋白表达的影响Fig.5 Effect of deoxyviolacein on expression of Caspase9, Bax and Bcl-2 in different concentration
3 讨论
结直肠癌是由环境、饮食以及生活方式与遗传因素等协同作用的结果[10-12],近年来,随着膳食结构和生活饮食习惯的改变,我国结肠癌的发病率也不断上升。5-氟尿嘧啶(5-Fu)作为第一个用于治疗结直肠癌的化疗药物,可降低术后结肠癌复发率,已被应用于结直肠癌化疗领域20余年[13-15]。已有文献报道显示,192 μmol/L的5-Fu作用于HT29细胞24 h和48 h后,抑制率分别可达14.49%和27.79%[16];而本研究通过MTT实验发现,浓度仅为9.6 μmol/L的脱氧紫色杆菌素作用HT29细胞24 h和48 h后,就可以使HT29细胞的增殖抑制率分别高达26.0%和48.0%,显然脱氧紫色杆菌素对结肠癌HT29细胞的增殖抑制效果要明显高于常规化疗药物5-Fu。
细胞无限增殖及凋亡受阻是肿瘤发病的症结所在。细胞增殖源于细胞周期的有序进行,受G1/S、G2/M两个关键点的调控;细胞凋亡是由基因控制的细胞自主有序的主动死亡,肿瘤细胞减弱或失去了凋亡能力。干扰细胞周期的正常运转以及诱导细胞凋亡的发生已经成为抗癌药物作用的新靶点。本实验以不同浓度的脱氧紫色杆菌素处理结肠癌HT29细胞,结果显示脱氧紫色杆菌素可将HT29细胞阻滞在G0/G1期,使DNA合成受阻,不能进行有丝分裂,抑制结肠癌细胞的无限增殖。浓度在2.4~38.4 μmol/L的脱氧紫色杆菌素作用HT29细胞48 h后,可使早凋及中晚期凋亡的细胞比例均明显增加,且凋亡比例随浓度的升高而增加。由此可见,脱氧紫色杆菌素在体外对结肠癌HT29细胞的生长抑制作用,可能是通过阻滞细胞周期、诱发细胞凋亡来实验的。
哺乳动物细胞凋亡主要有内部线粒体介导和外部死亡受体介导两种途径[17, 18]。为了进一步探索脱氧紫色杆菌素对HT29细胞的凋亡机制,选用Western-Blot法检测内部线粒体途径相关蛋白Caspase9、Bax和Bcl-2。Caspase9属于半胱氨酸蛋白酶家族,是细胞凋亡的重要调节因子。Bax和Bcl-2属于Bcl-2家族,通过调节线粒体通透性以及细胞色素C释放介导细胞凋亡。其中,Bcl-2是最主要的抗凋亡蛋白,可以稳定线粒体膜功能,阻止线粒体释放细胞色素C等[19];Bax是最早发现的促凋亡家族成员,主要存在于细胞质中,受到凋亡刺激后转位到线粒体,引起细胞色素C的释放。本实验结果显示随着脱氧紫色杆菌素浓度升高,Caspase9和Bax蛋白表达随之升高,而Bcl-2的蛋白表达随之下降,认为脱氧紫色杆菌素可通过内部线粒体途径诱导HT29细胞凋亡。
当前,结肠癌治疗面临转移复发和对放化疗产生抗性等主要问题[20],进一步明确结肠癌细胞凋亡的分子机制,通过诱导癌变细胞凋亡是癌症治疗需要研究的热点问题。本实验的结果印证,脱氧紫色杆菌素可抑制结肠癌HT29细胞,并干扰细胞周期,诱发细胞凋亡,上调Caspase9和Bax蛋白表达、下调Bcl-2蛋白表达可能是其作用机制之一。接下来,我们将进一步观察脱氧紫色杆菌素对结肠癌细胞其他凋亡通路的影响,为脱氧紫色杆菌素的未来临床应用提供理论基础。
[1] 李道娟,李倩,贺宇彤.结直肠癌流行病学趋势[J].肿瘤防治研究,2015,42(3):305-310.
[2] Ferlay J,Soerjomatarem I,Dikshit R,etal.Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359-E386.[3] Laszlo L.Predictive and prognostic factors in the complex treatment of patients with colorectal cancer[J]. Magy Onkol,2010,54(4):383-394.
[4] Jiang PX,Wang HS,Xiao S,etal.Pathway redesign for deoxyviolacein biosynthesis in Citrobacter freundii and characterization of this pigment[J]. Appl Microbiol Biotechnol,2012,94(6):1521-1532.
[5] Aruldass CA,Rubiyatno,Venil CK,etal.Violet pigment production from liquid pineapple waste by Chromobacterium violaceum UTM5 and evaluation of its bioactivity[J].Rsc Advances,2015,5(64):51524-51536.
[6] Wang HS,WANG FZ,Zhu XF,etal.Biosynthesis and characterization of violacein, deoxyviolaceiri and oxyviolacein in heterologous host, and their antimicrobial activities[J]. Biochemical Engineering Journal,2012,67:148-155.
[7] 孙勇,张金兰,刘鸿儒,等.紫色杆菌素及脱氧紫色杆菌素的基因毒性评价[J].食品科学,2016,37(9):208-213.
[8] Rodrigues AL,Trachtmann N,Becker J,etal.Systems metabolic engineering of Escherichia coli for production of the antitumor drugs violacein and deoxyviolacein[J].Metab Eng,2013,20:29-41.
[9] Menezes CB, Silva BP, Sousa IM,etal.In vitro and in vivo antitumor activity of crude extracts obtained from Brazilian Chromobacterium sp isolates[J]. Braz J Med Biol Res,2013,46(1):65-70.
[10] Vargas AJ,Thompson PA.Diet and Nutrient Factors in Colorectal Cancer Risk[J]. Nutr Clin Pract,2012,27(5):613-623.
[11] 乌日丽其,宋华,李左军,等.结直肠癌患病饮食相关危险因素病例对照研究[J].疾病监测与控制,2016,10(1):70-72.
[12] 万德森.结直肠癌流行趋势及其对策[J].癌症,2009,28(9):897-902.
[13] Pestalozzi BC,Jäger D,Knuth A.[Systemic therapy for colorectal cancer][J].Der Chirurg,2005,76(6):570-574.
[14] 蒋蔚茹,刘杰.结直肠癌化疗进展[J].中国肿瘤,2011,20(3):200-203.
[15] Van Cutsem E,Rivera F,Berry S,etal.Safety and efficacy of first-line bevacizumab with FOLFOX, XELOX, FOLFIRI and fluoropyrimidines in metastatic colorectal cancer: the BEAT study[J].Ann Oncol,2009,20(11):1842-1847.
[16] 周萍.EGCG联合5-FU抑制结肠癌HT-29细胞生长及其机制的实验研究[D].苏州大学,2008.
[17] 赵彦超,顾耘.细胞凋亡通路研究进展[J].现代医学,2013,41(4):285-288.
[18] 刘晓婷,王延让,张明.线粒体介导细胞凋亡的研究进展[J].环境与健康杂志,2013,30(2):182-185.
[19] Adams KW,Cooper GM.Rapid turnover of mcl-1 couples translation to cell survival and apoptosis[J]. J Biol Chem,2007,282(9):6192-6200.
[20] Zhang Q,Sha S,Xu B,etal.Prevalence of colorectal cancer in patients with ulcerative colitis: A retrospective, monocenter study in China[J]. J Cancer Res Ther,2015,11(4):899-903.
Effect of deoxyviolacein on inhibiting proliferation and inducing apoptosis of colon cancer HT29 cells
ZHANG Hai-yan1,2,SUN Yong3,4,XIA Hui2,WANG Feng2,WANG Shao-kang2,XING Xin-hui3,SUN Gui-ju2*,PENG Jing1*
(1.College of Food Science and Technology, Yangzhou University, Yangzhou 225001,China; 2.Key Laboratory of Environmental Medicine and Engineering, Ministry of Education, Department of Nutrition and Food Hygiene, School of Public Health, Southeast University, Nanjing 210009; 3.Key Laboratory of Industrial Biocatalysis, Ministry of Education, Department of Chemical Engineering, Tsinghua University, Beijing 100084,China; 4.China Meat Research Center, Beijing 100068)
Objective To evaluate the effect of deoxyviolacein on the apoptosis in HT29 cells and its possible mechanisms of anticancer effects. MethodsInvitro,human colon cancer HT29 cells were treated by deoxyviolacein in a series of concertrations.The absorbance value was detected by means of MTT assay and growth inhibition rate was calculate.Cell cycle and apoptosis was assessed by flow cytometry.The expression of Bax,Bcl-2 and Caspase9 were analyzed by Western blotting.Results Deoxyviolacein could inhibit the growth of human colon cancer HT29 cells.The cells at period G0/G1and the apoptosis rates were significantly increased,and the cells at period S were significantly decreased.The expression of Bax,Caspase9 were upregulated and Bcl-2 was downregulated by deoxyviolacein at 48 hours.Conclusions Deoxyviolacein could inhibit the growth and induce apoptpsis of human colon cancer HT29 cells.The mechanism may be associated with up-regulation of Bax and Caspase9 and down-regulation of Bcl-2 expression.
Deoxyviolacein; HT29 cells; Apoptpsis
张海燕(1991-),女,硕士研究生,研究方向:营养与食品卫生学。E-mail: zhyrita369@163.com
孙桂菊(1963-),女,博士生导师,研究方向:植物化学物与食品功效。E-mail: gjsun@seu.edu.cn; 彭景(1962-),女,副教授,研究方向:烹饪营养学。E-mail: yzupj@163.com
R-33
A
1671-7856(2017) 05-0089-05
10.3969.j.issn.1671-7856. 2017.05.019
2017-01-18
