Kruppel样因子6对肝癌HepG2细胞的作用及其缺失对斑马鱼肝脏发育的影响
2017-06-09杨振国伍水龙邬永富冯瑜菲高晓霞包仕廷张晶晶
陈 浩,杨振国,伍水龙,邬永富,冯瑜菲,高晓霞,包仕廷*,张晶晶*
(1.广东医科大学附属医院,广东 湛江 524001;2.广东医科大学,广东 湛江 524023)
研究报告
Kruppel样因子6对肝癌HepG2细胞的作用及其缺失对斑马鱼肝脏发育的影响
陈 浩1,2,杨振国1,伍水龙1,邬永富1,冯瑜菲1,高晓霞1,包仕廷1,2*,张晶晶1,2*
(1.广东医科大学附属医院,广东 湛江 524001;2.广东医科大学,广东 湛江 524023)
目的 探讨Kruppel样因子6(KLF6)低表达对肝癌细胞凋亡及迁移能力的影响,并以斑马鱼作为动物模型,研究klf6基因沉默对肝脏发育的作用。 方法 构建敲除KLF6基因质粒,转染肝癌细胞(HepG2)及正常人肝细胞(L-02),通过免疫印迹(WB)、凋亡及细胞周期测定、划痕实验检测KLF6基因敲除后对HepG2细胞的影响;设计合成沉默KLF6基因的吗啉代寡核苷酸(Morpholino),显微注射入转基因斑马鱼Tg(lfabp:eGFP)胚胎中,通过免疫荧光法观察KLF6蛋白表达的变化以及对转基因斑马鱼胚胎肝脏发育表型的影响。 结果 体外实验表明,L-02细胞中的KLF6蛋白的表达量明显高于HepG2细胞;敲除KLF6基因后,HepG2细胞KLF6蛋白表达明显减少、凋亡减弱、细胞周期主要集中于S期、迁移能力增强;体内实验表明,klf6基因沉默后,斑马鱼胚胎肝脏中的KLF6蛋白表达量减少,肝脏发育明显迟缓。 结论KLF6基因低表达促进肝癌细胞的增殖和迁移能力,减少凋亡;且影响斑马鱼肝脏的正常发育。探讨KLF6基因低表达及其功能,可为以后斑马鱼肝癌模型建立及药物筛选提供理论基础。
KLF6基因;HepG2细胞;斑马鱼;Morpholino
肝细胞癌(hepatocelluar carcinoma, HCC)已成为最常见的原发性肝脏恶性肿瘤[1],在世界上所有恶性肿瘤中现在排名第六,在所有癌症死亡率中排第三位[2]。Kruppel样因子6(KLF6)是Kruppel-like factor(KLF)家族基因编码一系列蛋白的转录调控因子,在哺乳动物中KLF基因至少含有18种家族成员,其蛋白C端均含有“C2H2”锌指DNA结合结构域。KLF家族成员在胚胎发育,细胞分化、增殖及凋亡等多种过程中均起着重要的作用[3];且KLF6是一种有效的生长调节剂和抑癌基因[4]。
KLF6在斑马鱼中的同源基因为corepromoterelementbindingprotein(copeb)基因,是一种锌指转录因子和抑癌基因。研究表明,在斑马鱼发育过程中,copeb在消化系统中具有很高的表达水平。利用吗啉代寡核苷酸Morpholino特异性沉默了copeb基因后,肝、胰腺和小肠的发生及发育过程受到严重的影响[5]。
本文通过检测KLF6基因的低表达对肝癌细胞的影响,进一步验证KLF6基因的抑癌作用;并通过斑马鱼肝体内实验,验证klf6基因缺失对斑马鱼肝发育的影响,为以后利用模式动物斑马鱼建立肝癌模型,进一步对KLF6基因进行研究奠定基础。
1 材料和方法
1.1 实验动物
转基因斑马鱼Tg(lfabp:eGFP)由广东医科大学斑马鱼模式动物平台提供。
1.2 主要材料及试剂
肝癌细胞HepG2及正常人肝细胞L-02由广东医科大学附属医院肝胆外科研究所提供。
KLF6多克隆抗体、DAPI、Hoechst抗体购自Sigma公司(美国);Cy5、Cy3标记的山羊抗兔IgG抗体均购自Jackson公司(美国);Rhodamine购自invitrogen公司(美国);β-actin单克隆抗体及辣根过氧化物酶标记羊抗兔、羊抗鼠IgG抗体均购自中杉金桥公司(北京);Morpholino购自Gene Tools公司(美国)序列:5’-TGCACATTGGTAGAACATCCATT GC’-3;piLenti-shRNA-GFP质粒购自恩晶公司(上海);周期检测试剂盒购自碧云天公司(上海);DMEM、胎牛血清(FBS)购自Gibco公司。
1.3 实验方法
1.3.1 细胞培养及质粒转染
肝癌细胞HepG2及正常人肝细胞L-02,用含10% FBS的DMEM培养基,培养于37 ℃,5% CO2恒温培养箱中培养及传代。将HepG2及L-02细胞以3×105/孔的密度接种至6孔板中,当细胞密度达到70%~90%时,利用EnoGeneFecTM2000(EGF2000)对敲除KLF6基因质粒piLenti-shRNA-GFP进行转染,转染8 h后,换成含血清的培养基继续培养24 h(sh-KLF6组)。同时设立未经任何处理的空白对照组(Control组)及空质粒转染(Control-sh)组。
1.3.2 转基因斑马鱼饲养及交配
转基因斑马鱼品系Tg(lfabp:eGFP),在28 ℃循环水系统中培育,丰年虾喂食,交配后,收集鱼卵在胚胎水中培育,放入28 ℃恒温箱中培养[6]。
1.3.3 细胞免疫荧光
将HepG2及L-02细胞以3×105个接种共聚焦皿,于37 ℃,5% CO2恒温培养箱培养48 h;冰浴下丙酮固定10 min;孵育一抗:将浓度为1 mg/mL的KLF6多克隆抗体以1∶200稀释,并在每个共聚焦皿中加入200 μL,4 ℃ 过夜;孵育二抗:将浓度为1.5 mg/mL的Cy5标记的羊抗兔IgG(H+L)以1∶200稀释,并于每个共聚焦皿中加入200 μL,37 ℃ 孵育90 min,4 ℃保存超过30 min;共聚焦显微镜下拍照(Leica,德国),Image-pro Plus 6.0分析图片数据,检测KLF6蛋白在HepG2及L-02细胞系中的表达差异。
1.3.4 Western-blot检测敲除KLF6基因后细胞KLF6蛋白的表达
参照1.3.1方法将piLenti-shRNA-GFP质粒转染入HepG2、L-02细胞,并设立空白对照组(Control组),24 h后,裂解细胞,4 ℃、12000 r/min 离心10 min;收取上清蛋白,进行SDS-PAGE凝胶电泳,以110 V、120 min将蛋白转移到PVDF膜上;用含5%脱脂奶粉的TBST中封闭2 h,分别孵育抗KLF6、β-actin抗体(1∶1000),4 ℃摇床过夜,TBST洗3次,每次10 min,孵育辣根过氧化物酶标记羊抗兔、羊抗鼠IgG抗体,室温孵育120 min,TBST洗3次,每次10 min;GDEQ成像仪(Bio-Rad美国)曝光胶片,并用Quantity one软件分析条带。
1.3.5 HepG2细胞凋亡检测
以1×105/孔的密度接种HepG2细胞到24孔板中,孔中放置已铺collagen胶的细胞玻片,分为3组,Control组、Control-sh组及sh-KLF6组;转染结束后(方法见1.3.1),PBS洗3次,每次5 min,冰上丙酮固定10 min,冰浴75%乙醇洗脱丙酮,冰浴PBS洗2次,每次5 min,Blocking buffer(1%BSA+0.05% Tween20)常温下放置15 min,按推荐的浓度加入抗体,并加入Hoechst(1∶200)室温孵育90 min,Blocking buffer洗5次,每次5 min,封片;Leica荧光显微镜(德国)下拍照,并用Image-Pro Plus 6.0分析图片。
1.3.6 HepG2细胞周期检测
以3×105/孔的密度接种HepG2细胞到6孔板中,实验分为3组,Control组、Control-sh组及sh-KLF6组,转染结束后(方法见1.3.1),用含有EDTA的0.25%的胰酶消化,1000 g离心5 min,弃上清,冰PBS重悬细胞,1000 g离心5 min,再次弃上清,加入70%乙醇固定超过12 h,冰PBS洗2次,每次5 min;染色,每个样品:碘化丙啶(PI)25 μL,RNaseA(50×)10 μL,染色缓存液500 μL,室温下避光30 min;细胞流式仪(BD FACS-CantoII细胞流式仪,美国)检测HepG2细胞周期。
1.3.7 HepG2细胞迁移检测
以3×105/孔的密度接种HepG2细胞到6孔板中,分为3组,Control组、Control-sh组及sh-KLF6组。转染结束后(方法见1.2.1),用10 μL枪头,在6孔板上划痕,每孔划5道平行的划痕,划痕均匀间隔约0.5 cm,划痕后PBS洗2次,换成无血清的DMEM培养,并在显微镜下于0、24、48 h观察拍照;分别计算24 h及48 h的划痕愈合率,计算方法:(0 h划痕宽度-24 h/48 h划痕宽度)÷ 0 h划痕宽度。观察划痕后细胞迁移情况。
1.3.8klf6基因沉默后斑马鱼肝脏表型观察
实验分为2组,正常对照组(Control组)、注射沉默klf6基因Morpholino组(klf6-MO组)。转基因斑马鱼Tg(lfabp:eGFP)交配后,收集鱼卵,在1~2个细胞期,将沉默klf6基因的Morpholino以300 mM的浓度显微注射入胚胎卵黄囊中;将胚胎在胚胎水中28℃培养3 d(3 dpf),5 d(5 dpf),7 d(7 dpf)时,进行麻醉,再用1%低熔点琼脂将2组的胚胎固定在玻底皿中,Leica荧光显微镜(德国)下拍照,并用Image-Pro Plus 6.0分析图片,实验完成后,将斑马鱼胚胎从低熔点琼脂中回收继续培育。
1.3.9 整体免疫荧光法检测转基因斑马鱼沉默klf6基因后蛋白表达
转基因斑马鱼Tg(lfabp:eGFP)交配后,收集鱼卵,分为2组,Control组及klf6-MO组。klf6-MO组显微注射Morpholino,浓度300 mM;胚胎水中28 ℃培养3 d(3 dpf),室温下用4%多聚甲醛固定胚胎鱼2 h,室温下PBST洗3次,每次5 min,室温下50%甲醇-50% PBST、100%甲醇分别脱水5 min后,换成新的100%甲醇-20℃保存至少2 h;再在室温下分别加入75%甲醇-25% PBST、50%甲醇-50% PBST、25%甲醇-75% PBST,各5 min,PBST洗5 min,室温下加入蛋白酶K(Proteinase K,PK)(PK:PBST 1∶1000)消化3 dpf的鱼18 min,PBDT洗5 min,加入4%多聚甲醛室温下再次固定20 min,PBDT洗6次,每次20 min,封闭液(2%FBS+PBDT)封闭1~4 h,加入抗KLF6多克隆抗体(1∶200),4℃过夜;PBDT洗6次,每次20 min,孵育Cy3标记的羊抗兔IgG抗体,4℃过夜;PBDT洗3次,每次5 min后,Leica荧光显微镜(德国)下拍照观察,并用Image-Pro Plus 6.0分析图片。
1.4 统计学方法
2 结果
2.1 细胞免疫荧光结果
通过免疫荧光结果可见,KLF6蛋白主要共定位在细胞核。Image-Pro Plus 6.0对荧光强度的分析结果显示,HepG2细胞中阳性信号占细胞个数的百分比为11.73%±1.40%,L-02细胞中阳性荧光信号占细胞个数的百分比为87.34%±1.75%,可见KLF6蛋白在肝癌细胞HepG2和正常肝细胞L-02中均有表达,且在HepG2中,KLF6蛋白的表达量要明显的低于L-02,二者差异有显著性(P< 0.01)(图1)。
2.2 敲除KLF6基因后HepG2及L-02细胞系中KLF6蛋白的表达
KLF6蛋白在HepG2及L-02细胞中均有表达,且在HepG2中,KLF6蛋白的表达量明显低于L-02,细胞HepG2及L-02转染了敲除KLF6基因的质粒后,细胞中KLF6的蛋白表达量明显降低。通过Quantity one的灰度分析,HepG2细胞表达KLF6蛋白的灰度值为0.11663±0.011,L-02细胞表达KLF6蛋白的灰度值为0.28032±0.024,二者差异有显著性(P< 0.001)。敲除KLF6基因后HepG2细胞表达KLF6蛋白的灰度值为0.04686±0.005,L-02细胞表达KLF6蛋白的灰度值为0.08344±0.006,二者与未转染组的比较,差异有显著性(P< 0.001)(图2)。
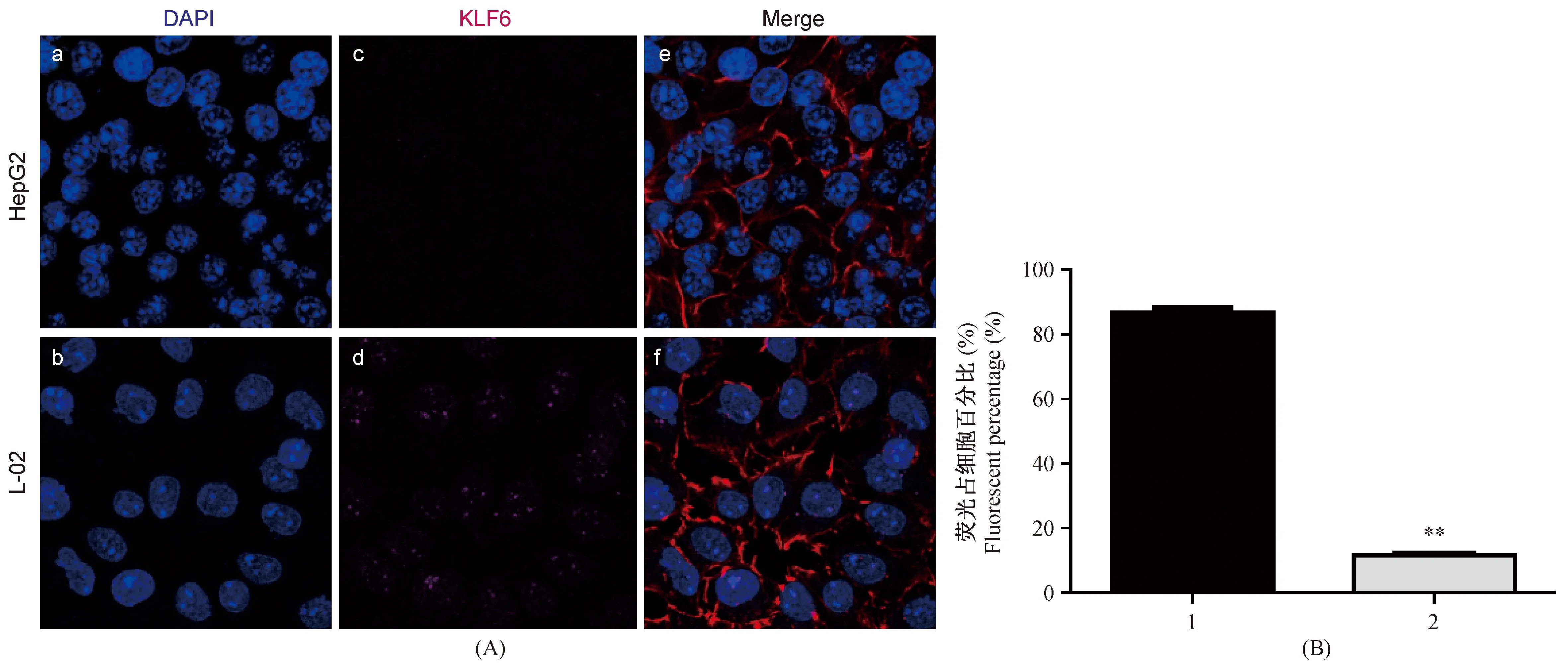
注:(A)a、b细胞核(蓝色);c、d KLF6蛋白(紫色);e、f 细胞骨架F-actin染色(红色)及合成图;(B)1.L-02细胞;2.HepG2细胞;第2组与第1组对比,差异有显著性;**P < 0.01。图1 细胞免疫荧光染色图Note. (A) a, b Nucleus (blue); c, d KLF6 (purple); e, f Cytoskeleton stain with F-actin (red) and Merge. (B) 1. L-02; 2. HepG2; The second group contrast to the first group, with statistical significance, **P < 0.01.Fig.1 Cell immunofluorescence images
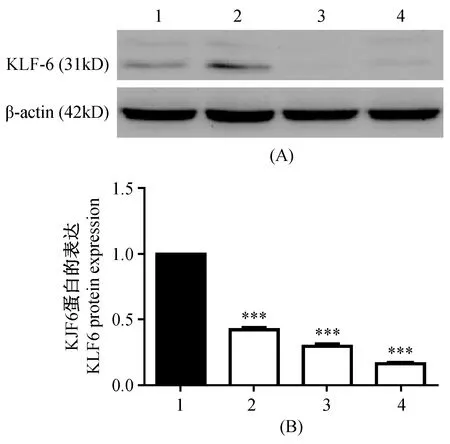
注:(A)1. HepG2;2. L-02;3. HepG2敲除KLF6基因;4. L-02敲除KLF6基因;(B)1. L-02;2. HepG2;3. L-02敲除KLF6基因;4. HepG2敲除KLF6基因;第2、3、4组分别与第1组对比,差异有显著性,***P < 0.001。图2 敲除KLF6基因后HepG2和L-02细胞KLF6蛋白表达Note. (A) 1. HepG2; 2. L-02; 3. HepG2+piLenti-shKLF6-GFP; 4. L-02+piLenti-shKLF6-GFP. (B) 1. L-02; 2. HepG2; 3. L-02+piLenti-shKLF6-GFP; 4. HepG2+piLenti-shKLF6-GFP; The second, third and fourth group were compared with the first group, with statistical significance, ***P < 0.001.Fig.2 KLF6 expression in HepG2 and L-02 cells with knockdown of KLF6
2.3 敲除KLF6基因后对HepG2细胞凋亡的影响
通过Image-Pro Plus 6.0软件对图片进行荧光强度分析,Control组、Control-sh组、sh-KLF6组凋亡细胞占细胞总数的百分比分别为9.62%±0.85%、15.90%±1.28%、14.93%±1.94%,可以看出HepG2细胞Control组和Control-sh组的固缩细胞核占细胞总数比例没有明显区别,sh-KLF6组的凋亡固缩细胞核占细胞总数比例明显少于Control组,差异有显著性(P< 0.01)(图3)。
2.4 敲除KLF6基因后对细胞周期的影响
Control组与Control-sh组对比,细胞处于G0-G1期及S期所占比例没有明显差异。sh-KLF6组细胞处于G0-G1期的比例为43.24%±1.66%,明显少于Control组的59.40%±5.60%;sh-Klf6组细胞处于S期的比例为43.73%±1.40%,明显多于Control组的31.69%±2.38%;差异有显著性(P< 0.01)。三组之间,G2-M期没有明显差异(图4)。
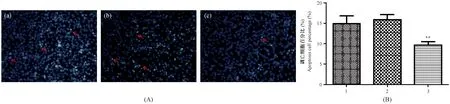
注:(A)红色箭头标注的致密发白的细胞核为凋亡细胞;a. Control组;b. Control-sh组;c. sh-KLF6组;(B)1. Control组;2. Control-sh组;3. sh-KLF6组;第3组与第1组对比,差异有显著性,**P < 0.01。图3 敲除KLF6基因后对HepG2细胞凋亡的影响Note. (A) Red arrows indicate the dense pale nucleus of apoptotic cells. a. Control; b. Control-sh; c. sh-KLF6. (B) 1. Control; 2. Control-sh; 3. sh-KLF6; The third group contrast to the first group, with statistical significance, **P < 0.01.Fig.3 The effects of knockout of KLF6 on the apoptosis of HepG2
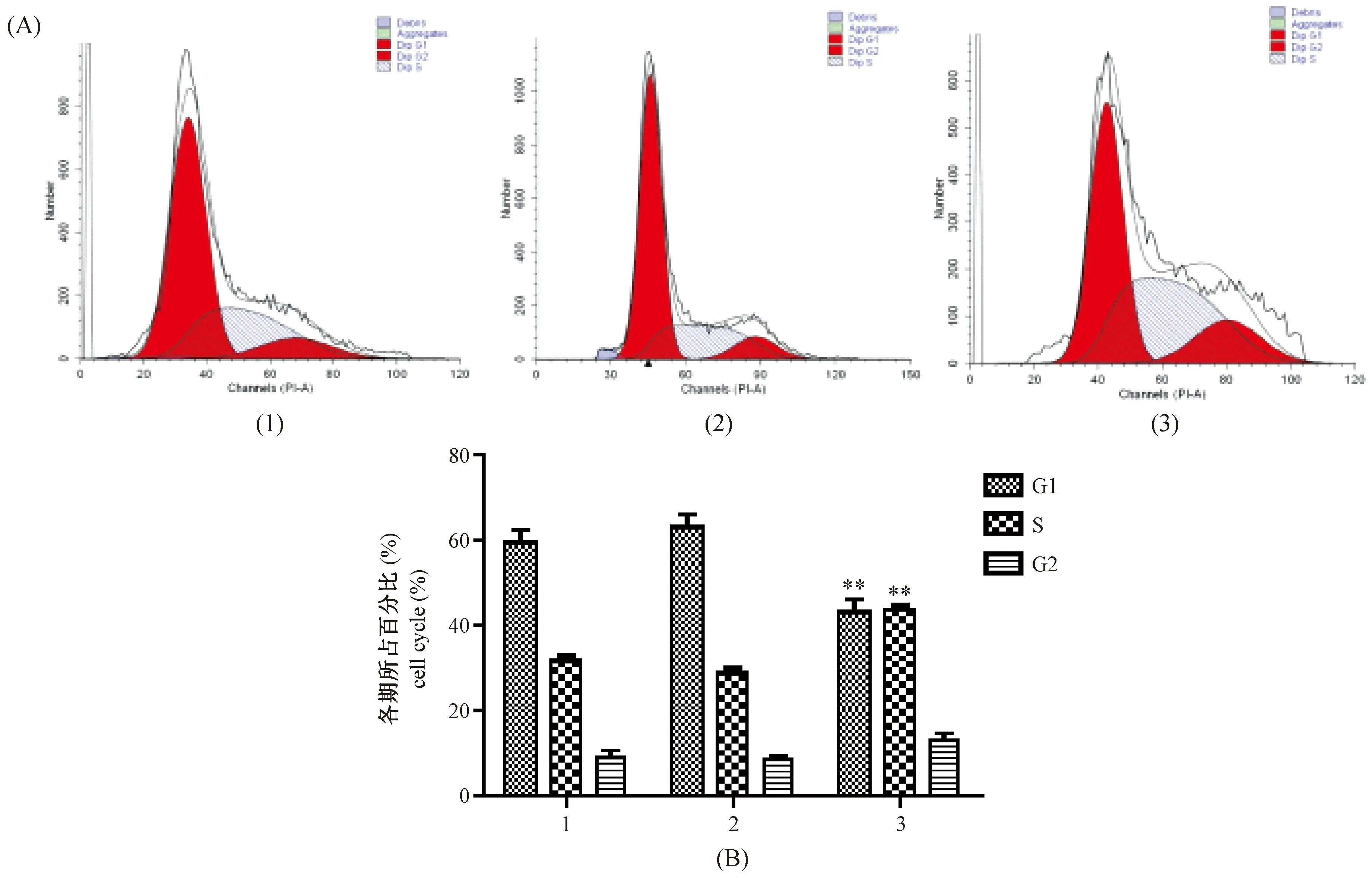
注:(A、B)1. Control组;2. Control-sh组;3. sh-KLF6组;(B)3组中G1期、S期与1组G1期、S期对比,差异有显著性,**P < 0.01。图4 敲除KLF6基因对HepG2细胞周期的影响Note. (A, B) 1. Control; 2. Control-sh; 3. sh-KLF6; (B) G1 phase, S phase of the third group contrast to G1 phase and S phase of the first group, with statistical significance, **P < 0.01.Fig.4 The effects of knockout of KLF6 on HepG2 cell cycle
2.5 敲除KLF6基因后对细胞迁移能力的影响
划痕24 h后sh-KLF6组的划痕愈合率为50.16%±3.12%,Control组的为28.74%±1.33%,Control-sh组的为29.65%±4.64%;划痕24 h后sh-KLF6组的划痕愈合率76.35%±2.86%,Control组的为61.26%±2.40%,Control-sh组的为63.23%±3.90%;划痕24 h及48 h后,可见Control组与Control-sh组的划痕愈合率比较,差异无显著性,sh-KLF6组划痕愈合率较Control组明显增多,差异有显著性(P< 0.01)。可见敲除KLF6基因后,HepG2细胞迁移能力明显增强(图5)。
2.6 沉默klf6基因后斑马鱼胚胎肝脏表型变化结果
通过Image-Pro Plus 6.0软件对斑马鱼肝脏荧光面积进行分析,在3 dpf时,klf6-MO组的肝脏荧光面积为1734.83±331.16,Control组胚胎为7329.75±383.32;5 dpf时,klf6-MO组的肝脏荧光面积为6766.75±376.33,Control组胚胎为26950.75±1393.31;7 dpf时,klf6-MO组的肝脏荧光面积为12138.75±997.61,Control组胚胎为23917.40±958.91;差异有显著性(P< 0.001),沉默klf6基因后肝脏发育明显延迟。此外,沉默klf6基因后,还出现其他表型变化:心包水肿,鱼鳔消失以及卵黄囊炎症(图6)。
2.7 沉默klf6基因后斑马鱼胚胎肝脏KLF6蛋白表达结果
通过Image-Pro Plus 6.0软件对斑马鱼肝脏荧光强度进行分析,klf6-MO组的IOD值6.72±1.63,明显小于Control组的肝脏IOD值24.66±3.36;二者差异有显著性(P< 0.001)。
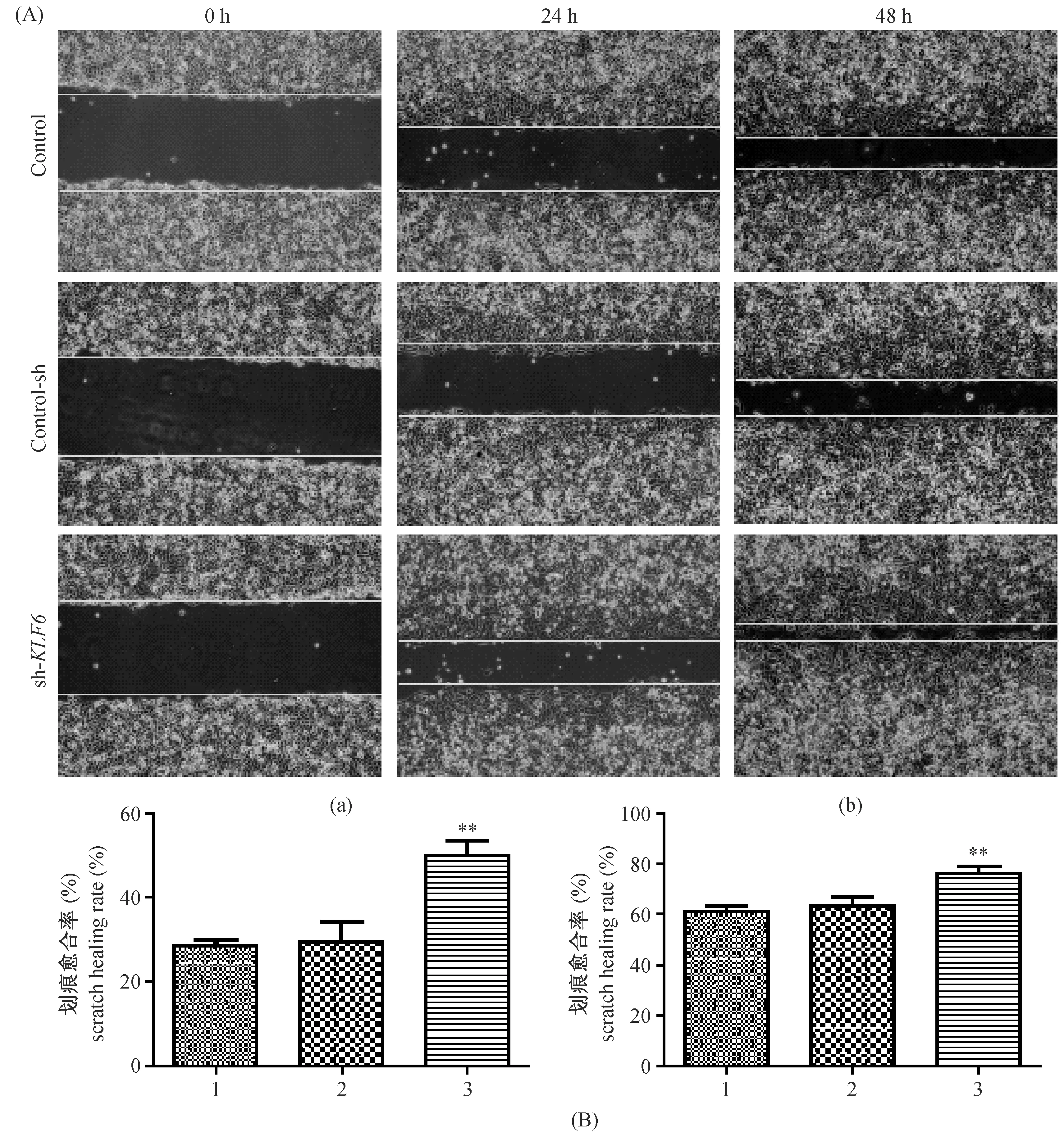
注:(A)白色横线之间的宽度为划痕的宽度;(B)a、b:1. Control组;2. Control-sh组;3. sh-KLF6组;(a)敲除KLF6基因24 h后对HepG2细胞迁移能力的影响;(b)敲除KLF6基因48 h后对HepG2细胞迁移能力的影响;(a、b)第3组与第1组对比,差异有显著性,**P < 0.01。图5 敲除KLF6基因后对HepG2细胞迁移能力的影响Note. (A) The width between the white lines is the width of the scratch. (B) a, b: 1. Control; 2. Control-sh; 3. sh-KLF6. (a) Knockout of KLF6 affects HepG2 cells migration ability after 24 h. (b) Knockout of KLF6 affects HepG2 cells migration ability after 48 h; (a, b) The third group contrast to the first group, with statistical significance, **P < 0.01.Fig.5 Knockout of KLF6 effects HepG2 cell migration ability
沉默斑马鱼klf6基因后,斑马鱼胚胎肝脏减小,KLF6蛋白表达量显著减少(图7)。
3 讨论
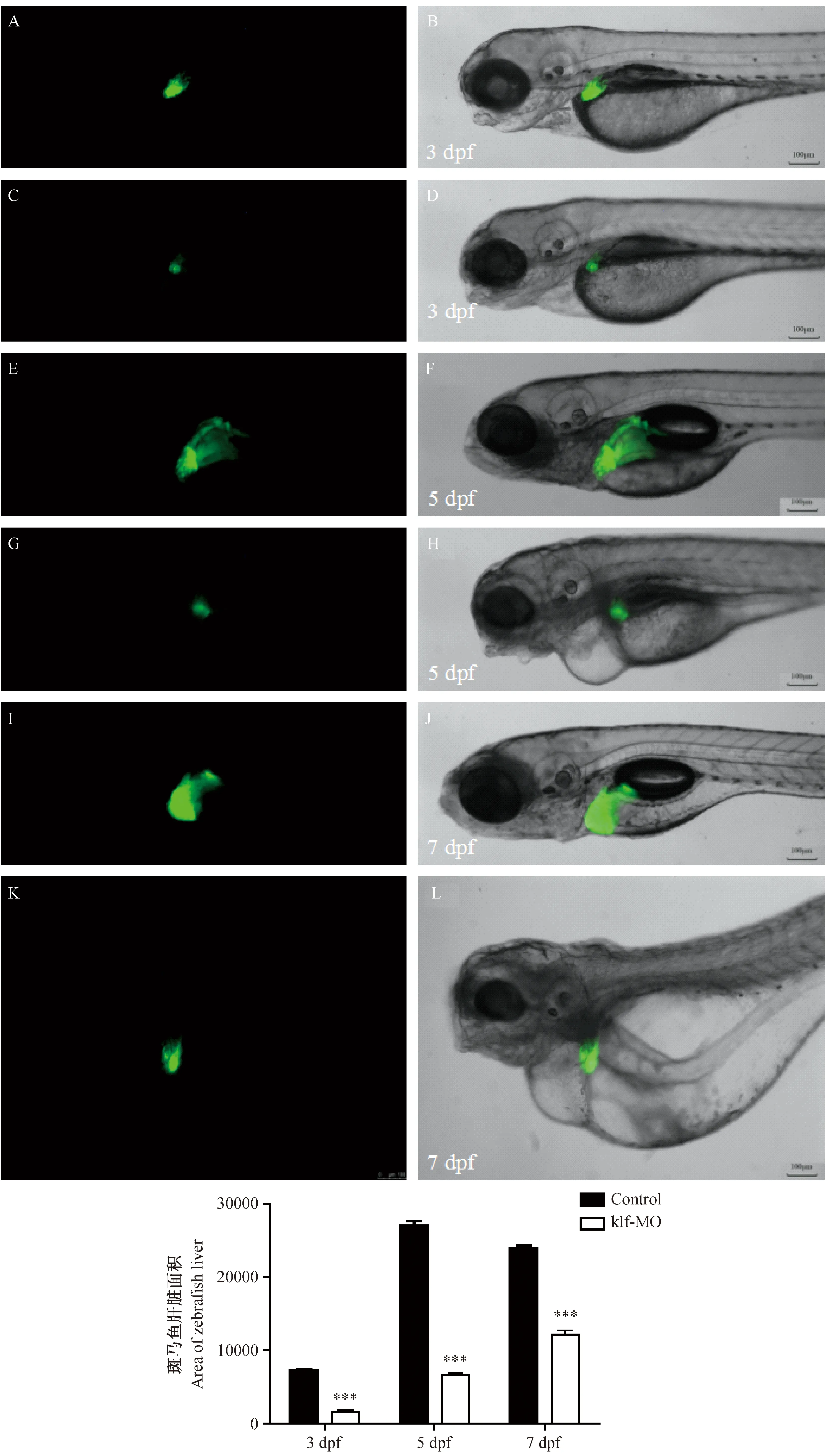
注:A、B为Control组(3 dpf),C、D为klf6-MO组(3 dpf),E、F为Control组(5 dpf),G、H为klf6-MO组(5 dpf),I、J为Control组(7 dpf),K、L为klf6-MO组(7 dpf);绿色部分为转基因斑马鱼肝脏;在统计图中,3、5、7 dpf中klf-MO组对比Control组差异有显著性,***P < 0.001。图6 klf6基因对斑马鱼肝脏发育的影响Note. A, B Control at 3 dpf; C, D klf6-MO at 3 dpf; E, F Control at 5 dpf; G, H klf6-MO at 5 dpf; I, J Control at 7 dpf; K, L klf6-MO at 7 dpf; green tissue is the zebrafish liver; In the statistics graph, the klf-MO group in the 3, 5, 7 dpf had statistical significance compared with the Control group, ***P < 0.001.Fig.6 Knockdown of klf6 effects zebrafish liver development
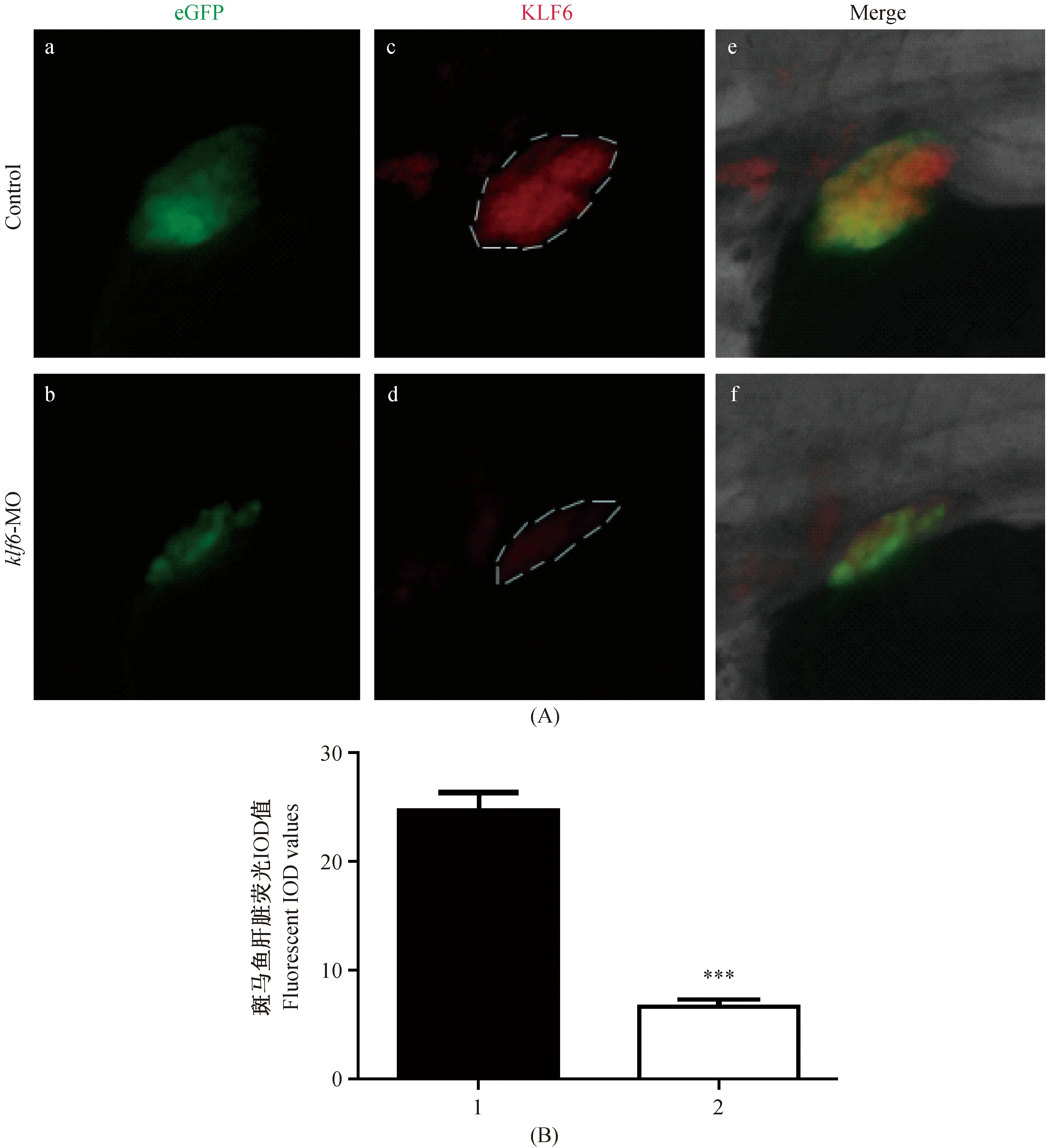
注:(A)白色虚线范围内为斑马鱼肝脏KLF6蛋白抗原抗体结合部分;a、b 肝脏自带荧光 (绿色);c、d 肝脏KLF6蛋白染色(红色);e、f 合成图;(B)1. Control组;2. klf-MO组;第2组与第1组对比,***P < 0.001图7 klf6基因沉默后斑马鱼肝内KLF6蛋白的表达Note. (A) The white dashed line indicates the KLF6 staining in the zebrafish liver; a, b eGFP; c, d KLF6 (red); e, f Merge; (B) 1. Control; 2. klf-MO; The second group contrast to the first group, ***P < 0.001.Fig.7 KLF6 protein expression in the zebrafish liver after klf6 knockdown
肝细胞癌(HCC)是一个主要的公共健康问题,因为缺乏早期诊断和行之有效的治疗方法[7],而成为社会及医学界关注的重点。目前肝癌治疗手段主要有三个,肝肿瘤的手术切除、经皮射频消融和原位肝移植,尚无有效的药物治疗及基因治疗方法[8],因此迫切的需要找到新的方法治疗肝细胞癌;因而人们将目光聚焦在基因水平研究,希望从基因层面去了解发病机理,从而找到更好的治疗方式。Narla等人发现,野生型KLF6通过上调p53通路中p21WAF1来抑制前列腺癌及肝癌组织中蛋白周期性依赖激酶(CDK)活性,导致细胞在细胞周期G1-S期阻滞,从而抑制肿瘤的生长[9, 10];Pan等通过对23例肝癌病例组织中KLF6基因的序列分析和KLF6蛋白的表达水平研究,发现了两个与肝癌发生相关的KLF6基因突变位点,首次揭示了KLF6蛋白第162位氨基酸色氨酸W突变为甘氨酸G后导致突变后的KLF6基因对肝癌细胞的增殖失去控制,在通过对肝癌细胞系HepG2的研究发现,当过表达KLF6基因后,可上调p21WAF1表达含量,达到抑制肝癌细胞中蛋白周期性依赖激酶(CDK)活性,导致肝癌细胞在细胞周期G1-S期阻滞的效果,从而减缓细胞的增殖[11];2010年,Lee等通过对KLF6基因的低表达对肝癌细胞HepG2的凋亡等的检测,发现HepG2的凋亡减少,增殖能力增强[12]。论证了KLF6的突变和表达水平的变化与肝癌发生的相关性,以往相关文献报道以KLF6基因过表达对肝癌细胞的影响较多,本实验从报道相对较少的KLF6低表达对肝癌细胞影响的方向继续进行研究。
作为人类KLF6的同源基因,斑马鱼klf6基因(copeb)所编码的 COPEB 蛋白与哺乳动物 KLF6 蛋白的序列的高度保守[13]。并且斑马鱼的性成熟时间只需要3个月的时间,每对交配鱼可以大量产卵,受精卵是透明的,可以利用显微镜进行实时观察,同时斑马鱼胚胎发育很快,受精24 h后主要的器官就可形成[14-16]。因此,利用斑马鱼作为模式动物来探究 KLF6 蛋白及其突变体对肝细胞的增殖、肿瘤发生发展提供了坚实的理论基础。以往的研究发现,斑马鱼消化器官包括肝脏发生于胚胎内胚层,Zhao发现在胚胎干细胞分化的早期阶段,klf6促进胚胎干细胞增殖,随后导致分化成内胚层细胞,促进斑马鱼胚胎消化器官增长和扩张;在沉默klf6基因后,斑马鱼肝脏发育明显延缓[5]。
本研究中,通过细胞免疫荧光法及Western blot检测肝癌细胞HepG2及正常肝细胞L-02之间的蛋白表达的差异,可以看出KLF6蛋白在L-02细胞中的表达明显高于HepG2细胞,可以说明KLF6基因在肝癌细胞中的表达明显低于正常肝细胞,再次验证了其抑癌的作用。在敲除HepG2细胞KLF6基因后,HepG2细胞KLF6蛋白表达明显减少,提示转染成功。再通过细胞凋亡、细胞周期检测及划痕实验,可以看出,敲除KLF6基因后,肝癌细胞HepG2凋亡减少,说明癌细胞增殖能力增强、增值活跃,与Lee等[12]报道的KLF6基因低表达使HepG2细胞增殖能力增强相符;肝癌细胞的迁移能力也增强,与Liang等报道的KLF6基因低表达使HepG2细胞迁移能力增强相互印证[17];本实验创新性的对敲除KLF6基因后细胞周期的检测,可以发现细胞分裂集中在S期增多,也再一次为KLF6基因的低表达对肝癌细胞的增值能力的增强提供了证据。体内实验中,沉默斑马鱼klf6基因,经过对3 dpf、5 dpf、7 dpf肝脏表型观察,发现沉默klf6基因的斑马鱼胚胎肝脏发育明显延迟于同时期对照组,与Zhao等[5]报道的klf6基因沉默对斑马鱼胚胎肝脏发育延迟相符合。以往实验多通过原位杂交方法,在基因水平检测斑马鱼胚胎肝中Klf6基因沉默后mRNA的表达减少,本实验通过整体免疫荧光法,对3 dpf的胚胎KLF6蛋白进行检测,发现沉默klf6基因的斑马鱼胚胎肝脏中的KLF6蛋白表达明显低于对照组;从蛋白水平说明klf6基因对斑马鱼肝脏发育有重要作用。
综上所述,KLF6低表达增强细胞增殖能力,促进肝癌细胞迁移,抑制斑马鱼肝细胞发育过程,提示KLF6基因在细胞迁移与分化进程可能扮演不同的角色。本研究验证了KLF6基因在肝发育和肝癌发展中的重要作用,为以后建立稳定的斑马鱼肝癌模型,研究KLF6基因的功能及抑癌机制提供实验基础。
[1] Byam J,Renz J, Millis JM. Liver transplantation for hepatocellular carcinoma[J]. Hepatobiliary Surg Nutr, 2013, 2(1): 22-30.[2] Bravi F, Bosetti C, Tavani A,etal. Coffee reduces risk for hepatocellular carcinoma: an updated meta-analysis[J]. Clin Gastroenterol Hepatol, 2013, 11(11): 1413-1421.
[3] Suske G, Bruford E, Philipsen S. Mammalian SP/KLF transcription factors: bring in the family[J]. Genomics, 2005, 85(5): 551-556.
[4] Kong LM, Yao L, Lu N,etal. Interaction of KLF6 and Sp1 regulates basigin-2 expression mediated proliferation, invasion and metastasis in hepatocellular carcinoma[J]. Oncotarget, 2016, 7(19): 27975-27987.
[5] Zhao X, Monson C, Gao C,etal. Klf6/copeb is required for hepatic outgrowth in zebrafish and for hepatocyte specification in mouse ES cells[J]. Dev Biol, 2010, 344(1): 79-93.
[6] 刘静, 何嘉玲, 暴国, 等. 应用TALEN技术敲除gata4基因建立斑马鱼先天性心脏病模型[J]. 中国比较医学杂志, 2015,23(4): 1-7.
[7] El-Serag HB, Mason AC. Rising incidence of hepatocellular carcinoma in the United States[J]. N Engl J Med, 1999, 340(10): 745-750.
[8] Bruix J, Sherman M. Management of hepatocellular carcinoma[J]. Hepatology, 2005, 42(5): 1208-1236.
[9] Narla G, Kremer-Tal S, Matsumoto N,etal. In vivo regulation of p21 by the Kruppel-like factor 6 tumor-suppressor gene in mouse liver and human hepatocellular carcinoma[J]. Oncogene, 2007, 26(30): 4428-4434.
[10] Narla G, Heath KE, Reeves HL,etal. KLF6, a candidate tumor suppressor gene mutated in prostate cancer[J]. Science, 2001, 294(5551): 2563-2566.
[11] Pan XC, Chen Z, Chen F,etal. Inactivation of the tumor suppressor Kruppel-like factor 6 (KLF6) by mutation or decreased expression in hepatocellular carcinomas[J].J Zhejiang Univ Sci B, 2006, 7(10): 830-836.
[12] Lee UE, Ghiassi-Nejad Z, Paris AJ,etal. Tumor suppressor activity of KLF6 mediated by downregulation of the PTTG1 oncogene[J]. FEBS Lett, 2010, 584(5): 1006-1010.
[13] Oates AC, Pratt SJ, Vail B,etal. The zebrafish klf gene family[J]. Blood, 2001, 98(6): 1792-1801.
[14] Pack M, Solnica-Krezel L, Malicki J,etal. Mutations affecting development of zebrafish digestive organs[J]. Development, 1996, 123: 321-328.
[15] Kimmel CB, Ballard WW, Kimmel SR,etal. Stages of embryonic development of the zebrafish[J]. Dev Dyn, 1995, 203(3): 253-310.
[16] Wells JM, Melton DA. Vertebrate endoderm development[J]. Annu Rev Cell Dev Biol, 1999, 15: 393-410.
[17] Liang WC, Wang Y, Xiao LJ,etal. Identification of miRNAs that specifically target tumor suppressive KLF6-FL rather than oncogenic KLF6-SV1 isoform[J]. RNA Biol, 2014, 11(7): 845-854.
Effects of Kruppel-like factor 6 on HepG2 and the development of liver in zebrafish
CHEN Hao1,2, YANG Zhen-guo1, WU Shui-long1, WU Yong-fu1, Feng Yu-fei1, GAO Xiao-xia1, BAO Shi-ting1,2*, ZHANG Jing-jing1,2*
(1. Affiliated Hospital of Guangdong Medical University, Zhanjiang 524001, China; 2. Guangdong Medical University, Zhanjiang 524023, China)
Objective To investigate the effects of Kruppel-like factor 6 (KLF6) on the apoptotic and migration ability of HepG2 cell, and the developmental role ofKLF6 on zebrafish liver. Methods Constructed plasmid with shRNA-KLF6 was transfected in HepG2 and L-02. The impacts of loss ofKLF6 on HepG2 was investigated by Western bolt, apoptosis analyses, cell cycle detection and scratch experiment;KLF6 morpholino oligonucleotides was microinjected into the Tg(lfabp:eGFP) transgenic zebrafish embryos. The morphant phenotype of the liver was imaged and the protein expression of KLF6 after knockdown ofKLF6 was analyzed by Immunofluorescence staining. Results The expression of KLF6 in L-02 was significantly higher than in HepG2. After knockout ofKLF6, KLF6 protein expression and apoptosis were significantly reduced. In addition, the cell cycle mainly stated in S phase and the migration ability of HepG2 was enhanced. Afterklf6 knockdown in transgenic zebrafish larvae, the development of zebrafish liver was delayed and KLF6 expression was obviously decreased in the liver. Conclusions The reduction of KLF6 expression increased the proliferation and migration ability, and reduced the apoptosis of HepG2. Loss ofKLF6 affects the development of zebrafish liver, which may open a possibility to use zebrafish as a liver cancer model and for anti-liver cancer drug screening.
KLF6; HepG2; Zebrafish; Morpholino
广东省科技计划项目(2013B060300021);广东省“培养高层次人才特殊支持计划”专项基金(粤人才办〔2015〕8号);广东省高等学校优秀青年教师培养计划(YQ2015081);广东医科大学科研基金(XK1418)。
陈浩(1989-),男,硕士研究生,研究方向:肝胆外科学。E-mail: 1024742919@qq.com
包仕廷,男,教授。E-mail: bst1967@sohu.com; 张晶晶,男,博士,教授。E-mail: gdmccrc@163.com
R-33
A
1671-7856(2017) 05-0042-09
10.3969.j.issn.1671-7856. 2017.05.011
2016-11-19
