miR-221在H2O2诱导的大鼠心肌细胞损伤中的作用及机制研究
2017-06-09符丽珍黄茂芹劳之勇肖孟生朱德康
符丽珍,黄茂芹,劳之勇,肖孟生,朱德康
(1.海南省农垦总医院内科,海口 570203;2.海南省农垦总医院心血管内科,海口 570203)
miR-221在H2O2诱导的大鼠心肌细胞损伤中的作用及机制研究
符丽珍1,黄茂芹2,劳之勇1,肖孟生1,朱德康1
(1.海南省农垦总医院内科,海口 570203;2.海南省农垦总医院心血管内科,海口 570203)
目的 探讨miR-221在过氧化氢(H2O2)诱导的大鼠心肌细胞(H9c2)损伤中的作用及机制研究。方法 MTT法检测不同浓度H2O2对H9c2细胞的损伤作用,RT-PCR法检测miR-221表达量。通过Lipofectamine 2000将miR-221 inhibitor及阴性对照转入H9c2心肌细胞,并将实验分为4组,正常对照组,模型对照组(H2O2组),阴性对照组(H2O2+阴性对照组),抑制组(H2O2+miR-221 inhibitor组)。MTT法检测细胞活力,吖啶橙染色检测细胞凋亡情况,Western blot检测Bax,Bcl-2,10号染色体缺失的磷酸酶及张力蛋白同源的基因蛋白(PTEN)及p-蛋白激酶(AKT)表达。结果 0、25、50、100、200、400 μmol/L H2O2对H9c2细胞活力的抑制作用逐渐加强,其中200 μmol/L H2O2对细胞活力抑制程度适中,因此作为后续诱导剂量。与正常对照组比较,模型对照组及阴性对照组中miR-221表达量显著上调(P< 0.01),H9c2细胞活力降低(P< 0.01),细胞凋亡率显著提高(P< 0.01),Bax及PTEN表达量上调(P< 0.01),Bcl-2及p-AKT表达量下调(P< 0.01)。与模型对照组及阴性对照组比较,抑制组中miR-221表达量显著下调(P< 0.01),H9c2细胞活力提高(P< 0.01),细胞凋亡率显著降低(P< 0.01),Bax及PTEN表达量下调(P< 0.01),Bcl-2及p-AKT表达量上调(P< 0.01)。结论 miR-221低表达能显著抑制H2O2诱导的H9c2心肌细胞氧化应激损伤,与调控PTEN/AKT信号通路有关。
miR-221;H9c2心肌细胞;氧化应激;凋亡;PTEN/AKT信号通路
在正常生理情况下,机体内氧自由基及活性氧的生成和清除处于动态平衡,而在病理情况下,活性氧的生成远大于机体清除能力后,会造成组织和细胞氧化应激损伤。大量研究证实,心血管疾病心肌梗死,心力衰竭,心肌重塑,心肌缺血及心肌缺血再灌注等病理条件下,机体会产生大量的氧自由基及活性氧,造成心肌组织及细胞氧化应激损伤,使得心肌细胞大量的凋亡或者坏死,加重病情,并造成恶性循环。其中细胞坏死一般是发生在心肌缺血或者缺血再灌注的终末阶段,而心肌细胞凋亡贯穿于整个心血管疾病病理过程。因此,抑制氧化应激引起的心肌细胞凋亡,对于心血管疾病的治疗将具有显著的改善作用[1, 2]。miRNA是一类具有18~23 nt氨基酸的保守的内源性非编码RNA分子,能结合于其下游靶基因mRNA的3’UTR端,进而对基因进行转录后水平调控,从而参与细胞的生长,凋亡,增殖,凋亡,迁移等生物学行为,也因此,miRNA与多种疾病的发生发展密切相关,包括心血管疾病[3, 4]。但是miRNA在心血管疾病的氧化应激损伤中的研究较少,所以本研究将选取一个miRNA,探讨其在心肌氧化应激中的作用。研究已显示miR-221在心肌梗死,心力衰竭等高表达,且miR-221与心肌氧化应激密切相关[5-7],但是具体的机制尚未见报道,因此,本研究将探讨miR-221在过氧化氢(H2O2)诱导的大鼠心肌细胞(H9c2)损伤中的作用及具体机制。
1 材料和方法
1.1 试剂与仪器
大鼠心肌细胞H9c2购于中国科学院上海细胞库。兔抗Bax,Bcl-2,PTEN,AKT,p-AKT,GAPDH单克隆抗体购自美国Epitmics公司;辣根过氧化物酶标记山羊抗兔IgG(H+L),BCA试剂盒购自碧云天生物技术研究所;Lipofectamine 2000,trizol 试剂盒,一步法RT-PCR试剂盒购自美国Invitrogen公司;胎牛血清,DMEM培养基,MTT购自美国Gibco公司。miR-221 inhibitor(5’-GAAACCCAGCAGACAAUGUA GCU-3’)及miR-221阴性对照(正义链:5’-CGAACGUGUCACGUTT-3’,反义链:5’-ACGUGACA CGUUCGGAGAATT-3’)由广州市锐博生物科技有限公司订购合成。迷你双垂直电泳仪,迷你转印电泳仪购自北京六一仪器厂;ChemiDocTM XRS凝胶成像系统购自美国Bio-Rad公司;Tecan Infinite F200/M200型多功能酶标仪购自瑞士TECAN集团公司;荧光显微镜购自德国Leica公司。
1.2 实验方法
1.2.1 不同浓度的H2O2处理H9c2心肌细胞
将处于生长对数期的H9c2细胞接种于96孔板后,24 h后,0、25、50、100、200、400 μmol/L H2O2作用48 h,采用MTT法检测H2O2对H9c2心肌细胞活力的影响。
1.2.2 细胞转染及分组
通过Lipofectamine 2000将miR-21 inhibitor及阴性对照转染到H9c2细胞中,转染浓度分别为200 nm和200 nm,6 h后换成含10%血清的DMEM培养基,37℃,CO2培养箱培养48 h,RT-PCR法检测miR-221 inhibitor转染效果。另将实验分为4组,正常对照组,模型对照组(H2O2组),阴性对照组(H2O2+阴性对照组),抑制组(H2O2+miR-221 inhibitor组)。
1.2.3 RT-PCR检测miR-221表达量
采用trizol试剂盒提取总RNA,并检测RNA纯度。接着一步法RT-PCR试剂盒将RNA逆转录,最后进行realtime-PCR,采用2-△△t方法对目的基因进行定量分析。引物设计如下,miR-221上游引物:5’- GGGCATGAACCTGGCATAC-3’, 下游引物:5’- AGGTAGCCTGAAACCCAGCA-3’。GAPDH上游引物:5’-AGCCACATCGCTCAGACA-3’,下游引物:5’-TGGACTCCACGACGTACT-3’。引物分别加入25 μL的PCR反应体系中,反应条件为94℃变性45 s,59℃复性45 s,72℃延伸60 s,共35个循环。
1.2.4 MTT法检测细胞活力
按“1.2.1”或 “1.2.2”方法处理细胞,将细胞继续培养48 h,每孔加入终浓度为5 mg/mL 的MTT 20 μL,4 h后,将上清液弃掉,每孔加入150 μL的二甲基亚砜,10 min后,酶标仪570 nm处测定OD值。
1.2.5 吖啶橙染色检测细胞凋亡
按“1.2.2”方法处理细胞,将细胞继续培养48 h,收集细胞,并加入1×Buffer A重悬细胞,接着将细胞浓度调整为106/mL,取95 μL细胞悬液加入5 μL的吖啶橙染液,并混合均匀,室温条件下避光染色15 min,后将细胞悬液接种于载玻片上,并盖上盖玻片,于荧光显微镜下观察并拍照,利用Image pro plus6.0软件分析图像计算细胞凋亡率(%)。其中正常细胞被均为染成黄绿色,而凋亡细胞胞质浓缩,细胞核破碎成点状,呈致密浓染的绿色。
1.2.6 Western-blot
按“12.2”方法处理细胞,将细胞继续培养48 h,收集细胞加入裂解液裂解30 min,离心,获得蛋白样品。用BCA试剂盒检测蛋白浓度。蛋白样品煮沸变性10 min,上样,进行十二烷基苯磺酸钠凝胶电泳1~2 h,转膜30~40 min,5%脱脂奶粉封闭1 h,一抗溶液(兔抗Bax,Bcl-2,PTEN,AKT,p-AKT,GAPDH单克隆抗体,稀释度皆为1∶100)4°C孵育过夜。次日二抗溶液(辣根过氧化物酶标记山羊抗兔IgG(H+L),稀释度为1∶200)室温孵育1 h,并滴加化学曝光液,于凝胶成像系统中曝光。
1.3 统计学方法
实验数据通过采用SPSS17.0软件进行统计分析,结果以均数±标准差(±s)表示,两组之间比较采用t检验,以P< 0.05为差异有显著性。
2 结果
2.1 H2O2对H9c2细胞活力的影响

注:与0 μmol/L H2O2比较,*P < 0.05,**P < 0.01。图1 H2O2对H9c2细胞活力的影响Note.Compared with 0 μmol/L H2O2, *P < 0.05,**P < 0.01.Fig.1 Effect of H2O2 on H9c2 cell viability
如图1所示, 0、25、50、100、200、400 μmol/L H2O2处理H9c2心肌细胞48 h后,MTT实验结果表明,随着H2O2剂量浓度的增加,H9c2细胞活力逐渐下降,差异有显著性(P< 0.01)。在200 μmol/L 时,既能显著抑制H9c2细胞活力,又不会使大量细胞凋亡,所以选此剂量浓度作为后续实验研究的诱导剂量。
2.2 miR-221在H2O2诱导的H9c2细胞中的表达量
与正常对照组(0.18±0.02)比较,模型对照组(0.94±0.09)细胞中miR-221表达量显著提高,差异有显著性(P< 0.01)。
2.3 miR-221 inhibitor的转染效果
如图2所示,与正常对照组比较,模型对照组及阴性对照组中miR-221表达量显著提高,差异有显著性(P< 0.01);与模型对照组及阴性对照组比较,抑制组中miR-221表达量显著降低,差异有显著性(P< 0.01)。

注:(1)正常对照组;(2)模型对照组;(3)阴性对照组;(4)抑制组;与正常对照组比较,**P<0.01;与模型对照组及阴性对照组比较,##P < 0.01。图2 miR-221 inhibitor的转染效果Note.(1)normal control group;(2)model control group;(3)negative control group;(4)inhibition group;Compared with normal control group, **P<0.01; Compared with model control group and negative control group, ##P < 0.01.Fig.2 Effect of miR-221 inhibitor transfection
2.4 miR-221 inhibitor对H2O2诱导的H9c2细胞活力的影响
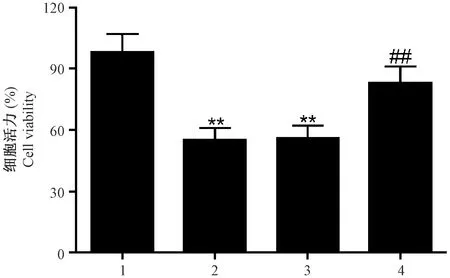
注:(1)正常对照组;(2)模型对照组;(3)阴性对照组;(4)抑制组;与正常对照组比较,**P<0.01;与模型对照组及阴性对照组比较,##P < 0.01。图3 miR-221 inhibitor对H2O2诱导的H9c2细胞活力的影响Note.(1)normal control group;(2)model control group;(3)negative control group;(4)inhibition group;Compared with normal control group, **P<0.01; Compared with model control group and negative control group, ##P < 0.01.Fig.3 Effect of miR-221 inhibitor on viability of H9c2 cell induced by H2O2
如图3所示,与正常对照组比较,模型对照组及阴性对照组中细胞活力显著降低,差异有显著性(P< 0.01);与模型对照组及阴性对照组比较,抑制组中细胞活力显著提高,差异有显著性(P< 0.01)。
2.5 miR-221 inhibitor对H2O2诱导的H9c2细胞凋亡的影响如图4所示,与正常对照组(3.47±0.35)比较,模型对照组(45.49±4.56)及阴性对照组(43.97±4.40)中细胞凋亡率显著提高,差异有显著性(P< 0.01);与模型对照组及阴性对照组比较,抑制组(7.21±0.72)中细胞凋亡率显著降低,差异有显著性(P< 0.01)。
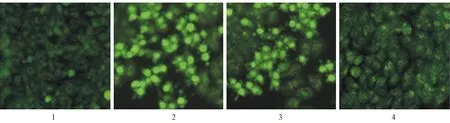
注:(1)正常对照组;(2)模型对照组;(3)阴性对照组;(4)抑制组。图4 miR-221 inhibitor对H2O2诱导的H9c2细胞凋亡的影响(×200)Note.(1)Normal control group;(2)Model control group;(3)Negative control group;(4)Inhibition group.Fig.4 Effect of miR-221 inhibitor on viability of H9c2 cell induced by H2O2
2.6 miR-221 inhibitor对H2O2诱导的H9c2细胞中Bax及Bcl-2表达量的影响
如图5,与正常对照组比较,模型对照组及阴性对照组中Bax表达量上调,Bcl-2表达量下调,差异有显著性(P< 0.01);与模型对照组及阴性对照组比较,抑制组中Bax表达量下调,Bcl-2表达量上调,差异有显著性(P< 0.01)。
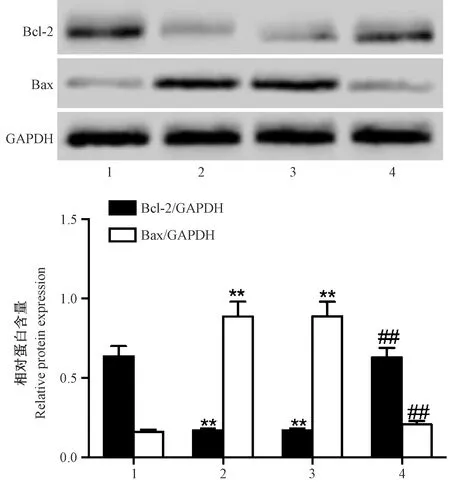
注:(1)正常对照组;(2)模型对照组;(3)阴性对照组;(4)抑制组;与正常对照组比较,**P<0.01;与模型对照组及阴性对照组比较,##P < 0.01。图5 miR-221 inhibitor对H2O2诱导的H9c2 细胞中Bax,Bcl-2表达量的影响Note.(1)Normal control group;(2)Model control group;(3)Negative control group;(4)Inhibition group;Compared with normal control group, **P<0.01; Compared with model control group and negative control group, ##P < 0.01.Fig.5 Effect of miR-221 inhibitor on the expression of Bad and Bcl-2 in H9c2 cell induced by H2O2
2.7 miR-221 inhibitor对H2O2诱导的H9c2细胞中PTEN及p-AKT表达量的影响
如图6所示,与正常对照组比较,模型对照组及阴性对照组中PTEN表达量上调,p-AKT表达量降低,差异有显著性(P< 0.01);与模型对照组及阴性对照组比较,抑制组中PTEN表达量下调,p-AKT表达量上升,差异有显著性(P< 0.01)。
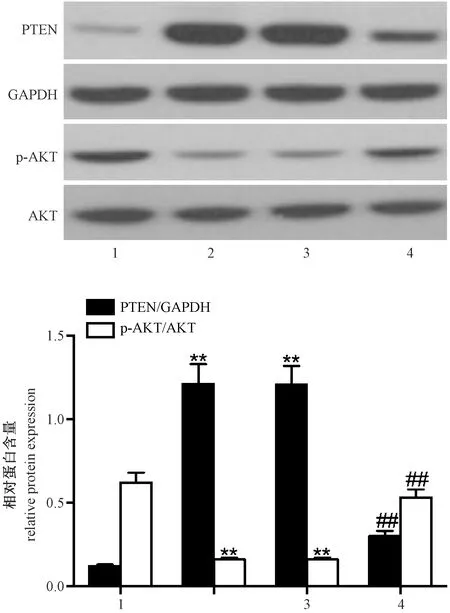
注:(1)正常对照组;(2)模型对照组;(3)阴性对照组;(4)抑制组;与正常对照组比较,**P<0.01;与模型对照组及阴性对照组比较,##P < 0.01。图6 miR-221 inhibitor对H2O2诱导的H9c2细胞中PTEN及p-AKT表达量的影响Note.(1)Normal control group;(2)Model control group;(3)Negative control group;(4)Inhibition group;Compared with normal control group, **P<0.01; Compared with model control group and negative control group, ##P < 0.01.Fig.6 Effect of miR-221 inhibitor on the expression of PTEN and p-AKT in H9c2 cell induced by H2O2
3 讨论
1993年Lee首次在研究线虫的发育调控过程中发现了miRNA,并命名为Lin-4,尔后2000年Reinhart也在线虫发现了另一个miRNA(Line-7),因此miRNA迅速的成为生命科学领域的关注热点。miRNA是一类长度约为18-25 nt的高度保守的小RNA,能通过与其靶基因的3’-UTR区域结合,调控基因的转录后水平,从而参与细胞生长,增值,分化与凋亡的调控,与机体的发育、代谢及众多疾病的进展密切相关。近些年研究发现miRNA与心肌梗死,心力衰竭,心脏重构,心肌缺血再灌注等心血管疾病的发生发展[8, 9]。而且研究也进一步显示miRNA与心血管基本氧化应激损伤密切相关,如Xu等[10]研究显示miR-19b在H2O2诱导的H9c2心肌细胞中高表达,下调miR-19b表达能显著抑制H2O2诱导的H9c2心肌细胞凋亡。Li等[11]研究显示miR-139在H2O2诱导的H9c2细胞中低表达,上调miR-139表达能显著抑制H2O2诱导的H9c2细胞凋亡。而miR-221被发现较早,是从斑马鱼中获得并克隆的miRNA,后来又在白血病细胞株HL-60进一步克隆获得。miR-221一直以来都被认为具有抑癌基因,在肺癌,乳腺癌,胃癌等多种肿瘤中高表达,并与miR-222是同一个onco-miR,都位于X染色体p11.3区[12]。而且Souza等[5]研究也表明miR-221在心力衰竭高表达。Coskunpinar等[6]研究证实心肌梗死组织中多种循环miRNA表达量异常,其中循环miR-221表达量最高,是正常组的3.89倍,且与心肌损伤标志物超敏心肌肌钙蛋白T及GARCE、 Synthax评分密切相关,提示循环miR-221是心肌梗死早期诊断新的标记物。另外miR-221与糖尿病心肌氧化应激密切相关[7],对缺氧再复氧引起的H9c2细胞凋亡具有保护作用[13]。所以本研究推测miR-221与心肌氧化应激损伤密切相关。
H2O2作为活性氧中的一种,常常被用来模拟心肌细胞、神经元细胞等细胞的氧化应激损伤模型,因此本研究首先采用不同浓度 的H2O2诱导心肌细胞,并结合MTT实验发现200 μmol/L H2O2能降低H9c2细胞一半活力,且此诱导剂量与以往文献报道一致[14, 15],因此被用于后续实验诱导剂量。接着利用RT-PCR法检测H2O2诱导的H9c2细胞中miR-221的表达量,结果表明H2O2组中miR-221表达量上升,与Souza等[5],Coskunpinar等[6]研究结果一致,RT-PCR结果进一步表明miR-221 inhibitor转染的成功。所以我们接着利用MTT法及吖啶橙检测miR-221 inhibitor对H2O2诱导的H9c2细胞活力及凋亡的影响,结果表明抑制组细胞活力显著提高,细胞凋亡率显著降低,提示miR-221 inhibitor对H2O2诱导的H9c2细胞凋亡具有抑制作用。
细胞的凋亡受众多信号通路调控,PI3K/AKT信号通路就是其中一种,其具有抗凋亡通路之称,能通过调控下游多种靶蛋白如Bax及Bcl-2的表达,从而参与调控细胞生长、凋亡、分化、迁移、侵袭及血管生成等过程[16, 17]。而同时PI3K/AKT信号通路上游蛋白PTEN是miR-221的下游靶基因[12]。PTEN能将三磷酸磷脂酰肌醇(PIP3)去磷酸化为二磷酸脂酰肌醇(PIP2),从而负调控PI3K/AKT信号通路,在细胞凋亡中起重要作用。研究显示miR-221通过调控PTEN/AKT信号通路及Bax、Bcl-2的表达参与多种肿瘤细胞的发生发展[18-20]。所以本研究继续探讨miR-221 inhibitor对H2O2诱导的H9c2细胞中PTEN/AKT信号通路的影响,结果表明miR-221 inhibitor能显著下调H2O2诱导的H9c2细胞中PTEN及Bax表达,上调p-AKT及Bcl-2表达,从而说明下调miR-221表达能通过激活PTEN/AKT信号通路,并调控下游蛋白表达,从而抑制H2O2诱导的H9c2细胞凋亡。
综上所述,miR-221在H2O2诱导的H9c2细胞中高表达,下调miR-221表达能通过调控PTEN/AKT信号通路,进而调节下游蛋白Bax及Bcl-2表达,从而抑制H2O2诱导的H9c2细胞凋亡。
[1] 王全伟, 凡文博, 王智昊, 等. 氧化应激与心血管疾病关系的研究进展[J]. 中国老年学杂志, 2014,34(1):270-273.
[2] Bello-Klein A, Khaper N, Llesuy S,etal. Oxidative stress and antioxidant strategies in cardiovascular disease[J]. Oxid Med Cell Longev, 2014,2014:678741.
[3] Gambari R, Brognara E, Spandidos DA,etal. Targeting oncomiRNAs and mimicking tumor suppressor miRNAs: Nuew trends in the development of miRNA therapeutic strategies in oncology (Review)[J]. Int J Oncol, 2016,49(1):5-32.
[4] Nouraee N, Mowla SJ. miRNA therapeutics in cardiovascular diseases: promises and problems[J]. Front Genet, 2015,6:232.
[5] Souza RW, Fernandez GJ, Cunha JP,etal. Regulation of cardiac microRNAs induced by aerobic exercise training during heart failure[J]. Am J Physiol Heart Circ Physiol, 2015,309(10):H1629-H1641.
[6] Coskunpinar E, Cakmak HA, Kalkan AK,etal. Circulating miR-221-3p as a novel marker for early prediction of acute myocardial infarction[J]. Gene, 2016,591(1):90-96.
[7] Costantino S, Paneni F, Luscher TF,etal. MicroRNA profiling unveils hyperglycaemic memory in the diabetic heart[J]. Eur Heart J, 2016,37(6):572-576.
[8] Sayed AS, Xia K, Salma U,etal. Diagnosis, prognosis and therapeutic role of circulating miRNAs in cardiovascular diseases[J]. Heart Lung Circ, 2014,23(6):503-510.
[9] 陶瑾, 李素芳, 徐明. MicroRNA:新的心血管疾病生物标志物[J]. 生理科学进展, 2011,42(5):335-339.
[10] Xu J, Tang Y, Bei Y,etal. miR-19b attenuates H2O2-induced apoptosis in rat H9C2 cardiomyocytes via targeting PTEN[J]. Oncotarget, 2016,7(10):10870-10878.
[11] Li T, Liang S, Zhang Y,etal. Effects of microRNA-139 on myocardial cell injury induced by oxidative stress[J]. Int J Clin Exp Med, 2015,8(11):19994-20001.
[12] 邢慧慧, 刘晓峰, 刘长江, 等. miR-221在肿瘤中的研究进展[J]. 医学研究杂志, 2014,43(8):14-16.
[13] Chen Q, Zhou Y, Richards AM,etal. Up-regulation of miRNA-221 inhibits hypoxia/reoxygenation-induced autophagy through the DDIT4/mTORC1 and Tp53inp1/p62 pathways[J]. Biochem Biophys Res Commun, 2016,474(1):168-174.
[14] 钟源, 孙善全. 番茄红素对心肌细胞氧化应激损伤的保护作用[J]. 重庆医学, 2015,44(9):1157-1161.
[15] Wang W, Wang L, Yang H,etal. Protective effects of yindanxinnaotong capsule in a rat model of myocardial ischemia/reperfusion injury[J]. J Tradit Chin Med, 2014,34(6):699-709.
[16] Miyata S, Fukuda Y, Tojima H,etal. Mechanism of the inhibition of leukemia cell growth and induction of apoptosis through the activation of ATR and PTEN by the topoisomerase inhibitor 3EZ, 20Ac-ingenol[J]. Leuk Res, 2015,39(9):927-932.
[17] 韩贵宾, 张寿, 孙薇薇, 等. 尼古丁抑制MIA诱导的骨关节炎软骨细胞凋亡[J]. 中国比较医学杂志, 2016,26(3):40-45.
[18] Zhu J, Liu F, Wu Q,etal. MiR-221 increases osteosarcoma cell proliferation, invasion and migration partly through the downregulation of PTEN[J]. Int J Mol Med, 2015,36(5):1377-1383.
[19] Yang W, Yang Y, Xia L,etal. MiR-221 Promotes Capan-2 Pancreatic Ductal Adenocarcinoma Cells Proliferation by Targeting PTEN-Akt[J]. Cell Physiol Biochem, 2016,38(6):2366-2374.
[20] Ye Z, Hao R, Cai Y,etal. Knockdown of miR-221 promotes the cisplatin-inducing apoptosis by targeting the BIM-Bax/Bak axis in breast cancer[J]. Tumour Biol, 2016,37(4):4509-4515.
The role of miR-221 in the injury induced by hydrogen peroxide in rat myocardial cells
FU Li-zhen1,HUANG Mao-qin2,LAO Zhi-yong1,XIAO Meng-Sheng1,ZHU De-kang1
(1.Department of Hainan Nongken General Hospital,Haikou 570203,China; 2.Department of Cardiology 2 Hainan Nongken General Hospital,Haikou 570203)
Objective To explore the role of miR-221 in the injury induced by hydrogen peroxide (H2O2) in rat myocardial cells (H9c2). Methods The viability of H9c2 cell induced by cell different concentrations of H2O2was determined by MTT. The expression of miR-221 was detected by RT-PCR method. The miR-221 inhibitor and negative control were transferred into H9c2 cells by Lipofectamine 2000, then the cells were divided into normal control group, model control group (H2O2group), negative control group (H2O2+ negative control group), inhibition group (H2O2+miR-221 inhibitor group). The cell viability was measured by MTT assay. Cell apoptosis was detected by acridine orange staining method. The expression of Bcl-2, Bax, phosphatase and tensin homolog deleted on chromosome ten (PTEN, p-protein kinase B (AKT) were assayed by Western Blot. Results 0,25,50,100,200,400 μmol/L H2O2inhibited H9c2 cell activity gradually, of which 200 mol/L inhibition of cell viability moderate, so as a subsequent induction dose. Compared with normal control group, cell viability was decreased (P< 0.01), cell apoptotic rat was increased (P< 0.01), the expression of Bax and PTEN was upregulated (P< 0.01), the expression of Bcl-2 and p-AKT was downregulated (P< 0.01) in model control group and negative control group. Compared with model control group and negative control group, inhibition group proves the contrary. Conclusions Down-expression of miR-221 could significantly inhibit oxidative stress damage in H9c2 cells, which related to regulation of PTEN/AKT signal pathway.
miR-221; H9c2 myocardial cell; Oxidative stress; Apoptosis; PTEN/AKT signal pathway
符丽珍(1980-),女,主治医师。E-mail: 13518828771@qq.com
研究报告
R-33
A
1671-7856(2017) 05-0083-06
10.3969.j.issn.1671-7856. 2017.05.018
2016-09-14
