布地奈德对哮喘小鼠模型IL-22的调控作用
2017-06-09王明磊王文革张俊红战大伟颜克松
王明磊,王文革,张俊红,战大伟,颜克松
(1.河北北方学院研究生部,河北 张家口 075000;2.中国人民解放军空军总医院儿科,北京 100142;3.解放军总医院第一附属医院实验动物科,北京 100048)
研究报告
布地奈德对哮喘小鼠模型IL-22的调控作用
王明磊1,王文革2*,张俊红2,战大伟3,颜克松3
(1.河北北方学院研究生部,河北 张家口 075000;2.中国人民解放军空军总医院儿科,北京 100142;3.解放军总医院第一附属医院实验动物科,北京 100048)
目的 观察白介素22(IL-22)在哮喘模型中的作用,研究布地奈德对哮喘小鼠模型气道炎症及IL-22的调控作用。方法 24只BALB/c小鼠随机分为对照组、哮喘模型组和布地奈德组3组,用卵清蛋白(OVA)致敏、激发小鼠以制备哮喘模型。小鼠肺组织进行HE及AB-PAS染色,进行气道炎症评分,ELISA法检测3组小鼠肺泡灌洗液(BALF)中IL-22的水平,实时荧光定量PCR检测小鼠肺组织中IL-22mRNA的表达水平。结果 与对照组相比较,哮喘小鼠肺组织炎症评分增加,BALF中IL-22水平增高,肺组织中IL-22mRNA表达水平升高,差异均具有统计学意义。给予布地奈德治疗后,小鼠气道炎症评分及肺组织IL-22mRNA的表达水平均较哮喘组降低,差异具有统计学意义。结论 布地奈德对哮喘气道炎症的治疗作用与其抑制肺内IL-22的表达和分泌有关。
哮喘;IL-22;布地奈德;气道炎症;气道重塑
哮喘是一种多种细胞及细胞组分共同参与的异质性疾病,以慢性气道炎症和气道高反应性为主要特征[1]。新近研究证实,在哮喘、炎症性肠病、类风湿关节炎等多种慢性炎症性疾病的进程中,均存在着以IL-22分泌亢进或受抑为特征的免疫调节机制异常[2,3]。以布地奈德为代表的吸入性糖皮质激素(inhaled corticosteroids,ICS)是目前控制哮喘气道炎症的首选治疗措施[4],ICS控制哮喘的作用机制涉及IL-17、IL-10、IL-4、IFN-γ等多种机制[5-9]。目前鲜有研究探讨ICS是否会对哮喘中IL-22的分泌和表达产生影响。本研究通过探讨哮喘小鼠肺组织中IL-22的表达水平,以及布地奈德干预后的影响,探讨IL-22在哮喘中的作用及ICS治疗哮喘的机制。
1 材料和方法
1.1 实验动物
SPF级雌性BALB/c小鼠24只,4周龄,体重12~14 g,购自北京斯贝福实验动物科技有限公司[SCXK(京)2016-0002],实验在中国人民解放军总医院第一附属医院屏障动物实验设施进行[SYXK(军)2012-0013],按3R原则给予实验动物人道关怀。本实验经中国人民解放军空军总医院伦理委员会批准进行。
1.2 主要试剂
卵清白蛋白(OVA,A5253-250 g,纯度≥98%)、十二水硫酸铝钾(237086)购自sigma;吸入用布地奈德混悬液(1 mg/2 mL)购自阿斯利康制药有限公司;HE染色试剂盒及AB-PAS染色试剂盒购自武汉谷歌生物公司;ELISA IL-22试剂盒购自eBioscience;RNAprep Pure 动物组织总RNA提取试剂盒(DP431)、FastQuant cDNA第一链合成试剂盒(KR106)及SuperReal 荧光定量预混试剂(FP205)购自天根生化科技有限公司;IL-22引物及内参β-actin由上海生工生物工程有限公司合成。
1.3 实验方法
1.3.1 建模方法
小鼠适应性饲养3 d后,经随机数表法分为A组对照组、B组哮喘模型组和C组布地奈德组,每组8只。参考文献[10,11]建立哮喘模型,B、C组小鼠分别于实验第0、7、14天腹腔注射OVA致敏液0.2 mL(内含OVA 100 μg,硫酸铝钾1 mg,PBS溶解),A组腹腔注射PBS溶液。自实验21 d起,将小鼠置于自制雾化盒内,用空气压缩泵对小鼠进行雾化激发。A组以PBS激发,B、C2组以5%的OVA溶液激发,每日1次,每次30 min,连续激发12 d。
1.3.2 给药方法
每次激发前30 min,给予C组小鼠雾化吸入布地奈德溶液30 min,A、B组小鼠同时给予生理盐水雾化。
1.3.3 一般情况观察
实验过程中注意观察小鼠是否出现挠耳抓鼻、打喷嚏、弓背直立、腹肌抽搐、烦躁不安等行为学改变。
1.3.4 ELISA检测支气管肺泡灌洗液(BALF)中IL-22的水平
1%的戊巴比妥钠麻醉小鼠后,引颈法处死小鼠,将小鼠置于 75%酒精中浸泡2 min,切开颈胸部皮肤,逐层分离组织,充分暴露气管,在气管上段做一横行切口,以21 G的注射器针头行气管插管,结扎右肺,以注射器吸取0.3 mL的PBS溶液,经气管插管缓慢注入小鼠左肺进行灌洗,待PBS溶液完全进入左肺后缓慢回抽。重复以上过程3次,3次灌洗的总回收率约为60%。回抽后所得液体用单层纱布过滤,以除去黏液,即刻离心(2000 r/min,4℃,10 min),回收上清置于-80℃保存,依照IL-22 ELISA试剂盒操作步骤检测BALF中IL-22的水平。
1.3.5 小鼠肺组织病理学检测及炎症评分
取右上叶肺组织,4%的多聚甲醛固定48 h。石蜡包埋、切片后进行HE及AB-PAS染色,观察小鼠支气管及血管周围嗜酸性粒细胞、中性粒细胞等炎细胞浸润情况,观察气道杯状细胞增生及黏液分泌情况,观察小鼠肺组织内是否出现了肺泡壁变薄甚至断裂,间隔增宽,以及是否存在支气管上皮增生,基底膜及气道平滑肌增厚,支气管管腔狭窄等典型哮喘病理学改变。观察综合文献[12,13]对各组病理学进行分级评分并进行统计:0分:无炎症细胞;1分:少许炎症细胞;2分:较多分布不均匀的炎症细胞,或炎症细胞形成环状,层厚为1个细胞;3分:大量分布均匀的炎症细胞,少见聚集成团,或炎症细胞形成环状;4分:大量炎症细胞聚集成团,或炎症细胞形成环状,层厚 < 4个细胞。
1.3.6 实时荧光定量PCR检测小鼠肺组织中IL-22mRNA的表达
IL-22 上游引物 5’-CCGAGGAGTCAGTGCTAA GG-3’,下游引物3’-TCTGGATGTTCTGGTCG TCA-5’。小鼠肺组织总RNA采用RNA prep Pure提取试剂盒提取,反转录为cDNA,之后进行RT-PCR。
1.4 统计学方法
2 结果
2.1 一般情况观察
哮喘模型组小鼠在激发过程中及激发后均可观察到挠耳抓鼻、打喷嚏、弓背直立、腹肌抽搐、烦躁不安等症状,可于短时间内自行缓解。对照组小鼠未见上述改变,布地奈德组小鼠以上行为改变与哮喘模型组比较明显减少。
2.2 小鼠肺组织病理学改变
如图1、图2所示,通过HE染色及AB-PAS染色可以看到,对照组小鼠支气管及肺泡等肺组织结构未见异常,仅在黏膜下可见少许散在的炎性细胞,血管及支气管周围无炎性细胞浸润,未见杯状细胞增生,也无肺泡壁变薄、断裂及间隔增宽等现象。哮喘模型组小鼠的病理切片可观察到明显的气道炎症反应,显微镜下可观察到小鼠肺泡壁变薄、甚至有些已经发生断裂,肺泡之间间隔增宽,支气管及血管周围可见大量嗜酸性粒细胞、中性粒细胞浸润,并伴有杯状细胞大量增生,黏液分泌增多的现象。哮喘小鼠肺组织同时伴发了支气管上皮增生,基底膜及气道平滑肌增厚,及支气管管腔狭窄等重塑性改变。给予布地奈德干预后,小鼠支气管及血管周围嗜酸性粒细胞、中性粒细胞等炎细胞浸润较模型组减少,杯状细胞增生减少,支气管上皮增生,基底膜及气道平滑肌增厚,及支气管管腔狭窄等病理学改变明显改善。
2.3 肺组织病理学炎症评分
如图3炎症评分结果显示:哮喘模型组的炎症评分明显高于对照组(P< 0.05),布地奈德组炎症评分高于对照组(P< 0.05),但低于哮喘模型组(P< 0.05)。
2.4 小鼠BALF中IL-22水平的变化
3组BALF中IL-22的水平如图4所示。与对照组相比较,哮喘组BALF中IL-22的水平明显增高(P< 0.05)。布地奈德组小鼠BALF中IL-22的水平高于对照组,但较哮喘模型组明显下降(P< 0.05)。
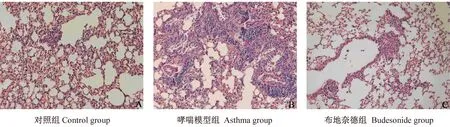
图1 HE染色下小鼠肺组织镜下观(×400)Fig.1 Histology of the mouse lung HE staining
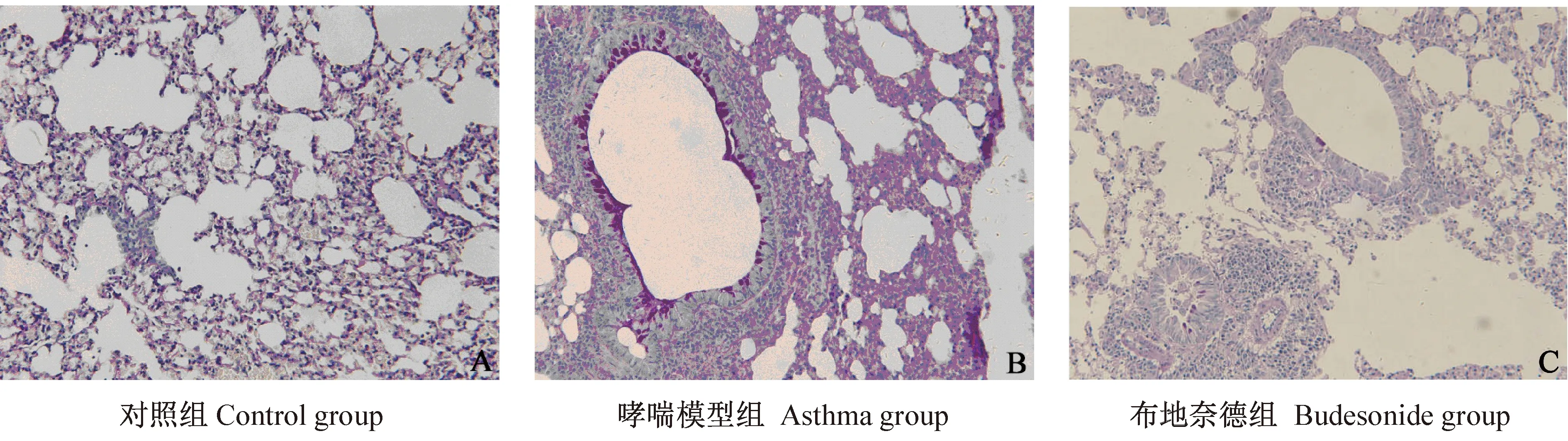
图2 AB-PAS染色下小鼠肺组织镜下观(×400)Fig.2 Histology of the mouse lung(AB-PAS staining)
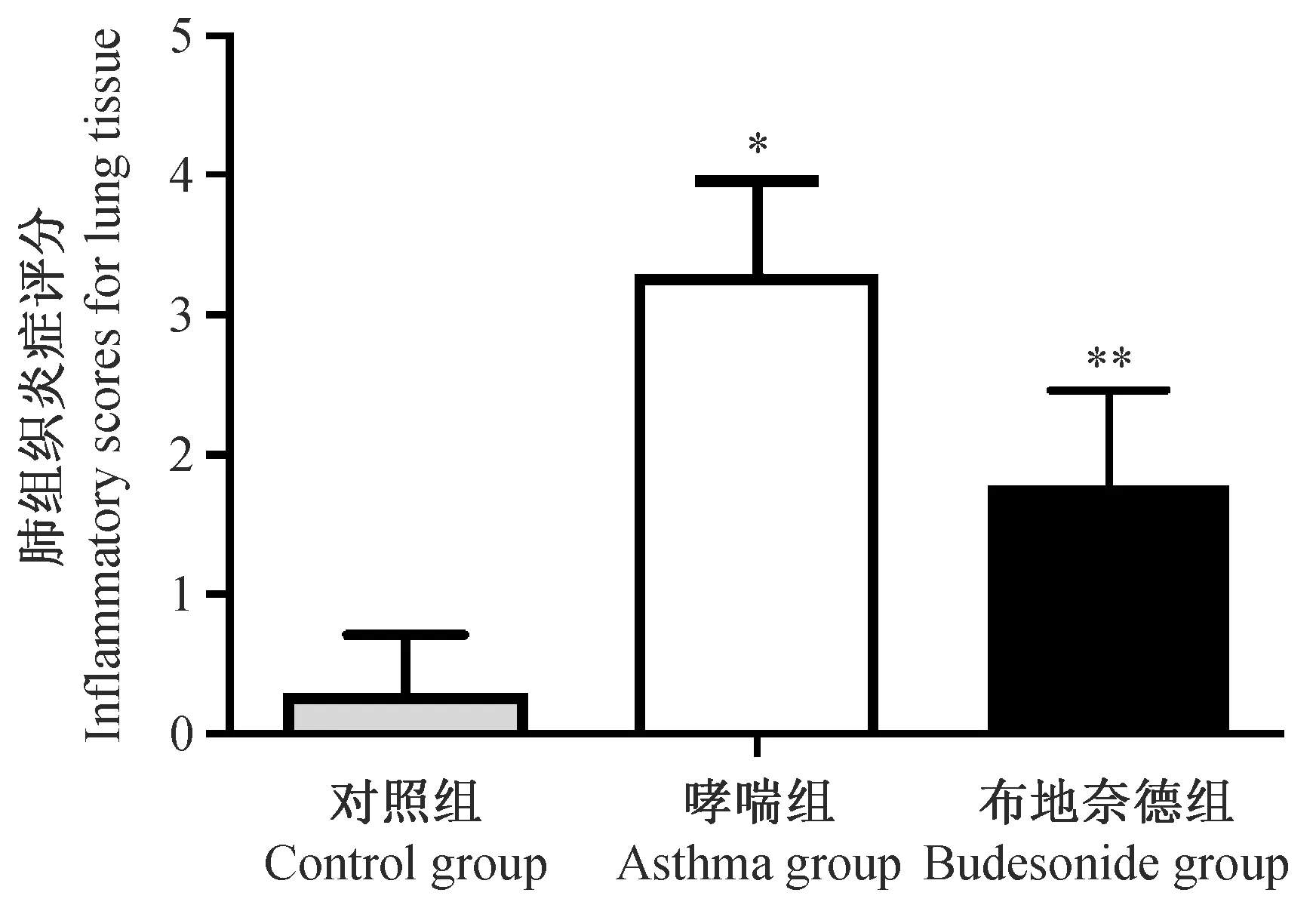
注:与对照组相比,*P < 0.05;与哮喘模型组相比,**P < 0.05。图3 布地奈德对哮喘小鼠肺组织炎症评分的影响(n=8)Note.*P < 0.05 compared with control group,**P < 0.05 compared with asthma group.Fig.3 Effect of budesonide on murine inflammatory scores for lung tissue
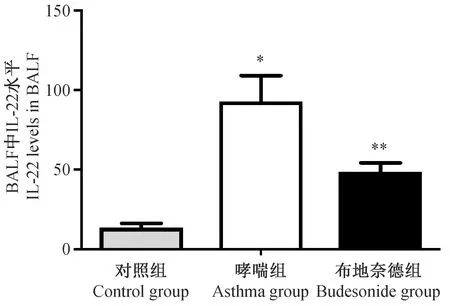
注:与对照组相比,*P < 0.05,与哮喘模型组相比,**P < 0.05。图4 支气管肺泡灌洗液中IL-22的水平(n=8)Note.*P < 0.05 compared with control group,**P < 0.05 compared with asthma group.Fig.4 Secretion levels of IL-22 in the bronchoalveolar lavage fluid
2.5 小鼠肺组织中IL-22 mRNA 的表达水平
3组小鼠肺组织中IL-22 mRNA 的表达水平如图5所示。统计表明,与对照组比较,哮喘组肺组织中IL-22 mRNA 的表达水平明显增高(P< 0.01)。给予布地奈德、黄芪甲苷治疗后,IL-22 mRNA水平较哮喘组下降(P< 0.01),黄芪甲苷组小鼠肺组织中IL-22 mRNA水平在数值上低于布地奈德组(P> 0.05)。

注:与对照组相比,*P < 0.05;与哮喘模型组相比,**P < 0.05。图5 肺组织中IL-22 mRNA 的表达水平(n=8)Note.*P < 0.05 compared with control group, **P < 0.05 compared with asthma group.Fig.5 Expression of IL-22 mRNA in mice of three groups
3 讨论
IL-22属于IL-10细胞因子家族,可由Th22细胞、Th17细胞、NK细胞、DCs、LTi-like细胞、固有淋巴细胞(ILCs)等分泌,巨噬细胞、DC和非免疫细胞则不产生IL-22。在体内IL-22的总分泌量中,Th22约占37%~63%,是体内IL-22的主要来源[14-17]。IL-22生物学效应的发挥依赖于其与IL-22R1/IL-10R2受体复合物的结合[18],IL-22与受体的特异性结合依赖于IL-22R1,IL-10R2则主要参与了细胞内的信号转导过程[19]。IL-22由免疫细胞产生,但由于免疫细胞不表达IL-22R1,故IL-22对T淋巴细胞、B淋巴细胞等免疫细胞并不发挥生物学作用,而呼吸道上皮细胞、呼吸道平滑肌细胞和肺成纤维细胞等表达IL-22受体的细胞,常成为其作用的靶点[20]。IL-22在保护皮肤及肺组织粘膜屏障、组织损伤及哮喘等疾病的发病过程中十分关键[21,22],有研究提示,它很可能是哮喘等炎症性疾病由急性改变转变为慢性改变的关键性因子之一[23-25]。现阶段对于IL-22的研究较多是通过采集患者标本进行,对于IL-22在动物模型中的研究仍比较少。哮喘发病机制复杂,由于不同患者遗传因素、所处环境、发病原因及病程的不同,常可对研究结果造成一定的影响。同时,针对患者的研究也常受到取材、检测发方法等方面的限制,不利于系统、全面、客观的探讨IL-22作用于哮喘的机制。与之相比,动物模型更便于控制实验条件,将临床标本研究、动物模型研究结合起来,有利于我们更系统的认识IL-22在哮喘中的作用及作用机制,但目前,对于IL-22在哮喘小鼠模型中作用的研究还较少。
我们通过对哮喘模型的研究发现,在哮喘病程的炎症反应阶段,哮喘模型组小鼠BALF中IL-22的水平,肺组织中IL-22 mRNA 的表达水平均较哮喘模型组明显增高,同时哮喘模型组小鼠伴有肺组织炎症评分增高,大量嗜酸性粒细胞、中性粒细胞浸润,杯状细胞增生,黏液分泌增多等气道炎症反应,甚至出现了支气管上皮增生,基底膜及气道平滑肌增厚,及支气管管腔狭窄等重塑性改变[26]。证实在哮喘发病的初期,即存在IL-22表达及分泌水平的增高,IL-22表达的增加很可能是促进哮喘气道炎症进行性发展,甚至导致后期气道重塑性改变的的重要因素之一。
吸入性糖皮质激素(ICS)是目前控制哮喘气道炎症的一线治疗措施,可有效控制哮喘气道炎症反应的发生,并减缓气道重塑进程,布地奈德作为ICS中最常应用于临床的一种药物,已被证实可通过影响Th17、Treg、Th1、Th2等多种炎症细胞及炎性细胞因子,抑制哮喘的发展[5-9]。目前尚无研究探讨吸入性糖皮质激素是否会对IL-22的表达和分泌产生影响。本研究发现,布地奈德可有效降低哮喘小鼠BALF中IL-22的水平,以及肺组织中IL-22 mRNA 的表达水平,提示ICS治疗哮喘的机制可能与其具有降低IL-22表达水平有关。
综上所述,本研究结果提示,IL-22表达水平的增高是开启哮喘气道炎症及气道重塑进程的炎性因子之一,布地奈德能通过抑制IL-22的表达及分泌,减缓肺组织内炎症反应及气道重塑的发生,从而对哮喘发挥治疗作用。
[1] 吕朝霞,杜志方,王淑玉,等.妥洛特罗贴剂联合布地奈德吸入治疗儿童支气管哮喘的临床观察[J].临床军医杂志,2014,42(8):866-867.
[2] 吴华勋,魏伟. Th22细胞在炎症免疫性疾病中作用的研究进展[J].免疫学杂志,2012,28(9):816-819.
[3] Eyerich K,Eyerich S.Th22 cells in allergic disease[J].Allergo J Int,2015,24(1):1-7.
[4] Park S,Chung H-S,Shin D,etal.Adenovirus-mediated Foxp3 expression in lung epithelial cells reduces airway inflammation in ovalbumin and cockroach-induced asthma model[J]. Exp Mol Med.2016,48(9):e259.
[5] 李华斌,罗菲菲,蒋莉,等.按需间断吸入和每日规律吸入糖皮质激素对哮喘患儿安全性和疗效的荟萃分析[J].第二军医大学学报,2014,(04):413-418.
[6] 闫晓燕,高晓增,逯春洁,等.布地奈德雾化吸入对哮喘患儿外周血调节性T细胞和Th1/Th2平衡的影响[J].中国煤炭工业医学杂志,2013,(05):706-707.
[7] 陈济明,李一禄,黄平,等.布地奈德对支气管哮喘患者Th17/Treg平衡的干预机制研究[J].中华哮喘杂志(电子版),2012,(05):329-333.
[8] 王文璐,李红岩,苗伟伟,等.布地奈德抑制支气管哮喘小鼠TSLP及Th2优势免疫作用的研究[J].南京医科大学学报(自然科学版),2012,(09):1207-1210.
[9] 江艳.布地奈德联对哮喘小鼠气道重塑的影响及机制研究[C].中华医学会第十三届全国儿科呼吸学术会议论文汇编,2012:1.
[10] 刘家齐,赵正晓,魏颖,等.芍药苷对哮喘模型小鼠气道炎症趋化因子及受体的干预作用[J].中国实验动物学报,2016,24(5):460-464.
[11] 任佳羽,杨贵方,胡松岩,等.越婢加半夏汤降低过敏性哮喘小鼠的血清IgE和升高肺组织中SOD的活力[J].中国比较医学杂志,2015,25(9):18-21,87.
[12] Henderson WJ,Tang LO,Chu SJ,etal.A role for cycsteinyl leukotrienes in airway remodeling in a mouse asthma model[J].Am J Respir Crit Care Med,2002,165(1):108-116.
[13] 金华良,王利民,罗清莉,等.淫羊藿对哮喘大鼠气道高反应性的影响[J].中国实验方剂学杂志,2014,20(23):169-173.
[14] Farahani R,Sherkat R,Hakemi MG,etal.Cytokines (interleukin-9, IL-17, IL-22, IL-25 and IL-33) and asthma[J]. Adv Biomed Res,2014,3:127.
[15] 孙奇.IL-22——炎症性疾病关键因子[J].免疫学杂志,2011,27(9):821-825.
[16] Takatori H,Kanno Y,Watford WT,etal.Lymphoid tissue inducer-like cells are an innate source of IL-17 and IL-22[J].J Exp Med,2009,206(1):35-41.
[17] Basu R,O'Quinn DB,Silberger DJ,etal. Th22 Cells are an Important Source of IL-22 for Host Protection against Enteropathogenic Bacteria[J].Immunity,2012,37(6):1061-1075.
[18] Duhen T,Geiger R,Jarrossay D,etal.Production of interleukin 22 but not interleukin 17 by a subset of human skin-homing memory T cells[J].Nat Immunol,2009,10:857-863.
[19] Wolk K,Witte E,Witte K,etal.Biology of interleukin-22[J].Semin Immunopathol,2010,32:17-31.
[20] 马继龙,彭经纬,王敏. IL-22的生物学效应及其在哮喘发病中的作用[J].医学综述,2013,19(11):1997-1999.
[21] Eyerich K,Eyerich S.Th22 cells in allergic disease[J].Allergo J,2015,24:1-7.
[22] 黄小丽,郭晓云,姜海行.Th22细胞在炎症免疫性疾病及肿瘤中的研究进展[J].世界华人消化杂志,2014,22(13):1812-1819.
[23] Pennino D,Bhavsar PK,Effner R,etal.IL-22suppresses IFN-γ-mediated lung inflammation in asthmaticpatients[J].J Allergy ClinImmunol,2013,131:562-570.
[24] Johnson JR,Nishioka M,Chakir J,etal. IL-22 contributes to TGF-beta1-mediated epithelial-mesenchymal transition in asthmatic bronchial epithelial cells[J].Respir Res,2013,14:118.
[25] Nakagome K,I mamura M,Kawahata K,etal. High expression of IL-22 suppresses antigen-induced immune responses and eosinophilic airway inflammation via an IL-10-associated mechanism[J].J Immunol,2011,187:5077-5089.
[26] 湛孝东,姜玉新,李良怿,等.不同浓度卵蛋白变应原对小鼠哮喘模型建立的影响[J].中国实验动物学报,2012,20(4):16-20,94.
Budesonide inhibits murine asthmatic airway inflammation through reduction IL-22 secretion
WANG Ming-lei1, WANG Wen-ge2*, ZHANG Jun-hong2, ZHANG Da-wei3, YAN Ke-song3
(1.Department of Postgraduates, Hebei North University, Zhangjiakou 075000, China; 2.Department of Paediatrics, Air Force General Hospital of People’s Liberation Army,Beijing 100142; 3.Department of Laboratory Animals, 304 Hospital of Chinese Peoples Liberation Army,Beijing 100048)
Objective To study the effect of Interleukin-22 (IL-22) on murine asthmatic airway inflammation and airway remodeling, observe the effect of budesonide on IL-22 of asthmatic mouse model, explore the mechanism of budesonide in the treatment of asthma. Methods Ovalbumin(OVA) was used as an allergen to sensitize and challenge the mice. 24 female specific-free (SPF) BALB/c mice aged four weeks were randomly divided into 3 groups:control group, asthma group and budesonide treatment group (BUD group). For Histopathological Examination, HE staining was used to measure the inflammation scores, AB-PAS staining was used to measure the hyperplasia of goblet cells and mucin. Enzyme-linked immunosorbent assay(ELISA) was used to analyze IL-22 levels in bronchoalveolar lavage fluid (BALF). Quantitative Real-time PCR was performed to analyze the effects of budesonide on IL-22 mRNA levels in lung tissue. Results The inflammation scores of asthma group were elevated compared with the control group. An overall change towards less severe asthmatic airway inflammation by the end of the trial was observed in the BUD group. IL-22 levels in BALF were significant decreased after the treatment of budesonide, the mRNA levels of IL-22 were obviously decreased in BUD group, too. A significant positive correlation was observed between the mRNA levels of IL-22 and airway inflammation. Conclusions The increasing IL-22 secretion can lead to the occurrence of airway inflammation of asthma. Budesonide can inhibit the expression of IL-22, thereby Budesonide could inhibit the development of airway inflammation of asthma.
Asthma; Interleukin-22; Budesonide; Airway inflammation;Airway remodeling
北京市自然科学基金面上项目(7162028);中国人民解放军空军总医院面上项目(KZ2014005)。
王明磊(1988- ),女,硕士研究生,研究方向:儿童哮喘。 E-mail:wangml2015@126.com
王文革(1966- ),女,副主任医师,博士,研究方向:中西医结合防治儿童哮喘。E-mail:1264516006@qq.com
R-33
A
1671-7856(2017) 05-0055-05
10.3969.j.issn.1671-7856. 2017.05.013
2017-04-13
