高分辨率熔解曲线技术用于结核分枝杆菌临床分离株异烟肼耐药性的快速检测
2017-06-09杨彩虹包海洋吴长新曹旭东陈创夫
杨彩虹,杨 敏,于 璐,包海洋,吴长新,曹旭东,陈创夫
高分辨率熔解曲线技术用于结核分枝杆菌临床分离株异烟肼耐药性的快速检测
杨彩虹1,杨 敏2,于 璐3,包海洋1,吴长新3,曹旭东3,陈创夫1
目的 评价高分辨率熔解曲线分析技术(high-resolution melting curve,HRM)检测结核分枝杆菌异烟肼耐药性的应用价值。方法 1)通过传统比例法药敏实验对本实验室保存的49株结核分枝杆菌进行异烟肼耐药性分析。2)进一步对该结核分枝杆菌进行异烟肼耐药相关基因KatG基因和inhA基因进行异烟肼耐药决定区测序分析,筛查突变位点。3)根据筛查到的突变位点设计高分辨率熔解曲线分析所用的特异性引物,对异烟肼耐药基因耐药决定区进行高分辨率熔解曲线分析检测DNA突变,评估用高分辨率熔解曲线分析技术对结核分枝杆菌异烟肼耐药性检测的效率。结果 1)比例法药敏结果显示,49株实验菌株中20株为异烟肼耐药株,29株为异烟肼敏感株。 2)测序分析结果显示:①KatG基因出现了4种突变形式,分别是234单位点突变;234、315双位点突变;234、463双位点突变;234、315、463三位点联合突变。②inhA基因检测到3种突变,即-8位、-15位、-152位。3) ①对耐药株的基因突变进行分析发现:20株异烟肼耐药株中11株存在KatG基因第315位密码子的突变、占异烟肼耐药株的55%;6株存在inhA基因-15(4株)位碱基、-8(1株)位碱基、-152(1株)位碱基的突变,共占异烟肼耐药株的30%;2株同时存在基因KatG315密码子和inhA-15位碱基的突变,占异烟肼耐药株的10%;1株均未检测到KatG基因和inhA基因的突变,占异烟肼耐药株的5%。通过基因突变检测结核分枝杆菌异烟肼耐药性的敏感性为95%、特异性为100%。 ②用高分辨率溶解曲线检测实验菌株耐药基因突变的结果显示,18株存在基因突变,24株不存在基因突变,检测的灵敏度为94.7%、特异性为80%。③以高分辨率熔解曲线检测到突变为耐药的判断标准,检出19株为耐药株,24株为敏感株。以比例法药敏结果为参照,检测的灵敏度为95%、特异性为82.76%。结论 高分辨率溶解曲线用于结核分枝杆菌对异烟肼耐药性的检测具有较好的灵敏度,耗时短,在异烟肼耐药结核病的快速诊断方面具有一定的应用价值。
结核分枝杆菌;高分辨率熔解曲线(HRM);DNA测序;耐药性;异烟肼
结核病是感染结核分枝杆菌引起的传染病。近年来由于HIV的流行及耐药结核分枝杆菌(MDR-TB)的出现等原因,使结核病成为一个严重威胁人类生存的公共卫生问题。在抗击结核病的医疗实践过程中,用到利福平、异烟肼、链霉素、乙胺丁醇、氧佛沙星、阿米卡星、卡那霉素等一线及二线抗结核药物。异烟肼对结核杆菌有很强的抑菌和杀菌作用,该药在消化道吸收完全,易渗入肺组织和脑脊液,对宿主细胞内外各期结核病病灶中的结核杆菌均有杀灭作用。异烟肼在肝内被乙酰化和羟化后,可随尿排出,毒性较小;由于其作用强、疗效好、用量少、价格低等原因,多年来异烟肼成为临床抗结核的首选药[1]。几十年过去了,结核杆菌对异烟肼已产生了耐药性,在1990年、2000年和2010年全国3次结核病流行病学抽样调查数据中显示,异烟肼初始耐药率分别为9.6%、11.0%、28.2%,呈现上升趋势;异烟肼获得性耐药率分别为23.5%、31%、30.8%,亦呈现严重上升趋势[2]。耐药及耐多药结核杆菌感染,使原来可治愈的结核病变成难以治疗的致死性疾病。
目前,常用的结核杆菌药敏检测方法,是将菌株接种到含有抗痨药物的固体培养基上进行培养,观察其生长情况来判断耐药性。该方法准确性高,但耗时长,一般需要1~2个月时间,不仅受培养条件、培养技术及各种人为因素的影响,而且对快速诊断结核耐药性来说,存在严重的滞后性,有些严重患者在药敏结果出来前已死亡。因此,快速检测获得菌株的耐药信息,及时设计制定临床化疗方案,是有效治疗耐药结核病的关键[3]。
回顾近年来结核杆菌异烟肼耐药机制研究资料显示,结核杆菌发生异烟肼耐药与其基因组中katG、inhA、kasA、oxy-ahpC、ndh、efpA、furA、iniA等基因突变有关;其中50%~70%的结核杆菌异烟肼耐药株katG基因有突变,25%的的结核杆菌异烟肼耐药株与inhA基因突变有关。总体上,高达80%的结核杆菌异烟肼耐药株基因突变发生在katG和inhA这两个基因。因此,katG和inhA这两个基因可作为临床检测异烟肼耐药菌的靶点[4]。
本实验在传统耐药分析基础上,对异烟肼耐药相关基因耐药决定区进行DNA测序,根据测序检测到的DNA突变,设计HRM实验检测KatG基因、inhA基因突变的特异性引物,对实验菌株进行HRM检测,分析HRM检出耐药基因突变的效率,评估以HRM检测到DNA突变为菌株耐药的判断标准,分析用HRM对结核分枝杆菌异烟肼耐药性进行检测的效率。以建立一种快速检测异烟肼耐药性的方法,并评价其应用价值,为结核病的治疗提供可靠的依据。
1 材料与方法
1.1 材料
1.1.1 菌株 结核分枝杆菌H37Rv及49株实验菌株均由本实验保存。
1.1.2 主要试剂 氨酸钠、磷酸二氢钾、硫酸镁、柠檬酸镁、丙三醇、天泽恩基因柱式分支杆菌DNAout 试剂盒、高分辨率熔解曲线试剂盒(罗氏公司)、谷核酸染料及2×Taq PCR Master Mix 购与生工生物科技有限公司、引物均由上海祥音生物科技有限公司合成、DNA ladder购自北京康为世纪生物科技有限公司。
1.1.3 主要仪器与设备 涡旋混合仪、恒温培养箱、实时荧光定量PCR仪(LightCycler480,瑞士罗氏公司)。Nanodrop 2000分光光度计。
1.2 方法
1.2.1 比例法药敏实验 将培养至出现可见菌落的结核分枝杆菌进行药敏实验,实验操作遵循《结核分枝杆菌药物敏感性试验标准化操作程序及质量保证手册》进行,异烟肼在含药培养基中的浓度为0.2 μg/mL[5]。
1.2.2 结核分枝杆菌DNA的提取及HRM检测模板浓度的标准化 在改良的罗氏培养基上挑取适量生长良好的结核分枝杆菌加入磨菌瓶,磨菌瓶提前加入磨菌株高压备用,使用时再加入5~6滴生理盐水。每株菌磨3 min,静止5 min,然后分装到0.5 mL的灭菌管中,再将其放入灭活仪85 ℃,1 h。灭活后的菌液按照柱式分枝杆菌DNAout试剂盒说明书提取,获得的DNA原液用分光光度计检测浓度, HRM检测所需模板将DNA原液用双蒸水稀释成10 ng/μL,备用。
1.2.3 异烟肼耐药决定区(IRDR)DNA测序分析 结核杆菌异烟肼耐药机制研究资料显示,结核杆菌发生异烟肼耐药与其基因组中katG、inhA、kasA、oxy-ahpC、ndh、efpA、furA、iniA等基因突变有关[6]。但总体上,高达80%的结核杆菌异烟肼耐药株基因突变发生在katG(基因登录号为X68081)和inhA(基因登录号为U66801)这两个基因,这两个基因分别存在跟异烟肼耐药相关的突变位点,这些位点主要集中在基因的某一区域,这个区域就称为异烟肼耐药决定区(IRDR)[7]。katG基因的异烟肼耐药决定区有2个,分别为KatG1区和KatG2区;KatG1区从第194个密码子到第348个密码子之间,包含189个密码子,片段长度为569bp;KatG2区从第348个密码子到第524个密码子之间,包含177个密码子,片段长度为531 bp。inhA基因启动子区的扩增覆盖-8、-15位点,片段长度为300 bp。针对katG基因和inhA基因异烟肼耐药决定区设计的测序引物序列见表1所示。
表1 异烟肼耐药决定区DNA测序用到的引物
Tab.1 Primers of DNA sequencing

基因(Gene)序列(Thesequence)退火温度(Tm)片段长度(Fragmentlength)KatG1F1:CGATGAGGTC-TATTGGGGCA58.5℃568bpR1:AGAGGTCAGT-GGCCAGCATCKatG2F2:CTGGCGCTTG-GCAATACACC59.5℃531bpR2:GGATCTCTTC-CAGGGTGCGAInhAF:ACATACCTGCT-GCGCAATTC59.7℃300bpR:CCGATCCCCCG-GTTTCCTC
对49株实验菌株进行异烟肼耐药决定区进行PCR扩增,PCR体系为25 μL,包括9.7 μL dd H2O、25 μm上下游引物各0.4 μL、模板2 μL、Mix 12.5 μL。PCR反应条件为95 ℃预变性5 min、94 ℃变性40 s、59.5 ℃退火30 s、72 ℃延伸40 s、重复30个循环、72 ℃再延伸10 min,4 ℃保存。
将PCR扩增产物进行DNA测序分析,DNA测序结果与GenBank上公布的结核分枝杆菌H37Rv标准株对应基因序列进行比对分析,获得每株菌在耐药决定区的突变信息,将该突变信息与文献报道过的突变位点进行比较,观察二者之间的异同并统计各突变位点在耐药株里所占比例。
1.2.4 高分辨率熔解曲线(HRM)分析 根据结核分枝杆菌在异烟肼耐药决定区的测序结果,针对耐药突变发生频率最高的部位设计HRM检测KatG基因和inhA基因突变的特异性引物(引物序列见表2),片段长度约为100~400 bp。
表2 HRM检测异烟肼耐药性的引物
Tab.2 Primers of detecting isoniazid-resistance by HRM

GeneSequenceAnnealingtempSizeofproductKatGF:TCGTATGGCACCG-GAACC59℃123bpR:CAGCTCCCACTCG-TAGCCInhAF:CGTTACGCTCGTG-GACATAC57℃126bpR:TCCGGTAACCAG-GACTGAAC
对异烟肼耐药决定区进行DNA突变的HRM检测。HRM检测的反应体系为10 μL,其中包括HRM Mix 5μL 、10 μmol/L上下游引物各0.5 μL、ddH2O 1.8 μL、MgCl2 1.8 μL、模板1 μL。
HRM检测检测参数如表3、表4。
表3 高峰辩率熔解曲线(HRM)分析实验条件设计
Tab.3 Experiment conditions of HRM
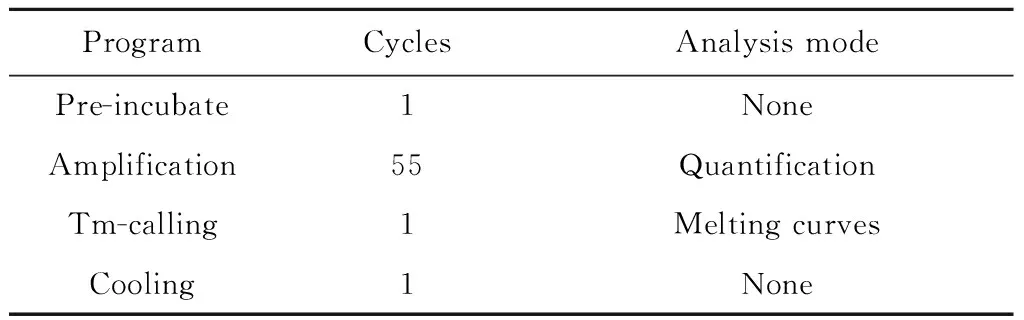
ProgramCyclesAnalysismodePre-incubate1NoneAmplification55QuantificationTm-calling1MeltingcurvesCooling1None
表4 不同反应阶段条件
Tab.4 Experiment conditions of each procedure
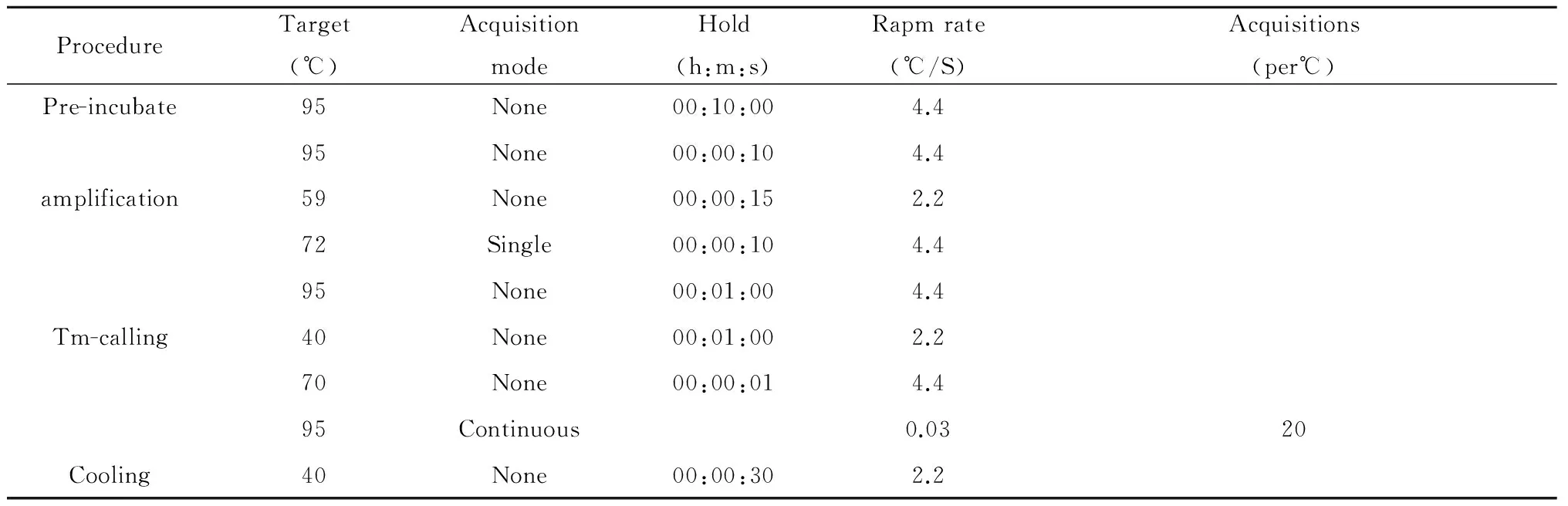
ProcedureTarget(℃)AcquisitionmodeHold(h:m:s)Rapmrate(℃/S)Acquisitions(per℃)Pre-incubate95None00:10:004.495None00:00:104.4amplification59None00:00:152.272Single00:00:104.495None00:01:004.4Tm-calling40None00:01:002.270None00:00:014.495Continuous0.0320Cooling40None00:00:302.2
每个样本检测时设置3个重复样本孔。HRM扩增完成后,对结果进行分析。
首先,①对样本的扩增曲线进行分析,确定模板浓度是否符合要求,当CP<30时符合;②再观察每个样本扩增曲线上显示的CP值是否一致对模板的起始量是否在同一水平进行分析。然后,再对样本的熔解峰进行分析,确定设计的引物是否符合要求,观察是否存在杂峰或者引物二聚体。最后,再对样本是否存在基因突变进行分析,以H37Rv为野生型参照,比较3个重复样本孔与野生型复孔的峰形和颜色异同来判断样本是否存在基因突变。当样本的3个复孔或2个复孔的峰形和颜色相同且与野生型复孔的峰型不同时,则判断为基因突变株;反之则为野生株。若3个重复样本孔之间的峰形和颜色都不同,则要重复试验以确定。
以上分析完成后,对49株结核分枝杆菌异烟肼耐药性HRM检测的结果进行整理分析,再评估用HRM对结核分枝杆菌临床分离株进行异烟肼耐药性检测的效率。
1.2.5 统计学分析 对所有菌株HRM检测结果分析完成后,应用spss17.0统计软件进行统计分析,以DNA测序结果为参照,计算HRM检测结果与DNA测序检测结果之间的符合率。以传统药敏结果为参照,计算HRM检测结果与传统药敏检测结果之间的符合率。再用卡方检测法分析HRM检测菌株耐药性与传统药敏检测菌株耐药性、DNA测序检测菌株耐药性与之间存在的差异性。用Kappa检测来分析两种结果的一致性。Kappa<0.4时为低度一致性;0.75≥Kappa≥0.4时为中度一致性;1≥Kappa≥0.75时为高度一致性。
2 结 果
2.1 比例法药敏实验结果 比例法药敏结果显示49株结核分枝杆菌中20株为异烟肼耐药株,29株为异烟肼敏感株。
2.2 异烟肼耐药决定区(IRDR)DNA测序分析结果
2.2.1 目的基因KatG和inhA的扩增结果 用测序引物PCR分别扩增实验菌株的基因组DNA,取5μL扩增产物经1%琼脂糖凝胶电泳。49株分枝杆菌及H37Rv标准株全部扩增出KatG基因568 bp和531 bp片段长度,如图1。inhA基因扩增出300 bp片段长度,如图2所示。将可以观察到阳性扩增条带的样本剩余部分送至生工基因公司测序。
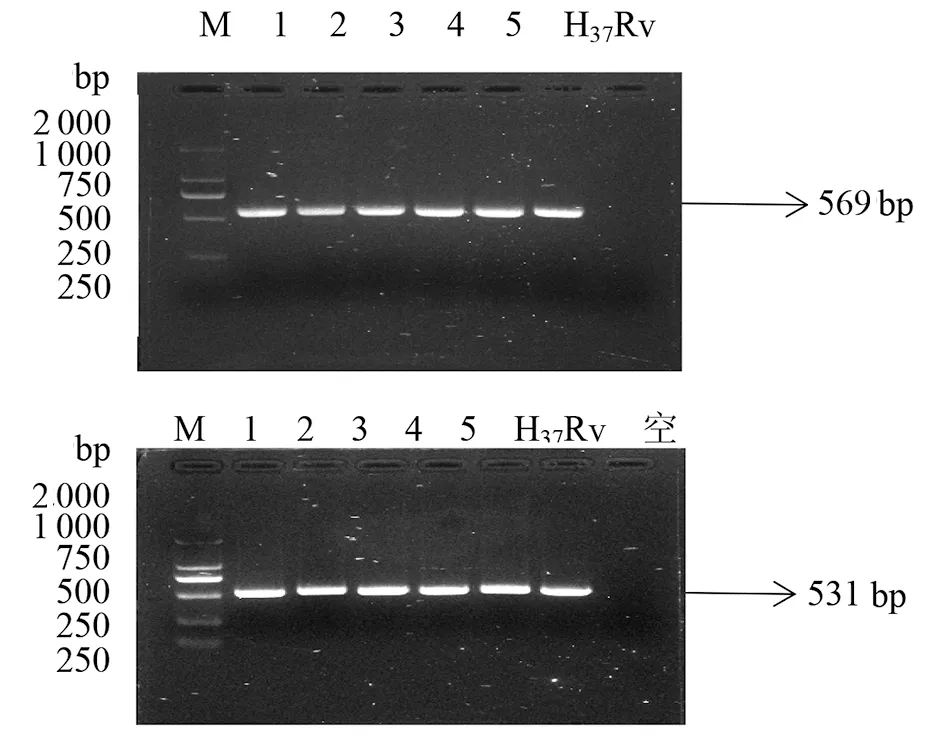
M: 2000 mark; 1-5: strains; H37Rv: positive control; Empty: blank control.图1 katG基因 IRDR 区域PCR扩增结果Fig.1 PCR amplification results of isoniazid resistance-determining region
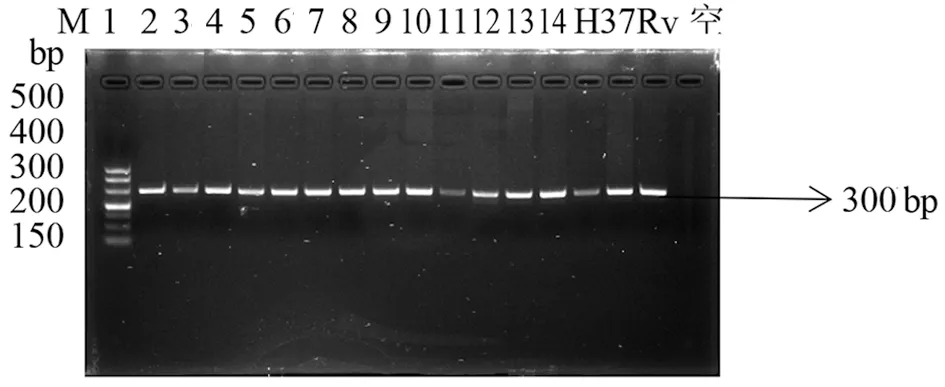
M: 500 mark; 1-5: strains; H37Rv: positive control; Empty: blank control图2 InhA基因PCR扩增结果Fig.2 PCR amplification results of inhA
2.2.2 目的基因KatG和inhA的测序分析 将DNA测序结果分别与GenBank上公布的结核分枝杆菌H37Rv基因KatG和inhA基因对应序列进行比较,50株分枝杆菌中异烟肼耐药相关基因KatG存在3种突变类型,分别为第234位密码子GCG突变为GGG,氨基酸由丙氨酸(Ala)突变为甘氨酸(Gly),如图3A所示;第315位密码子AGC的突变,如图3B所示;第463位密码子CGG的突变,如图3C所示。inhA基因存在3种突变类型,分别为inhA-8位T的突变,如图3D所示;inhA-15位C的突变,如图3E所示;inhA-152位G的突变,如图3F所示。
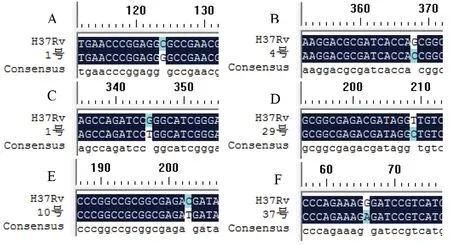
A: KatG234 GCG→GGG,Ala→Gly; B: KatG315 AGC→ACC,Ser→Thr; C: KatG463 CGG→CTG,Arg→Leu; D: inhA T-8 C; E: inhA C-15 T; F: inhA-152 G→A 图3 DNA序列比对结果Fig.3 DNA sequence alignment results
2.2.3 各菌株在异烟肼耐药决定区的突变位点分析 将每株菌的测序结果与GenBank上公布的标准株H37Rv的KatG基因和inhA基因对应序列进行比对分析,结果见表5所示。
表5 不同株菌在异烟肼耐药决定区的突变信息
Tab.5 Mutation information of different strains in isoniazid resistance-determining region
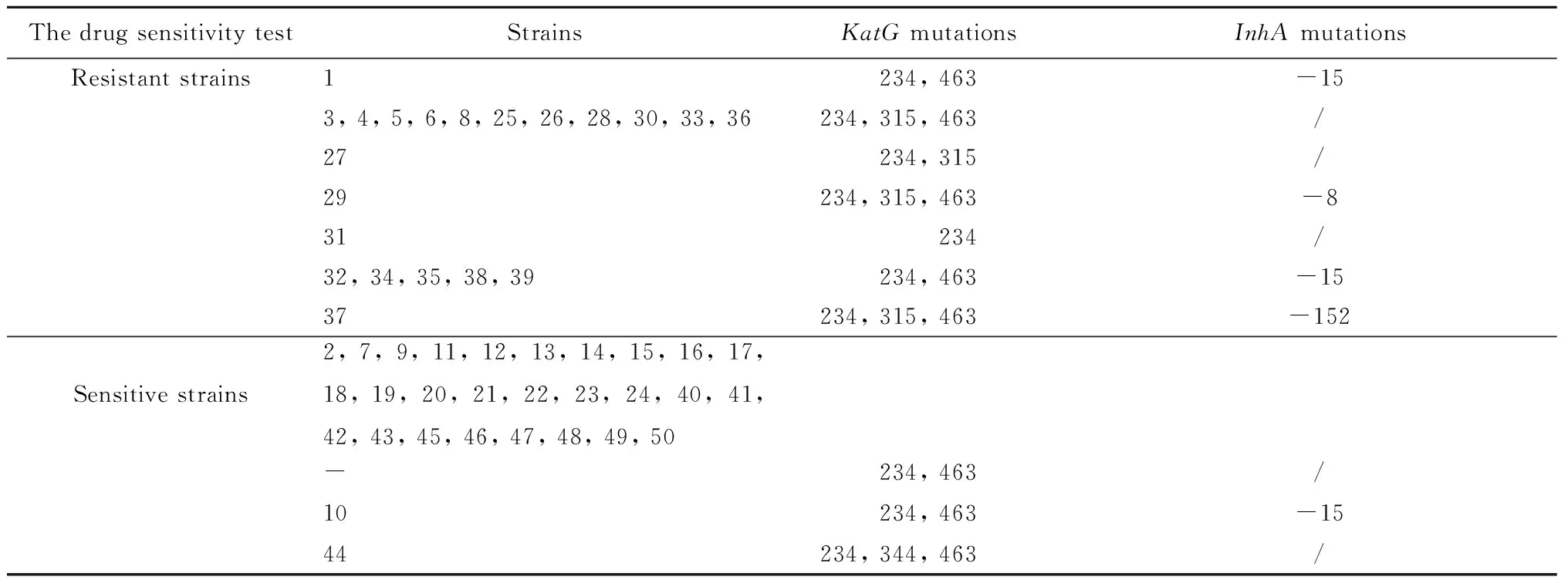
ThedrugsensitivitytestStrainsKatGmutationsInhAmutationsResistantstrains1234,463-153,4,5,6,8,25,26,28,30,33,36234,315,463/27234,315/29234,315,463-831234/32,34,35,38,39234,463-1537234,315,463-152Sensitivestrains2,7,9,11,12,13,14,15,16,17,18,19,20,21,22,23,24,40,41,42,43,45,46,47,48,49,50-234,463/10234,463-1544234,344,463/
2.2.4KatG基因和inhA基因各位点突变类型及密码子变化 通过对49株分枝杆菌KatG基因突变位点分析发现,20株异烟肼耐药株中出现了4种突变类型,分别为GCG 234 GGG 单位点突变(1株);234、AGC 315 ACC双位点突变(1株);234、CGG 463 CTG双位点突变(6株);234、315、463三位点联合突变(12株);30株异烟肼敏感株中出现了3种突变类型,分别为234、463双位点突变,234、358双位点突变,234、344、463三位点联合突变,见表6所示。
表6KatG基因突变位点分析
Tab.6 Analysis of mutations ofKatGgene
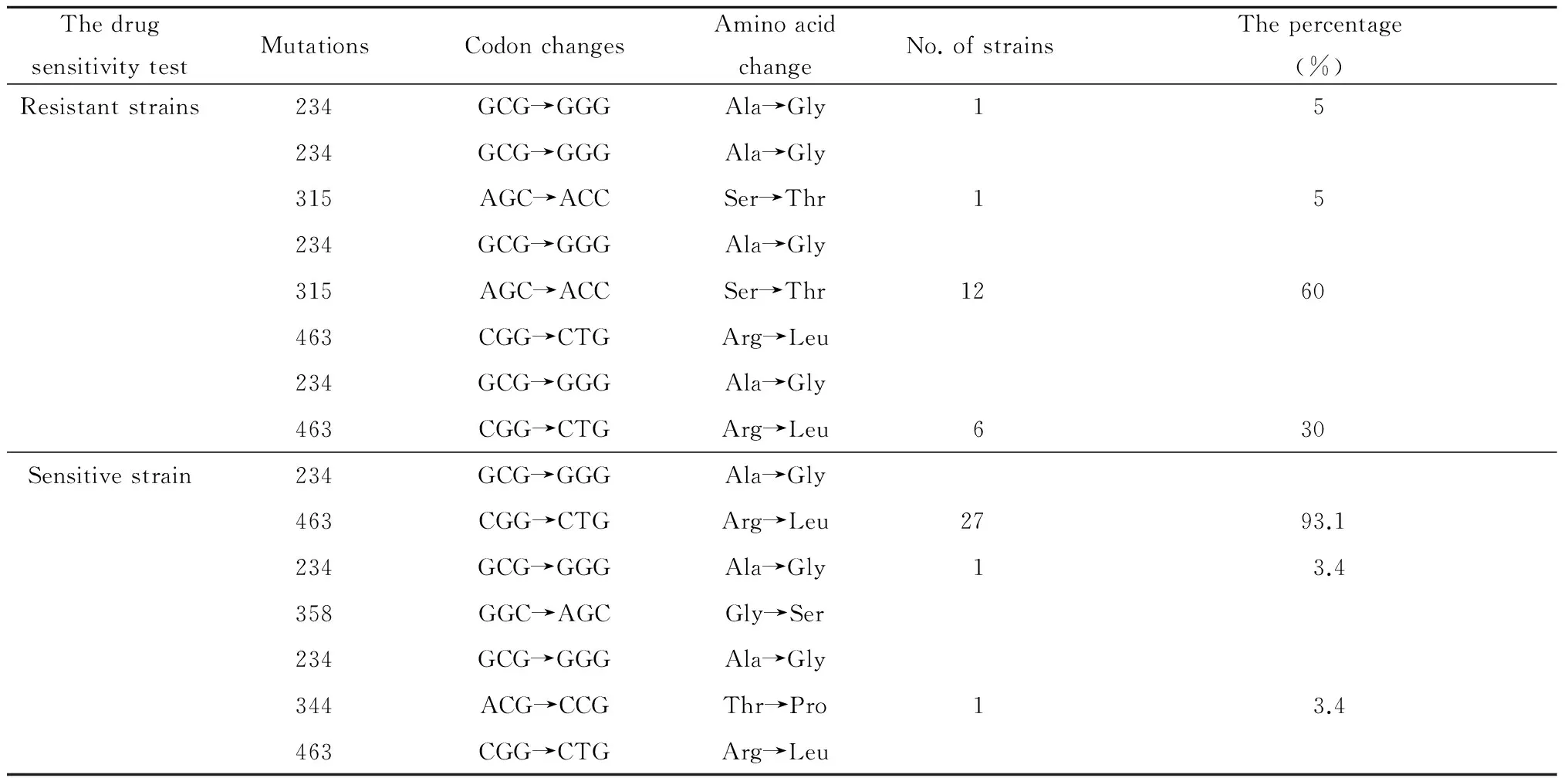
ThedrugsensitivitytestMutationsCodonchangesAminoacidchangeNo.ofstrainsThepercentage(%)Resistantstrains234GCG→GGGAla→Gly15234GCG→GGGAla→Gly315AGC→ACCSer→Thr15234GCG→GGGAla→Gly315AGC→ACCSer→Thr1260463CGG→CTGArg→Leu234GCG→GGGAla→Gly463CGG→CTGArg→Leu630Sensitivestrain234GCG→GGGAla→Gly463CGG→CTGArg→Leu2793.1234GCG→GGGAla→Gly13.4358GGC→AGCGly→Ser234GCG→GGGAla→Gly344ACG→CCGThr→Pro13.4463CGG→CTGArg→Leu
研究结果显示,出现频率最高的突变位点是KatG234、KatG463,几乎每株菌都有这两个突变位点的存在,这与文献报道的结果一致[9]。而KatG315位点突变是在耐药菌株中出现频率较多的位点, 20株耐药株中有13株存在KatG315位点的突变,占异烟肼耐药株的65%,而敏感株中没有该位点的突变,因此,KatG315的突变是异烟肼耐药突变位点之一,可作为检测菌株异烟肼耐药的靶点之一,见图4所示。
对49株分枝杆菌inhA基因进行突变位点分析发现,20株异烟肼耐药株中存在3种突变类型,分别为-8 T→C(1株),-15 C→T(6株) ,-152 G→A(1株)。29株异烟肼敏感株有1株存在inhA-15位C→T的突变;28株未检测到inhA基因的突变,如表7所示。
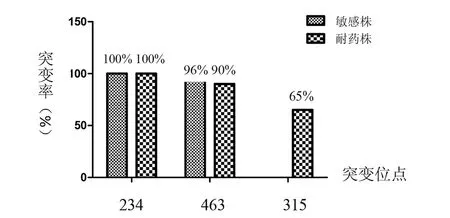
图4 katG各突变位点在敏感株及耐药株中所占比例Fig.4 Mutations proportion of katG in sensitive strains and resistant strains
表7inhA基因突变位点分析
Tab.7 Analysis of mutations ofinhAgene
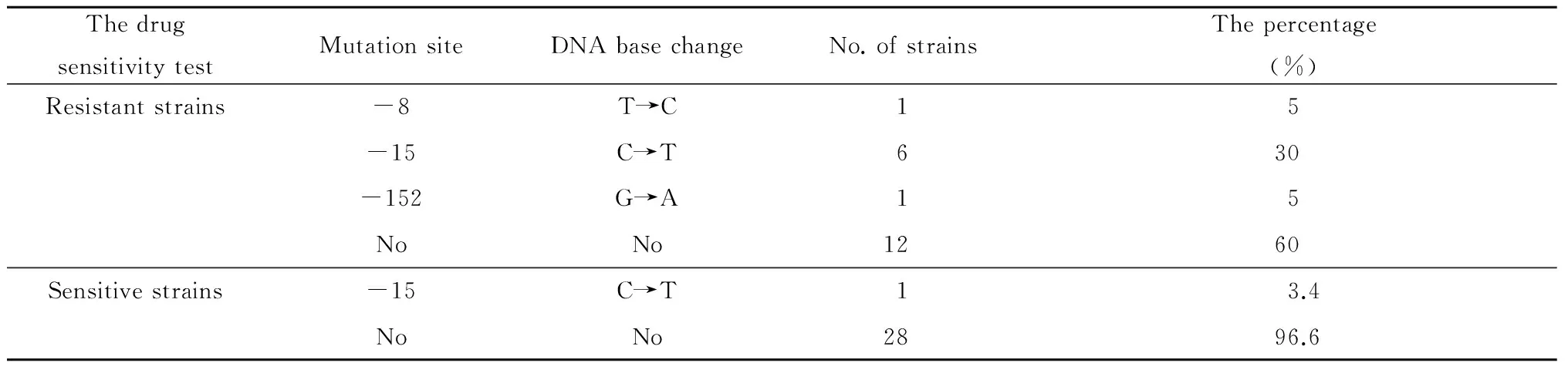
ThedrugsensitivitytestMutationsiteDNAbasechangeNo.ofstrainsThepercentage(%)Resistantstrains-8T→C15-15C→T630-152G→A15NoNo1260Sensitivestrains-15C→T13.4NoNo2896.6
inhA基因的DNA测序结果显示,出现频率最高的突变位点是inhA-15,在异烟肼耐药株中占30%,在异烟肼敏感株中仅占5%;而inhA-8位点、inhA-152位点的突变在异烟肼耐药株中各占5%,而敏感株中没有这两个突变位点的存在,因此,inhA-8、inhA-152、inhA-15的突变是异烟肼的耐药突变位点,可作为检测菌株异烟肼耐药的靶点。见图5所示。
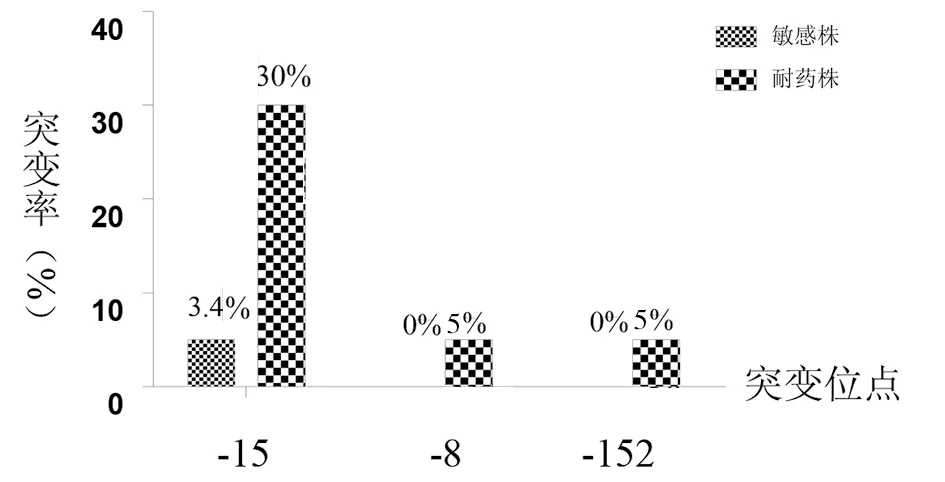
图5 inhA各突变位点在敏感株及耐药株中所占比例Fig.5 Mutations proportion of inhA in sensitive strains and resistant strains
3 评估用HRM对结核分枝杆菌异烟肼耐药性进行检测的价值
3.1 以DNA测序检测到突变判断菌株耐药性的效率 传统比例法药敏结果与基因突变结果进一步分析发现,20株异烟肼耐药株中11株存在KatG基因的突变,6株存在inhA基因的突变,2株同时存在KatG基因和inhA基因的突变,1株不存在KatG基因或inhA基因中任何一个基因的突变。以DNA测序检测到KatG基因第315位密码子发生突变或inhA基因第-8位碱基发生突变为异烟肼耐药的判断标准。
经卡方检测分析,以比例法为标准,在异烟肼耐药株中,耐药突变的菌株占95%,耐药未突变的菌株占5%。即用DNA测序法检测异烟肼耐药性的敏感性为95%,特异性为100%,异烟肼耐药检测的Kappa值为0.957,大于0.75,故而可认为两种检测方法的检测结果具有高度一致性。见表8所示。
表8 传统耐药与基因突变之间的关系
Tab.8 Relationship between the traditional resistance and genetic mutations

ThesequencingresultsThedrugsensitivitytestResistanceSensitiveTotalSensitivitySpecificityPositivepredictiveNegativepredictiveKappaMutation1901995%100%100%96.7%0.957No12930Total202949
3.2 用高分辨率溶解曲线(HRM)检测菌株耐药突变的效率
3.2.1 目的基因KatG和inhA的HRM扩增 用针对耐药突变发生频率最多的KatG315位点、inhA基因-15位点设计的HRM检测的特异性引物,对49株结核分枝杆菌临床分离株进行HRM扩增,扩增片段长分别为123 bp和126 bp。获得的扩增曲线和熔解峰型见图6、图7所示,不存在引物二聚体的峰及其他杂峰,显示引物特异性较好。
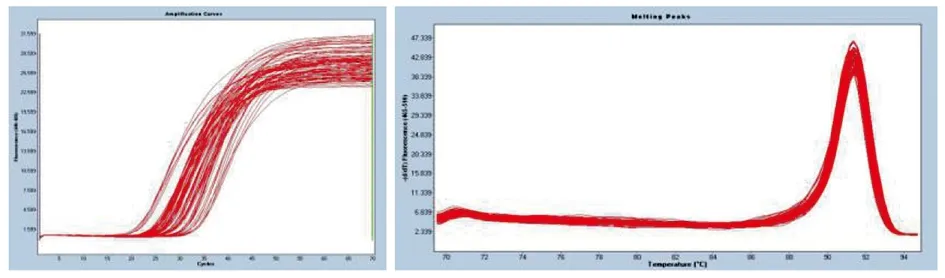
图6 KatG基因HRM扩增结果Fig.6 HRM amplification results of KatG
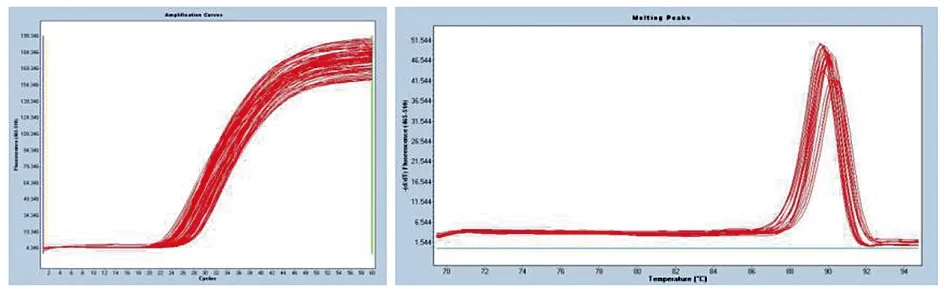
图7 inhA基因HRM扩增结果Fig.7 HRM amplification results of inhA
3.2.2KatG基因和inhA基因突变位点的HRM分析 经HRM分析,以标准株H37Rv为野生型敏感株对照,49株结核分枝杆菌KatG基因和inhA基因突变位点检测获得的HRM分析曲线见图8和图9。
经DNA测序确定,HRM检测区不仅存在耐药突变位点,还存在跟耐药不相关的突变位点,因此本实验以HRM检测到KatG基因和inhA在检测区存在基因突变为异烟肼耐药的判断标准,来评价HRM检测基因突变的效率。
经卡方检测分析,以DNA测序结果为标准,19株DNA测序结果显示存在基因突变的菌株,HRM检测出了18株;30株DNA测序结果显示不存在基因突变的菌株(29株敏感株和1株未发生基因突变的耐药株),HRM检测出了24株。即用HRM检测基因突变的敏感性为94.7%,特异性为80%,两者方法检测基因突变的Kappa值为0.713,小于0.75,大于0.4,故而可认为两种检测方法的检测结果具有中度一致性。见表9所示。
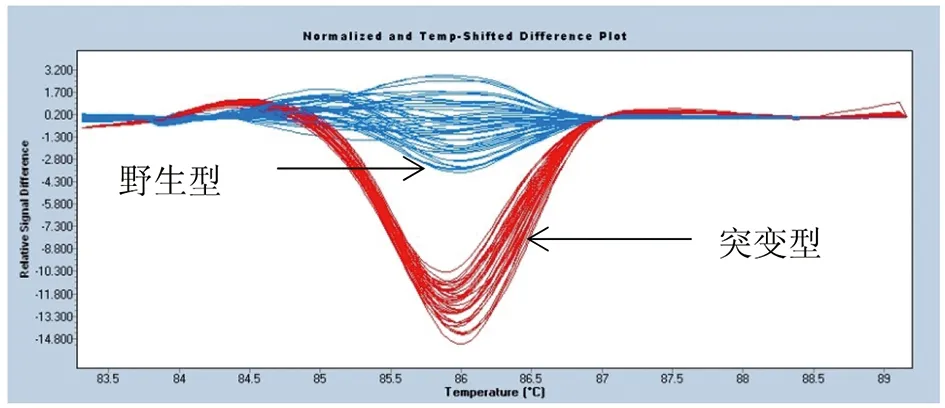
图8 KatG315位点HRM分析曲线图Fig.8 HRM analysis of KatG315 locus
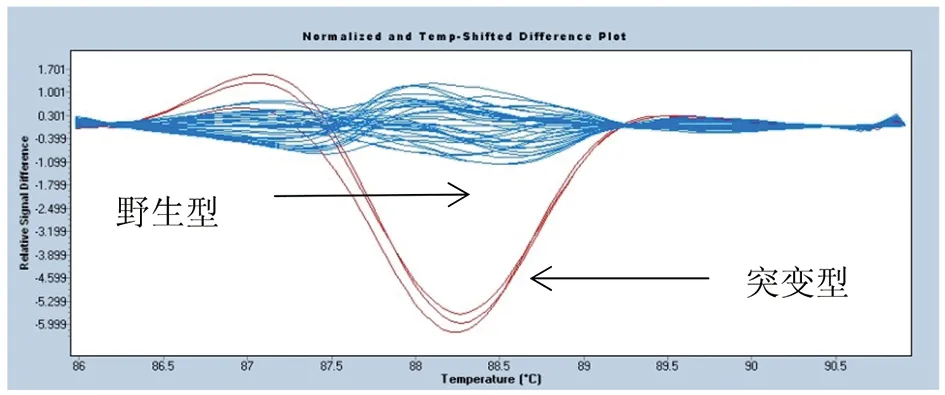
图9 inhA-15位点HRM分析曲线图Fig.9 HRM analysis of inhA-15 locus
3.3 评估高分辨率溶解曲线(HRM)检测结核分枝杆菌异烟肼耐药性的应用价值 以HRM检测到突变为菌株耐药的判断标准,以比例法药敏结果为参照,HRM检测结果显示,检出24株发生了基因突变,包括19株耐药株和5株敏感株;25株未发生基因的突变,包括24株敏感株和1株耐药株。
经卡方检测分析, HRM检测的敏感性为95%,特异性为82.76%,异烟肼耐药检测的Kappa值为0.754,大于0.75,故而可认为两种检测方法的检测结果具有高度一致性。见表10所示。
表9 HRM检测基因突变的效率
Tab.9 HRM detection efficiency of genetic mutations
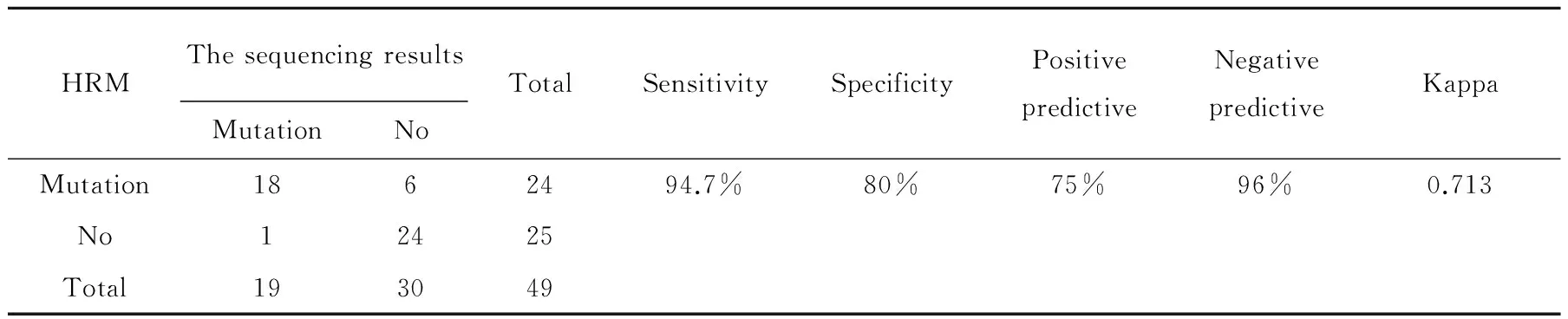
HRMThesequencingresultsMutationNoTotalSensitivitySpecificityPositivepredictiveNegativepredictiveKappaMutation1862494.7%80%75%96%0.713No12425Total193049
表10 HRM检测结核分枝杆菌异烟肼耐药性的效率
Tab.10 HRM detection efficiency of isoniazid-resistance
4 讨 论
我国是WHO认定的27个耐多药/广泛耐药结核病高负担国家之一。化学疗法是控制结核病流行的主要方法,在结核病治疗中发挥着重要作用,但由于不规范的治疗、导致耐药现象的出现。由于人口流动性增大及艾滋病流行等因素的影响,耐多药及广泛耐药性结核病的感染人数越来越多。使结核杆菌耐药株流行趋势不断上升,导致结核病的防控面临巨大挑战[8],严重威胁人类的生命健康。异烟肼是酰肼类化学合成药物,其作用主要是通过抑制结核杆菌分枝菌酸的生物合成,造成细胞壁破损而起到抑菌作用。作为有效的抗菌药物,异烟肼不仅对结核杆菌有抑制作用,对溶血性链球菌、肺炎球菌、沙门氏菌、流行性感冒病毒等都有抵抗作用[9]。该药除了做为抗结核病的首选药物外,在治疗百日咳、急性痢疾、肠炎、麦粒肿、沙门氏菌感染、上呼吸道病毒感染、多发性硬化的动作性震颤、白癜风、甚至遗传性舞蹈病方面都有明显疗效,从而使异烟肼的临床使用范围扩大,耐药现象也越来越普遍[9]。异烟肼耐药与其基因组中katG、inhA、kasA、oxy-ahpC、ndh、efpA、furA、iniA等基因突变有关[10];其中50%~70%的结核杆菌异烟肼耐药株katG基因存在突变,25%的的结核杆菌异烟肼耐药株与inhA基因突变有关。katG基因编码的产物是过氧化氢酶-过氧化物酶,其作用是活化异烟肼,使其发挥作用,当KatG基因发生突变以后,会导致过氧化氢酶活性的丧失,达不到活化异烟肼的作用,进而导致结核分枝杆菌对异烟肼产生耐药性。而inhA基因是烯酰基还原酶编码基因,编码的产物烯酰基载体蛋白还原酶,是异烟肼的作用靶点,与结核分枝杆菌的耐药性密切相关[11]。总体上,高达80%的结核杆菌异烟肼耐药的耐药相关基因突变发生在katG和inhA这两个基因。
对于异烟肼耐药结核病的诊断领域,传统的固体培养基药敏检测法,由于耗时长,费用高,已不能满足耐药结核病早发现、早治疗的迫切需求。由于结核分枝杆菌异烟肼耐药性的产生与异烟肼耐药相关基因的突变存在直接的关系,因此,衍生出一些基因诊断方法。如:PCR-SSCP法、PCR-DNA测序法、PCR-基因芯片法、荧光PCR熔解曲线法等[12]。近十多年来,这些方法在结核杆菌异烟肼耐药性检测中起到了较好的辅助诊断作用;同时,在临床应用实践中也发现了不足之处。例如,PCR-SSCP法检测虽然耗时短,但是其操作复杂,结果判读容易受到电泳条件、以及凝胶染色条件的影响,而不易判断,不易在基层推广。PCR-DNA测序法虽然结果较准确,但DNA测序耗时长,费用高,不易在边远地区推广。PCR-基因芯片法假阳性、假阴性影响其检测结果,且仪器价格高,操作条件要求较高,推广受限[13]。
本实验使用的方法高分辨率熔解曲线法,是在对异烟肼耐药相关基因突变进行DNA测序检测的基础上,针对耐药突变发生频率最高的部位设计高分辨率熔解曲线检测基因突变的特异性引物,对实验菌株进行HRM检测。
分析DNA测序结果发现,katG基因出现最多的突变是234位、315位、463位,而65%的异烟肼耐药与KatG315位点的突变有关。40%的异烟肼耐药株与inhA基因的突变有关,inhA基因出现最多的突变为-15位。用DNA测序方法分析菌株异烟肼耐药性,结果显示敏感性为95%、特异性为100%。虽然该方法检测菌株耐药性的敏感性及特异性较好,但这种方法耗时长,检测费用大,尤其在边远地区不易推广使用。以DNA测序结果为参照,用HRM检测结核分枝杆菌基因突变的敏感性为94.7%、特异性为80%。分析其特异性较低的原因,主要与检测过程中假阳性结果的增多有关,这可能是因为荧光熔解曲线检测技术本身很灵敏,假阳性的出现可能与实验操作过程存在一定的关系。以比例法药敏结果为参照,以HRM检测到突变为菌株耐药的判断标准,HRM检测菌株异烟肼耐药的敏感性为95%;特异性为82.76%。通过HRM方法获得的结果直观,易于判断;耗材便宜,耗时短,在获得结核分枝杆菌临床分离株的基础上,只需2~3 d即可获得菌株耐药性信息,而传统的比例法药敏实验获得菌株耐药信息至少需要一个月的时间,所以在一定程度上对结核杆菌异烟肼耐药性检测起到较好的辅助诊断作用。但katG基因和inhA基因之外的其他基因突变导致的异烟肼耐药,可能是影响HRM检测敏感性的主要原因。另外,katG基因和inhA基因中异烟肼耐药突变热点区的同义突变,可能是影响HRM检测特异性的主要原因。
总的来说,高分辨率熔解曲线分析技术与传统的药敏实验相比,在结核分枝杆菌异烟肼耐药性检测中可作为较好的辅助诊断,可尽快为设计耐药结核病的临床治疗方案提供依据。
[1] Hua CL,Song XH,Ping JZ,et al. The research of drug resistance ofMycobacteriumtuberculosis[J]. Chin J Disinfect,2013,30(7): 626-627. (in Chinese)
花春玲,孙晓穗,平静珍,等. 结核分枝杆菌的耐药性研究[J]. 中国消毒学杂志,2013,30(7):626-627.
[2] The survey technical steering group of National tuberculosis epidemiological sampling. The National tuberculosis epidemiological sampling survey report in the year 2000[J]. Chin J Prey Phthisiol,2002,24(2): 65-108. (in Chinese)
全国结核病流行病学抽样调查技术指导组. 2000年全国结核病流行病学抽样调查报告[J]. 中国防痨杂志,2002,24(2):65-108.
[3] Danaviah S,Sacks JA,Kumar KP,et al. Immunohistological characterization of spinal TB granulomas from HIV-negative and-positive patients[J]. Tuberculosis,2013,93(4): 432-441.
[4] Viader-Salvadó JM,Luna-Aguirre CM,Reyes-Ruiz JM,et al. Frequency of mutations inrpoBand codons 315 and 463 of katG in rifampin-and/or isoniazid-resistantMycobacteriumtuberculosisisolates from northeast Mexico[J]. Microbial Drug Resist,2003,9(1): 33-38.
[5] Fan HY,Zhang H,Li AY. The technology research progress ofMycobacteriumtuberculosisdrug resistance of formation mechanism and drug sensitivity testing technology about isoniazid and rifampicin[J]. Hebei Med J,2009,31(8): 999-1001. (in Chinese)
范怀玉,张宏,李爱英. 结核分枝杆菌对异烟肼和利福平的耐药性形成机制及药物敏感性检测技术研究进展[J]. 河北医药,2009,31(8):999-1001.
[6] Wiedemann B,Heisig A,Heisig P. Uncomplicated urinary tract infections and antibiotic resistance—epidemiological and mechanistic aspects[J]. Antibiotics,2014,3(3): 341-352.
[7] Scarpellini P,Carrera P,Cichero P,et al. Detection of resistance to isoniazid by denaturing gradient-gel electrophoresis DNA sequencing inMycobacteriumtuberculosisclinical isolates[J]. New Microbiologica,2003,26(4): 345-351.
[8] Rong QJ,Lyu HX,Song AH. Rapid detection onkatGgene mutation ofMycobacteriumtuberculosisusing genetic microarray and the correlation between mutation and isoniazid resistance[J]. Chin J Zoonoses,2011,27(3): 233-237. (in Chinese)
戎奇吉,吕火祥,孙爱华. 基因芯片快速检测结核分枝杆菌katG基因突变及其与异烟肼耐药相关性[J].中国人兽共患病学报,2011,27(3):233-237.
[9] Yan H,Zhang SB. Isoniazid clinical new uses[J]. Heilongjiang Med,1991(3): 44-45. (in Chinese)
延红,张树本. 异烟肼临床新用途[J].黑龙江医学,1991(3):44-45.
[10] Wang HY,Liu ZM,Zheng JL,et al. Research of the relationship between isonazid-resistance andKatGgene change[J]. Qilu J Med Lab Sci,2005,16(5): 31-33. (in Chinese)
王海英,刘志敏,郑建礼,等. 结核杆菌异烟肼表型耐药与katG基因突变相关性研究[J]. 齐鲁医学检验; 2005,16(5):31-33.
[11] Marahatta SB,Gautam S,Dhital S,et al. katG (SER 315 THR) gene mutation in isoniazid resistantMycobacteriumtuberculosis[J]. Kathmandu Univ Med J,2011,9(33): 19-23.
[12] Gupta A,Prakash P,Singh SK,et al. Rapid genotypic detection of rpoB andkatGgene mutations inMycobacteriumtuberculosisclinical isolates from Northern India as determined by MAS-PCR[J]. J Clin Lab Analysis,2013,27(1): 31-37.
[13] Yang L,Ming-Quan SU,Cheng XD,et al. Study on rapid detection ofkatG,rpoB,rpsLgenomic mutations ofMycobacteriumtuberculosis[J]. Chin J Hlth Lab Technol,2009.
Rapid detection of isoniazid resistance in clinicalMycobacteriumtuberculosisisolates by high-resolution melting curve analysis
YANG Cai-hong1,YANG Min2,YU Lu3,BAO Hai-yang1, WU Chang-xin3,CAO Xu-dong3,CHEN Chuang-fu1
(1.SchoolofAnimalSciencesandTechnology,ShiheziUniversity,Shihezi832003,China; 2.SchoolofLifeScience,ShiheziUniversity,Shihezi832003,China; 3.MedicalSchool,ShiheziUniversity,Shihezi832003,China)
We detected the isoniazid resistance in clinicalMycobacteriumtuberculosisisolates by high-resolution melting (HRM) curve analysis and assessed the application value of the assay. The isoniazid resistance of 49M.tuberculosisisolates preserved in laboratory was analyzed by the drug sensitivity test (traditional proportion method). Further analysis was made on the sequencing of the isoniazid resistance determining region in these test strains,and their mutation sites were screened. Specific primers used in the HRM curve analysis were designed based on the screened mutation sites,DNA mutations were assayed in the isoniazid-resistant gene determining region by the HRM curve analysis,and an assessment was made of the detection efficiency of the assay in isoniazid resistance inM.tuberculosis. Results of the drug sensitivity test (proportion method) showed that,of the 49 test strains,there were 20 isoniazid-resistant strains,29 isoniazid-sensitive strains. Results of the sequencing analysis showed that: 1)KatGgene had four mutation patterns,i.e.,point mutations at site 234,at sites 234 and 315,at sites 234 and 463,and at sites 234,315 and 463; 2) there were three mutations were detected ininhAgene,i.e.,mutations in inhA-8,-15 and-152. Analysis of gene mutation in drug-resistant strains found that of the 20 isoniazid-resistant strains,11 (55%) were mutated at codon 315 ofKatGgene; 6 (30%) were mutated ininhA-15 (4/20),-8 (1/20) and-153 (1/20) ofinhAgene; two (10%) were mutated at codon 315 ofKatGgene and ininhA-15; in one strain (5%),no mutation was detected inKatGandinhAgenes. Through the gene mutation detection,the sensitivity and specificity of isoniazid resistance inM.tuberculosiswere 95% and 100%,respectively. Results of HRM curve analysis of drug-resistance gene mutations in test strains showed gene mutations were present in 18 strains and absent in 24 ones; referring to DNA sequencing results,the sensitivity and specificity of the assay were 94.7% and 80%,respectively. Judged by mutations as drug-resistance via the HRM curve analysis,19 resistant and 24 sensitive strains were tested. With the drug sensitivity test results by the proportion method as controls,the sensitivity and specificity of the assay were 95% and 82.76%,respectively. Use of the HRM curve in the detection of resistance ofM.tuberculosisto isoniazid is characterized by good sensitivity and short time consuming,and has certain value in the rapid diagnosis of isoniazid-resistant tuberculosis.
Mycobacteriumtuberculosis; high-resolution melting (HRM) curve; DNA sequencing; drug resistance; isoniazid
Chen Chuang-fu,Email: ccf-xb@163.com
10.3969/j.issn.1002-2694.2017.05.004
“十二五”国家科技重大专项(No.2013ZX10003003-002),国家自然科学基金项目(No.31060333)
陈创夫,Email:ccf-xb@163.com;
1.石河子大学动物科技学院,石河子 832003; 2.石河子大学生命科学学院,石河子 832003; 3.石河子大学医学院,石河子 832002
S855.2
A
1002-2694(2017)05-0403-10
2016-07-25 编辑:刘岱伟
Supported by the National Science and Technology Major Project of the 12th Five-Year Plan: "Prevention and Control of Severe Infectious Diseases Like AIDS and Viral Hepatitis" (No. 2013ZX10003003-002) and the National Natural Science Foundation of China (No. 31060333)
猜你喜欢
杂志排行
中国人兽共患病学报的其它文章
- MicroRNA通用探针法的建立及布鲁氏菌病患者血浆microRNA-146a的检测
- 美国《Emerging Infectious Diseases》2017年第3期有关人兽共患病论文摘译
- 龟头包皮炎患者淋病奈瑟菌分离与鉴定及其耐药机制研究
- miR-16在金黄色葡萄球菌脓毒症中的表达及意义探讨
- Identification of non-tuberculosis mycobacteria speciesof clinical isolates from patients clinically diagnosed with tuberculosis in Fujian Province,China
- 四对结核分枝杆菌毒素-抗毒素系统基因功能的初步研究
