飞机用7B04铝合金缝隙腐蚀试验及仿真研究
2017-06-08王晨光陈跃良张勇卞贵学
王晨光,陈跃良,张勇,卞贵学
飞机用7B04铝合金缝隙腐蚀试验及仿真研究
王晨光,陈跃良,张勇,卞贵学
(海军航空工程学院 青岛校区,山东 青岛 266041)
目的开展飞机用7B04铝合金缝隙腐蚀仿真研究,理解缝隙腐蚀机理,找出影响缝隙腐蚀的关键因素。方法分析缝隙腐蚀类型,开展缝隙腐蚀试验,建立缝隙腐蚀数学模型,选择合适的边界条件,利用有限元法进行仿真计算。结果缝隙内pH值分布计算结果与试验测量值一致,缝隙口与外部液体/大气连接时,缝隙内溶液分别呈酸性或碱性。缝隙口溶液电势较低,缝隙口附近的铝合金腐蚀较快,含Al腐蚀产物多集中在缝隙口附近。缝隙宽度在0.1~0.3 mm范围内变化不影响铝合金腐蚀速率;缝隙深度增加,缝隙口与底部溶液电势差增大,铝合金腐蚀面积增大,但铝合金最大腐蚀电流密度不变。电位升高,缝隙内铝合金的腐蚀加剧,电位提高10 mV,腐蚀24 h后缝隙内铝合金界面的腐蚀电流密度增加59倍,Al(OH)2Cl的最大浓度为自然电位下的30倍。结论缝隙腐蚀主要受缝隙外部阴极还原反应影响,电位对铝合金缝隙腐蚀的影响最大,飞机结构中应避免高电位材料同铝合金直接接触。
7B04铝合金;缝隙腐蚀;数值计算;边界条件
飞机结构中存在大量的搭接结构,搭接结构连接处产生的缝隙容易使腐蚀介质侵入而发生腐蚀。同时连接孔处一般存在应力集中,在环境和载荷的双重作用下,搭接结构易发生腐蚀失效并诱发疲劳断裂,飞机结构中85%的破坏都发生在构件的连接处[1]。对沿海服役飞机的铝合金搭接结构拆解检查发现[2],虽然搭接结构外表面光亮无腐蚀痕迹,但其内部搭接面已是严重腐蚀,说明主要发生了缝隙腐蚀。搭接结构处发生的缝隙腐蚀具有隐蔽性,难于检测,潜在危险大,甚至会导致灾难性事故[3],因此开展铝合金搭接结构的缝隙腐蚀研究具有重要的现实意义。
随着计算机技术和有限元方法的不断发展,考虑了缝隙内质量守恒与传递、化学反应的缝隙腐蚀模型理论日臻成熟,近年来成为研究的热点。Engelhardt等计算了缝隙内的电位及电流密度分布[4],Sun等[5]研究了缝隙内pH值、电位分布随时间的变化,并与Alavi的实验数据[6]基本吻合。国内的文博和刘冬鹏等分别预测了稳态下不锈钢的缝隙腐蚀[7—8],结果均与文献值相近。美军已将缝隙腐蚀模型纳入到其加速腐蚀专家模拟器(Accelerated Corrosion Expert Simulator, ACES)中[9],由欧洲十个研究所合作开发的“基于仿真的腐蚀管理”(Simulation Based Corrosion Management, SICOM)计划也包括了缝隙腐蚀仿真模型[10]。
模拟飞机服役过程中缝隙的干湿交替过程,设计制作缝隙腐蚀模拟件并进行腐蚀试验,建立缝隙腐蚀数学模型,以电化学试验获得的7B04铝合金极化曲线作为边界条件,采用有限元法对缝隙腐蚀进行了计算仿真,缝隙内pH值分布计算结果与试验测量数据基本一致。证明了模型的准确性,进一步计算了缝隙内溶液电势、各物质浓度分布及铝合金界面腐蚀电流密度,考察了缝隙尺寸及电位对缝隙腐蚀的影响。
1 试验
1.1 试验材料
试验选用7B04铝合金板材,由东北轻合金有限责任公司生产,其化学成分(质量分数)为:Zn 5.0%~6.5%,Mg 1.8%~2.8%,Cu 1.4%~2.0%,Fe 0.05%~0.25%,Si 0.10%,Mn 0.2%~0.6%,Cr 0.10%~0.25%,Ni 0.10%,Ti 0.05%,Al 余量。
1.2 缝隙腐蚀试验
缝隙内的腐蚀溶液一般来自雨水、凝露及湿气等。雨水、凝露等在飞机机体表面形成连续的薄液层,在潮湿的大气环境下,水蒸气吸附在机体表面也会形成一层薄液膜,缝隙内的液体通过缝隙口与外部液膜相连,如图1a所示。阴极反应为缝隙内外的O2和H+的还原反应,阳极反应为发生在缝隙内的铝合金氧化反应。当机体表面液膜蒸发后,缝隙内液体直接与大气相连,如图1b所示。此时阴阳极反应均发生在缝隙内,为O2和H+的还原反应和铝合金的氧化反应。
飞机服役过程中,机体表面不断进行着干湿交替过程,即图1a与图1b不断循环,据此设计了缝隙腐蚀试验。将7B04铝合金板和PVC板切割加工成尺寸为50 mm × 50 mm × 3 mm的试验件,沿PVC试验件中线等距钻取9个直径为2 mm的圆孔作为测量孔。PVC试验件表面紧密贴合聚乙烯薄膜后与7B04试验件叠放,接触面积为50 mm × 50 mm。中间用厚度为0.2 mm的纸张相隔,缝隙周围用AB胶密封,仅留一个缝隙口,待AB胶固化后,抽去纸张,这样就形成了一个宽度为0.2 mm,深度为50 mm的缝隙,如图2所示。
按照上述方法,制备了4个模拟试验件,平分为2组:一组竖直放置于盐雾箱中,缝隙口朝上,以模拟缝隙内液体与外界液体相连情况;另一组缝隙内充满溶液后缝隙口朝上竖直置于大气中,以模拟缝隙内液体与外界大气相连情况。试验溶液均为0.6 mol/L的NaCl溶液,温度为25 ℃。当试验进行至24 h和48 h时分别取出一个试验件,使用尖头型pH计扎穿聚乙烯薄膜测量不同点的pH值。
1.3 电化学测试
用直径30 mm的PVC管将尺寸为10 mm × 10 mm × 3 mm的7B04铝合金电极固定,预留100 mm2的测试面,其余面均用环氧树脂封装。测试面采用水磨砂纸逐级打磨至3000 #,经金刚石研磨膏抛光,丙酮和无水乙醇除油、除水后,放入干燥器备用,采用动电位扫描法测量极化曲线,扫描速率为0.1667 mV/s。
电化学测量设备为PARSTAT 4000电化学综合测试仪,电解池均为三电极体系,参比电极为饱和甘汞电极(Saturated Calomel Electrode, SCE),辅助电极为铂片电极。
随着反应的进行,缝隙溶液pH值发生变化,故测量了7B04铝合金在不同pH值下的极化曲线。测试溶液为0.6 mol/L的NaCl溶液,由NaCl分析纯及去离子水配制而成,通过滴加盐酸调节pH值来模拟酸性环境,添加NaOH固体颗粒使溶液呈碱性来模拟碱性环境,测量温度均为25 ℃。
2 仿真模型
2.1 几何模型
根据腐蚀试验件设计了二维几何模型,如图3所示。缝隙宽度为,深度为,缝隙下部边界为7B04铝合金,上部及右侧底部边界绝缘,左侧缝隙口与外界液体或大气相连。
2.2 控制方程
假设在25 ℃常温下,缝隙内腐蚀介质为0.6 mol/L的NaCl溶液,根据质量守恒,溶液中物质浓度随时间的变化可由Nernst–Planck方程表示:
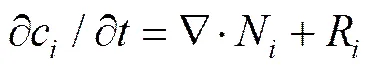
式中:c为第种离子的浓度,mol/m3;为时间,s;N为摩尔通量,mol/(m3·s);R为反应速率,mol/(m3·s)。缝隙溶液中离子的质量传递有扩散和电迁移两种方式,故N可由方程(2)表示:
(2)
式中:D为扩散系数,m2/s;z为电荷数;为法拉第常数,96 485 C/mol;为溶液电势,V;u为迁移率,s·mol/kg。可由Nernst-Einstein方程计算获得:

式中:为通用气体常数,8.314 J/(mol·K);为绝对温度,K。由方程(1)、(2)、(3)可导出溶液的电导率:
(4)
由以上公式获得个方程,但是溶液电势也是未知的,故计算还需要一个方程,即溶液电中性方程:

溶液中各带电物质的定向移动产生了电流,净电流密度可表示为:
(6)
式中:为溶液电流密度,A/m2。将(2)式代入(6)式有:

结合(3)、(4)两式可将(7)进行变换,获得溶液电势差公式:
(8)
2.3 电化学反应
7B04铝合金含有质量分数为90%左右的Al,其他元素在铝合金中呈不均匀分布,且大量存在于第二相中[11],加之含量相对较少,故7B04铝合金发生阳极反应时,只考虑Al的失电子反应:

缝隙内还存在着O2,H+的阴极还原反应:
(10)
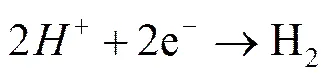
2.4 溶液中的化学反应
Al3+在pH值大于3的溶液中与水结合,生成AlOH2+,Al(OH)2+,Al(OH)4−,Al2(OH)24+,Al3(OH)45+,Al(OH)3等[12],达到平衡速度较快,生成AlOH2+仅需1 μs的时间即达到平衡,这里只考虑平衡常数≥-9,反应产物较多的两种反应[13]:

,(13)
Al3+和AlOH2+均能与Cl-发生反应,反应方程式和平衡常数[13]如下:
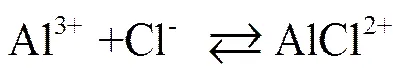
,(15)
AlCl2+和Al(OH)Cl+又进一步反应,生成相对稳定的Al(OH)2Cl:

(17)
Al(OH)2Cl是最初形成的固态物质,能稳定大约3天左右[14],随后形成不稳定的非晶态Al(OH)3,再进一步转化为室温下稳定的α-Al(OH)3和γ-Al(OH)3沉淀。

(19)
(20)
文献[15]显示,在铝合金点蚀坑及缝隙中,腐蚀溶液一般呈酸性,Al(OH)3的浓度可忽略,故模型可不考虑方程(18)—(20)。此外,还应考虑到H2O的离解反应:

2.5 模型所需参数
该模型包括有方程(12)—(15)及(21)共5个平衡反应,(16)和(17)两个非平衡反应,共有Na+,Cl-等12种物质。25 ℃下,化学反应的动力学常数[10]见表1,12种物质的电荷数、扩散系数[16]及初始浓度见表2。

表1 化学反应的动力学常数

表2 不同物质的电荷数、扩散系数及初始浓度
表1中Al3+和AlOH2+分别为Al3+和AlOH2+的浓度,表2中Al3+的初始浓度假设为10-6mol/m3,其他含Al物质的初始浓度结合表1数据计算得出,方程(1)中每种物质的反应速率R也由表1中的数据计算获得。
2.6 边界条件
边界条件是影响仿真模型准确性的关键因素,该模型的边界条件包含了缝隙内铝合金界面上发生的Al的阳极氧化反应及O2,H+的阴极还原反应。试验进行24 h时,测量缝隙内溶液的pH值发现,盐雾中放置的试验件溶液呈酸性,pH为4左右;空气中放置的试验件溶液呈碱性,pH值为10左右。故两种情况下,Al的阳极反应分别由pH=4和10时的极化曲线表示,如图4所示。将从极化曲线中获得的电位与电流密度关系用分段线性插值函数表示,并以此作为模型的边界条件。
O2,H+阴极还原反应的动力学关系式由文献[10]获得:
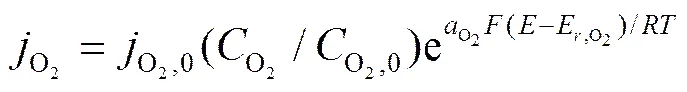
,(23)
式中:j为电流密度,A/m2;j0为交换电流密度,A/m2;C为浓度,mol/m3;C0为初始浓度,mol/m3;a为传递系数;为电极电位(vs.SCE),V;E为平衡电位(vs.SCE),V,各参数的取值见表3。

表3 O2和H+阴极还原反应的电化学动力学参数
其他边界绝缘,即无电势梯度:

缝隙底部及铝合金界面没有通量,即无浓度梯度:
(25)
缝隙口液体初始浓度与缝隙内溶液一致,缝隙口铝合金接地,即电势为0。
3 结果与讨论
3.1 缝隙腐蚀仿真模型的试验验证
计算两种情况下,腐蚀进行24 h和48 h时缝隙中央截线上的pH分布,与试验测量结果做对比,如图5所示。
从图5中可以看出,两种腐蚀情况下的缝隙溶液呈现不同的pH分布,缝隙口与液体相连的试验件,缝隙内溶液呈酸性分布;缝隙口与空气相连的试验件,缝隙内溶液呈碱性分布。pH值测量数据与仿真结果相近且变化趋势相同,证明了缝隙腐蚀仿真模型的准确性。
3.2 缝隙溶液电势及铝合金界面腐蚀电流密度分布
电化学腐蚀发生后,不仅铝合金/溶液界面形成电势差,而且由于溶液电阻的存在,缝隙深度方向也产生电势差,不同时间内的溶液电势分布如图6所示。
从图6可以发现,缝隙口与外界液体相连时,反应1 h溶液电势即达到稳定,与48 h后的溶液电势分布基本相同;缝隙口与外界大气相连时,反应1 h溶液电势未稳定,缝隙中部电势较高,到48 h时电势趋于稳定。两种情况下缝隙内溶液电势分布均呈现相同梯度趋势,即缝隙口电势较低。故靠近缝隙口的铝合金的电极电位(铝合金电势与溶液电势之差)较高,缝隙内部较低,所以缝隙口附近铝合金腐蚀电流密度较高,缝隙内部较低,如图7所示。
从图7还可看出,缝隙口与空气相连试验件铝合金腐蚀电流密度较小,部分区域因电位低作为阴极受到保护,其最大值仅为与液体相连试验件的1/200,说明缝隙腐蚀主要受外部O2还原反应影响,缝隙内的O2和H+还原反应对其影响较小。图8为缝隙口与液体相连的试验件缝隙内铝合金界面阴阳极反应总电流随时间的变化情况,在反应的初始阶段,缝隙内O2阴极反应电流较大,但反应2 h,O2消耗殆尽后,其阴极反应电流与H+的基本相同,接近于0。
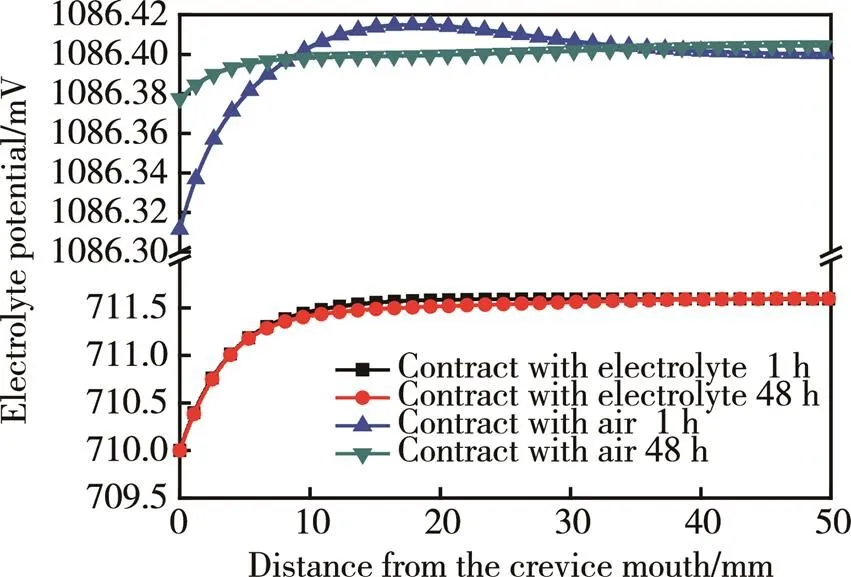
图6 缝隙中央截线上的溶液电势分布
将腐蚀48 h的试验件拆解检查,结果发现缝隙口附近的铝合金腐蚀均比缝隙内部严重,放置于盐雾中的试验件腐蚀较重,而放置于大气中的试验件腐蚀较轻,如图9所示。与仿真结果一致,进一步验证了模型的准确性。

a 缝隙口与外部液体相连
b 缝隙口与外部空气相连
图9 7B04铝合金缝隙腐蚀形貌
鉴于缝隙腐蚀主要发生在缝隙口与液体相连的情况下,故下文主要讨论此种情况。
3.3 缝隙内物质的浓度分布
缝隙内铝合金界面发生电化学腐蚀,Al失电子变为Al3+并向溶液中扩散的同时,溶液中同时进行着Al3+的水解等化学反应及物质的移动,整个过程是动态的。当腐蚀进行到24 h时,缝隙中央截线上含Al物质的浓度分布如图10所示。由图7可知,铝合金的腐蚀主要集中在缝隙口附近,在溶液电场的作用下,电化学腐蚀生成的Al3+及其水解产物发生电迁移和扩散而聚集于缝隙口附近。与生成Al(OH)2Cl有关的物质及Al(OH)2Cl在缝隙口约7 mm处浓度达到最大值,其余含Al物质在缝隙口浓度最高。
3.4 缝隙尺寸对缝隙腐蚀的影响
缝隙腐蚀通常只发生在几微米至几百微米宽的缝隙中[17],宽度范围较小。从计算结果来看,在缝隙深度一定的情况下,缝隙宽度在0.1~0.3 mm的范围内变化,没有改变缝隙内溶液的电势分布及铝合金界面的腐蚀电流密度分布,但是宽度越大,缝隙内的溶液含量越多,相应延长了腐蚀时间。
缝隙深度的增加使缝隙口与缝隙底部溶液电势差加大,如图11所示。接地的缝隙口铝合金电位未变,故其最大腐蚀电流密度不变,而缝隙底部的铝合金因电位更负而受到保护。缝隙深度的增加同时使铝合金腐蚀面积增大,单位时间内生成的腐蚀产物Al(OH)2Cl增加,如图12所示。
3.5 电位对缝隙腐蚀的影响
飞机结构材料种类繁多,铝合金可能会与其他高电位金属搭接发生缝隙腐蚀,此时铝合金作阳极电位升高。图13为在深度5 mm的缝隙中,电位分别升高5,10 mV后铝合金界面腐蚀电流密度的分布(腐蚀时间:24 h)。可以看出,铝合金电位升高后,其腐蚀电流密度大大增加,电位升高10 mV后的最大腐蚀电流密度增加59倍。
铝合金电位升高引起的腐蚀电流密度增加导致腐蚀产物Al(OH)2Cl浓度的快速增加,如图14所示。电位升高10 mV后,Al(OH)2Cl的最大浓度为原来自然电位下的30倍(腐蚀时间为24 h)。
4 结论
1)缝隙口与外部液体相连时,缝隙内溶液呈酸性分布;缝隙口与外部大气相连时,缝隙内溶液呈碱性分布。两种情况下缝隙内pH值分布计算结果与试验测量结果相一致,证明了仿真模型的准确性。
2)缝隙腐蚀主要受缝隙外部阴极还原反应影响,缝隙内的O2和H+还原反应对其影响较小,缝隙口溶液电势较低,缝隙口附近的铝合金界面腐蚀较快,与试验件腐蚀形貌相一致。
3)在溶液电场的作用下,含Al物质多集中于缝隙口附近,腐蚀24 h后,参与生成Al(OH)2Cl的物质及Al(OH)2Cl在缝隙口约7 mm处浓度达到最大值,其余含Al物质在缝隙口处浓度最高。
4)缝隙宽度通常为几微米至几百微米宽,能产生毛细作用而使液体进入缝隙并滞留其中,宽度在0.1~0.3 mm范围内变化不影响缝隙内铝合金的腐蚀速率。缝隙深度的增加使缝隙口与底部溶液电势差增大,同时使铝合金腐蚀面积增大,单位时间内生成的腐蚀产物Al(OH)2Cl增加,但铝合金最大腐蚀电流密度不变。
5)电位对缝隙腐蚀的影响最大,电位升高,缝隙内铝合金的腐蚀加剧,Al(OH)2Cl的生成速率加快,电位提高10 mV,腐蚀24 h后缝隙内铝合金界面的腐蚀电流密度增加59倍,Al(OH)2Cl的最大浓度为自然电位下的30倍。
[1] 中国特种飞行器研究所. 海军飞机结构腐蚀控制设计指南[M]. 北京: 航空工业出版社, 2005.
[2] 谭晓明, 陈跃良, 段成美. 飞机结构搭接件腐蚀三维裂纹扩展特性分析[J]. 航空学报, 2005, 26(1): 66—69.
[3] 陈跃良, 金平, 林典雄, 等. 海军飞机结构腐蚀控制及强度评估[M]. 北京: 国防工业出版社, 2007.
[4] ENGELHARDT G R, MACDONALD D D. Possible Distribution of Potential and Corrosion Current Density Inside Corroding Crevices[J]. Electrochimica Acta, 2012, 65(65): 266—274.
[5] SUN W, WANG L, WU T, et al. An Arbitrary Lagrangian–Eulerian Model for Modelling the Time-dependent Evolution of Crevice Corrosion[J]. Corrosion Science, 2014, 78(1): 233—243.
[6] ALAVI A, COTTIS R A. The Determination of pH, Potential and Chloride Concentration in Corroding Crevices on 304 Stainless Steel and 7475 Aluminium Alloy[J]. Corrosion Science, 1987, 27(5): 443—451.
[7] 刘冬鹏, 王亚飞, 程光旭, 等. 奥氏体不锈钢缝隙腐蚀的数值模拟研究[J]. 腐蚀与防护, 2012(S1): 72—76.
[8] 文博. 循环水中不锈钢缝隙腐蚀数值模拟研究[J]. 广州化工, 2016(3): 95—97.
[9] SAVELL C T, HANDSY I C, AULT P, et al. Accelerated Corrosion Expert Simulator(ACES)[C]// Department of Defense Corrosion Conference. Washington D C, 2009.
[10] DEROSE J A, SUTER T, HACK T, et al. Aluminum Alloy Corrosion of Aircraft Structures: Modelling and Simulation[M]. Great Britain: WIT Press, 2013.
[11] 李志辉, 熊柏青, 张永安, 等. 7B04铝合金预拉伸厚板的微观组织与性能[J]. 稀有金属, 2007, 31(4): 440—445.
[12] FOLEY R T, NGUYEN T H. The Chemical Nature of Aluminum Corrosion[J]. Journal of the Electrochemical Society, 1982, 129(1): 673—679.
[13] BAES C F, MESMER R F. The Hydrolysis of Cations[M]. New York: Wiley & Sons Inc, 1976.
[14] TURNER R C, ROSS G J. Conditions in Solution during the Formation of Gibbsite in Dilute Al Salt Solutions 4 Effect of Cl Concentration and Temperature and a Proposed Mechanism for Gibbsite Formation[J]. Canadian Journal of Chemistry, 2011, 48(5): 723—729.
[15] KAI P W. Local Chemistry and Growth of Single Corrosion Pits in Aluminum[J]. Journal of the Electrochemical Society, 1990, 137(10): 3010—3015.
[16] GUSEVA O, SCHMUTZ P, SUTER T, et al. Modelling of Anodic Dissolution of Pure Aluminium in Sodium Chloride[J]. Electrochimica Acta, 2009, 54(19): 4514—4524.
[17] 陶春虎. 紧固件的失效分析及其预防[M]. 北京: 航空工业出版社, 2013.
Crevice Corrosion Experiment and Simulation Study of 7B04 Aluminum Alloy for Aircraft
WANG Chen-guang, CHEN Yue-liang, ZHANG Yong, BIAN Gui-xue
(Qingdao Branch, Naval Aeronautical Engineering Institute, Qingdao 266041, China)
Objective To develop the crevice corrosion simulation study of 7B04 aluminum alloy for aircraft, understand the mechanism of crevice corrosion, and find out key factors affecting crevice corrosion. Methods Types of crevice corrosion were analyzed, crevice corrosion tests were developed, a mathematical crevice corrosion model was established, proper boundary conditions were selected, and simulating calculation was performed with the finite element method. Results The calculation result of pH value distribution in the crevice was consistent with test measurement value, and when crevice mouth communicated with external liquid/atmosphere, the solution in the crevicewas in acidic or in alkaline respectively. The solution at the crevice mouth was relatively low in potential, the aluminum alloy near the crevice mouth corroded relatively fast, and most Al-containing corrosion products were concentrated near the crevice mouth. The corrosion rate of the aluminum alloy was not affected by change of the crevice width in the range of 0.1~0.3 mm; if the depth of the crevice was increased, the solution potential difference between the crevice mouth and the bottom was increased, the corrosion area of the aluminum alloy was increased, but the maximum corrosion current density of the aluminum alloy was unchanged. If the potential rose, corrosion of the aluminum alloy in the crevice was intensified, the potential was increased by 10 mV, the corrosion current density of aluminum alloy interface in the crevice after 24 h corroding was increased by 59 times, and the maximum concentration of Al(OH)2Cl was 30 times that of Al(OH)2Cl under natural potential. Conclusions Crevice corrosion is mainly affected by cathode reduction reaction outside the crevice. The potential has a maximum influence on crevice corrosion of aluminum alloy. High-potential materials should be prevented from making direct contact with aluminum alloy in the aircraft structure.
7B04 aluminum alloy; crevice corrosion; numerical calculation; boundary condition
10.7643/ issn.1672-9242.2017.03.008
TJ04; TG172.2
A
1672-9242(2017)03-0039-08
2016-09-14;
2016-10-10
王晨光(1983—),男,山东人,博士研究生,主要研究方向为飞机结构的腐蚀与防护。
