分子空间构型及杂化的快速预判
2017-06-05内蒙古赤峰市平庄煤业高级中学024076
内蒙古赤峰市平庄煤业高级中学(024076)
于春辉● 马风雨●
分子空间构型及杂化的快速预判
内蒙古赤峰市平庄煤业高级中学(024076)
于春辉● 马风雨●
在历年高考选修三模块中计算分子杂化类型、判断空间构型是高频考点,但对于学生来说,掌握起来还是比较吃力,本文对教材公式进行简单改编,使学生能更加快简单的掌握判断方法和快速得出结论.
杂化;空间构型
杂化类型和空间构型判断一直都是高中学生较难记忆的地方,为了让学生们更好更快的得出结论,因此对高中现有的教材公式进行了整合改编,使学生只需简单的三步骤就能更快的做出准确判断.
1.快速判断杂化类型
字母说明:A为价电子对数
a为中心原子价电子数
x为与中心原子结合的原子数
b为与中心原子相连的原子最多能接受的电子.
2.快速计算出孤电子对数
B=A-x
B为孤电子对数
3.参考对照表(见表1)得出结论

通过以上三步,可快速准确得出答案,现在对上述公式进行推导及实例验证.
公式推导:
中心原子上的孤电子对数
杂化轨道数=孤电子对数+σ数 (2)
根据分析可知中心原子与其他原子相结合时,中心原子与其相连的原子之间一定会存在一条σ键,因此中心原子与几个原子相连时认为就会存在几条σ键,所以只需要将公式(2)中σ键数换成与中心原子相连的原子数目,同时将公式(1)带入公式(2)即可得到.

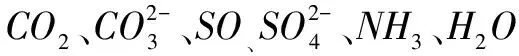
CO2:
杂化轨道数
孤电子对数
B=4-2=2
对比对照表,得出CO2为sP杂化,空间构型为直线形.
杂化轨道数
孤电子对数
B=3-3=0
SO2:

孤电子对数B=3-2=1
对比对照表,得出CO2为sP2杂化,空间构型为V形.
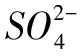
杂化轨道数
孤电子对数B=4-4=0
NH3:
杂化轨道数
孤电子对数B=4-2=2
对比对照表,得出NH3为sP3杂化,空间构型为V型.
G632
B
1008-0333(2017)13-0093-01
