miR-497对肝癌细胞增殖、凋亡的影响及机制
2017-06-05张猛张锐杨季红谭雨莎张笑影贾佳
张猛,张锐,杨季红,谭雨莎,张笑影,贾佳
(河北大学附属医院,河北保定071000)
miR-497对肝癌细胞增殖、凋亡的影响及机制
张猛,张锐,杨季红,谭雨莎,张笑影,贾佳
(河北大学附属医院,河北保定071000)
目的 探讨微小RNA-497(miR-497)对肝癌细胞增殖能力、凋亡的影响及机制。方法 RT-PCR观察肝癌组织和癌旁组织、肝癌细胞和正常肝细胞miR-497的表达差异;转染肝癌细胞过表达miR-497,MTT法和软琼脂集落形成试验观察miR-497对肝癌细胞增殖能力的影响,肝癌细胞周期和凋亡采用流式细胞仪检测,Western blotting法观察miR-497对肝癌细胞Fas相关死亡结构域蛋白(FADD)表达的影响。结果 肝癌组织miR-497 表达水平显著低于癌旁组织(P<0.05);癌细胞miR-497表达水平显著低于肝细胞(P<0.05);miR-497过表达组在96 h和120 h肝癌细胞增殖能力显著低于对照组(P均<0.05);对照组细胞增殖能力显著高于miR-497过表达组(P<0.05);miR-497过表达组早期凋亡细胞数显著高于对照组(P<0.05);对照组FADD相对表达量显著低于miR-497过表达组(P<0.05)。结论 miR-497可抑制肝癌细胞的增殖,促进凋亡,其作用可能与miR-497促进FADD表达有关。
肝肿瘤;微小RNA-497;细胞增殖;Fas相关死亡结构域蛋白
微小RNA(miRNA)是长度约为22 nt的非编码调控RNA,多数位于基因组中脆弱的位点或与肿瘤相关的区域,参与机体早期发育、细胞增殖、细胞分化及细胞凋亡等过程。针对miRNA与乙肝病毒、丙肝病毒患者相关性的研究日益增多[1]。miR-497位于17号染色体P13.1,与肿瘤、心血管疾病、神经退行性疾病关系密切[2,3]。在前期研究中发现,miR-497可表达于肝癌组织中。2014年1月~2016年1月我们进一步研究了miR-497对肝癌细胞增殖能力、凋亡的影响及可能的作用机制。
1 材料与方法
1.1 材料 人肝癌细胞(HepG2)和人正常肝细胞系(L-02细胞)购买于复旦大学肝癌研究所,培养基为10%特级胎牛血清DMEM(高糖),于37 ℃、5% CO2培养箱中培养。肝细胞癌组织标本来源于本院肝癌患者,均行肝癌根治术,术后经病理检查;癌旁组织取自距离肝肿瘤2 cm的组织。FBS胎牛血清(美国Gibco公司),胰酶(美国Invitrogen公司),EX Taq酶(日本Takara公司),T4连接酶(日本Takara公司),TRIzol(日本Takara公司),细胞转染试剂 Lipofectamine 2000(美国Invitrogen公司)。miRNA 提取试剂盒(美国 Ambion 公司),Real-time Taqman 探针(美国APPLIED BIOSYSTEMS公司),Taq Man 逆转录试剂盒(美国 APPLIED BIOSYSTEMS 公司),四甲基偶氮唑蓝(MTT) (美国Amresco公司),低熔点琼脂糖(宝泰克生物科技公司)。CO2培养箱(哈尔滨东联电子技术公司),Nano Drop 2000C紫外可见分光光度计(美国Thermo Scientific公司),Gene Amp 9700基因扩增仪(美国APPLIED BIOSYSTEMS公司),iMark酶标仪(美国伯乐公司),凝胶成像仪(美国KODAK公司)。
1.2 肝癌组织和癌旁组织、HepG2、L-02 miR-497表达检测 采用RT-PCR技术。组织样本经过液氮研磨,TRIzol法提取总RNA,分光光度计测定RNA质量(OD260/OD280),琼脂糖凝胶电泳。HepG2和L-02接种于6孔板,待细胞汇合度达到90%~100%,TRIzol法提取总RNA,分光光度计测定RNA质量(OD260/OD280)。琼脂糖凝胶电泳,采用试剂盒步骤进行逆转录,Taqman探针法检测miR-497的表达。引物序列:上游引物5′-CGCCGCCCAGTGTTCAGA-3′,下游引物5′-GTGCAGGGTCCGAGG-3′;反应体系:taqman Universal Master Mix Ⅱ 5 μL,taqman assay 0.5 μL,cDNA 0.665 μL,Nuclease free water 3.835 μL。95 ℃ 10 min酶激活,95 ℃ 15 s变性,60 ℃ 15 s退火,72 ℃ 15 s延伸,40个循环。用2-△△Ct计算miR-497相对表达量。
1.3 细胞分组及转染 HepG2接种于24孔板中,待细胞培养至汇合率达到50%进行转染,1.25 μL 50 nmol miRNA mimics和阴性对照通过Lipofectamine2000(美国英潍捷基公司)进行转染,转染后24 h收集细胞进行实验。转染阴性细胞为对照组,转染阳性细胞为过表达组。
1.4 细胞增殖能力检测 转染后24 h,将细胞接种到 96孔板中,4×103/孔,每组6个复孔,分别在细胞生长24、48、72、96、120 h,加入20 μL MTT,震荡均匀,37 ℃孵育4 h,注射器小心吸取上清,加入150 μL DMSO,490 nm测定每孔吸光度。配置 1%的低熔点琼脂糖,加入等体积20% FBS和0.5%青霉素的DMEM,6孔板每孔加1.5 mL作为底层基质,细胞转染24 h后,调整至5×104/mL,100 μL细胞与琼脂糖混合作为上层基质,培养15 d,结晶紫染液进行染色,显微镜下观察结果并拍照。用Image Pro Plus6分析克隆大小和数目,统计直径大于50 μm的细胞克隆数目。
1.5 细胞周期和凋亡检测 转染后24 h,收集细胞,缓冲液清洗细胞3次,Annexin V和PI孵育染色。孵育20 min后,加入200 μL结合缓冲液,流式细胞仪检测细胞凋亡率。凋亡率=凋亡细胞数/细胞总数×100%。
1.6 肝癌细胞内Fas相关死亡结构域蛋白(FADD)表达检测 采用Western blotting法。转染后24 h,收集细胞,裂解液裂解细胞,检测蛋白浓度,聚丙烯酰胺胶电泳,转移至备好的硝酸纤维素膜上(恒压100 V,50 min),奶粉封闭,FADD抗体4 ℃过夜孵育,二抗孵育1 h,加入ECL,并进行显影观察。采用Image J软件进行蛋白相对量计算。
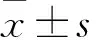
2 结果
2.1 组织和细胞中miR-497表达比较 肝癌组织、癌旁组织中miR-497 相比表达量分别为0.010±0.001、0.021±0.004,二者比较差异有统计学意义(P<0.05)。癌细胞、肝细胞中miR-497相对表达量分别为0.023±0.009、0.055±0.011,二者比较差异有统计学意义(P<0.05)。
2.2 miR-497过表达对肝癌细胞增殖能力的影响 对照组和过表达组在接种后24、48、72 h肝癌细胞增殖能力均无统计学差异(P均>0.05),过表达组在96 h和120 h肝癌细胞增殖能力显著低于对照组(P均< 0.05)。见表1。对照组细胞克隆数目达到(378.5±11.2)个,过表达组(154.7±15.3)个,对照组细胞克隆数目高于过表达组(P<0.05)。

表1 两组不同时间增殖能力比较(个
注:与对照组比较,*P<0.05。
2.3 miR-497对细胞凋亡和细胞周期的影响 过表达组和对照组各细胞周期分布无统计学差异(P>0.05);过表达组早期凋亡细胞数显著高于对照组(P<0.05)。见表2。
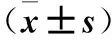
表2 miR-497对细胞凋亡和细胞周期的影响
注:与对照组比较,*P<0.05。
2.4 miR-497对FADD表达的影响 对照组FADD相对表达量为0.54±0.24,过表达组FADD相对表达量为1.23±0.31,对照组FADD相对表达量低于抑制组(P<0.05)。
3 讨论
肝细胞癌是目前最为常见的实体恶性肿瘤之一,亚太地区和非洲地区为其高发地区,我国肝细胞癌发病人数占全球肝细胞癌发病人数的55%。肝癌在早期不易发现,患者发现时多为晚期,生存期一般只有3~16个月,确诊时病人常失去接受根治性治疗的机会。肝移植和手术切除可使肝细胞癌患者的五年生存率达到 70%。肝癌的危险因素众多,如丙肝病毒感染、营养缺乏、寄生虫感染和遗传等。miRNA在肝癌发病过程中作用尚不明确,但是miRNA参与了乙肝病毒感染过程,miRNA可通过RNA沉默调控乙肝病毒在体内的复制和机体免疫应答,从而导致了肝脏的正常生理活动的异常[4]。
miRNA是长度为20~25个的单链小分子 RNA,miRNA通过对基因编码的翻译进行控制,实现对调控基因表达功能的控制,miRNA调控作用可见于机体的生长发育、器官形成和细胞增殖等过程[5]。miRNA在肿瘤的发生发展中可能起到原癌或抑癌的作用。miRNA在多种肿瘤中表现出表达紊乱[5],如食管癌、前列腺癌和甲状腺癌等。不同的miRNA在肿瘤细胞中表现出不同的行为模式,一般表达上调,一部分表达下调,上调的miRNA可促进癌症的发生发展,对抑癌基因、抑制细胞分化的基因和抑制细胞调亡的基因具有抑制作用,乳腺癌患者可表达20倍于正常人的miR-195,骨髓瘤中miR-155可促进肿瘤细胞的异常增殖[6]。表达下调的miRNA表现出抑癌基因作用,对于原癌基因具有沉默作用,miR-192可抑制人骨肉瘤细胞的抑制增殖,发挥抗癌功能[7]。
乙型肝炎感染是亚洲肝细胞癌的主要危险因素。乙型肝炎感染过程中,miRNA可调控病毒复制和机体免疫应答,不同种类的miRNA在乙型肝炎感染功能各有不同,比较转染HBV基因组HepG2 细胞与正常HepG2细胞,11种miRNA表达上调,7 种miRNA表达下调[8]。肝癌中也可检测到多种miRNA的表达异常,目前研究最为特异的为miR-122,miR-122 在几乎所有肝癌细胞系中表达下调,肝癌组织中miR-122也低于癌旁组织[9]。miR-21 在肝癌组织中比正常肝组织表达量高 10 倍,miR-21 能抑制 PTEN翻译,促进癌细胞增殖、转移[10]。本研究发现,肝癌组织miR-497表达低于癌旁组织,肝癌细胞中低于正常肝细胞,说明miR-497可能和肝癌的发生发展存在一定的关联。进一步研究中,通过转染在肝癌细胞中过表达miR-497,MTT实验和软琼脂集落形成实验均表明miR-497可抑制肝癌细胞的增殖,miR-497对癌细胞的细胞周期无影响,但可诱发其早期凋亡。miR-497是miR15家族中的一员,是一种高度保守的miRNA,miR-497与肿瘤、心血管疾病、神经退行性疾病存在密切关联。miR-497在乳腺癌中可使癌细胞细胞周期G1期受抑制。结肠直肠癌细胞中能抑制 IGF1-R3UTR的活性,下调IGF1-R。而在肾上腺皮质癌中,miR-497可促进癌细胞的凋亡[11]。细胞凋亡包含多种途径,而其中有多种蛋白参与其中,如Caspase系列蛋白、Bcl-2系列蛋白和 p53蛋白等[12]。Casapse在某些肿瘤的诱发和发展过程中扮演了重要的角色。凋亡因子FADD可通过调节Caspase蛋白表达诱导细胞的凋亡[13]。本研究结果显示过表达miR-497后,FADD表达显著上升,说明miR-497可通过某种机制上调FADD的表达,从而导致肝癌细胞的凋亡。
综上所述,miR-497可抑制肝癌细胞的增殖,促进凋亡,其作用可能与miR-497促进FADD表达有关。但其具体的作用机制,有待进一步的研究。
[1] 张蔚,刘珍,胡晓霞,等.miRNA-497与miRNA-195基因簇在宫颈癌组织中的表达及预测靶基因的生物信息学分析[J].中国医药导报,2014,11(31):4-9.
[2] 项涛,雷慧.腹水miRNA-497、miRNA-936测定在胃癌性腹水腹腔化疗联合全身靶向治疗中的意义[J].肿瘤基础与临床,2013,26(2):142-144.
[3] 郑晓辉,刘平.MiR-497对人胃癌细胞株顺铂耐药性的影响和机制[J].中国医院药学杂志,2016,36(3):191-195.
[4] Liu L, Zheng W, Song Y, et al. miRNA-497 Enhances the Sensitivity of Colorectal Cancer Cells to Neoadjuvant Chemotherapeutic Drug[J].Curr Protein and Pept Sci, 2015,16(4):310-315.
[5] 王雪晴,石群立,王建东,等.结直肠癌组织中miR-195和miR-497的表达差异及临床病理学意义[J].医学研究生学报,2012,25(11):1163-1167.
[6] Sun N, Ye L, Chang T, et al. microRNA-195-Cdc42 axis acts as a prognostic factor of esophageal squamous cell carcinoma[J]. Int J Clin Exp Pathol, 2014,7(10):6871-6879.
[7] Chung AC, Huang XR, Meng X, et al. miR-192 Mediates TGF-β/Smad3-Driven Renal Fibrosis[J]. J Am Soc Nephrol, 2010, 21(8):1317-1325.
[8] Zhao WY, Wang Y, An ZJ, et al. Downregulation of miR-497 promotes tumor growth and angiogenesis by targeting HDGF in non-small cell lung cancer[J]. Biochem Biophys Res Commun, 2013,435(3):466-471.
[9] Tanimizu N, Kobayashi S, Ichinohe N, et al. Downregulation of miR122 by grainyhead-like 2 restricts the hepatocytic differentiation potential of adult liver progenitor cells[J]. Development, 2014,141(23):4448-4456.
[10] Asangani IA, Rasheed SA, Nikolova DA, et al. MicroRNA-21 (miR-21) post-transcriptionally downregulates tumor suppressor Pdcd4 and stimulates invasion, intravasation and metastasis in colorectal cancer[J]. Oncogene, 2008,27(15):2128-2136.
[11] Zheng D,Radziszewska A,Woo P,et al. MicroRNA 497 modulates interleukin 1 signalling via the MAPK/ERK pathway[J]. FEBS Lett,2012,586(23):4165-4172.
[12] Luo M,Shen D,Zhou X,et al. MicroRNA-497 is a potential prognostic marker in human cervical cancer and functions as a tumor suppressor by targeting the insulin-like growth factor 1 receptor[J]. Surgery, 2013,153(6):836-847.
[13] Lionetti M,Musto P,Martino MT,et al. Biological and clinical relevance of miRNA expression signatures in primary plasma cell leukemia[J]. Clin Cancer Res, 2013,19(12):3130-3142.
张锐(E-mail:20131321@qq.com)
10.3969/j.issn.1002-266X.2017.17.014
R735.7
A
1002-266X(2017)17-0042-03
2016-11-01)
