脑卒中后抑郁大鼠额叶、海马、杏仁核神经元数量变化
2017-06-05李漾超李云李姝杨宁
李漾超,李云,李姝,杨宁
(1大理大学附属医院,云南大理671000 ;2大理大学临床医学院)
脑卒中后抑郁大鼠额叶、海马、杏仁核神经元数量变化
李漾超1,李云1,李姝,杨宁2
(1大理大学附属医院,云南大理671000 ;2大理大学临床医学院)
目的 观察脑卒中后抑郁(PSD)大鼠大脑情感障碍相关脑区额叶、海马、杏仁核神经元数量变化。方法 将20只健康成年雌性SD大鼠随机分为抑郁组、卒中组、PSD组和对照组,每组5只。抑郁组采用孤养法加以慢性不可预见的中等强度应激刺激(CUMS)制作抑郁模型。卒中组用线栓法建立脑卒中模型。PSD组先用线栓法建立脑卒中模型,然后用孤养法加以CUMS制作PSD模型。对照组大鼠正常饲养。给予CUMS后第29天处死各组大鼠,取额叶、海马、杏仁核区脑组织行神经元特异性核蛋白(NeuN)免疫荧光组织染色,光镜下计数并比较各组大鼠额叶、海马、杏仁核中神经元(NeuN阳性细胞)的数量。结果 PSD组大鼠情感障碍相关脑区额叶、海马、杏仁核中神经元数量分别为(98.20±1.78) 、(43.00±7.87) 、(93.00±3.53) 个/视野,均低于其他三组(P均<0.05) 。结论 PSD组大鼠情感障碍相关脑区额叶、海马和杏仁核神经元数量减少。
脑卒中后抑郁;额叶;海马;杏仁核;神经元;神经元特异性核蛋白
脑卒中是当今危害人类健康的最主要的疾病之一,具有高死亡率和高致残率的特点。抑郁症是脑卒中常见的并发症,常与卒中后残疾、认知障碍和较高的病死率相关。脑卒中后抑郁(PSD)表现为卒中后情绪低落、悲观厌世、烦躁、缺乏主动性、食欲不振、睡眠障碍及全身疲劳等症状。抑郁症并非完全是功能性的精神障碍,患者存在脑形态结构的改变,发生结构改变的部位可涉及额叶、颞叶以及与其相联系的纹状体、皮层和丘脑。边缘系统的海马和杏仁核参与了情感和行为的形成过程,与抑郁症关系密切。有研究发现PSD大鼠杏仁核神经元出现明显的凋亡现象[1]。提示PSD大鼠大脑情感障碍相关脑区神经元数量可能发生了变化,但尚未见相关文献报道。NeuN是神经元的一种敏感、特异的标记物,脑组织中的NeuN阳性染色细胞即为神经元[2]。本研究观察了PSD大鼠情感障碍相关脑区额叶、海马、杏仁核区神经元数量的变化,明确PSD大鼠情感相关脑区神经元存活情况。现报告如下。
1 材料与方法
1.1 材料 选择清洁级健康成年雌性SD大鼠20只,体质量200~250 g。大鼠由昆明医科大学动物实验中心提供,动物质量合格证号:SYXK(滇)2005-0004。实验过程中对动物处置符合大理大学实验动物处置的伦理学标准。小鼠抗神经核单克隆抗体(一抗)购自 Millipore公司;DylightTM488标记的羊抗小鼠IgG(二抗)购自KPL公司。
1.2 动物分组及处理 将20只大鼠按随机数字表法分为抑郁组、卒中组、PSD组、对照组,每组5只。卒中组采用线栓法[3]建立局灶性脑缺血模型,制备后置于同一笼内饲养,正常饮食、饮水。抑郁组每笼1只单独饲养,采用慢性不可预见的中等应激刺激(CUMS)结合孤养法建立慢性应激抑郁模型,共刺激28 d。PSD组:采用线栓法建立局灶性脑缺血模型,造模后每笼1只单独饲养,术后1周采用CUMS结合孤养方法建立PSD大鼠模型,共刺激28 d。正常组:大鼠置于同一笼内饲养,正常饮食、饮水。以上各组动物在相互隔离的环境下饲养,术后常规腹腔注射青霉素预防感染。各组均造模成功。
1.3 各组大鼠额叶、海马、杏仁核区神经元计数方法 采用NeuN免疫荧光组织染色法。各组大鼠CUMS第29天断头取脑,将脑组织放入4%多聚甲醛固定6 h。梯度酒精脱水后进行石蜡包埋、切片,冠状面上切取大脑额叶、海马、杏仁核,片厚5 μm,捞片后自然干燥,放入60 ℃烤箱烤2 h。二甲苯脱蜡,梯度酒精水化,置于修复液中高压修复后自然冷却,依次用蒸馏水、PBS漂洗,封闭非特异性的抗原抗体反应1h后,加入1∶750稀释的一抗4 ℃过夜,PBST充分漂洗后加入1∶100的二抗,室温下孵育1h(严格避光),PBS漂洗后50%甘油封片(严格避光)。荧光显微镜下观察。激发波长493 nm,发射波长518 nm,细胞核或细胞质内出现绿色荧光者为神经元细胞。每只大鼠每个脑区选择5张切片,每个切片选择5个非重叠视野(×400),计数视野内神经元细胞数量。
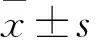
2 结果
各组大鼠额叶、海马、杏仁核中神经元数量见表1。由表1可见,PSD组大鼠额叶、海马、杏仁核中神经元数量均低对照组、抑郁组和卒中组(P均<0.05),抑郁组和卒中组大鼠额叶、海马、杏仁核中神经元数量均低于对照组(P均<0.05)。

表1 各组大鼠额叶、海马、杏仁核中神经元数比较
注:与对照组相比,☆P<0.05;与抑郁组相比,*P<0.05;与卒中组相比,#P<0.05。
3 讨论
NeuN是一种可溶解的核蛋白, 在体外可与DNA疏松的结合,同时NeuN也是脊椎动物神经系统大多数神经元胞核中的特异性蛋白质, 其只在成熟神经元细胞核中特异性表达,因此NeuN被作为脊椎动物成熟神经元的特异性标记物。NeuN能与脊椎动物神经系统中很多部位的成熟神经细胞核发生免疫反应, 包括脊髓、大脑皮质、海马、背侧丘脑、尾壳核、小脑等的神经元,主要参与调解神经元发育成熟的转录过程,而且仅仅在于神经元前体细胞迁移结束后才表达。NeuN检测神经元成熟比其他常用的神经元标记物更为敏感。
大脑皮质是机体的最高调节者,也是情感活动的最高调节者。前皮质尤其是额叶皮质与人的情绪、抽象思维和高级神经活动相关,是脑内重要的情感整合中枢。海马的功能是参与情绪的控制和反应,与情绪和认知关系密切;杏仁核是边缘系统的一部分,是产生情绪,识别情绪和调节情绪,控制学习和记忆的脑组织。研究表明,PSD患者存在海马及杏仁核容积异常缩小[3]。影像学研究结果也表明抑郁患者杏仁核容积明显小于对照组[4,5]。本研究结果发现PSD大鼠额前皮质、海马及杏仁核NeuN阳性细胞较其他对照组明显减少,提示PSD大鼠情感障碍相关脑区神经元细胞存活较少,神经细胞存在异常的死亡和丢失情况。
细胞凋亡是指为了维持内环境稳定,而形成的由基因控制的细胞自主的有序的死亡。正常情况下,细胞凋亡涉及一系列基因的激活、表达以及调控,细胞凋亡能使细胞更好的适应环境。但有研究发现脑缺血可以引起神经元的凋亡[6,7],在中枢神经系统中,额叶、海马、杏仁核等部位对缺血极为敏感,缺血后神经元细胞极易出现凋亡、坏死。卒中导致神经元细胞凋亡、坏死的途径有:受体途径[8,9]、线粒体途径[10,11]及内质网应激[12]途径。缺血性脑卒中后,缺血、缺氧可导致神经元出现一系列异常变化,如细胞肿胀、细胞裂解、细胞器游离等,加速了神经元细胞的凋亡、坏死,进而形成脑组织不可逆性损伤,出现脑神经功能损害表现[13,14]。有研究发现PSD大鼠海马和杏仁核区域凋亡细胞增加[15,16]。本研究结果显现,脑卒中组、抑郁组及PSD组情感障碍相关脑区NeuN阳性细胞较正常对照组明显减少,而PSD组较各对照组明显减少,提示上述疾病状态均可导致细胞凋亡增加,细胞存活减少,这种改变在PSD病理过程中可能最为明显。
[1] 刘昊,王海涛,徐爱军,等.卒中后抑郁模型大鼠杏仁核神经元凋亡增加.中风与神经疾病杂志,2011,28(8):685-687.
[2] 胡晓松,NeuN及其在局灶性脑缺血再灌注研究中的应用[J].华西医学,2004,19 (2):329-330
[3] 陈宇,徐坚民,冯敢生,等.脑梗死后抑郁症患者海马及杏仁核体积的MRI研究[J].放射学实践,2009,24:603-606.
[4] 夏军,陈军,周义成,等.抑郁患者海马及杏仁核容积异常的MRI研究[J].中华放射学杂志,2005,39:140-143.
[5] 何苗,李敏清,文曦娜,等. 灯盏花素防治急性脑梗死作用机制及应用进展[J]. 中国医药科学,2012,22(2):30-31.
[6] 刘昊,王海涛,徐爱军,等. 卒中后抑郁模型大鼠杏仁核神经元凋亡增加[J]. 中风与神经疾病杂志,2011,28(8):685-687.
[7] 樊蔚虹,姚建平,赵文景. 柴胡疏肝散对卒中后抑郁大鼠海马组织Bcl- 2,Bax 蛋白表达的影响[J]. 中国实验方剂学杂志,2011,1 (3):181-183.
[8] Mehta SL,Manhas N,Raghubir R. Molecular targets in cerebral ischemiafor developing novel therapeutics [J]. Brain Res Rev,2007,54(1):34- 66.
[9] Broughton BR,Reutens DC,Sobey CG. Apoptotic mechanisms after cerebral ischemia [J]. Stroke,2009,40 (5):331 - 339.
[10] Sims NR,Muyderman H. Mitochondria,oxidative metabolism and cell death in stroke [J]. Biochim Biophys Acta,2010,1802 (1):80- 91.
[11] Ekert PG,Silke J,Hawkins CJ,et al. DIABLO promotes apoptosis by removing MIHA/XIAP from processed caspase -9 [J]. J Cell Biol,2001,152 (3):483- 490.
[12] 关丽英,许彩民,潘华珍,等. 内质网应激介导的细胞凋亡[J]. 生物化学与生物物理进展,2007,34(11):1136- 1141.
[13] 刘毓和,吴新民,应舜伟,等.反复吸入七氟醚对老龄大鼠海马组织Apaf-1和Caspase-9 mRNA表达的影响[J].中华麻醉学杂志,2009,29(10):903- 907.
[14] 吴浩,许鹏程,杨俊霞. 亚麻醉浓度的七氟烷对成年大鼠认知功能及海马齿状回神经发生的影响[J]. 山东医药,2011,51(9):28- 29.
[15] 张敬坤,攻莉,郭敏.C57/BL6 小鼠海马的发育和衰老[J].西安交通大学学报(医学版), 2010, 31(5): 653- 656.
[16] 史萌,时燕薇,赵虎,等.条件性恐惧记忆形成中大鼠海马CA1/CA3区Hsp90表达变化[J].热带医学杂志,2015,15(4):450- 453.
国家自然科学基金资助项目(81360208)。
李云(E-mail: liyun_neuron@163.com)
10.3969/j.issn.1002-266X.2017.19.012
R749.1
A
1002-266X(2017)19-0043-03
2016-09-07)
