Matrigel三维细胞培养方法培养的原代乳腺癌细胞生长情况及对阿霉素敏感性观察
2017-06-05张震齐晓敏张薇张培曹旭晨肖春花
张震,齐晓敏,张薇,张培,曹旭晨,肖春花
(1天津医科大学肿瘤医院,国家肿瘤临床医学研究中心,天津300060;2天津市“肿瘤防治”重点实验室;3天津市恶性肿瘤临床医学研究中心;4乳腺癌防治教育部重点实验室)
Matrigel三维细胞培养方法培养的原代乳腺癌细胞生长情况及对阿霉素敏感性观察
张震1,2,3,齐晓敏1,2,3,张薇1,2,3,张培1,2,3,曹旭晨1,2,3,肖春花1,2,3
(1天津医科大学肿瘤医院,国家肿瘤临床医学研究中心,天津300060;2天津市“肿瘤防治”重点实验室;3天津市恶性肿瘤临床医学研究中心;4乳腺癌防治教育部重点实验室)
目的 观察Matrigel三维细胞培养方法培养的原代乳腺癌细胞生长情况及其对阿霉素的敏感性。方法 分别采用二维单层培养法、Matrigel三维细胞培养方法培养原代乳腺癌细胞。在培养的第1、3、5、7天,采用Olympus Ⅸ70倒置显微镜观察二维单层培养及三维培养条件下的原代乳腺癌细胞形态, 采用CellTiter-Glo®发光法观察细胞生长增殖情况及其对阿霉素的敏感性,绘制原代乳腺癌细胞生长曲线及药敏曲线。结果 二维单层培养的原代乳腺癌细胞贴壁生长,癌细胞聚集成巢状,呈多种形态。三维细胞培养的原代乳腺癌细胞聚集成紧密的多肿瘤细胞微球。二维单层培养第1、3、5、7天原代乳腺癌细胞的增殖倍数分别为1.00±0.00、1.39±0.29、2.08±0.25、3.26±0.41;三维培养第1、3、5、7天原代乳腺癌细胞的增殖倍数分别为1.00±0.00、1.25±0.08、1.79±0.10、1.58±0.02。随阿霉素浓度升高,二维单层培养及三维培养下的原代乳腺癌细胞增殖抑制率增高。但三维细胞培养的原代乳腺癌细胞增殖抑制率均低于二维细胞培养。结论 Matrigel三维细胞培养的原代乳腺癌细胞可聚集成紧密的球形,细胞增殖速度变慢,对阿霉素的敏感性降低。Matrigel三维细胞培养原代乳腺癌细胞效果较好。
乳腺肿瘤;乳腺癌;Matrigel三维细胞培养方法;细胞形态;细胞增殖;药物敏感性
乳腺癌是女性最常见的恶性肿瘤,病死率占女性癌症死亡原因的15%[1]。对肿瘤组织进行药物敏感性检测,根据检测结果对患者进行个体化用药是目前的研究热点。二维单层细胞培养是传统的药物敏感性检测方法。人体组织和器官是以三维结构的形式存在并发挥功能。研究[2~4]证实,与人体组织中三维结构细胞相比,二维环境中培养形成的单层细胞的组织特异性结构、生物学行为、细胞间及细胞与胞外基质之间的相互作用明显缺失。三维细胞培养技术是通过让细胞聚集成细胞球或将细胞包裹到在成分及结构上类似于实体组织的细胞外基质中,一定程度模拟了细胞在生物体内的生存状态[5, 6],目前已经被用于肿瘤细胞系的生长及耐药性研究中[7~9]。关于三维环境下培养的原代乳腺癌细胞的生长情况、药物敏感性方面的相关报道较少。本研究观察了Matrigel三维细胞培养方法培养的乳腺癌细胞的形态、增殖及药物敏感性变化。现将结果报告如下。
1 材料与方法
1.1 细胞与材料 乳腺癌组织取自天津医科大学肿瘤医院经手术切除并病理确诊的乳腺癌标本,患者术前均未经过放化疗,DMEM培养基、青链霉、HEPES、Ⅰ型胶原酶、0.25%胰酶均购自美国Gibico公司,胎牛血清购自兰州百灵公司,表皮生长因子购自R&D systems公司,Matrigel基质胶购自美国BD公司,CellTiter-Glo®发光法检测试剂盒购自美国Promega公司。
1.2 原代乳腺癌细胞培养方法的建立及纯化 取适量乳腺癌组织,用无菌手术剪刀将组织剪碎至1 mm3,PBS冲洗,弃上清,加入2% Ⅰ型胶原酶,37 ℃孵箱消化15 h。取消化后的组织,40 g 离心1 min,取上清,100 g离心2 min;弃上清,取下层沉淀用原代培养基重悬培养。此时肿瘤细胞和成纤维细胞混杂生长,肿瘤细胞呈巢状分布。培养至细胞汇合度70%左右时0.05%胰酶消化约8 min,弃上清,加入10%原代培养基继续培养,重复差异消化1次,得到纯度约70%的原代乳腺癌细胞,备用。
1.3 原代乳腺癌细胞的Matrigel三维细胞培养方法 在冰盒上用预冷枪头缓慢吸取30 μL Matrigel基质胶(4 ℃预冷过夜后解冻),加入96孔板,37 ℃培养箱静置30 min,使Matrigel凝固。取生长状态良好的原代乳腺癌细胞,0.05%胰酶消化,原代培养基终止消化并反复吹打均匀,400目过滤网过滤3次,计数板行台酚蓝活细胞计数。调整细胞浓度至50 000/mL,吹打均匀后取100 μL细胞悬液,缓慢加入到凝固Matrigel基质胶上。37 ℃孵育30 min。将Matrigel基质胶与原代培养基按照体积比1∶10混合,轻柔混合均匀,将Matrigel-培养基混合物缓慢加至96孔板中。放入细胞培养箱培养。2天更换1次上层Matrigel-培养基混合物,备用。
1.4 细胞生长情况观察
1.4.1 原代乳腺癌细胞形态观察 在培养第3天时,分别取“1.2”中原代乳腺癌细胞、“1.3”中三维培养的原代乳腺癌细胞,采用Olympus Ⅸ70倒置显微镜观察细胞形态。
1.4.2 原代乳腺癌细胞增殖情况观察 分别取“1.2”中纯化的原代乳腺癌细胞、“1.3”中三维培养的原代乳腺癌细胞,调整细胞浓度至20 000/mL,各取96孔板,铺12个复孔。每孔取100 μL细胞悬液,加入100 μL原代培养基培养。分别在第1、3、5、7天,各取3个复孔采用CellTiter-Glo®发光法测量原代乳腺癌细胞的增殖倍数。取出CellTiter静置至室温,室温静置30 min后取细胞,弃上清,每孔加入100 μL 10% DMEM,加入100 μL CellTiter试剂,震荡2 min使其充分反应,静置10 min,检测RLU值(代表乳腺癌细胞增殖倍数),并绘制原代乳腺癌细胞生长曲线。
1.5 原代乳腺癌细胞对阿霉素的敏感性检测 分别取“1.2”中纯化的原代乳腺癌细胞、“1.3”中三维培养的原代乳腺癌细胞,取96孔板,分别将细胞分为A组、B组、C组、对照组,每组3个复孔,每孔加入100 μL细胞悬液。第2天向A、B、C组分别加入0.15 、1.5 、15 μg/mL的阿霉素,对照组加入100 μL原代培养基。置于培养箱中继续培养48 h后,采用Olympus Ⅸ70倒置显微镜观察各组细胞形态变化,采用CellTiter-Glo®发光法检测不同患者来源的各组细胞增殖抑制率(代表原代乳腺癌细胞对其阿霉素的敏感性),所有操作方法均严格按照使用说明书进行。
2 结果
2.1 原代乳腺癌细胞形态 在二维单层培养条件下,乳腺癌细胞贴壁生长,癌细胞聚集成巢状,呈多种形态,包括梭形、多边形、不规则形。三维环境中的乳腺癌细胞聚集成紧密的球形。见图1。

注:A 原代乳腺癌细胞在二维单层培养条件下,细胞贴壁生长,呈梭形、多边形、不规则形。B原代乳腺癌细胞在三维培养条件下,细胞聚集并增殖形成紧密的球形。
图1 二维单层培养及三维培养条件下的原代乳腺癌细胞形态
2.2 原代乳腺癌细胞增殖情况比较 二维单层培养第1、3、5、7天原代乳腺癌细胞的增殖倍数分别为1.00±0.00、1.39±0.29、2.08±0.25、3.26±0.41;三维培养第1、3、5、7天原代乳腺癌细胞的增殖倍数分别为1.00±0.00、1.25±0.08、1.79±0.10、1.58±0.02。二维单层培养及三维培养条件下的原代乳腺癌细胞生长曲线见图2。
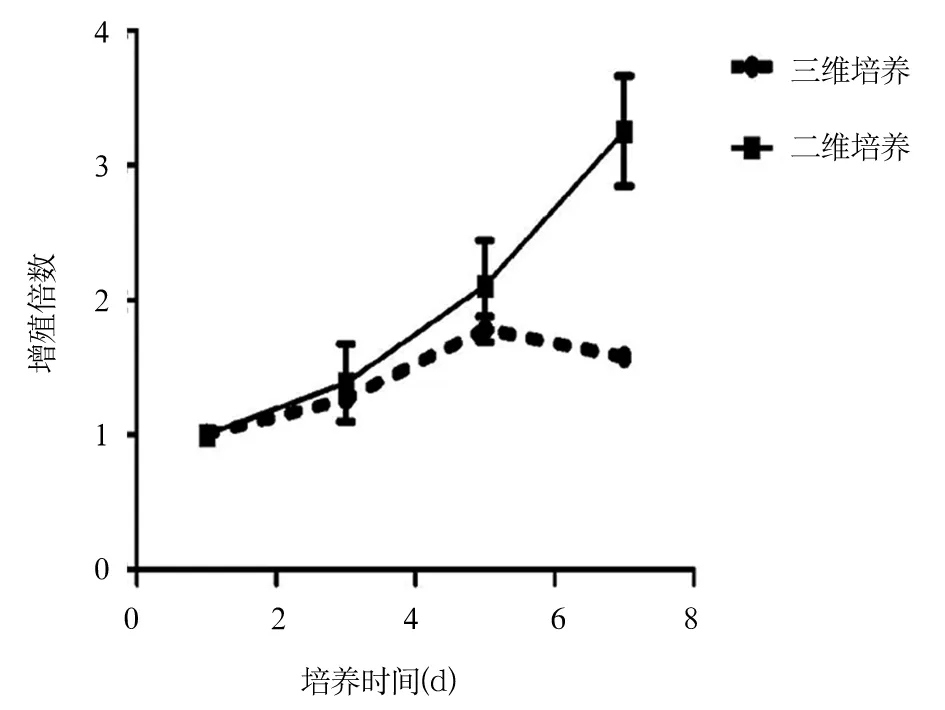
图2 二维单层培养及三维培养条件下的原代乳腺癌细胞生长曲线
2.3 原代乳腺癌细胞对阿霉素的敏感性比较 二维和三维培养条件下原代乳腺癌细胞的细胞形态改变见图3。纳入乳腺癌标本最终仅培养成功4例份。培养48 h各组细胞增殖抑制率比较见表2。
3 讨论
在1983年,有学者[10]首次将体外药物敏感实验同患者对药物的反应进行了前瞻性实验,由于当时的培养条件限制及患者例数的不足,药敏实验的假阴性率及假阳性率均较高。然而,人们对于肿瘤组织药物敏感性检测的探索从未停止,试图通过体外药敏结果指导患者的临床用药,进行个体化治疗,减少患者不必要的经济损失及健康损害。当前,我们对药物敏感性检测主要基于两种模式——二维条件下的细胞培养以及动物模型实验。虽然动物实验是公认的体外药敏检测的金标准,但因其周期长和伦理问题等原因在预测患者药物敏感性的应用中受到限制。传统的二维单层细胞培养,细胞在培养皿中贴壁生长,不能真正反映组织生理状态下的复杂性,以此为基础的细胞学功能试验一定程度上错误的评估了组织的特异性应答反应。二维环境下的单层细胞主要是进行细胞去分化的细胞增殖,丧失了细胞本来的功能[11,12]。相反,在三维环境中培养的细胞在细胞增殖、分化、形态及功能等方面表现出与体内更高的相似性,从而替代一些动物实验[13],搭建了二维细胞培养与动物实验之间的桥梁。

注:A 二维单层培养对照组细胞贴壁生长,呈多边形、梭形;B 二维单层培养A组癌细胞汇合度低;C二维单层培养B组癌细胞大量死亡,仅有少量细胞存活,且细胞形态不规则,细胞活力差;D二维单层培养中C组细胞大量死亡,细胞结构消失,失去细胞形态;E 三维培养对照组细胞聚集成球状;F三维培养A组三维乳腺癌多细胞球的形态、大小及数量变化不明显;G三维培养B组癌细胞球结构变得松散,呈葡萄状;H三维培养C组多细胞球结构更加松散,细胞离散,可见细胞碎片。
图3 二维和三维培养条件下原代乳腺癌细胞形态改变
表2 培养48 h各组细胞增殖抑制率比较
本研究构建了原代乳腺癌细胞的二维单层培养及Matrigel三维培养的方法,原代乳腺癌细胞在三维环境中形成紧密的细胞球,生长缓慢。研究认为,三维环境下细胞聚集成多肿瘤细胞微球体(MCTS),处于快速增殖期的癌细胞位于微球体最外层,而微球体中心则出现缺氧及营养物质供应不充分,中心的细胞主要处于静止期,甚至为坏死细胞[14]。我们的结果发现,三维环境中细胞在初始阶段缓慢增长,随着培养时间的延长,细胞数量出现下降趋势。我们认为这是由于在三维环境中肿瘤细胞形成紧密的细胞球,随着培养时间的延长,细胞增殖细胞球体积增大,处于多细胞球中心的细胞则由于缺少氧气及营养物质,发生坏死,从而引起活细胞数减少。这与体内的肿瘤组织中的微环境非常相似,尤其是在肿瘤发生的早期血管生成之前的阶段,肿瘤组织中心的癌细胞处于缺血缺氧的状态,营养物质及氧气供应不充分,代谢废物排出障碍,局部微环境不适宜细胞生存,细胞生长缓慢甚至发生坏死,处于肿瘤组织与正常组织交界处的肿瘤细胞则生长最活跃。此外,对卵巢癌的31个细胞系进行三维培养发现,三维环境下主要可以形成三种形态:大的致密球形、大的疏松球形、小的聚集物,且结构不同可能影响细胞对药物的敏感性。
本研究结果采用CellTiter-Glo®发光法进行原代乳腺癌细胞的药物敏感性检测,比传统的MTT法、CCK8法更灵敏,适用于二维单层细胞及三维细胞球。结果显示,同传统二维单层细胞培养条件相比,三维环境下原代乳腺癌细胞对阿霉素的敏感性下降,表现出对阿霉素耐受性增加。Lee等[15]报道,1847AD、FUOV1、OV2008等细胞系在三维环境中对药物耐受性增加,同时发现三维培养环境下形成的多肿瘤细胞微球中,肿瘤细胞的分化程度与肿瘤组织相似性更高,认为三维环境中的药物敏感性检测的实验结果能更真实的反应活体内细胞的药物耐受性。对于三维环境中肿瘤细胞对药物耐受性增加的机制,目前还不是十分清楚,但是已经引起了广泛地关注,已有文献报道可能同基因的改变、缺氧、细胞外基质的调控等有关[16],其具体机制还有待后续进一步研究探索。
综上所述,Matrigel三维细胞培养的原代乳腺癌细胞可聚集成紧密的球形,细胞增殖速度变慢,对阿霉素的敏感性降低。Matrigel三维细胞培养原代乳腺癌细胞效果较好。
[1] Torre LA. Global cancer statistics, 2012[J]. CA Cancer J Clin , 2015,65(2):87-108.
[2] Bissell MJ,Rizki A, Mian IS,et al. Tissue architecture: the ultimate regulator of breast epithelial function[J]. Curr Opin Cell Biol, 2003,15(6):753-762.
[3] Cukierman E, Pankov R, Yamada KM. Cell interactions with three-dimensional matrices[J]. Curr Opin Cell Biol,2002,14(5):633-639.
[4] Nelson CM ,Bissell MJ. Of extracellular matrix,scaffolds,and signaling: tissue architecture regulates development,homeostasis,and cancer[J]. Annu Rev Cell Dev Biol,2006,22:287-309.
[5] Khademhosseini A. Microscale technologies for tissue engineering and biology[J]. Proc Natl Acad Sci USA ,2006,103(8):2480-2487.
[6] Langer R , Tirrell DA. Designing materials for biology and medicine[J]. Nature , 2004,428(6982):487-492.
[7] Bader DL, Salter DM , Chowdhury TT,et al. Biomechanical influence of cartilage homeostasis in health and disease[J]. Arthritis,2011,2011(6):979032.
[8] Usui T. Establishment of a novel model for anticancer drug resistance in three-dimensional primary culture of tumor microenvironment[J]. Stem Cells Int, 2016,2016:7053872.
[9] Santoro M. Flow perfusion effects on three-dimensional culture and drug sensitivity of Ewing sarcoma[J]. Proc Natl Acad Sci U S A, 2015,112(33): 10304-10309.
[10] Tung YC. High-throughput 3D spheroid culture and drug testing using a 384 hanging drop array[J]. Analyst, 2011,136(3):473-478.
[11] Casey J. 3D hydrogel-based microwell arrays as a tumor microenvironment model to study breast cancer growth[J]. Biomed Mater, 2017,12(2): 025009.
[12] Fujiwara D. The usefulness of three-dimensional cell culture in induction of cancer stem cells from esophageal squamous cell carcinoma cell lines[J]. Biochem Biophys Res Commun, 2013,434(4):773-778.
[13] Mitragotri S , Lahann J . Physical approaches to biomaterial design[J]. Nat Mater, 2009,8(1):15-23.
[14] Ma HL. Multicellular tumor spheroids as an in vivo-like tumor model for three-dimensional imaging of chemotherapeutic and nano material cellular penetration[J]. Mol Imaging, 2012,11(6):487-498.
[15] Lee JM. A three-dimensional microenvironment alters protein expression and chemosensitivity of epithelial ovarian cancer cells in vitro[J]. Lab Invest, 2013,93(5):528-542.
[16] Liu C. Role of three-dimensional matrix stiffness in regulating the chemoresistance of hepatocellular carcinoma cells[J]. Biotechnol Appl Biochem, 2015,62(4):556-562.
Growth of primary breast cancer cells cultured by Matrigel three-dimensional cell culture method and its sensitivity to adriamycin
ZHANGZhen1,QIXiaomin,ZHANGWei,ZHANGPei,CAOXuchen,XIAOChunhua
(1TianjinMedicalUniversityCancerInstituteandHospital,NationalClinicalResearchCenterforCancer,Tianjin300060,China)
Objective To observe the growth of primary breast cancer cells cultured in Matrigel three-dimensional cell culture method and its sensitivity to adriamycin. Methods The primary breast cancer cells were cultured by two-dimensional monolayer culture and Matrigel three-dimensional cell culture methods. On the 1st, 3rd, 5th and 7th day of culture, Olympus IX70 inverted microscope was used to observe the morphology of primary breast cancer cells under the condition of two-dimensional monolayer culture and three-dimensional culture. CellTiter-Glo®Luminescent Cell Viability Assay was applied to observe the cell proliferation and its sensitivity to adriamycin. Primary breast cancer cell growth curve and drug sensitivity curve were drawn based on the observation results. Results The primary breast cancer cells with two-dimensional monolayer culture were in adherent growth, and the cancer cells gathered like a nest, with a variety of forms. The primary breast cancer cells with three-dimensional cell culture gathered into close multi-tumor cell microspheres. The proliferation of primary breast cancer cells cultured by two-dimensional monolayer culture on the 1st, 3rd, 5th and 7th day was 1.00±0.00, 1.39±0.29, 2.08±0.25 and 3.26±0.41. The proliferation of primary breast cancer cells cultured by Matrigel three-dimensional cell culture was 1.00±0.00, 1.25±0.08, 1.79±0.10 and 1.58±0.02. With the increase of adriamycin concentration, the inhibition rate of proliferation of primary breast cancer cells increased under two-dimensional monolayer culture and three-dimensional culture. But the proliferation inhibition rate of primary breast cancer cells with three-dimensional cell culture was lower than that with two-dimensional cell culture. Conclusion The primary breast cancer cells with Matrigel three-dimensional cell culture can gather into close spheres, the cell proliferation rate slows down, and the sensitivity of adriamycin decreases. Matrigel three-dimensional cell culture is better for culturing primary breast cancer cells.
breast neoplasms; breast carcinama; Matrigel three-dimensional cell culture method; cell morphology; cell proliferation; drug sensitivity
中国医学基金会肿瘤预防与科研项目(314.2222)。
张震(1990-),男,硕士研究生在读,主要研究方向为乳腺肿瘤外科。E-mail: zzhen2015@163.com
肖春花(1971-),女,硕士研究生导师,主任医师,主要研究方向为乳腺肿瘤外科、乳腺疾病早期诊断及乳腺癌保乳手术和一期乳房重建手术。E-mail: xxcchh2002@163.com
10.3969/j.issn.1002-266X.2017.19.005
R734.2
A
1002-266X(2017)19-0017-04
2016-10-18)
