17号染色体rs1859962单核苷酸多态性与前列腺癌易感性的meta分析
2017-06-05黄垂国赵兴华许长宝王若凡李武学魏磊崔喆
黄垂国,赵兴华,许长宝,王若凡,李武学,魏磊,崔喆
(郑州大学第二附属医院 泌尿外科,河南 郑州 450014)
·论 著·
17号染色体rs1859962单核苷酸多态性与前列腺癌易感性的meta分析
黄垂国,赵兴华,许长宝,王若凡,李武学,魏磊,崔喆
(郑州大学第二附属医院 泌尿外科,河南 郑州 450014)
目的:系统评价17q24 rs1859962单核苷酸多态性与前列腺癌易感性的关系。方法:检索Pubmed、Embase、CNKI、VIP、CBM和万方数据库,搜集有关rs1859962与前列腺癌易感性的研究,由2名研究员独立进行文献筛选及提取资料,采用STREGA标准对纳入文献进行质量评价,采用RevMan 5.3和Stata 12.0进行meta分析。结果:最终纳入8篇病例对照研究(病例组7863例,对照组17122例)。Meta分析结果提示,rs1859962与前列腺癌易感性相关。种族亚组分析结果提示,rs1859962基因多态性与欧洲人种、亚洲人种和美洲人种的前列腺癌发病风险升高相关。结论:17q24 rs1859962基因多态性与前列腺癌发病存在关联,该结论需未来更高质量研究进一步验证。
前列腺癌;17q24 rs1859962;基因多态性;meta分析
前列腺癌(prostate cancer,Cap)是常见的男性恶性肿瘤,其病死率高居男性肿瘤中第二位[1]。Cap的病因和发病机制迄今尚未阐明,年龄、种族、遗传、生活方式等都能影响Cap的发生[2]。全基因组关联研究 (genome wide association studies,GWAS) 是通过检测人类全基因组内存在的单核苷酸多态性(single nucleotide polymorphism,SNP) 来研究复杂疾病遗传机制的一种重要手段[3]。目前多个GWAS研究已确定了多个突变的基因位点与Cap相关[4],其中SNP rs1859962成为国内外学者近年来的研究热点。2007年Gudmundsson等[5]首次报道了17号染色体上的rs1859962(T>G)对Cap的易感性具有重要意义,但该位点影响Cap易感性的表达机制及其分子生物学功能尚未明确。由于目前学者们对SNPrs1859962在Cap中研究结果尚不一致,本研究采用meta分析方法综合探讨SNP rs1859962在Cap发病机制中的作用。
1 资料与方法
1.1 文献检索
系统检索PubMed、Embase、中国知网(Chinese national knowledge infrastructure,CNKI)、维普(VIP)、中国生物医学文献(China biology medicine,CBM)、万方等在线数据库,搜集17q24 rs1859962基因多态性与前列腺癌相关的病例对照研究(case-control study,CCS),辅以手工检索相关学术、会议论文及相关参考文献。英文检索词:prostatic neoplasms,prostate cancer,prostate carcinoma,prostatic carcinoma,Cap,rs1859962,polymorphism,mutation,variation,genotype,gene,single nucleotide polymorphism,SNP;中文检索词:前列腺癌、rs1859962、多态性、单核苷酸多态性、基因多态性等。
1.2 文献纳入与排除标准
(1)研究的类型均为病例对照研究。(2)研究对象(种族、年龄、家族史不限制)病例组为经临床病理学确诊的前列腺癌患者,对照组为健康人群。(3)纳入研究采用恰当的统计学方法且数据完整。(4)排除综述、病例报道、评论、信件及重复发表文献。
1.3 文献筛选与资料提取
由两名研究者独立检索以上数据库,通过阅读题目和摘要,剔除明显不符合纳入标准的文献,对剩余文献进行全文阅读,严格按照纳入与排除标准确定符合条件的文献。采用EXCEL提取相关数据:(1)作者信息、发表年份;(2)研究类型;(3)人群的基本特征;(4)基因检测方法;(5)病例组与对照组中基因频率及基因型分布情况;(6)哈迪-温伯格平衡(Hardy-Weinberg equilibrium,HWE)[6]。两名研究者之间存在的争议通过重新审核和讨论解决;若仍得出不一致的结果,请专家评议。
1.4 文献质量评价
参照STREGA标准[7]对纳入的CCS进行质量评分:(1)是否有足够的样本量;(2)是否有明确的诊断标准;(3)分组是否匹配合理;(4)对照组与病例组是否具有可比性,对照组基因型分布是否符合H-W平衡定律;(5)是否有合理的基因诊断方法;(6)数据是否充分。每项1分。
1.5 统计学处理
基于遗传模型进行meta分析:(1)共显性模型GGvs.TT、TGvs.TT;(2)显性模型(TG+GG)vs.TT;(3)隐性模型GGvs.(TG+TT)。效应量分析选用比值比(Odds ratios,OR)及95% 可信区间(Confidence interval,CI)作为二分类指标统计量。通过Q检验和I2进行异质性分析,当结果一致性良好或异质性低时,采用固定效应模型,反之则采用随机效应模型。发表偏倚采用漏斗图和Egger′s检验进行判断,P<0.05为差异有统计学意义。其中敏感性分析和发表性偏倚采用Stata 12.0软件,其余分析均采用RevMan5.3。
2 结 果
2.1 文献检索及筛选结果
最初检索到文献42篇,经阅读题目、摘要排除综述、重复发表文献、评论、信件等,得到14篇相关文献;进一步阅读全文,严格按照纳入及排除标准,最终8篇CCSs[5,8-14]被纳入。见表1。
2.2 质量评价
纳入的研究参考STREGA标准[7]进行质量评价,结果显示:各个研究样本量充足,前列腺癌诊断明确,纳入的研究对基线特征均进行合理的检验,病例组与对照组可比性良好,对照组符合H-W平衡,纳入研究的文献质量良好。见表1。
表1 纳入文献的基线特征
Tab 1 Characteristics of publications included in the meta-analysis

作 者国家种族对照组样本来源例数 病例 对照 病例组对照组TTTGGGTTTGGGSTREGA评分Gudmundsson冰岛白种人社区1501112904087183753319571322586等(2007)[5]荷兰白种人社区99914662364832804956043676西班牙白种人医院45610781172111283224862706美国美洲人社区5375101362511501732091286Zheng等(2008)[13]瑞典白种人社区2893178163713888684528844456Zhou等(2011)[14]中国亚洲人医院1191053660234449126Liu等(2011)[10]日本亚洲人医院51832327919742189119156Zhang等(2012)[12]中国亚洲人医院267265791345489135416Jason等(2013)[8]新加坡亚洲人社区287141106141405364246Rojas等(2014)[11]智利美洲人医院1673329885051996Li等(2015)[9]中国亚洲人医院1191303958221764496
2.3 Meta分析结果
采用RevMan5.3软件对纳入的研究进行合并效应量后提示:(1)在共显性模型(GGvs.TT)中,17q24 rs1859962中突变纯合子(GG)能增加前列腺癌发病风险(OR=1.41,95%CI=1.29~1.54);(2)在另一共显性模型(TGvs.TT)中,提示杂合型突变基因型(TG)使前列腺癌的发病风险上升(OR=1.22,95%CI=1.07~1.38);(3)在隐性模型(GGvs. TG+TT)中,提示与携带杂合子(TG)和野生型纯合子(TT)合并的效应量相比,突变的纯合子(GG)提升前列腺癌患者发病率(OR=1.27,95%CI=1.18~1.36);(4)在显性模型中(GG+TGvs.TT)中,提示与野生型纯合子(TT)相比,携带杂合子(TG)和突变纯合子(GG)的前列腺癌患者合并的风险上升(OR=1.25,95%CI=1.17~1.34)。见图1,表2。
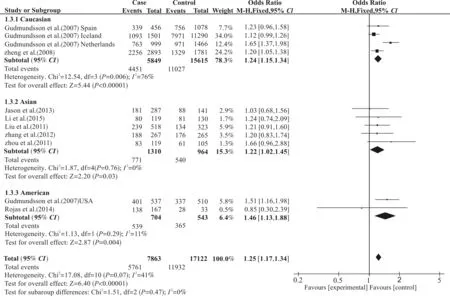
图1 17q24rs1859962(T>G)基因多态性与前列腺癌易感性的森林图(GG+TGvs.TT)
Fig1 Forest plot for the association between the 17q24 rs1859962 (T>G) polymorphism and prostate cancer risk(GG+TGvs.TT)表2 Meta分析结果
Tab 2 Meta-analysis of the 17q24 rs1859962 (T>G) polymorphism and risk of prostate cancer

变 量nGGvs.TTTGvs.TTGGvs.(TG+TT)(TG+GG)vs.TTOR(95%CI)P值OR(95%CI)P值OR(95%CI)P值OR(95%CI)P值总数111.41(1.29~1.54)0.0011.22(1.07~1.38)0.0031.27(1.18~1.36)0.0011.25(1.17~1.34)0.001种族 白种人41.40(1.27~1.54)0.0011.22(0.99~1.51)0.071.27(1.17~1.37)0.0011.24(1.15~1.34)0.001 亚洲人51.48(1.21~1.96)0.0061.15(0.96~1.38)0.131.36(1.05~1.76)0.021.22(1.02~1.45)0.03 美洲人21.44(1.06~1.98)0.021.37(0.85~2.21)0.21.16(0.89~1.50)0.281.46(1.13~1.88)0.004对照组样本来源 社区来源51.40(1.27~1.54)0.0011.26(1.02~1.55)0.031.26(1.16~1.36)0.0011.25(1.16~1.35)0.001 医院来源61.47(1.19~1.82)0.0011.16(0.99~1.36)0.051.32(1.10~1.58)0.0031.24(1.07~1.44)0.005
2.4 亚组分析
2.4.1 基于种族亚组分析 纳入的研究中有2篇[5,13]前列腺癌患者是欧洲人(Caucasian),5篇[8-10,12,14]研究是亚洲人,2篇[5,11]是美洲人。进一步亚组分析提示:(1)在共显性模型(GGvs.TT)中,突变纯合型(GG)增加不同种族前列腺癌患者的发病风险(欧洲人:OR=1.40,95%CI=1.27~1.54,P<0.001;亚洲人:OR=1.48,95%CI=1.21~1.96,P=0.006;美洲人:OR=1.44,95%CI=1.06~1.98,P=0.02);(2)在另一共显性模型(TGvs.TT)中,未发现杂合型基因突变型(TG)与前列腺癌的易感性相关(欧洲人:OR=1.22,95%CI=0.99~1.51,P=0.07;亚洲人:OR=1.15,95%CI=0.96~1.38,P=0.13;美洲人;OR=1.37,95%CI=0.85~2.21,P=0.20);(3)在隐性模型(GGvs.TG+TT)中,突变纯合型(GG)增加欧洲人和亚洲人的前列腺癌患病风险,而未发现与美洲人相关(欧洲人:OR=1.27,95%CI=1.17~1.37,P<0.001;亚洲人:OR=1.36,95%CI=1.05~1.76,P=0.02;美洲人:OR=1.16,95%CI=0.89~1.50,P=0.28);(4)在显性模型中(TG+GGvs.TT)中,携带杂合子(TG)和突变纯合子(GG)增加了各个种族的前列腺癌发病风险(欧洲人:OR=1.24,95%CI=1.15~1.34,P<0.001;亚洲人:OR=1.22,95%CI=1.02~1.45,P=0.03;美洲人:OR=1.46,95%CI=1.13~1.88,P=0.004)。见表2。
2.4.2 基于对照人群来源亚组分析 纳入的研究中有6篇[5,9-12,14]对照人群是以医院人群为基础的病例对照研究,5篇[5,8,13]是以社区人群为基础的病例对照研究。亚组分析提示:(1)在共显性模型(GGvs.TT)中,突变纯合基因型(GG)与不同对照人群来源的前列腺癌患者的发病风险相关联(社区人群:OR=1.40,95%CI=1.27~1.54,P<0.001;医院人群:OR=1.47,95%CI=1.19~1.82,P=0.0004);(2)遗传模型(TGvs.TT)提示,杂合型基因突变型(TG)能增加对照人群来源于社区和来源于医院前列腺癌患者的发病风险(社区人群:OR=1.26,95%CI=1.02~1.55,P=0.03;医院人群:OR=1.16,95%CI=0.99~1.36,P=0.05);(3)在隐性模型(GGvs.TG+TT)中,突变纯合型(GG)均增加了不同对照人群来源的前列腺癌患者的患病风险(社区人群:OR=1.26,95%CI=1.16~1.36,P<0.001;医院人群:OR=1.32,95%CI=1.10~1.58,P=0.003);(4)在显性模型中(TG+GGvs.TT)中,杂合子(TG)和突变纯合子(GG)均增加不同对照人群来源的前列腺癌的患病风险(社区人群:OR=1.25,95%CI=1.16~1.35,P<0.001;医院人群:OR=1.24,95%CI=1.07~1.44,P=0.005)。见表2。
2.5 敏感性分析
采用Stata 12.0软件,对异质性较大的遗传模型进行敏感性分析,按质量评价标准将纳入的文献逐步剔除后重新采用固定效应模型和随机效应模型进行分析,提示与之前结果相似,证明本研究的结果稳定、可靠。见图2。

图2 17q24 rs1859962(T>G)基因多态性与前列腺癌易感性的敏感性分析(TGvs.TT)
Fig 2 Sensitivity analysis on the association of the rs1859962 T>G SNP with prostate cancer risk (TGvs.TT)
2.6 发表性偏移
采用Egger回归法[15]验证meta分析是否存在发表性偏倚,结果提示:前列腺癌在所有比较模型中均无发表性偏倚(P>0.05),结果属实可信。见图3,表3。
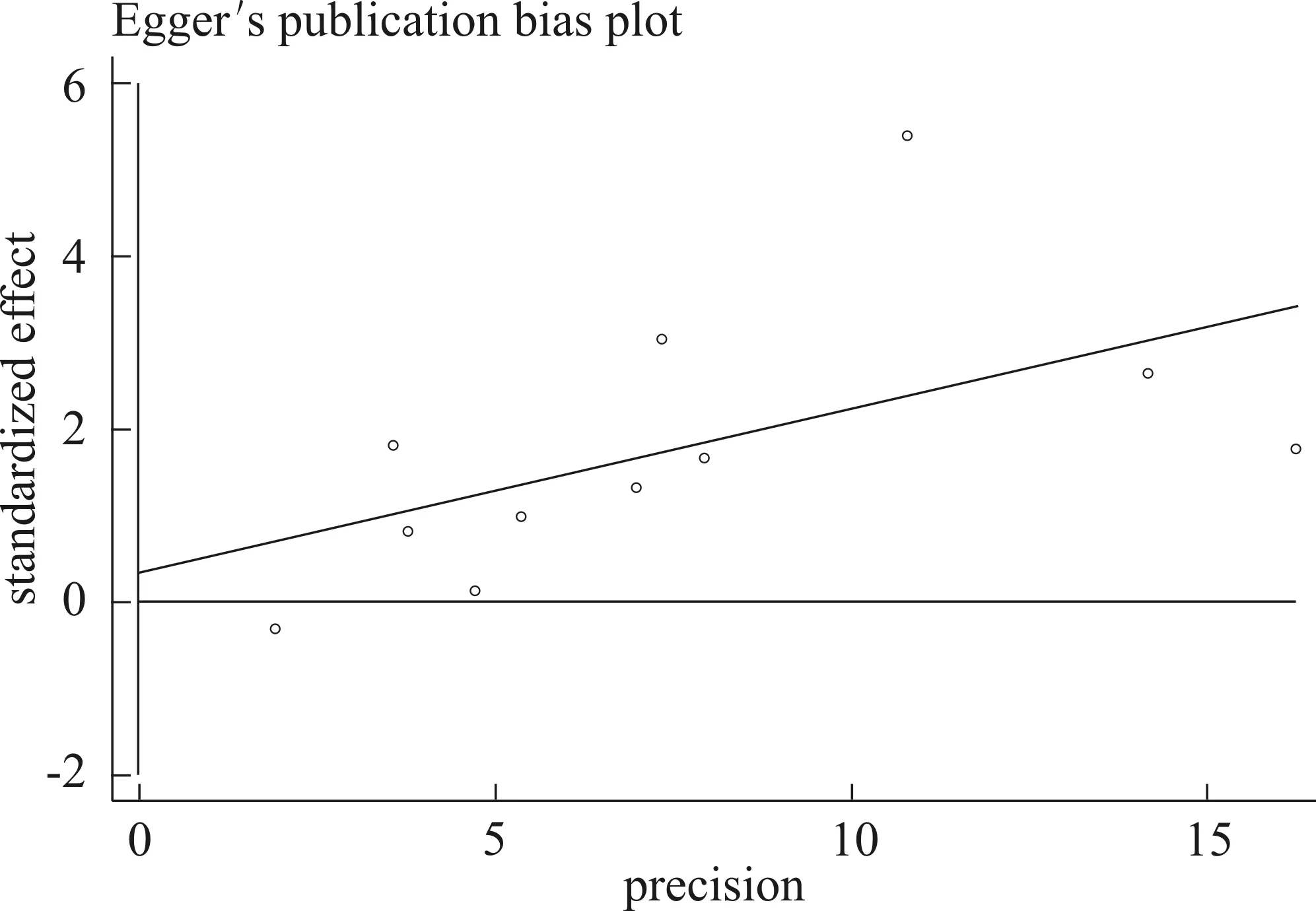
图3 17q24 rs1859962(T>G)基因多态性与前列腺癌易感性的漏斗图(GG+TGvs.TT)
Fig 3 Eegg′s funnel plot with the publication bias for the rs1859962 T>G polymorphism (GG+TGvs.TT)
表3 发表性偏移检验结果
Tab 3 The result of publication bias for the 17q24 rs1859962 T>G polymorphism

变 量t值P值GGvs.TT0.330.75TGvs.TT0.560.59GGvs.(TG+TT)0.010.99(TG+GG)vs.TT0.390.71
3 讨 论
前列腺癌是一种多基因遗传相关联的复杂疾病[16],近年来多个GWAS研究[5,8-14]表明SNPrs1859962与前列腺癌关系密切。SNPrs1859962属于定位于全长约600kb的17号染色体长臂2区4带非编码致病基因,并且其生物学表达机制尚未明了,曾被认为是“基因沙漠区”[5]。在17q24.3~25.1位置上存在SOX基因家族中研究最为详细的SOX9,该基因在前列腺癌中接受Wnt/beta-catenin通路的调控,与癌细胞的侵袭生长相关[17-18]。2012年Zhang等[19]研究表明,前列腺癌细胞株中的肿瘤细胞发生变异和分化是染色体17q24内多个SNP与SOX9基因过表达共同作用的结果。目前国内外学者对rs1859962的研究结论尚不一致,甚至相反。本研究共纳入了符合标准的8篇文献[5,8-14],分析后发现SNPrs1859962在4种遗传模型中(GGvs.TT、TGvs.TT、GGvs.TG+TT、TG+GGvs.TT)的G等位基因与GG基因型是前列腺癌易感性的危险因素,可能是由于该位点密码子T→G的转换影响了正常前列腺细胞的生物学功能表达,导致前列腺癌发病风险的增加。
由于种族之间存在个体差异,可致等位基因频率分布不一致,因此本研究在不同人种之间进行了分析,其中在共显性模型(TGvs.TT)分析结果提示与种族差异无关,可能是因为G等位基因在该模型中频率较低所致;而在隐性模型(GGvs.TG+TT)分析结果提示,rs1859962增加欧洲人种和亚洲人种的前列腺癌患病风险,未发现与美洲人相关,可能是由于美洲人组样本量较小,因此,该结果需要更大样本量研究加以证实;另外两种基因模型(GGvs.TT,TG+GGvs.TT)分析结果均提示,rs1859962增加不同人种的前列腺癌发病风险。考虑到对照人群来源不同可能会给研究结果带来偏倚,研究还基于不同对照人群来源进行了分层分析,结果表明,作为对照的前列腺癌患者无论是医院来源的还是社区来源的,均提示SNP rs1859962能提升前列腺癌的发病风险。
本研究的局限性:(1)纳入研究均来源于已发表的文献,缺乏未发表的文献;(2)本研究探讨异质性来源时仅对种族和对照人群的来源进行了亚组分析,而未对基因检测方法等其他影响因素进行分析;(3)本研究所纳文献数量少、整体质量不高,对结果的证据等级造成一定影响;(4)meta分析仅涉及单一基因因素,未对多种因素如基因与基因、环境与基因等交互作用分析。
综上所述,本研究结果初步提示,17q24 rs1859962与前列腺癌的发病风险相关,未来需开展更多大样本、高质量的研究以进一步阐明其在前列腺癌发病机制中的作用。
[1] SIEGEL R L,MILLER K D,JEMAL A.Cancer statistics,2016[J].CA J Clin,2016,66(1):7-30.
[2] GRONBERG H.Prostate cancer epidemiology [J].Lancet,2003,361(9360):859-864.
[3] HUNTER D J,KRAFT P.Drinking from the fire hose--statistical issues in genomewide association studies [J].N Engl J Med,2007,357(5):436-439.
[4] ISHAK M B,GIRI V N.A systematic review of replication studies of prostate cancer susceptibility genetic variants in high-risk men originally identified from genomewide association studies [J].CA Epid Bio Prev,2011,20(8):1599-1610.
[5] GUDMUNDSSON J,SULEM P,STEINTHORSDOTTIR V,et al.Two variants on chromosome 17confer prostate cancer risk,and the one in TCF2 protects against type 2 diabetes [J].Nat Genet,2007,39(8):977-983.
[6] ZHENG S L,SUN J,WIKLUND F,et al.Cumulative association of five genetic variants with prostate cancer [J].N Engl J Med,2008,358(9):910-919.
[7] 李星慧,张政,张毓洪,等.EEFSEC 基因、染色体 17q24和染色体11q13.2基因变异与前列腺癌的关联研究[J].中国老年保健医学,2015,13(1):5-9.
[8] MAO W G,HE H Q,XU Y,et al.Powerful haplotype-based Hardy-Weinberg equilibrium tests for tightly linked loci [J].PLoS One,2013,8(10):e77399.
[9] LITTLE J,HIGGINS J P,IOANNIDIS J P,et al.STrengthening the REporting of Genetic Association studies (STREGA)-an extension of the STROBE statement[J].Eur J Clin Invest,2009,39(4):247-266.
[10] CHAN J Y,LI H,SINGH O,et al.8q24 and 17q prostate cancer susceptibility loci in a multiethnic Asian cohort[J].Urol Oncol,2013,31(8):1553-1560.
[11] LIU M,SUZUKI M,ARAI T,et al.A replication study examining three common single-nucleotide polymorphisms and the risk of prostate cancer in a Japanese population[J].Prostate,2011,71(10):1023-1032.
[12] ROJAS P A,TORRES E V,CERDA I J,et al.Association of a single-nucleotide polymorphism from chromosome 17q12 with the aggressiveness of prostate cancer in a Hispanic population [J].J Cancer Res Clin Oncol,2014,140(5):783-788.
[13] ZHANG Y R,XU Y,YANG K,et al.Association of six susceptibility Loci with prostate cancer in northern chinese men [J].Asian Pac J Cancer Prev,2012,13(12):6273-6276.
[14] ZHOU C H,WANG J Y,CAO S Y,et al.Association between single nucleotide polymorphisms on chromosome 17q and the risk of prostate cancer in a Chinese population[J].Chin J Cancer,2011,30(10):721-730.
[15] EGGER M,DAVEY S G,SCHNEIDER M,et al.Bias in meta-analysis detected by a simple,graphical test [J].BMJ,1997,315(7109):629-634.
[16] BETHESDA.Genetics of Prostate Cancer [PDQ(R)]:Health Professional Version [M].PDQ Cancer Information Summaries.USA:National Cancer Institute,2002.
[17] WANG H,LEAV I,IBARAG I S,et al.SOX9 is expressed in human fetal prostate epithelium and enhances prostate cancer invasion [J].Cancer Res,2008,68(6):1625-1630.
[18] WANG H,MCKNIGHT N C,ZHANG T,et al.SOX9 is expressed in normal prostate basal cells and regulates androgen receptor expression in prostate cancer cells [J].Cancer Res,2007,67(2):528-536.
[19] ZHANG X,COWPER S R,BAILEY S D,et al.Integrative functional genomics identifies an enhancer looping to the SOX9 gene disrupted by the 17q24.3 prostate cancer risk locus [J].Genome Res,2012,22(8):1437-1446.
A meta-analysis of the association between the 17q24 rs1859962 polymorphism and risk of prostate cancer
HUANG Chui-guo,ZHAO Xing-hua,XU Chang-bao,Wang Ruo-fan,LI Wu-xue,WEI Lei,CUI Zhe
(DepartmentofUrology,theSecondAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450014,China)
Objective:To systematic evaluate the relationship between 17q24 rs1859962 polymorphism and the risk of prostate cancer.Methods: PubMed,Embase,CNKI VIP,CBM and Wan Fang database were researched to collect case-control studies of the relationship between rs1859962 polymorphism and risk of prostate cancer.And the date based on inclusion and exclusion criteria was independently screened and extracted by two reviewers.The quality of included articles was evaluated according to recommendation of STREGA,and meta-analysis was performed by Revman 5.3 and stata 12.0 software.Results: Eight case-control studies were included in the final meta-analysis(cases:7863,controls:17122).Overall,a significantly increased risk of prostate cancer was observed in the rs1859962 polymorphism.In the subgroup analysis by ethnicity,significantly increased risks were found among Caucasians,Americans,and Asians.Conclusion:17q24 rs1859962 (T>G) polymorphism may be associated with the risk of prostate cancer.This findings need additional and high-quality studies to validate in the future.
prostate cancer;17q24 rs1859962;polymorphism;meta-analysis
2016-06-13
2016-09-02
河南省教育厅科技攻关项目(162102310535)
黄垂国(1991-),男,海南海口人,在读硕士研究生。E-mail:Huangcg0727@163.com
赵兴华 E-mail:xhzhao2006@163.com
黄垂国,赵兴华,许长宝,等.17号染色体rs1859962单核苷酸多态性与前列腺癌易感性的meta分析[J].东南大学学报:医学版,2017,36(1):24-30.
R697.3
A
671-6264(2017)01-0024-07
10.3969/j.issn.1671-6264.2017.01.007
