埃索美拉唑和替普瑞酮对功能性消化不良影响的对比研究
2017-06-05赵卫东钟晓琴庄新英纪红梅李安庆李鑫鑫王瑞才朱建友李延青
赵卫东, 钟晓琴, 庄新英, 纪红梅, 李安庆, 李鑫鑫, 王瑞才, 朱建友, 李延青
滨州医学院附属临淄区人民医院 1.消化内科; 2.病理科,山东 临淄 255400; 3.山东大学齐鲁医院消化内科
埃索美拉唑和替普瑞酮对功能性消化不良影响的对比研究
赵卫东1, 钟晓琴1, 庄新英1, 纪红梅1, 李安庆1, 李鑫鑫1, 王瑞才2, 朱建友2, 李延青3
滨州医学院附属临淄区人民医院 1.消化内科; 2.病理科,山东 临淄 255400; 3.山东大学齐鲁医院消化内科
目的 探讨埃索美拉唑和替普瑞酮对H.pylori阴性功能性消化不良(functional dyspepsia, FD)患者症状评分及胃肠道嗜酸粒细胞的影响。方法 基线时对FD患者进行腹部症状问卷调查、胃镜检查、病理学检查、H.pylori检测。对H.pylori阴性者行埃索美拉唑或替普瑞酮治疗。第2周和第6周分别行腹部症状问卷调查,部分患者第6周末复查胃镜检查及病理学检查。结果 第2周末时埃索美拉唑组和替普瑞酮组的症状均较基线时明显改善。第6周末时埃索美拉唑组症状评分较基线时也明显改善,但替普瑞酮组未见显著改变。第6周末时埃索美拉唑组较替普瑞酮组的症状显著减轻。治疗前后埃索美拉唑组与替普瑞酮组在胃十二指肠嗜酸性粒细胞计数及集簇率比较差异均无统计学意义(P>0.05)。结论 埃索美拉唑对H.pylori阴性FD患者的治疗效果优于替普瑞酮。埃索美拉唑和替普瑞酮均不影响H.pylori阴性FD患者的胃十二指肠嗜酸性粒细胞计数及集簇率。
功能性消化不良;嗜酸性粒细胞;幽门螺杆菌;药物疗法
功能性消化不良( functional dyspepsia, FD)从病理生理机制上来讲很可能是一种异质性疾病[1]。Lee等[2]概述了十二指肠的病理生理异常与FD的关系,认为FD的发生与十二指肠对酸、脂质的异常反应及十二指肠的免疫激活有关。十二指肠嗜酸性粒细胞的激活及脱颗粒可能是FD的重要发病机制,这些强效的效应细胞可能会成为这些相关疾病有价值的治疗靶点[3]。质子泵抑制剂、促动力药、根除H.pylori及抗抑郁药是治疗FD的常用选择[4],但对FD的治疗一直以来都颇具挑战性,好转率常常不到60%[5]。
1 资料与方法
1.1 一般资料 收集2011年3月-2012年8月在滨州医学院附属临淄区人民医院门诊就诊的FD患者共215例,男77例,女138例,年龄(54.2±12.8)岁(18~70岁)。纳入标准:所有FD患者均符合功能性胃肠疾病罗马Ⅲ诊断标准[6],均无手术史及过敏性疾病史,入组前4周未应用抗酸剂、制酸剂、促胃肠动力药、非甾体类抗炎药,肝功、肾功、血糖、电解质化验及腹部B超、胃镜检查均无代谢性和器质性疾病。H.pylori阴性患者入组,阳性者行其他治疗。
1.2 研究方法
1.2.1 腹部症状问卷调查:自评问卷调查通过面谈或电话随访在基线时、第2周末及第6周末3个时间点进行。问卷内容包括上腹痛、烧心、餐后饱胀、早饱、恶心、呕吐、干呕、嗳气、厌食、腹胀、上腹不适、腹鸣、咽下困难及胸骨后痛,症状评分统计前4项(上腹痛、烧心、餐后饱胀和早饱)。评分标准采用5-point Likert量表[7]:0分:无腹部不适症状;1分:轻度,需注意腹部才能感觉到有症状;2分:中度,有症状,但不影响日常工作、生活;3分:重度,症状明显,影响工作、生活;4分:极重度,症状严重,不能正常工作,严重影响日常生活。
1.2.2 胃镜检查:由2名高年资内镜医师进行。胃体(胃小弯和胃大弯中部)、胃窦(胃小弯和胃大弯)、十二指肠球部和十二指肠降部各取活检2块。活检组织即刻放入10%中性甲酫液中。
1.2.3 病理组织学检查[8]:常规组织学处理、切片,行HE染色和Warthin-Starry染色。光学显微镜下观察有无急慢性炎症及严重程度,有无恶性肿瘤。胃体、胃窦、十二指肠球部、十二指肠降部的嗜酸性粒细胞分别计数。高倍镜下(400×)随机选取互不重叠的5个视野,分别计数每个视野的嗜酸性粒细胞数并记录。1个高倍视野中嗜酸性粒细胞计数≥10定义为嗜酸粒细胞集簇阳性。黏膜表面或腺凹见典型集簇状或弥漫分布的杆状或球状幽门螺杆菌定义为H.pylori阳性。
1.2.414C呼气试验:14C尿素胶囊与H.pylori检测仪呼气卡配套使用,生产厂家为安徽养和医疗器械设备有限公司(安徽桐城),产品注册号:皖食药监械(准)。
1.2.5 试验设计和分组:胃窦黏膜组织Warthin-Starry染色及14C呼气试验双阴性定义为H.pylori阴性,符合上述标准的FD患者纳入本研究。入组FD患者随机数字表法分为埃索美拉唑组和替普瑞酮组(n=215)。分别给予埃索美拉唑镁肠溶片(阿斯利康制药有限公司)20 mg,2次/d;或替普瑞酮胶囊(卫材(中国)药业有限公司)50 mg,3次/d。两组疗程均为14 d。
2 结果
2.1 一般情况 符合FD诊断标准的患者共215例,其中Warthin-Starry 染色和14C呼气试验双阳性者90例,双阴性者77例,Warthin-Starry 染色阳性而14C呼气试验阴性者19例,Warthin-Starry 染色阴性而14C呼气试验阳性者17例,失访12例,由于难以忍受腹泻或胃部不适而中途退出者5例(替普瑞酮组3例,埃索美拉唑组2例)。在第2周末埃索美拉唑组和替普瑞酮组完成试验者分别为36例、36例,两组于第6周末复查胃镜并取黏膜活检者分别为18例、16例。
2.2 病理检查结果 入组FD患者基线时对胃体、胃窦、十二指肠球部及降部活检标本均行HE染色,胃窦标本行Warthin-Starry 染色。第6周复查时胃镜所取活检标本均行HE染色。所检标本HE染色均显示正常的形态学表现或轻度慢性炎症改变,未见活动性十二指肠炎、肠道寄生虫或癌症组织学表现。HE染色标本可见嗜酸性胞浆包绕双叶形细胞核的典型嗜酸性粒细胞形态学表现,在黏膜固有层中可见围绕腺体的嗜酸性粒细胞集簇现象(见图1)。所检胃窦标本Warthin-Starry染色显示H.pylori被染成黑色杆状或球状,集簇状或弥漫分布于黏膜表明或腺凹处,背景为金色或浅棕色,细胞浆为浅黄色,细胞核呈黑褐色,未见典型H.pylori染色表现则为Warthin-Starry 染色阴性(见图1)。

图1 FD患者胃十二指肠病理检查结果(400×) 十二指肠球部(A)和十二指肠降部(B)黏膜组织(HE染色),显示嗜酸性胞浆包绕双叶形细胞核的典型嗜酸性粒细胞表现;十二指肠球部(C)和十二指肠降部(D)黏膜组织学(HE染色),黏膜固有层中可见围绕腺体的嗜酸性粒细胞集簇现象;胃窦(H.pylori阳性)(E)和胃窦(H.pylori阴性)(F)黏膜组织(Warthin-Starry染色),显示背景为金色或浅棕色,阳性者H.pylori被染成黑色杆状或球状,集簇状或弥漫分布于黏膜表明或腺凹处
Fig 1 Pothological results of gastric biopsy specimens from patients with FD (400×) Duodenal bulb (A) and duodenal descending part (B) mucosal histology (HE staining), showed typical eosinophil morphology with a bi-lobed nucleus and eosinophilic cytoplasm; duodenal bulb (C) and duodenal descending part (D) mucosal histology (HE staining), showed clusters of eosinophils in the lamina propria adjacent to glands; gastric antrum (H.pyloripositive) (E) and gastric antrum (H.pylorinegative) (F) mucosal histology (Warthin-Starry staining), showedH.pyloristained black while the background was light golden
2.3 药物治疗与症状评分 基线时埃索美拉唑组与替普瑞酮组的症状评分比较,差异无统计学意义(P>0.05),但第6周末时前者较后者症状显著减轻(见表1~2)。第2周末时埃索美拉唑组和替普瑞酮组的症状评分均较基线时明显改善(见表2)。埃索美拉唑组在第6周末时症状评分较基线时也明显改善,但替普瑞酮组未见显著改变(见表2)。
2.4 药物治疗对胃十二指肠嗜酸性粒细胞的影响
2.4.1 埃索美拉唑和替普瑞酮对嗜酸性粒细胞计数的影响:基线及第6周时埃索美拉唑与替普瑞酮两组胃十二指肠嗜酸性粒细胞计数差异均无统计学意义(P>0.05)(见表1、图2)。埃索美拉唑组及替普瑞酮组基线和第6周嗜酸性粒细胞计数比较,差异无统计学意义(P>0.05)(见表3)。
2.4.2 埃索美拉唑和替普瑞酮对嗜酸性粒细胞集簇的影响:基线及第6周时埃索美拉唑与替普瑞酮两组胃十二指肠嗜酸性粒细胞集簇率差异无统计学意义(P>0.05)(见表1、图2)。埃索美拉唑组基线时和第6周嗜酸性粒细胞集簇率与替普瑞酮比较,差异无统计学意义(P>0.05)(见表3)。
表1 埃索美拉唑组与替普瑞酮组在基线时症状评分、嗜酸性粒细胞计数及嗜酸性粒细胞集簇率比较
Tab 1 Symptom scores, eosinophil counts and clustering rate of the esomeprazole group and teprenone group at baseline

例数症状评分(x±s)嗜酸性粒细胞计数(x±s)胃体胃窦十二指肠球部十二指肠降部嗜酸性粒细胞集簇率(%)胃体胃窦十二指肠球部十二指肠降部埃索美拉唑组364.92±1.577.78±7.667.61±5.0030.83±12.5631.47±14.2119.4433.3350.0063.89替普瑞酮组364.53±1.879.56±5.6212.14±4.0736.56±24.0531.11±17.8922.2227.7855.5658.33P值0.340.800.070.110.900.770.610.640.63
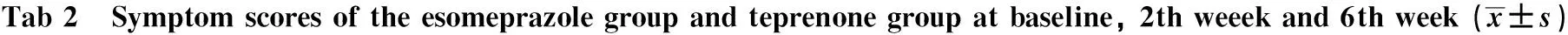

组别例数基线第2周第6周埃索美拉唑组364.92±1.571.33±0.57☆0.67±0.62☆替普瑞酮组364.53±1.871.67±1.15☆3.67±3.21P值0.340.120.00
注:与本组基线时比较, ☆P<0.05。
3 讨论
研究发现,十二指肠对酸的高敏感性、十二指肠酸暴露增加、十二指肠对脂质或缩胆囊素(CCK)的异常反应及十二指肠免疫激活等多种病理生理机制与FD的发生有关[2]。Samsom等[9]发现部分FD患者中对十二指肠进行酸灌注会引起恶心,而健康对照组没有类似的表现,提示FD患者存在十二指肠对酸的高敏感性。另有研究发现FD患者存在自发的十二指肠酸暴露增加,酸暴露增加者较正常酸暴露者消化不良症状更加严重[10]。部分FD患者十二指肠酸暴露增加的机制可能与十二指肠酸中、受损和十二指肠酸清除减少有关,但目前缺乏FD患者十二指肠酸中和的相关研究。
十二指肠酸暴露增加导致消化不良症状的机制还有待进一步阐明。H+能刺激十二指肠传入神经上的辣椒素受体等酸感受器,继而释放降钙素基因相关肽和一氧化氮。因此,酸能够直接刺激源自十二指肠的化学敏感性传入通道。如果化学刺激能够在外周或脊髓水平诱导感受性增强,那么由酸导致的十二指肠传入刺激就可能强化由脊髓感受性增强所诱导的胃的机械敏感性[11]。通过恒压器研究发现,对健康志愿者十二指肠内灌注盐水或酸时进行比较,灌注酸时胃的机械敏感性增强[12]。
十二指肠内酸灌注诱发肠胃反射,抑制胃窦蠕动波,激发幽门压力波,从而延迟胃排空[13]。另一方面,十二指肠pH影响移形复合运动,并且碱性pH对于消化Ⅲ期的出现是必要的[14]。十二指肠内酸性化时间延长会抑制消化Ⅲ期的出现。近来有研究发现,对健康志愿者进行十二指肠酸灌注并不影响消化Ⅲ期的出现和时程,但是会诱发胃窦动力低下。上述研究表明,十二指肠酸化诱发或加重消化不良症状是通过对胃运动功能的影响而产生。
表3 埃索美拉唑组与替普瑞酮组在基线时和第6周症状评分、嗜酸性粒细胞计数及嗜酸性粒细胞集簇率比较
Tab 3 Comparison of symptom scores, eosinophil counts and clustering rate of the esomeprazole group and teprenone group at baseline and 6th week

例数嗜酸性粒细胞计数(x±s)胃体胃窦十二指肠球部十二指肠降部嗜酸性粒细胞集簇率(%)胃体胃窦十二指肠球部十二指肠降部埃索美拉唑组 基线时367.78±7.667.61±5.0030.83±12.5631.47±14.2119.4433.3350.0063.89 第6周188.50±2.8910.5±5.2039.00±19.6333.00±8.0422.2227.7750.0055.56 P值0.700.0530.070.670.810.681.000.13替普瑞酮组 基线时369.56±5.6212.14±4.0735.56±24.0531.11±17.8922.2227.7855.5658.33 第6周1811.69±7.6318.00±19.6437.81±10.7431.50±8.6025.0031.2550.0056.25 P值0.270.090.720.990.830.800.710.89

图2 埃索美拉唑组与替普瑞酮组第6周时嗜酸粒细胞计数及集簇率比较 A:嗜酸性粒细胞集簇率;B:嗜酸性粒细胞计数
Fig 2 Comparison of eosinophil counts and clustering rate of the esomeprazole group and teprenone group at 6th week A: eosinophil counts; B: clustering rate
近年研究发现嗜酸性粒细胞增多可能与FD的发病机制有关。嗜酸粒细胞是胃肠道强有力的固有免疫细胞,它们参与宿主针对外来病原体的免疫,同时有助于维持肠上皮细胞的动态平衡[15]。嗜酸性粒细胞是超敏反应的关键细胞,十二指肠免疫激活是FD的重要发病机制之一。肥大细胞促使嗜酸粒细胞迁移,而嗜酸粒细胞激活肥大细胞。活化的肥大细胞释放组胺、纤维蛋白溶酶原和前列腺素D2,肥大细胞和嗜酸性粒细胞脱颗粒引起神经受刺激、平滑肌收缩,其中,嗜酸性粒细胞为效应细胞,能释放颗粒,而细胞因子的释放和抗原表达起到免疫调节作用。在动物模型中发现嗜酸性粒细胞引起胃肠动力障碍和胃舒张受损,这些将导致腹痛、腹胀等胃肠道症状,嗜酸性粒细胞在人类胃肠道疾病中的相关作用值得进一步研究[2]。
目前FD的治疗主要是对症治疗,且大多数效果不佳[16]。质子泵抑制剂抑酸疗效优于安慰剂,促动力药治疗FD可能主要影响与进食相关的症状,而根除H.pylori对少数FD患者有益,抗抑郁药治疗可能对难治性FD有益[4]。Talley研究中展望白三烯受体拮抗剂、IL-5抗体、组胺1和2拮抗剂等可能通过抑制嗜酸性粒细胞或嗜酸性粒细胞衍生的物质,抑制十二指肠的免疫激活,从而对改善症状有益[3]。理论上讲类固醇激素具有免疫抑制作用,但目前研究认为类固醇激素对感染后肠易激综合征(PI-IBS)无效,尚未见应用类固醇激素治疗FD的报道[17]。
在我们的研究中随机选取H.pylori阴性FD患者应用埃索美拉唑治疗,发现该药能明显缓解FD的消化不良症状,2周治疗结束后随访4周,患者消化不良症状较基线时及第2周末仍明显好转。推测埃索美拉唑对FD的治疗作用可能是通过强大的抑酸作用减少胃酸分泌,从而减少十二指肠酸暴露,相应地缓解机体对胃扩张的敏感性,促进胃排空,减少胃潴留。但停药后该组患者消化不良症状仍能持续缓解的机制不明,是否与质子泵抑制剂治疗后十二指肠对酸刺激的敏感性下降有关尚需进一步阐明。
替普瑞酮治疗胃炎、胃溃疡的药理作用包括抗溃疡作用、胃黏液分泌增加、增加胃黏膜血流、保护胃黏膜、诱导热休克蛋白(HSP)产生的细胞保护作用等。HSP能显著提高机体对有害物质的抵抗能力,替普瑞酮能诱导HSP70的产生[18]。HSP具有很强的细胞保护作用,作为胃黏膜保护剂在临床上已有应用。动物实验发现替普瑞酮诱导脑、心、肺、肝、肾及小肠等这些脏器中HSP的产生,从而保护这些脏器[19]。一项前瞻、随机、双盲对照的交叉研究发现,替普瑞酮可减轻双氯芬酸所致的健康志愿者胃黏膜和小肠黏膜损伤[20]。目前关于替普瑞酮治疗FD的研究还较少,最新资料表明替普瑞酮只改善胃潴留,约52%的FD患者应用替普瑞酮治疗[21]。
在我们的研究中随机选取H.pylori阴性的FD患者对其应用替普瑞酮进行治疗2周,第2周末患者消化不良症状较基线时有所改善,但在6周末时患者症状评分与基线时相比,差异无统计学意义。替普瑞酮改善FD患者临床症状的机制尚不明确,可能与其诱导HSP产生、增加胃黏膜血流量及促进胃黏液分泌的药理作用有关,这些因素可能降低了胃十二指肠对酸、脂质等刺激的敏感性,从而改善了消化不良症状。但替普瑞酮对FD的治疗效果又是有限的和暂时的,或许它可能只是作为安慰剂而起作用。相比而言,埃索美拉唑对FD的治疗作用优于替普瑞酮。
本研究探讨了埃索美拉唑和替普瑞酮对FD患者胃十二指肠嗜酸性粒细胞计数、嗜酸性粒细胞集簇现象的影响,及嗜酸粒细胞计数变化与患者症状评分变化的关系。结果发现埃索美拉唑或替普瑞酮治疗后FD患者的症状有不同程度的改善,但同时未见十二指肠嗜酸性粒细胞数量及集簇现象出现相应的变化。上述结果表明,埃索美拉唑和替普瑞酮对FD的治疗作用并非通过影响十二指肠嗜酸性粒细胞水平途径而起作用。本研究还不够深入,未涉及两种药物对嗜酸性粒细胞免疫激活的研究,如嗜酸性粒细胞脱颗粒及细胞因子水平的变化。同时随访时间相对较短,且未对FD亚型进一步分组,需要将来进一步深入探讨。
[1]Fischler B, Tack J, De Gucht V, et al. Heterogeneity of symptom oatern,psychsocial factors,and pathophysiologizal mechanisms in severe functional dyspepsia [J]. Gastrornterology, 2003, 124(4): 903-910.
[2]Lee KJ, Tack J. Duodenal implications in the pathophysiology of functional dyspepsia [J]. Neurogastroenterol Motil, 2010, 16(3): 251-257.
[3]Talley NJ, Walker MM, Aro P, et al. Non-ulcer dyspepsia and duodenal eosinophilia. An adult endoscopic population-based case-control study [J]. Clin Gastroenterol Hepatol, 2007, 5(10): 1175-1183.
[4]McNally MA, Talley NJ. Current treatments in functional dyspepsia [J]. Curr Treat Options Gastroenterol, 2007, 10(2): 157-168.
[5]Mönkemüller K, Malfertheiner P. Drug treatment of functional dyspepsia [J]. World J Gastroenterol, 2006, 12(1): 2694-2700.
[6]柯美云, 方秀才. 罗马Ⅲ:功能性胃肠病[M]. 北京: 科学出版社, 2008: 378. Ke MY, Fang XC. Rome Ⅲ: the Functional Gastrointestinal Disorders [J]. Beijing: Science Press, 2008: 378.
[7]Veldhuyzen van Zanten SJ, Tytgat KM, Pollak PT, et al.Can severity of symptoms be used as outcome measures in trials of non-ulcer dyspepsia and Helicobacter pylori? [J]. J Clin Epidemiol, 1993, 46(3): 273-279.
[8]Talley NJ, Walker MM, Aro P, et al. Non-ulcer dyspepsia and duodenal eosinophilia: an adult endoscopic population-based case-control study [J]. Clin Gastroenterol Hepatol, 2007, 5(10): 1175-1183.
[9]Samsom M, Verhagen MA, vanBerge Henegouwen GP, et al. Abnormal clearance of exogenous acid and increased acid sensitivity of the proximal duodenum in dyspeptic patients [J]. Gastroenterology, 1999, 116(3): 515-520.
[10]Lee KJ, Demarchi B, Demedts I, et al. A pilot study on duodenal acid exposure and its relationship to symptoms in functional dyspepsia with prominent nausea [J]. Am J Gastroenterol, 2004, 99(9):1765-1773.
[11]Mayer EA, Gebhart GF. Basic and clinical aspects of visceral hyperalgesia [J].Gastroenterology, 1994, 107(1): 271-293.
[12]Lee KJ, Vos R, Janssens J, et al. Influence of duodenal acidification on the sensorimotor function of the proximal stomach in humans [J]. Am J Physiol Gastrointest Liver Physiol, 2004, 286(2): 278-284.
[13]Schwarz MP, Samsom M, Smout AJ. Chemospecific alterations in duodenal perception and motor response in functional dyspepsia [J]. Am J Gastroenterol, 2001, 9(6): 2596-2602.
[14]Woodtli W, Owyang C. Duodenal pH governs interdigestive motility in humans [J].Am J Physiol, 1995, 26(8): 146-152.
[15]Jawairia M, Shahzad G, Mustacchia P. Eosinophilic gastrointestinal diseases: review and update [J].ISRN Gastroenterol,2012,46(3):68-69.
[16]Talley N, Vakil NB, Moayyedi P. American Gastroenterological Association technical review on the evaluationof dyspepsia [J].Gastroenterology, 2005, 12(9): 1756-1780.
[17]Dunlop SP, Jenkins D, Neal KR, et al. Randomized,double-blind, placebo-controlled trial of prednisolone in post-infectious irritable bowel syndrome [J]. Aliment Pharmacol Ther, 2003, 18(1): 77-84.
[18]Asano T, Tanaka K, Yamakawa N, et al. HSP70 confers protection against indomethacin-induced lesions of the small intestine [J].Pharmacol Exp Ther, 2009, 330(2): 458-467.
[19]Yokota A, Ohno R, Takahira Y, et al. Protective effect of teprenone against indomethacin-induced small intestinal lesions in rats [J]. Jpn Pharmacol Ther, 2005, 33(1): 51-61.
[20]Niwa Y, Nakamura M, Miyahara R, et al. Geranylgeranylacetone protects against diclofenac-induced gastric and small intestinal mucosal injuries in healthy subjects: a prospective randomized placebo-controlled double-blind cross-over study [J].Digestion, 2009, 80(4): 260-266.
[21]Hongo M, Harasawa S, Mine T, et al. Large-scale randomized clinical study on functional dyspepsia treatment with mosapride or teprenone: Japan Mosapride Mega-Study (JMMS) [J]. J Gastroenterol Hepatol, 2012, 27(1): 62-68.
(责任编辑:陈香宇)
Comparison of esomeprazole and teprenone on patients with functional dyspepsia
ZHAO Weidong1, ZHONG Xiaoqin1, ZHUANG Xinying1, JI Hongmei1, LI Anqing1, LI Xinxin1, WANG Ruicai2, ZHU Jianyou2, LI Yanqing3
1.Department of Gastroenterology; 2.Department of Pathology, People’s Hospital of Linzi District, Linzi 255400; 3.Department of Gastroenterology, Qilu Hospital Affiliated to Shandong University, China
Objective To investigate the influence of esomeprazole and teprenone on symptom scores and gastrointestinal eosinophils ofH.pylori(-) functional dyspepsia (FD). Methods Abdlominal symptoms questionnaire, gastroscopy, histologic examination andH.pyloridetection were made according to baseline information.H.pylori-negative patients were enrolled in this study and randomly divided into two groups, treated with esomeprazole or teprenone seperately. The self-administered abdominal symptom questionnaire was used at 2nd week and 6th week, and part of the patients underwent gastroscopy and pathology again at the end of 6th week. Results The symptom scores of both groups were all significantly different between 2nd week and baseline. The symptom scores of esomeprazole group were significantly different between 6th week and baseline, but those of teprenone group were not. The symptom scores were significantly different between esomeprazole group and teprenone group at 6th week. The eosinophil counts of duodenums and clustering rate in the esomeprazole group and teprenone group were all not statistically different before and after treatment.Conclusion The effect of esomeprazole is better than that of teprenone onH.pylori-negative FD patients. Neither esomeprazole nor teprenone show effect on the eosinophils level of stomach and duodenum inH.pylori-negative patients with FD.
Functional dyspepsia; Eosinophils; Helicobactor pylori; Drug therapy
10.3969/j.issn.1006-5709.2017.05.011
赵卫东,副主任医师,博士研究生,研究方向:功能性胃肠病。E-mail: zhaoweidong1580@163.com
R57
A
1006-5709(2017)05-0521-05
2017-01-23
