替普瑞酮对胃上皮细胞增殖、迁移及凋亡的影响*
2015-03-05袁伟建李新华
刘 浪,刘 丹,袁伟建,李新华,许 明
(中南大学湘雅医院消化内科,湖南长沙410008)
替普瑞酮又名二牛龙牛儿基丙酮,是众所周知的胃黏膜保护剂,能够促进损伤胃黏膜的再生修复[1]。人们发现替普瑞酮的黏膜保护作用最初是由于它能促进消化性溃疡的愈合,而消化性溃疡的愈合是一个非常复杂的过程,包括胃上皮细胞增殖和迁移,腺体重建,肉芽组织形成,新生血管形成等,其中胃上皮细胞增殖和迁移覆盖损伤面是关键环节之一[2],而胃黏膜上皮细胞凋亡减少,使胃黏膜对损伤因子的抵抗能力增强,损伤不再进一步加重。为此,本研究以人正常胃上皮细胞为对象,着重探讨替普瑞酮对胃上皮细胞增殖、迁移及凋亡的直接影响。
1 材料与方法
1.1 实验材料 人胃黏膜上皮细胞系GES-1培养于中南大学湘雅医院医学研究中心;替普瑞酮粉剂(日本卫材公司)用无水乙醇溶解后,无血清RPMI1640稀释配成5 000μmol/L 的母液,并且使乙醇的最终浓度为0.01%;Transwell试剂盒(美国Corning 公 司);Annexin V/APC凋亡检测试剂盒(美国Ebioscience公司)。
1.2 方法
1.2.1 细胞培养 GES-1细胞培养于RPMI1640培养液(含10%胎牛血清,100μmol/mL青霉素,100μg/mL链霉素,pH 7.4),置37 ℃,5%CO2的培养箱中培养。
1.2.2 MTT 检测细胞增殖活性 将处于对数生长期的人胃黏膜上皮细胞以每孔4×103接种至96孔培养板中,每孔180 μL,培养24h贴壁后分别加入不同浓度(0、10、20、40、80、160、320μmol/L)的替普瑞酮。分别连续培养0、24、48、72h和96 h后,加入MTT(5mg/mL)20μL,置于37℃,5%CO2的培养箱中避光培养4h。小心吸出培养液,每孔加入二甲亚砜(DMSO)150μL,室温振荡10min溶解。以490nm 为测定波长,用酶标仪检测OD490值。各时间点实验均重复3次,每组别设3个复孔,结果取平均值。
1.2.3 Transwell迁移实验检测细胞迁移能力 以含乙醇(浓度为0.01%)的RPMI1640 为对照组,将替普瑞酮(80μmol/L)和等体积含乙醇的RPMI1640与对数生长期的GES-1细胞作用24h后,0.25%胰酶消化,用无血清培养基重悬细胞,调整细胞浓度至1×106/mL;取细胞悬液100μL 分别接种到各组Transwell小室中,再往实验组Transwell小室中加入替普瑞酮,对照组加入等体积含乙醇的RPMI1640,调整最终小孔内液体积为200μL(最终替普瑞酮浓度为80μmol/L,乙醇浓度为0.01%);于下室加入600μL含30%胎牛血清的培养液,每组设3个复室,37 ℃5%CO2培养箱孵育24h。同时,每组各设置一孔细胞作为参照:同样吸取100μL 细胞悬液,进行MTT药物处理后染色,检测OD470值(3复孔/组)。取出小室去除培养基和非转移细胞,将小室浸泡在Giesma染液中20min,再将小室冲洗、晾干后显微镜下拍照,然后用10% 醋酸脱色,洗脱液在酶标仪上570nm 测其OD570值,计算并比较两组细胞迁移率,迁移率=Giesma染色后OD570值/接种时OD470值。
1.2.4 细胞划痕实验检测细胞迁移能力 细胞长满单层后,分别用最佳浓度(80μmol/L)的替普瑞酮和乙醇溶剂(浓度0.01%)预处理24h的胃上皮细胞做划痕实验(3复孔/组),用10μL 枪头在中间划一横线,使用无血清培养基轻轻漂洗2次,加入低浓度血清培养基,减少细胞增殖的影响,分别于0、8、24h镜下观察并拍照,并应用NIS-Elements检验软件检测两组细胞迁移的宽度差异,计算各组细胞迁移率,迁移率为拍照时间点迁移距离与“0h”划痕区宽度值的比值。
1.2.5 流式细胞术检测细胞凋亡 以含乙醇(浓度为0.01%)的RPMI1640为对照组,替普瑞酮(浓度80μmol/L)作用对数生长期的胃上皮细胞48h后,0.25%胰酶消化,冷PBS液洗涤2次,1 500r/min离心5min,收集细胞,加入适量染色缓冲液重悬细胞,调整细胞浓度至1×106~1×107/mL,取细胞悬液100μL加入5μL Annexin V-APC 染色液,室温避光15min,再加入PI染色液,轻轻混匀,避光放置10 min后立即用流式细胞仪检测各组细胞凋亡情况(3复孔/组),凋亡率=(早期凋亡细胞数+晚期凋亡细胞数)/细胞总数×100%。
1.3 统计学处理 采用SPSS19.0软件进行数据处理分析,计量资料以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 MTT 实验观察替普瑞酮对胃正常上皮细胞增殖能力的影响 用不同浓度替普瑞酮(0、10、20、40、80、160、320μmol/L)处理胃上皮细胞,连续培养0、24、48、72和96h后分别测定OD490值,采用单因素方差分析法比较药物作用96h后各组细胞间的增殖差异,结果显示10μmol/L替普瑞酮组的胃上皮细胞的增殖能力明显高于0μmol/L组(P<0.05),20μmol/L 组明显高于10μmol/L组(P<0.05),40μmol/L 组明显高于20 μmol/L组(P<0.05),80、160、320μmol/L 组均明显高于40 μmol/L组(P<0.05),而80、160、320μmol/L 组间差异无统计学意义(P>0.05),见图1。结果表明,在0~80μmol/L 范围内,随着替普瑞酮浓度增加,胃正常上皮细胞的增殖能力随之增强;继续加大替普瑞酮浓度,胃正常上皮细胞的增殖无明显变化。由此可见,替普瑞酮明显促进胃正常上皮细胞增殖,同时,选择80μmol/L为最佳药物浓度进行后续的实验。

图1 替普瑞酮对胃正常上皮细胞增殖能力的影响
2.2 Transwell实验和细胞划痕实验观察替普瑞酮对胃正常上皮细胞迁移能力的影响
2.2.1 Transwell实验 替普瑞酮(80μmol/L)处理胃正常上皮细胞24h,Giemsa染色观察转移至Transwell小室膜下侧面的细胞,细胞被染成蓝紫色,染色的程度反应迁移细胞的数量,将膜下侧面的细胞进行OD570检测,利用接种时的参照孔细胞OD470值计算迁移率。加药组细胞的迁移率为3.338±0.293,对照组细胞的迁移率为1.328±0.208,加药组细胞迁移率明显高于对照组(P<0.01)。见图2。

图2 替普瑞酮对胃正常上皮细胞迁移率的影响(×400)
2.2.2 细胞划痕实验 细胞划痕后继续培养加药组(80 μmol/L)和对照组细胞并观察划痕周围细胞向中间空白区迁移情况,分别测量0、8、24h两组细胞划痕区的宽度,以此计算各组细胞的迁移率,替普瑞酮作用8h后,加药组的迁移率为0.54±0.20,对照组为0.38±0.03,两组差异无统计学意义(P>0.05),而替普瑞酮作用24h后,加药组细胞已经完全迁移覆盖划痕区,迁移率为1.00±0.18,对照组迁移率为0.72±0.08,加药组迁移率明显高于对照组(P<0.05)。见图3。

图3 细胞划痕实验检测替普瑞酮对胃正常上皮细胞迁移能力的影响(×100)
2.3 流式细胞术观察替普瑞酮对胃正常上皮细胞凋亡的影响 替普瑞酮(80μmol/L)处理细胞48h后,Annexin-V/PI双染法检测细胞凋亡,如图4所示,凋亡图右下象限(FITC+/PI-)为早期凋亡细胞,右上象限(FITC+/PI+)为晚期凋亡细胞,左下象限(FITC-/PI-)为正常活细胞。加药组与对照组比较,早期凋亡细胞和晚期凋亡细胞明显减少;加药组细胞凋亡率为(11.90±1.53)%,对照组细胞凋亡率为(25.61±0.15)%,加药组细胞凋亡率低于对照组(P<0.01)。
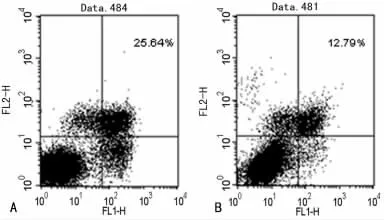
图4 流式细胞术检测替普瑞酮对胃正常上皮细胞凋亡的影响
3 讨 论
替普瑞酮是众所周知的胃黏膜保护剂,在临床广泛用于急慢性胃炎、胃溃疡的治疗,但其胃黏膜保护作用的具体机制尚不明确。既往以动物模型为研究对象,结果表明替普瑞酮不仅能上调前列腺素E2、NO、己糖胺的表达,下调内皮素-1(ET-1)的表达,增强胃黏膜血流和加强黏液碳酸氢盐屏障,还能降低胃黏膜溶酶体酶活性和减轻脂质过氧化,减轻胃黏膜损伤[3-4]。Ishihara等[5]、Watanabe等[6]和Isoir等[7]以 动 物 胃 黏 膜 细 胞为模型进一步从细胞水平,证明了替普瑞酮能够促进胃上皮细胞增殖及迁移,以及Suemasu等[8]和Takano等[9]以鼠和猪等胃黏膜上皮细胞为研究对象,证明了替普瑞酮能够显著降低胃黏膜上皮细胞的凋亡,从而起到促进溃疡愈合、减轻胃黏膜细胞损伤的作用。而以上研究均以动物模型或动物胃黏膜细胞为研究对象,与人胃黏膜细胞存在一定的差异,本研究首次选用人胃黏膜上皮细胞为研究对象并成功证明了替普瑞酮能够促进人正常胃上皮细胞增殖及迁移,抑制人正常胃上皮细胞凋亡,从细胞水平上对替普瑞酮的胃黏膜保护机制进行了初步探讨。
胃上皮细胞系源于人胎儿正常胃黏膜上皮细胞用SV40病毒感染转化而建立,保留了人正常胃黏膜上皮细胞骨架结构,接种于裸鼠6个月无致瘤性,适宜于各种致病因子及药物等对其损伤或保护作用机制的研究[10],已得到广泛应用。例如,有研究通过体外培养胃上皮细胞探讨三叶肽因子、中药制剂等对胃黏膜上皮的保护作用及分子机制[11-12],也有研究以胃上皮为细胞模型探讨氯吡格雷、幽门螺杆菌等对胃黏膜上皮细胞的损伤作用及分子机制[13-14]。与以往动物胃黏膜细胞相比,该细胞系消除了物种之间可能的生物差异性,与人正常胃黏膜上皮细胞机能更为接近,为进一步探讨替普瑞酮对胃黏膜保护的相关信号通路和靶分子机制提供了一个更好的细胞模型。
该研究结果表明,用不同浓度替普瑞酮处理人胃正常上皮细胞后,细胞的增殖能力明显增强,且在一定范围内随着浓度增加,作用越明显,具有一定浓度依赖性;同时,Transwell迁移实验和划痕实验表明加入替普瑞酮后胃正常上皮细胞的迁移能力明显增强,替普瑞酮促进胃上皮细胞增殖和迁移的作用,不仅有利于消化性溃疡的愈合,同时对于改善再生黏膜修复质量也具有重要意义。研究还表明,替普瑞酮有抗肿瘤作用[15]。然而,这一系列的分子机制目前还不清楚。据以往研究,Ishihara等[5]成功证明替普瑞酮通过诱导HSP70的高表达促进溃疡边缘细胞增殖和迁移以及新生血管及组织不断形成,从而加速溃疡的愈合。最新的研究显示mTOR 信号转导通路活化能促进胃上皮细胞的迁移[16]。此外,替普瑞酮还能够激活MAPK 信号通路,MAPK 激活后能活化上皮细胞的增殖,MAPK 途径激活也能下调P53 及Rb基因表达,促进细胞增殖[17]。因此,作者推测替普瑞酮可能通过激活胃上皮细胞内MAPK 信号通道以及HSP70、mTOR 等靶分子参与调节胃上皮细胞的增殖与迁移。
该实验结果同时也发现替普瑞酮能够显著降低人胃黏膜上皮细胞的凋亡,替普瑞酮通过抑制胃上皮细胞凋亡从而减轻胃黏膜损伤。早先的研究发现替普瑞酮能诱导热休克蛋白(HSP)如HSP70、HSP72、HSP90高表达,而HPS是机体内重要的抗凋亡因子[8-9]。随着替普瑞酮能刺激HSP 的表达被证实,替普瑞酮能抑制细胞凋亡的研究越来越受到人们的关注,人们相继证明了替普瑞酮通过激活HSP的表达,对阿尔茨海默病、心肌纤维化及药物相关性肝肾损害等诸多疾病具有明显的抗细胞凋亡作用[18-20]。替普瑞酮作为一种无毒害作用的HSP诱导剂,受到研究者们的青睐,但是目前具体的凋亡机制尚不明显,对于替普瑞酮保护人胃黏膜的途径及具体分子机制还有待进一步实验。
综上所述,该研究首次选用人胃黏膜上皮细胞为研究对象并成功证明了替普瑞酮能够促进人正常胃上皮细胞增殖及迁移,抑制人正常胃上皮细胞凋亡,从而对替普瑞酮的胃黏膜保护机制进行了初步探讨,也为进一步探讨替普瑞酮对胃黏膜保护的相关信号通路和靶分子机制提供了一个更好的细胞模型。
[1] Niwa Y,Nakamura M,Miyahara R,et al.Geranylgeranylacetone protects against Diclofenac-Induced gastric and small intestinal mucosal injuries in healthy subjects:aprospective randomized Placebo-Controlled Double-Blind Cross-Over study[J].Digestion,2009,80(4):260-266.
[2] Tarnawski AS,Ahluwalia A.Molecular mechanisms of epithelial regeneration and neovascularization during healing of gastric and esophageal ulcers[J].Curr Med Chem,2012,19(1):16-27.
[3] Ning JW,Lin GB,Ji F,et al.Preventive effects of geranylgeranylacetone on rat ethanol-induced gastritis[J].World J Gastroenterol,2012,18(18):2262-2269.
[4] Nagano Y,Matsui H,Shimokawa O,et al.Bisphosphonate-induced gastrointestinal mucosal injury is mediated by mitochondrial superoxide production and lipid peroxidation[J].J Clin Biochem Nutr,2012,51(3):196-203.
[5] Ishihara T,Suemasu S,Asano T,et al.Stimulation of gastric ulcer healing by heat shock protein 70[J].Biochem Pharmacol,2011,82(7):728-736.
[6] Watanabe S,Wang XE,Hirose M,et al.Effects of teprenone on gastric epithelial restoration in a rabbit cultured cell model[J].J Gastroenterol,1998,33(2):153-159.
[7] Isoir M,Roque T,Squiban C,et al.Protective effect of geranylgeranylacetone against Radiation-Induced delayed effects on human keratinocytes[J].Radiat Res,2013,179(2):232-242.
[8] Suemasu S,Tanaka KI,Namba TA,et al.A role for HSP70in protecting against indomethacin-induced gastric lesions[J].J Biol Chem,2009,284(29):19705-19715.
[9] Takano T,Tsutsumi S,Tomisato W,et al.Geranylgeranylacetone protects Guinea pig gastric mucosal cells from gastric stressor-induced apoptosis[J].Dig Dis Sci,2002,47(7):1546-1553.
[10] Ke Y,Ning T,Wang B.Establishment and characterization of a SV40transformed human fetal gastric epithelial cell line-GES-1[J].Zhonghua Zhong Liu Za Zhi,1994,16(1):7-10.
[11] Sun ZR,Liu HM,Yang ZZ,et al.Intestinal trefoil factor activates the PI3K/Akt signaling pathway to protect gastric mucosal epithelium from damage[J].Int J Oncol,2014,45(3):1123-1132.
[12] Liu XH,Zhao LG,Liang J,et al.Component analysis and structure identification of active substances for anti-gastric ulcer effects in Radix Astragali by liquid chromatography and tandem mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci,2014,960:43-51.
[13] Wu HL,Duan ZT,Jiang ZD,et al.Increased endoplasmic reticulum stress response is involved in Clopidogrel-Induced apoptosis of gastric epithelial cells[J].PLoS One,2013,8(9):e74381.
[14] Guo LH,Chen W,Zhu HT,et al.Helicobacter pylori Induces Increased Expression of the Vitamin D Receptor in Immune Responses[J].Helicobacter,2014,19(1):37-47.
[15] Sysa-Shah P,Xu Y,Guo X,et al.Geranylgeranylacetone blocks Doxorubicin-Induced cardiac toxicity and reduces cancer cell growth and invasion through RHO pathway inhibition[J].Mol Cancer Ther,2014,13(7):1717-1728.
[16] Kim YW,Lee WH,Choi SM,et al.DA6034promotes gastric epithelial cell migration and wound-healing through the mTOR pathway[J].J Gastroenterol Hepatol,2012,27(2):397-405.
[17] Wang L,Yu L,Zhang TL,et al.HMGB1enhances embryonic neural stem cell proliferation by activating the MAPK signaling pathway[J].Biotechnol Lett,2014,36(8):1631-1639.
[18] Hoshino T,Suzuki K,Matsushima TA,et al.Suppression of alzheimer′s Disease-Related phenotypes by geranylgeranylacetone in mice[J].PLoS One,2013,8(10):e76306.
[19] Hoogstra-Berends F,Meijering RA,Zhang DA,et al.Heat shock Protein-Inducing compounds as therapeutics to restore proteostasis in atrial fibrillation[J].Trends Cardiovasc Med,2012,22(3):62-68.
[20] Luo FC,Zhao L,Deng J,et al.Geranylgeranylacetone protects against morphine-induced hepatic and renal damage in mice[J].Mol Med Rep,2013,7(2):694-700.
