洛铂与奥沙利铂腹腔热灌注化疗治疗腹膜转移胃腺癌的疗效和安全性比较
2017-06-05刘洪霞
李 光,刘洪霞,刘 军
黑龙江省佳木斯市中心医院二部肿瘤内科,黑龙江 佳木斯 154002
洛铂与奥沙利铂腹腔热灌注化疗治疗腹膜转移胃腺癌的疗效和安全性比较
李 光,刘洪霞,刘 军
黑龙江省佳木斯市中心医院二部肿瘤内科,黑龙江 佳木斯 154002
目的对比评价同为第三代铂类药物的洛铂和奥沙利铂分别联合卡培他宾D2术后行腹腔热灌注化疗治疗腹膜转移胃腺癌的疗效和安全性。方法选取佳木斯市中心医院2012年1月-2013年12月D2术后行腹腔热灌注化疗的患者83例,随机分为XELLOBA组和XELOX组,其中XELLOBA组采用洛铂+卡培他宾方案,XELOX组采用奥沙利铂+卡培他宾方案,比较两组患者的并发症发生率、毒副反应发生率及生存情况。结果两组患者有效率、并发症发生率、毒副反应比较,差异无统计学意义(P>0.05)。Ⅱ期患者3年总生存率(91.5%)高于Ⅲ期患者3年总生存率(59.7%),差异有统计学意义(P=0.009)。XELLOBA组3年总生存率(75.2%)高于XELOX组(62.9%),差异无统计学意义(P=0.253)。结论洛铂、奥沙利铂分别联合卡培他宾腹腔热灌注化疗治疗腹膜转移胃腺癌,两者疗效类似。洛铂抗肿瘤谱广、水溶性好、毒副反应轻,较其他铂类药物用于腹腔热灌注化疗治疗腹膜胃腺癌更为理想,具有重要临床应用价值。
洛铂;奥沙利铂;热灌注化疗;腹膜转移胃腺癌
胃癌是临床较为常见且严重威胁人类生命健康的恶性肿瘤之一,死亡率居各大恶性肿瘤第2位[1]。其中,由胃黏膜上皮细胞恶化发展而来的腺癌占95%。我国每年新增胃癌患者40万例,几乎占全球发病率的45%。胃癌发病隐匿,往往发现时已为进展期和晚期,多有癌灶远处转移和腹腔转移,于腹腔常可见微小转移癌灶,患者往往并发恶性腹水。有文献[2]表明,进展期胃癌40%~50%患者已发生腹膜转移。除手术残存癌灶引起的复发外,腹膜转移胃腺癌也是患者D2术后死亡的重要原因。目前,手术根治术仍为临床上治疗胃癌的首选方案,而对于D2术后患者如何采用辅助化疗治疗,一直存在争议,在国际上也无统一的标准方案[3]。基于此,历时5年的CLASSIC研究[4],为一项有中国人参与在内的关于进展期胃癌D2术后辅助化疗治疗的多中心前瞻性随机对照研究,其目的在于解决辅助化疗的标准方案问题。腹腔热灌注化疗利用热效应和化疗药物的协同作用,具有更有效地杀灭腹腔转移微小癌灶的作用,已被临床证实优于全身化疗[5]。洛铂(Lobaplatin,D19466,LBP)与奥利沙铂同为第三代铂类抗癌一线药物,已被临床证实具有广谱抗肿瘤作用,与第一代顺铂(PDD)相比,具有更强抗肿瘤作用,用于腹腔热灌注化疗更具优势。本研究旨在对比同为第三代铂类药物洛铂和奥沙利铂分别联合卡培单宾用于腹腔热灌注化疗治疗腹膜转移胃腺癌的疗效和安全性。
1 资料与方法
1.1 一般资料选取佳木斯市中心医院2012年1月-2013年12月行根治性全胃切除术的患者83例,男53例,女30例,年龄46~69岁,中位年龄62岁。入选标准:年龄<70岁,术前无放化疗治疗,术前无严重心肺及肝肾功能障碍,术前病理均证实为腺癌,且术中发现肿瘤侵透或侵出外膜。其中XELLOBA组41例腹腔热灌注化疗用洛铂+卡培他宾,XELOX组42例应用奥沙利铂+卡培他宾,其中胃癌Ⅱ期39例,胃癌Ⅲ期44例,ECOG评分均为0~1分。两组均于术后1个月内给予XELLOBA、XELOX方案化疗8周。两组患者年龄、性别、病理分期比较,差异无统计学意义(P>0.05),具有可比性。本研究经医学伦理委员会通过,经患者同意签署知情同意书。
1.2 治疗方法腹腔热灌注化疗:依照患者体表面积、年龄及一般情况确定化疗药物用量,灌注液应用0.9%的生理盐水3 000 ml,加热至43 ℃恒温,以200~300 ml/min的速度灌注入腹腔,并进行体外循环,灌注时间为60 min,术后第1天及术后第3天各进行1次。XEELOBA组使用洛铂+卡培他宾进行腹腔热灌注化疗,XELOX组使用奥沙利铂+卡培他宾他疗。两组患者术后均监测其生命体征、血常规及生化指标等,保证灌注安全顺利进行。
1.3 评价指标疗效评价标准:对于两组患者的疗效评价参考实体瘤近期疗效标准进行。包括:完全缓解(CR),影像学检查可见肿瘤完全消失;部分缓解(PR),肿瘤病灶消失度>50%;无变化(PD),肿瘤病灶度消失度25%~50%;恶化(PD),肿瘤病灶增加>25%。有效率为CR+PR。对比两组患者术后指标监测情况、并发症发生情况。以上患者均随访3年,并对1年、3年生存率及2年复发率进行统计。

2 结果
2.1 两组患者疗效比较XELLOBA组有效率(80.5%)略高于XELOX组(78.6%),差异无统计学意义(χ2=-23.484,P=0.849)。表明两组腹腔热灌注化疗方案疗效相似(见表1)。
表1 两组患者临床疗效比较
Tab 1 Comparison of clinical effects between two groups
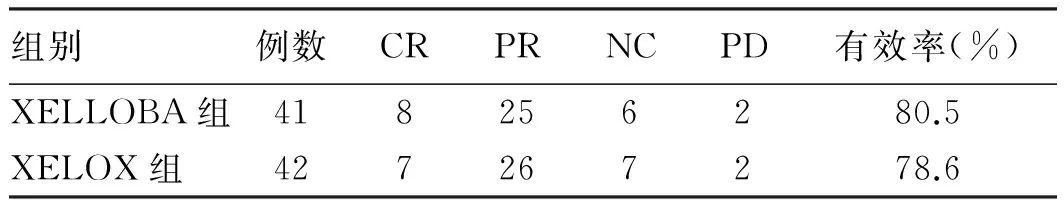
组别例数CRPRNCPD有效率(%)XELLOBA组418256280.5XELOX组427267278.6
2.2 安全性分析两组在吻合口瘘、黏连性肠梗阻、切口感染等手术并发症方面比较,差异无统计学意义(P>0.05,见表2)。两组白蛋白降低、骨髓抑制及重度消化道反应毒副反应相比,差异无统计学意义(P>0.05,见表3)。以上所有患者并发症及毒副反应对症处理后均恢复正常。
表2 两组患者术后并发症比较[例数(%)]
Tab 2 Comparison of postoperative complications between two groups [n(%)]
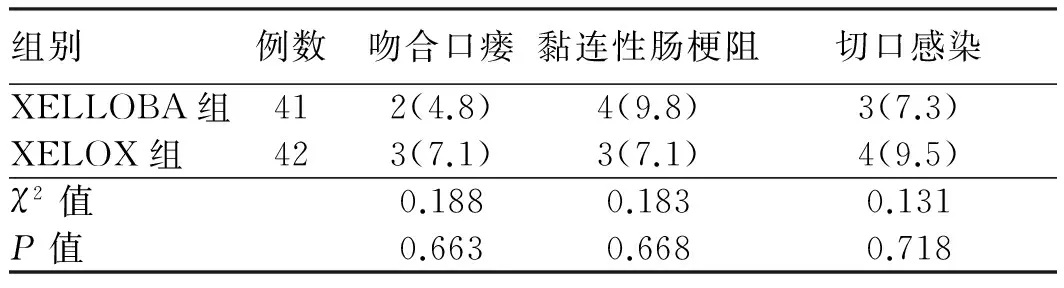
组别例数吻合口瘘黏连性肠梗阻切口感染XELLOBA组412(4.8)4(9.8)3(7.3)XELOX组423(7.1)3(7.1)4(9.5)χ2值0.1880.1830.131P值0.6630.6680.718
表3 两组患者毒副反应比较[例数(%)]
Tab 3 Comparison of toxic and adverse effects between two groups[n(%)]
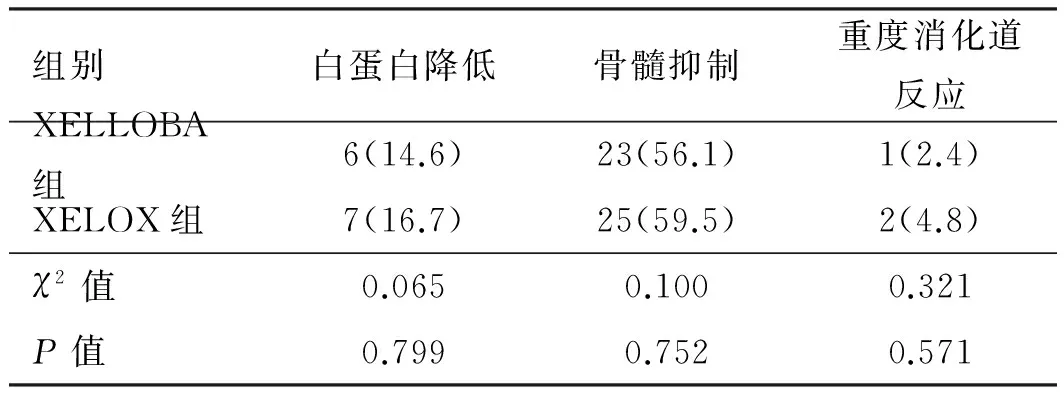
组别白蛋白降低骨髓抑制重度消化道反应XELLOBA组6(14.6)23(56.1)1(2.4)XELOX组7(16.7)25(59.5)2(4.8)χ2值0.0650.1000.321P值0.7990.7520.571
2.3 生存分析以上两组患者随访3年,所有患者的总生存率为68.6%(57/83),Ⅱ期患者3年总生存率(91.5%)高于Ⅲ期(59.7%),差异有统计学意义(P=0.009)(见图1);XELLOBA组3年总生存率(75.2%)高于XELOX组(62.9%),差异无统计学意义(P=0.253)(见图2)。亚组分析中,XELLOBA组Ⅱ期患者3年总生存率(100%)高于XELOX组(80.0%),差异无统计学意义(P=0.584)(见图3);XELLOBA组Ⅲ期患者3年总生存率(63.2%)高于XELOX组(56.0%),差异无统计学意义(P=0.333)(见图4)。
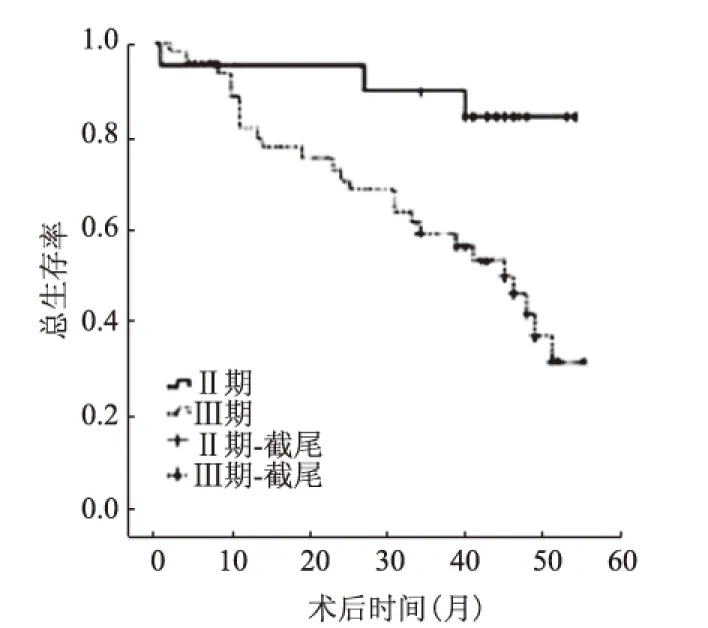
图1 Ⅱ期、Ⅲ期患者3年总生存率比较
Fig 1 Comparison of 3 years of overall survival between Ⅱ and Ⅲ stage patients

图2 两组患者3年总生存率比较
Fig 2 Comparison of 3 years of overall survival between two groups

图3 两组Ⅱ期患者3年总生存率比较
Fig 3 Comparison of 3 years of overall survival between two groups for Ⅱ stage patients
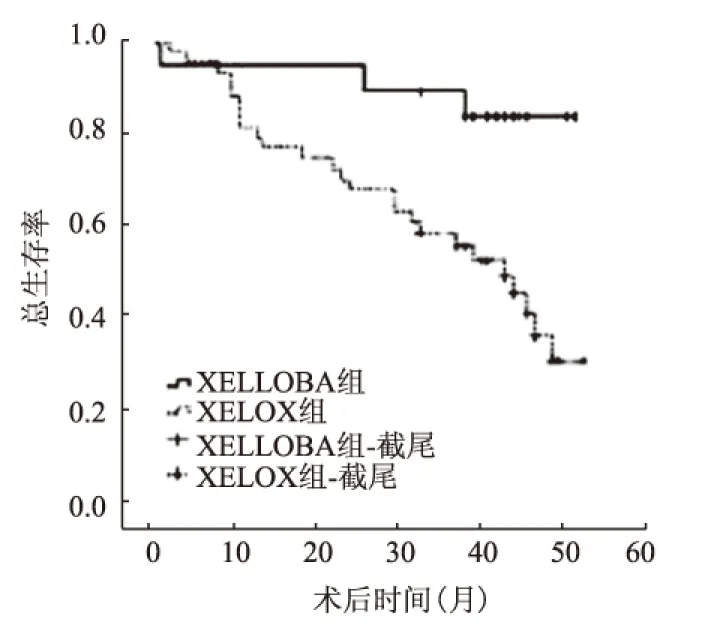
图4 两组Ⅲ期患者3年总生存率比较
Fig 4 Comparison of 3 years of overall survival between two groups for Ⅲ stage patients
3 讨论
研究[6]表明,胃癌发生腹腔转移的几率很高,40%~50%患者在进展期即已发生腹腔转移。胃癌单纯手术根治术因残存癌灶极易复发,因而5年生存率很低,预后较差。胃癌原发肿瘤未切除患者生存期为3~4个月,切除者生存期为9~10个月。胃癌患者常见于D2术后死亡。已有研究[7]证实,除手术残存病灶引起复发外,腹膜转移胃腺癌也是引起D2术后患者死亡的重要原因,因而,单纯手术治疗进展期胃癌很难达到满意治疗效果。如何改善进展期胃癌D2术后的生存状况仍是当前首要解决的问题。D2根治术作为进展期胃癌的标准治疗已被世界各国特别亚洲地区所认可[8]。但如何在此基础上进行辅助化疗治疗一直存在争议。目前国际上也无统一的辅助化疗治疗标准。
转移复发也成为D2术后患者死亡的常见原因。因而,如何彻底有效杀灭微小癌细胞、改善预后,对于胃癌术后的辅助化疗研究,国际上已经有两项多中心的前瞻性随机对照研究[9],均取得了阳性结果。对于ⅢA以上患者的研究,其影响因素将更为复杂,但同时也成为当前研究的重点。胃癌辅助化疗主要有全身化疗与腹腔热灌注化疗。已有研究[10]证实,D2术后患者行腹腔热灌注化疗优于全身化疗。因而,有效的腹腔热灌注化疗方案,对于改善患者生存状况,具有重要临床价值。
腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)自1980年由Spratt等[11]首先提出,并应用于1例腹膜假黏液瘤男性患者的治疗,至今已经历近30年发展,在我国已广泛应用于腹膜播散癌的治疗。但目前HIPEC仍缺乏统一的标准方案,采用何种方案更佳,并无定论。
洛铂为1,2二氨基环丁烷乳酸合铂,与第一代顺铂(PDD)和第二代卡铂(CBP)比较,具有更多优势,在稳定性、抗瘤谱及活性上均优于第一、二代铂类抗肿瘤药物。且与其他铂类药物无交叉耐药性,毒性与CBP类似。其作用机理与PDD类似,主要通过与DNA形成链内交链联接,阻碍DNA的复制和转录,从而干扰肿瘤细胞周期的运行,由LBP引起的DNA损伤,可以影响肿瘤细胞特定的基因表达。奥沙利铂为左旋反式二氨基环已烷酸铂,在体液中通过转化含有活性的水合和二水合1,2-二氨基环已烷铂,与DNA形成链内和链间交链结构,对DNA的复制和转录具有抑制作用,从而发挥抗肿瘤作用。本研究中,两种药物用于腹腔热灌注化疗,都取得较满意的疗效,其原因可能为:大量的腹腔灌注液持续冲洗,可以稀释腹腔里游离的癌细胞浓度,并将部分癌细胞带出腹腔。正常细胞和癌细胞对热损伤的耐受限度不一样,在同一温度下,可在杀死癌细胞的同时,保证正常细胞的安全,温热和化疗可以协同作用,热疗可以促进化疗药物进入细胞内发生抗癌作用,还可提高化疗敏感度。化疗药物在热灌注过程中可被腹膜吸收,还可通过静脉网流到达肝脏,有效预防肝转移的发生。
本研究结果提示采用洛铂+卡培他宾方案在疗效上与采用沙利铂+卡培他宾组胃腺癌患者D2术后辅助化疗效果类似。但对于患者的生存状况改善,甚至有可能要优于奥沙利铂联合卡培他宾方案。与我们的研究结果一致,李元方等[12]采用卡培他宾分别联合洛铂与奥沙利铂治疗Ⅱ期、Ⅲ期胃癌D2术后全身辅助化疗的对比研究,其结果差异也无统计学意义。武海涛等[1]用洛铂联合多西他赛行细胞减灭术加腹腔热灌注化疗治疗腹膜癌获得DEF为75.6%。结合既往研究与本研究的结果,均表明,采用XELLOBA方案冶疗腹膜转移胃腺癌,所取得的疗效可能更优。
在安全性方面,两组患者接受腹腔热灌注化疗的时间、化疗反应毒性总发生率及并发症发生率差异均无统计学意义,但XELLOBA组在吻合口瘘、黏连性肠梗阻、切口感染等并发症发生率均低于XELOX组,两组患白蛋白下降、骨髓抑制及重度消化道反应等毒副反应发生率也低于XEOLX组,据此可以推断,对于患者的生存状况改善,优于XEOLX组。同类研究[13]曾对比了两种方案在直肠癌治疗中的不良反应,所取得的结果与本文类似。刘思海等[14]进行了评价LBP、OXA联合替加氟(Ft207)腹腔热灌注治疗晚期胃癌的对比研究,两组毒副反应差异无统计学意义,但LBP组毒副反应较OXA组轻,患者易于接受。
本研究观察还发现,LBP在患者中出现骨髓抑制的毒副反应较为常见,血小板减少为剂量限制性毒性,与CBP的血小板减少的发生率与严重程度相近。一般于化疗第7~10天出现,第10~14天减少到最低值。因而在行腹腔热灌注化疗过程中,必须严密监测血象及出血症状。对原已有出血倾向的患者,包括活动性溃疡和原有癌灶出血危险者,须慎用。其他可见消化道反应及乏力等,但较PDD轻。LBP未见PDD常见的肝肾毒性、神经毒性等。此外,由于LBP是唯一能溶于水的铂类药物,水溶性较好,对于原本脱水或尿少患者必须适当补液。可见,LBP相较其他铂类药物,用于腹腔热灌注化疗治疗腹膜转移胃腺癌,更为理想。因而,对于胃癌术后辅助化疗,其重要临床意义已不言而喻。其应用价值也因此而引起临床普遍重视。欧美等国家已基于此展开对胃癌Ⅱ期的临床应用试验研究[15]。
需要指出的是,采用LBP方案行腹腔热灌注化疗可更好地改善预后,但其疗效可能还受腹腔热灌注化疗自身存在的一些问题影响,需要解决:导管黏连,可能由化疗药物及导管刺激使导管末端发生炎症而黏连,术后腹腔黏连。术后腹腔黏连而形成黏连腹腔。使灌注液及药物不能均匀地散入腹腔,影响疗效。带管时间过长可能会导致感染。随着腹腔热灌注化疗技术自身的成熟,LBP的优势还将更充分地显示出来。
总之,LBP与OXA同作为第3代新的铂类抗肿瘤药物,但因其具有抗肿瘤谱广、活性强、水溶性好,及与其他铂类药物不发生交叉耐药性,较低的毒副反应等特点,相较其他铂类药物,用于腹腔热灌注化疗治疗腹膜转移胃腺癌,更具明显优势。迄今为止针对进展期胃癌术后腹腔热灌注辅助化疗的基础研究还较少,更缺乏大样本的、随机对照的多中心Ⅱ临床研究,因此,迫切需要加强研究,进一步确证LBP在胃癌治疗中的有效性及安全性。
[1]武海涛, 杨肖军, 孙建华, 等. 洛铂联合多西他赛行肿瘤细胞减灭术加腹腔热灌注化疗治疗腹膜癌的临床观察[J]. 肿瘤防治研究, 2016, 43(2): 150-157. Wu HT, Yang XJ, Sun JH, et al. Clinical observation of Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy with Lobaplatin and Docetaxel on peritoneal carcinoma [J]. Cancer Research on Prevention and Treatment, 2016, 43(2): 150-157.
[2]Yang XJ, Huang CQ, Suo T, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy improves survival of patients with peritoneal carcinomatosis from gastric cancer: final [J]. Ann Surg Oncol, 2011, 18(6): 1575-1581.
[3]Liu Y, Ishibashi H, Takeshita K, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for peritoneal dissemination from small bowel malignancy: results from a single specialized center [J].Ann Surg Oncol, 2015, 36(2): 1-7.
[4]Sun Y, Shen P, Stewart JH, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for peritoneal carcinomatosis from small bowel adenocarcinoma [J]. Am Surg, 2013, 79(6): 644-648.
[5]蒙艳凤, 徐学新, 杨国稳. 铂类药物腹腔热灌注化疗治疗恶性腹腔积液的现状与进展[J]. 中国综合临床, 2013, 29(12): 33-35. Meng YF, Xu XX, Yang GW. Platinum drugs intraperitoneal hot perfusion chemotherapy to treat malignant peritoneal effusion status and progress [J]. Clinical Medicine of China, 2013, 29(12): 33-35.
[6]吴印兵, 巴明臣, 崔书中, 等. 进展期胃癌腹腔热灌注化疗临床疗效与安全性Meta分析[J]. 中华肿瘤防治杂志, 2013, 20(21): 1686-1690. Wu YB, Ba MC, Cui SZ, et al. Meta-analysis of clinic effect and security of perioperative intraperitoneal hyperthermic perfusion chemotherapy treatment for radical resection of local advanced gastric cancer [J]. Chinese Journal of Cancer Prevention and Treatment, 2013, 20(21): 1686-1690.
[7]侯仰韶, 时红萍. 热疗联合腹腔热灌注化疗治疗恶性腹水疗效与安全性的Meta分析[J]. 中国循证医学杂志, 2013, 13(10): 1244-1250. Hou YS, Shi HP. Effectiveness and safety of hyperthermia plus intraperitoneal hyperthermic perfusion chemotherapy for malignant ascites: a Meta-analysis [J]. Chinese Journal of Evidence-Based Medicine, 2013, 13(10): 1244-1250.
[8]Seyfried F, Rahden BH, Miras AD, et al. Incidence, time course and independent risk factors for metachronous peritoneal carcinomatosis of gastric origin-a longitudinal experience from a prospe [J]. Bmc Cancer, 2015, 15(1): 1-10.
[9]Lam KO, Law TT, Law YK, et al. Intraperitoneal chemotherapy for gastric cancer with peritoneal carcinomatosis: is HIPEC the only answer? [J]. Mod Chem, 2014, 3(2): 11-19.
[10]Novotny AR, Reim D, Friess HM, et al. Secondary gastrectomy for stage Ⅳ gastroesophageal adenocarcinoma after induction-chemotherapy [J]. Langenbecks Arch Surg, 2014, 399(6): 773-781.
[11]Spratt JS, Adcock RA, Muskovin M, et al. Clinical delivery system for intraperitoneal hyperthermic chemotherapy [J]. Cancer Res, 1980, 40(2): 256-260.
[12]李元方, 周志伟, 李威, 等. 卡培他滨联合洛铂对比联合奥沙利铂用于进展期胃癌D2术后辅助化疗[J]. 广东医学, 2012, 33(9): 1324-1327. Li YF, Zhou ZW, Li W, et al. Capecitabine combined los platinum contrast combined for advanced gastric cancer D2 postoperative adjuvant chemotherapy Oxaliplatin into [J]. Guangdong Medical Journal, 2012, 33(9): 1324-1327.
[13]Marrelli D, Polom K, Pascale V, et al. Strong prognostic value of microsatellite instability in intestinal type non-cardia gastric cancer [J]. Ann Surg Oncol, 2015, 36(2): 1-8.
[14]刘思海, 冯雯, 朱瑞霞, 等. 斑蝥酸钠维生素B_6注射液联合草酸铂与替加氟持续泵入治疗晚期胃癌的比较研究[J]. 实用中西医结合临床, 2008, 8(4): 3-4. Liu SH, Feng W, Zhu RX, et al. Comparative study of disodium Cantharidinate and Vitamin B6 injection combined with Oxaliplatin and Tegafur in the treatment of advanced gastric cancer [J]. Practical Clinical Journal of Integrated Traditional Chinese and Western Medicine, 2008, 8(4): 3-4.
[15]安贞兰, 章岳山, 姚新明. 腹腔热灌注洛铂联合口服替吉奥对晚期胃癌的疗效观察[J]. 临床和实验医学杂志, 2015, 14(10): 840-841. An ZL, Zhang YS, Yao XM. Efficacy of intraperitoneal hyperthermic perfusion lobaplatin combined with tegafur in patients with advanced gastric cancer [J]. Journal of Clinical and Experimental Medicine, 2015, 14(10): 840-841.
(责任编辑:陈香宇)
The efficacy and safety of hyperthermic intraperitoneal chemotherapy by Los platinum and Oxaliplatin for peritoneal metastasis of gastric adenocarcinoma
LI Guang, LIU Hongxia, LIU Jun
Department of Oncology, the Heilongjiang Province Jiamusi Central Hospital, Jiamusi 154002, China
Objective To investigate and compare efficacy and safety of hyperthermic intraperitoneal chemotherapy by Los platinum and Oxaliplatin for peritoneal metastasis of gastric adenocarcinoma.Methods Eighty-three cases patients given D2 postoperative hyperthermic intraperitoneal chemotherapy by Los platinum (LBP) and Oxaliplatin (OXA) respectively combined with Capecitabine selected from the Heilongjiang Province Jiamusi Central Hospital from Jan. 2012 to Dec. 2013 were randomly divided into XELLOBA group and XELOX group, XELLOBA group was given the scheme of LBP combined with Capecitabine, XELOX group was given the scheme of OXA combined with Capecitabine, the incidence of complications, the incidence of adverse reaction and survival situation were compared between two groups.Results There was no significant difference in the effective rate, incidences of adverse reactions and complica tions between two groups (P>0.05). The 3 year overall survival rate of Ⅱ patients was higher than that of patients with Ⅲ, the difference was statistically significant (P=0.009). Three years overall survival (75.2%) in XELLOBA group was higher than that in the XELOX group (62.9%), there was no statistically significant difference (P=0.253).Conclusion The curative effect of hyperthermic intraperitoneal chemotherapy by Los platinum and Oxaliplatin respectively combined with Capecitabine for peritoneal metastasis of gastric adenocarcinoma are similar. Los platinum has wide antitumor spectrum, good water solubility, toxic and side reaction. It is more ideal than other platinum drugs used in hyperthermic intraperitoneal chemotherapy for peritoneal metastasis of gastric adenocarcinoma, it has the important clinical value.
Los platinum; Oxaliplatin; Hyperthermic intraperitoneal chemotherapy; Peritoneal metastasis gastric adenocarcinoma
李光,副主任医师,E-mail:lg_8989@163.com
刘军,主任医师,研究方向:肿瘤内科。E-mail:liujunde9773@163.com
10.3969/j.issn.1006-5709.2017.03.006
R735.2
A 文章编号:1006-5709(2017)03-0266-05
2016-08-14
