快速进入高海拔地区小肠动力紊乱大鼠Cajal间质细胞及P物质表达的变化
2017-06-05范兴爱杨生岳刘睿年
贺 巍, 朱 琳, 范兴爱, 杨生岳, 刘睿年, 陈 磊
解放军第四医院消化内科,青海 西宁 810007
快速进入高海拔地区小肠动力紊乱大鼠Cajal间质细胞及P物质表达的变化
贺 巍, 朱 琳, 范兴爱, 杨生岳, 刘睿年, 陈 磊
解放军第四医院消化内科,青海 西宁 810007
目的探讨快速进入高海拔地区发生小肠动力紊乱过程中Cajal间质细胞(interstitial cell of Cajal,ICC)的作用机制。方法50只SD大鼠以低海拔地区(海拔400 m)为对照组,并以进入高海拔地区(海拔4 300 m)后的时间节点依次分为1 d、3 d、7 d和14 d组,每组10只。测定各组大鼠小肠电活动数据,应用电子显微镜观察小肠ICC的微观结构变化,应用双重免疫荧光组织化学染色的方法观察同区域ICC的功能与P物质(substance P,SP)的表达变化。结果快速进入高海拔地区后,大鼠小肠电波幅及波频受损明显,于高海拔区3 d组下行到最低点(P<0.05)。其小肠ICC的微观结构也可观察到类似改变。使用双重免疫荧光组织化学染色可发现,ICC与SP的表达呈同步变化,同样在高海拔区3 d组表达下降到最低点(P<0.05)。结论快速进入高海拔地区所致小肠动力紊乱的发生,可能与小肠ICC及SP的表达变化有密切关系。
高原病;高海拔;小肠动力;Cajal间质细胞;P物质;大鼠
快速进入高海拔地区的人易因缺氧引起胃肠动力紊乱,其多以食欲减退、恶心、腹胀等消化道症状最为突出,通常经7~10 d的高原适应后可逐渐缓解或消失[1],目前有关快速进入高海拔地区胃肠动力紊乱的发生机制尚不明确。已知研究表明Cajal间质细胞(interstitial cell of Cajal, ICC)不但是胃肠基本电节律(basic electric rhythm)的起始点[2],同时又扮演着传导者的作用[3],是胃肠道壁内神经与平滑肌间的信息传导中介,对P物质(substance P, SP)、内源性一氧化氮(NO)、血管活性肠肽(vasoactive intestinal peptide,VIP)等多种胃肠道活性物质有反应[4],在胃肠动力调控中发挥重要作用。SP则在胃肠运动调节中起重要的兴奋性作用,在胃肠道内广泛分布。为此本实验将使用双重免疫荧光组织化学标记的方法观察大鼠小肠ICC与SP的表达变化,及快速进入高海拔地区大鼠小肠动力紊乱过程中ICC的作用机制。
1 材料与方法
1.1 主要仪器及试剂RM6280B生物信号采集处理系统(成都仪器厂生产),超低温冰箱(-80 ℃)及超低温切片机(美国NUAIR公司),FV1000激光共聚焦显微镜(日本OLYMPUS公司),TecnaiG2分析透射电镜(美国FEI公司),兔抗大鼠多克隆c-kit抗体(LifeSpan BioSciences公司),小鼠抗大鼠单克隆SP抗体(Santa Cruz Biotechnology公司),驴抗兔FITC标记单克隆抗体(Abcom公司),驴抗小鼠alexa fluor单克隆抗体(Abcom公司)。
1.2 实验动物与分组SD雄性大鼠50只,SPF级,许可证号:SCXK(陕)2012-003,体质量(200±20)g,购自西安交通大学实验动物中心,以低海拔地区(西安,海拔400 m)为对照组。另以大鼠起运后3 d内进驻实验现场模拟快速进入高海拔地区状态,并以进入高海拔地区(玛多,海拔4 300 m)后的时间节为依据,依达到实验地区后的时间顺序依次分为1 d、3 d、7 d和14 d组,每组10只。
1.3 小肠电生理活动检测SD大鼠术前12 h禁食,术前6 h禁水,戊巴比妥钠腹腔注射(40 mg/kg)麻醉,通过大鼠腹部正中切开,选择大鼠幽门后10 cm处小肠浆膜层埋置引导电极,测量小肠电活动变化,参数设定为“生物电,200 μV,0.02 s,100 Hz”,记录波形并分析。
1.4 实验标本的采集与固定电生理测定完成后处死大鼠,剪开胸腔,经升主动脉插管,快速灌入生理盐水冲去血液,于大鼠幽门后10 cm小肠处截取0.2 cm×0.1 cm大小组织,放入3%戊二醛固定用于电镜染色,后继续经升主动脉先快后慢灌注冷的(4 ℃)4%多聚甲醛的0.1 mol/L磷酸缓冲液(PB,pH=7.4)500 ml,注毕立即截取大鼠幽门后10~15 cm段置于20%的蔗糖溶液中过夜沉淀。
1.5 电镜观察小肠ICC细胞微观结构变化取3%戊二醛固定后组织用0.2 mol/L蔗糖磷酸缓冲液漂洗,再用2%的四氧化锇后固定1 h,丙酮中梯度脱水,在1%醋酸双氧铀中停滞染色1 h,再通过环氧丙烷与环氧树脂。1 mm切片用亚甲蓝染色,在光镜下观察,确定黏膜层、环形肌层、纵行肌层,再次经70 nm超薄切片后用酒精醋酸双氧铀、再用柠檬酸盐后染色,保留纵行肌层、环形肌层、黏膜下层、部分黏膜层,用透射电镜观察、照相。
1.6 双重免疫荧光化学法标记ICC及SP并观察、采集图像取固定后小肠组织0.4 cm×0.2 cm组织用超低温切片机切片10 μm,使用0.01 mol/L PBS反复漂洗3次后,置入含0.3 % Triton X-100的0.01 mol/L PBS中浸泡30 min(室温),再经0.01 mol/L PBS液漂洗后进行免疫组织化学荧光染色(以c-kit抗体标记ICC):分别加入兔抗大鼠多克隆c-kit抗体(1∶150)及小鼠抗大鼠单克隆SP抗体(1∶200)孵育24 h(室温),经0.01 mol/L PBS液漂洗3次后,分别加入荧光二抗,驴抗兔FITC标记单克隆抗体(1∶400)及驴抗小鼠alexa fluor 594单克隆抗体(1∶400),避光孵育2 h(室温)。经0.01 mol/L PBS洗3次后,80%甘油封片,以上过程均需避光操作。每切片取10张,在FV1000激光共聚焦显微镜下采用20倍及40倍视野观察,每一张切片取6~8个视野,并将数字化图像储存。

2 结果
2.1 快速进入高海拔地区后大鼠在各时间段下的小肠电生理变化快速进入高海拔地区后,大鼠小肠电的波频及波幅均受损明显,1 d组即可观察到明显变化(P<0.05),至3 d组下降到最低点(P<0.05),此后缓慢恢复。波频恢复相对较快,7 d组即基本恢复正常,与低海拔组比较差异无统计学意义,而波幅恢复相对较慢(见表1、图1)。


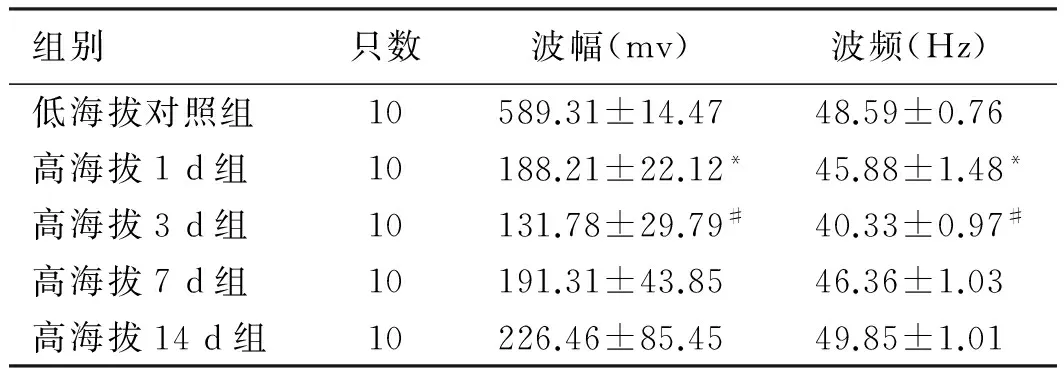
组别只数波幅(mv)波频(Hz)低海拔对照组10589.31±14.4748.59±0.76高海拔1d组10188.21±22.12*45.88±1.48*高海拔3d组10131.78±29.79#40.33±0.97#高海拔7d组10191.31±43.8546.36±1.03高海拔14d组10226.46±85.4549.85±1.01
注:与低海拔组比较,*P<0.01;与1 d组及7 d组比较,#P<0.05。
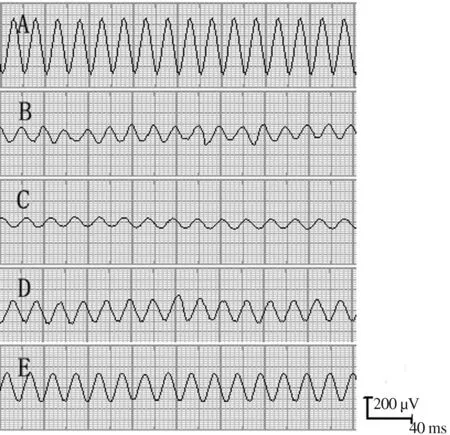
图1 快速进入高海拔地区后大鼠小肠电活动时程变化图
A:低海拔对照组;B:高海拔1 d组;C:高海拔3 d组;D:高海拔7 d组;E:高海拔14 d组
Fig 1 Effects of ascending to high altitude on small intestine electrical activity in the rats
A: low altitude; B: high altitude 1 d; C: high altitude 3 d; D: high altitude 7 d; E: high altitude 14 d
2.2 快速进入高海拔地区后各时间段下大鼠小肠ICC的微观结构变化低海拔对照组ICC在电镜下观察可见:细胞结构完整,缝隙连接紧密,核周细胞质充盈,细胞器数量较多,细胞内部罕见空泡样改变,无凋亡小体。快速进入高海拔地区后,细胞微观结构开始受外界环境影响、受损,尤其在高海拔地区3 d组表现最为明显。ICC细胞缝隙连接变得明显松散;细胞内细胞器数量明显减少,线粒体可见空泡样肿胀、变性,部分可见内质网轻度扩张;核周细胞质空泡样改变加重,甚至部分ICC基膜不完整形成空洞;可见核固缩形成,核内可见异染色质,凋亡小体显著增多(见图2)。
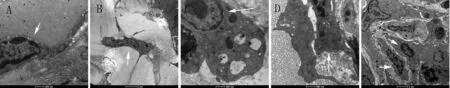
图2 快速进入高海拔地区后对大鼠小肠ICC细胞微观结构的影响
A:低海拔对照组(20500×);B:高海拔1 d组(6000×);C:高海拔3 d组(20500×);D:高海拔7 d组(20500×);E:高海拔14 d组(6000×)
Fig 2 Effects of ascending to high altitude on ultrastructure of ICC in the rats’ small intestine
A: low altitude (20500×); B: high altitude 1 day (6000×); C: high altitude 3 days (20500×); D: high altitude 7 days (20500×); E: high altitude 14 days (6000×)
2.3 快速进入高海拔地区后各时间段下小肠c-kit及SP表达的变化进入高海拔地区后,大鼠小肠c-kit表达明显下降,1 d组即出现明显变化(P<0.05),并于3 d组下行到最低点(P<0.05),而后缓慢恢复。SP免疫荧光染色结果表明,其表达与ICC呈网络样分部,彼此紧密相邻,表达变化与ICC表达改变同步,均于1 d组即出现改变(P<0.05),于3 d组表达减少到最低(P<0.05),而后缓慢恢复(见表2、图3)。


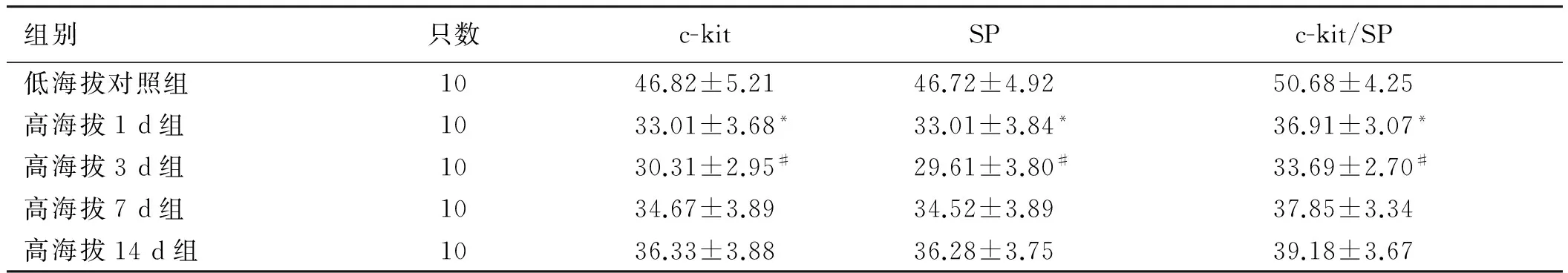
组别只数c-kitSPc-kit/SP低海拔对照组1046.82±5.2146.72±4.9250.68±4.25高海拔1d组1033.01±3.68*33.01±3.84*36.91±3.07*高海拔3d组1030.31±2.95#29.61±3.80#33.69±2.70#高海拔7d组1034.67±3.8934.52±3.8937.85±3.34高海拔14d组1036.33±3.8836.28±3.7539.18±3.67
注:与低海拔组比较,*P<0.05;与1 d组及7 d组比较,#P<0.05。
3 讨论
快速进入高海拔地区的人们,因外界气压迅速降低会引起全身低张性缺氧,从而导致高原胃肠应激反应。本研究前期实验结果已表明,在进入地区海拔高度越高,大鼠小肠动力下行的速度越快,恢复越慢,比起胃动力下行的趋势更为明显,并且ICC在其中广泛参与,并发挥重要的作用[5]。而作为胃肠动力基本功能单位(basical functional unit GI motility, BFUGM)重要的组成部分ICC[6],在小肠内,依据功能和部位的不同可划分为肌间ICC(ICC-MY)、肌内ICC(ICC-IM)、深层肌层ICC(ICC-DMP)三种[7]。ICC-MY是导致起搏的主要细胞,自动产生节律性慢波[8],而ICC-IM则能够将ICC-MY产生的起搏信号向下传递给与其形成紧密连接平滑肌,并对神经信号传递进行调节[3-9],ICC-DMP则能被胆碱能及NOS阳性神经双重支配[10],其与ENS及邻近的SMC存在特殊连接,形成“ENS-ICC-DMP-SMC”的功能单位。可见肠神经系统(enteric nervous system,ENS)的调控,除了直接作用于平滑肌系统外,主要通过ICC发挥作用,其对乙酰胆碱、SP、NO、VIP等多种神经的递质均有反应[4]。SP则作为一种重要兴奋性的神经递质,广泛存在于整个胃肠道及ENS[11],并对胃肠运动的调控广泛发挥作用,是研究胃肠动力学领域的重要一种神经递质[12]。通过本实验的结果可知,快速进入高海拔地区后,伴随大鼠小肠电活动的明显受损,ICC的微观结构及功能表达均出现明显损伤,并同样于高海拔地区的3 d组下降到最低点。双重免疫荧光组织化学染色结果发现,SP表达的变化与ICC表达改变同步,均于1 d组即出现改变,于3 d组表达减少至最低,而后缓慢恢复。其表达阳性的神经丛与ICC呈网络样分布,彼此紧密相邻,并与小肠平滑肌毗邻,提示大鼠小肠SP的表达量降低,与小肠壁内神经元兴奋性、小肠电基础及平滑肌的活动下降存在明显关联,其可能是快速进入高海拔地区大鼠小肠动力紊乱过程中ICC作用机制的重要组成部分。

注:E:Bar=50 μm,40×;其余:Bar=200 μm,20×。
图3 快速进入高海拔地区后对大鼠小肠c-kit及SP表达影响
A:低海拔对照组;B:高海拔1 d组;C:高海拔3 d组;D:高海拔7 d组;E:高海拔14 d组
Fig 3 Expressions of ICC and SP in rats’ small intestine by ascending to high altitude
A: low altitude; B: high altitude 1 d; C: high altitude 3 d; D: high altitude 7 d; E: high altitude 14 d
[1]高钰琪. 高原军事医学 [M]. 重庆: 重庆出版社, 2005: 106-110. Gao YQ. High altitude military medicine [M]. Chongqing: Chongqing Publishing Press, 2005: 106-110.
[2]Bielefeldt K, Conklin JL. Intestinal motility duringhypoxia and reoxygenation in vitro [J]. Dig Dis Sci, 1997, 42(5): 878-884.
[3]Sanders KM. A case for interstitial cells of Cajal as pacemakers and mediators of neurotransmission in the gastrointestinal tract [J]. Gastroenterology, 1996, 111(2): 492-515.
[4]孙金山, 王宝西. Cajal间质细胞与胃肠动力疾病[J]. 中国当代儿科杂志, 2006, 8(2): 164-168. Sun JS, Wang BX. Interstitial cells of cajal and gastrointestinal disease [J]. Chinese Journal of Contemporary Pediatrics, 2006, 8(2): 164-168.
[5]朱琳, 贺巍, 杨生岳, 等. 急进高原对大鼠胃电活动及胃Cajal间质细胞微观结构和功能的影响[J]. 山西医科大学学报, 2016, 47(6): 505-519. Zhu L, He W, Yang SY, et al. Effects of ascending to high altitude on gastric motility, ultrastructure and function of interstitial cell of Casals in the rats [J]. Journal of Shanxi Medical University, 2016, 47(6): 505-519.
[6]Wang XY, VannucchiMG, Nieuwmeyer F, et al. Changes in interstitial cells of Cajal at the deep muscular plexus are associated with loss of distention-induced burst-type muscle activity in mice infected by Trichinella spiralis [J]. Am J Pathol, 2005, 167(2): 437-453.
[7]Ward SM, Sanders KM. Interstitial cells of Cajal: primary targets of enteric motor innervation [J]. Anat Rec, 2001, 262(1): 125-135.
[8]Dickens EJ, Hirst GD, Tomita T. Identification of rhythmically active cells in guinea-pig stomach [J]. J Physiol, 1999, 514 (Pt 2): 515-531.
[9]Beckett EA, McGeough CA, Sanders KM, et al. Pacing of interstitial cells of Cajal in the murine gastric antrum: neurally mediated and direct stimulation [J]. J Physiol, 2003, 553(Pt 2): 545-559.
[10]Wang XY, Paterson C, Huizinga JD. Cholinergic and nitrergic innervation of ICC-DMP and ICC-IM in the human small intestine [J]. Neurogast Roenterol Motil, 2003, 15(5): 531-543.
[11]Maake C, Kloas W, Szendefi M, et al. Neurohormonal peptides, serotonin, and nitric oxide synthase in the enteric nervous system and endocrine cells of the gastrointestinal tract of neotenic and thyroid hormone-treated axolotls (Ambystoma mexicanum) [J]. Cell Tissue Res, 1999, 297(1): 91-101.
[12]Cui N, Luo H, Chen W, et al. Influence of Helicobacter pylori infection on gastrointestinal hormone and colon motility of rats [J]. Am J Med Sci, 2016, 351(5): 520-524.
(责任编辑:李 健)
Expressions of the interstitial cell of Cajal and substance P in small intestine in the rats by ascending to high altitude
HE Wei, ZHU Lin, FAN Xing’ai, YANG Shengyue, LIU Ruinian, CHEN Lei
Department of Gastroenterology, the Fourth Hospital of PLA, Xining 810007, China
Objective To explore the mechanism of interstitial cells of Cajal (ICC) in rats with small intestine motility disorder by high altitude exposed. Methods Fifty SD male rats were divided into five groups, control group was located in low altitude (Xi’an, 400 m), on the basis of the time points of entering high altitude (Ma’duo, 4 300 m), rats were divided into four groups of 1 day, 3 days, 7 days and 14 days. Each group contained 10 rats. Rats’ small intestine electrical activity was measured in different groups. Electron microscopy was applied to observe the physiological ultrastructure of ICC, and the immunofluorescence staining was applied to observe the physiological function of ICC and the expression of substance P in small intestine. Results The amplitude and frequency of small intestine electrical activity of rats were lowest in high altitude 3 days group (P<0.05). The gap junctions and organelles of ICC were reduced. The expressions of ICC and substance P were the lowest in high altitude 3 days group (P<0.05). ConclusionThe changes of the expressions of ICC and SP in small intestine are closely related to small intestine dynamic disorders in high altitude exposed rats.
Mountain sickness; High altitude; Small intestine motility; Interstitial cell of Cajal; Substance P; Rat
10.3969/j.issn.1006-5709.2017.03.008
青海省(应用)基础研究计划项目(2013-z-760)
贺巍,硕士,主任医师,E-mail:hewei.1971@163.com
R574.5
A 文章编号:1006-5709(2017)03-0275-04
2016-08-06
