胃息肉和胃癌组织中HSP70、Apaf-1和ST13的表达及相关性
2017-06-05贾明旭
陈 吉, 贾明旭
内蒙古包钢医院消化内科,内蒙古 包头 014010
胃息肉和胃癌组织中HSP70、Apaf-1和ST13的表达及相关性
陈 吉, 贾明旭
内蒙古包钢医院消化内科,内蒙古 包头 014010
目的检测正常胃黏膜组织、胃息肉及胃癌组织中HSP70、Apaf-1和ST13的表达,为胃癌的早期诊断提供一定的临床依据。方法收集2014年12月-2015年9月于内蒙古包钢医院消化内科行胃镜检查患者的胃黏膜组织,分为正常胃黏膜组、增生性息肉组、腺瘤性息肉组及腺癌组,共72例。运用蛋白免疫印迹法(Western blotting)检测HSP70、Apaf-1和ST13蛋白表达水平。结果HSP70在正常胃黏膜、增生性息肉、腺瘤性息肉、腺癌组织中的平均灰度值(IOD)分别为0.33±0.05、0.46±0.05、0.77±0.07、0.93±0.04,组间比较,差异有统计学意义(P<0.05)。Apaf-1的IOD分别为0.74±0.03、0.65±0.03、0.49±0.06、0.28±0.05,正常胃黏膜组与增生性息肉组比较,差异无统计学意义(P>0.05)。其他组两两比较,差异有统计学意义(P<0.05)。ST13的IOD分别为0.85±0.11、0.64±0.07、0.31±0.06、0.14±0.01,组间比较,差异有统计学意义(P<0.05)。腺瘤性息肉组HSP70与Apaf-1呈负相关(r=-0.817,P<0.05),HSP70与ST13呈负相关(r=-0.818,P<0.05),Apaf-1与ST13呈正相关(r=0.830,P<0.05);腺癌组HSP70与Apaf-1呈负相关(r=-0.816,P<0.05),HSP70与ST13呈负相关(r=-0.969,P<0.05),Apaf-1与ST13呈正相关(r=0.865,P<0.05)。结论HSP70在胃息肉癌变中表达递增,可用于胃癌早期监测;Apaf-1及ST13在癌变中表达递减,监测Apaf-1变化及ST13在胃癌中的特异性降低可作为胃癌诊断指标深入研究;在胃息肉癌变中,HSP70与Apaf-1、HSP70与ST13表达均呈负相关,Apaf-1与ST13呈正相关,联合检测更有助于胃癌的早期诊断。
HSP70;Apaf-1;ST13;胃息肉;胃癌
胃癌是全球范围内最常见的癌症之一,根据世界卫生组织国际癌症研究中心(IARC)公布的最新数据显示,2012年世界范围内胃癌死亡病例约72.3万,居恶性肿瘤病死率第三位。我国胃癌死亡病例约32.5万,占世界胃癌病死率的44.9%[1]。早期胃癌治疗后的5年生存率超过90%[2]。胃镜操作简便、损伤小,是诊断胃部疾病的金标准。目前胃息肉是已确定的胃癌的癌前状态,在人群中发病率为2%~4%[3],根据不同的病理组织学将其分为炎性息肉、增生性息肉、腺瘤性息肉、胃底腺息肉等,其中炎性息肉又称假性息肉,约占80%,癌变率低;增生性息肉的直径>1 cm时存在癌变的可能,约占1%[4];腺瘤性息肉检出率较低但癌变率较高,为6%~47%[5],且易复发,对术后患者进行随访发现复发率可达2.6%,且有1.3%的患者进展为胃癌。目前,内镜下切除是治疗胃息肉的首选方法,也是预防其癌变的直接方法。细胞凋亡状态及其调控基因的异常可参与肿瘤的发生、发展。热休克蛋白70(heat-shock protein 70,HSP70)的表达受细胞周期的调控,肿瘤细胞中突变或异常蛋白质的存在刺激HSP70的合成,促进肿瘤细胞增殖或抑制细胞凋亡使其呈现持续的高诱导表达,是胃癌形成、发展的重要影响因素之一。凋亡蛋白酶活化因子-1(apoptotic protease activating factor-1,Apaf-1)被认为是凋亡体的真正核心,在线粒体凋亡途径中发挥核心作用。人体内一系列信号传导级联反应均以Apaf-1为靶目标调节凋亡体,是一种重要的肿瘤抑制基因。肿瘤抑制基因13(suppression of tumorigenecity 13,ST13)由国际命名委员会命名,对ST13的研究也多集中在分子结构及与分子伴侣的相互作用,其在蛋白质调节方面扮演着非常重要的角色,可能与肿瘤细胞的生长和转移有关。本研究旨在测定胃息肉及胃癌中HSP70蛋白、Apaf-1蛋白和ST13蛋白的表达水平,探索胃息肉癌变过程中的潜在影响因素,为胃癌的早期诊断及治疗研究提供临床依据。
1 资料与方法
1.1 一般资料收集2014年12月-2015年9月于内蒙古包钢医院消化内科就诊并行胃镜检查患者的胃黏膜组织及胃息肉组织,经内窥镜和病理结合确诊,正常胃黏膜组、增生性息肉组、腺瘤性息肉组及胃癌组共72例。组织标本来源还应排除合并下列情况者:C14呼气试验提示幽门螺杆菌阳性者;既往患家族性腺瘤性息肉病史;既往患恶性肿瘤或合并其他器官系统恶性肿瘤;患有其他内分泌系统疾病;长期及4周内服用过NSAIDs、质子泵抑制剂(PPI)或糖皮质激素等;合并其他系统慢性器官功能衰竭。息肉样本选取直径>2 cm者。
1.2 分组试验分为4组,A组:正常胃黏膜组20例,男12例,女8例,年龄27~65岁,均以腹胀、中上腹不适为主要症状就诊,行胃镜检查未见异常;B组:增生性息肉组18例,男12例,女6例,年龄38~68岁,经过病理组织学证实为增生性息肉;C组:腺瘤性息肉组14例,男6例,女8例,年龄46~63岁,经过内镜形态学及病理组织学证实为腺瘤性息肉;D组:胃腺癌组20例,男14例,女6例,年龄50~95岁,消化内科内窥镜中心行胃镜活检胃腺癌标本,经过内镜形态学及病理组织学证实为胃腺癌。兔抗人HSP70抗体(美国Abcam公司)、ST13抗体(美国Abcam公司)、Apaf-1抗体(美国Abcam公司)、β-actin抗体(碧云天生物技术研究所)、二抗(Santa cruz公司)、蛋白Marker(北京全式金生物技术有限公司)。
1.3 方法
1.3.1 SDS-PAGE浓缩胶与分离胶(为1.5 mm厚双面胶的剂量)的配制:清洗装置并安装后,根据待检测蛋白分子量大小选取8%的分离胶和5%的浓缩胶,配置好凝胶,待凝固后用保鲜膜包好,4 ℃放置过夜。
1.3.2 组织中总蛋白的提取:将剪碎的组织在液氮中研磨粉碎后放入离心管(EP管)中,按每20 mg组织加入150~200 μl裂解混合液(RIPA∶PMSF=100∶1),在冰盒上充分裂解,4 ℃离心,14 000 r/min,离心40 min,取上清液进行蛋白浓度测量,吸取150 μl的样本溶液加入50 μl的4×上样缓冲液,煮5 min,冷却后进行上样。
1.3.3 电泳:安装装置,加入电泳缓冲液(1×Running buffer),每孔上样量20 μl,Marker上样量为5 μl,先设置电压50 V,30 min,待溴酚蓝将要进入分离胶,将电压换为100 V,90 min,溴酚蓝前沿将要泳出胶外立即关闭电源。
1.3.4 转膜:用超纯水冲洗凝胶,然后对比Maker切下含有目的条带的凝胶,将凝胶放入转膜缓冲液(1×Transfer buffer)中进行浸泡平衡,约30 min,处理PVDF膜,浸泡海绵,按转移装置的要求以下列顺序进行组装:负极-海绵垫-滤纸-凝胶-PVDF膜-滤纸-海绵垫-正极,调节电压为26 V,30 min。
1.3.5 封闭:取出PVDF膜,将其转移到盛有超纯水的平皿中洗5 min,放入封闭缓冲液中37 ℃水浴慢摇2 h。
1.3.6 一抗孵育:PVDF膜漂洗5 min,使用2%脱脂奶粉按照1∶5 000比例稀释HSP70抗体,1∶2 000比例稀释Apaf-1抗体,1∶2 500比例稀释ST13抗体,将稀释好的一抗与PVDF膜充分接触,4 ℃慢摇,过夜。
1.3.7 二抗孵育:PVDF膜用TBST buffer洗5 min×3次,5%脱脂奶粉稀释二抗,稀释比例为1∶5 000,室温孵育2 h。
1.3.8 ECL显色:PVDF膜用TBST buffer洗5 min×3次,避光混合ECL显色液的A液和B液(1∶1),将混合液滴在膜上,室温放置3 min,暗室中压片,待条带显出,立即用自来水洗涤、定影、捞片、晾干、扫描。
1.3.9 结果判断:扫描胶片后,采用Image J软件对蛋白印迹的灰度值(IOD)进行定量分析,以目的蛋白灰度值/内参蛋白灰度值用来反映蛋白的相对表达水平。

2 结果
2.1 HSP70蛋白在4组中的表达Western blotting结果如图1所示。HSP70蛋白在A组、B组、C组、D组组织中蛋白灰度值/内参蛋白灰度值(IOD值)的平均值分别为0.33±0.05、0.46±0.05、0.77±0.07、0.93±0.04,表达呈逐渐递增趋势。4组两两比较,差异均有统计学意义(P均<0.05)。
图1 Western blotting法检测HSP70蛋白在4组组织中的表达
Fig 1 The level of HSP70 protein detected by Western blotting
2.2 Apaf-1蛋白在4组中的表达Western blotting结果如图2所示。Apaf-1蛋白在A组、B组、C组及D组中的平均IOD值分别为0.74±0.03、0.65±0.03、0.49±0.06、0.28±0.05,表达呈逐渐递减趋势。A组与B组比较,差异无统计学意义(P>0.05)。其他组两两比较,差异有统计学意义(P<0.05)。
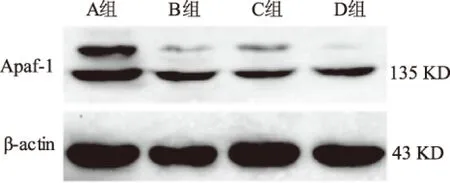
图2 Western blotting法检测Apaf-1蛋白在4组组织中的表达
Fig 2 The level of Apaf-1 protein detected by Western blotting
2.3 ST13蛋白在4组中的表达Western blotting结果如图3所示。ST13蛋白在A组、B组、C组及D组中的平均IOD值分别为0.85±0.11、0.64±0.07、0.31±0.06、0.14±0.01,表达呈逐渐递减趋势。4组两两比较,差异均有统计学意义(P均<0.05)。
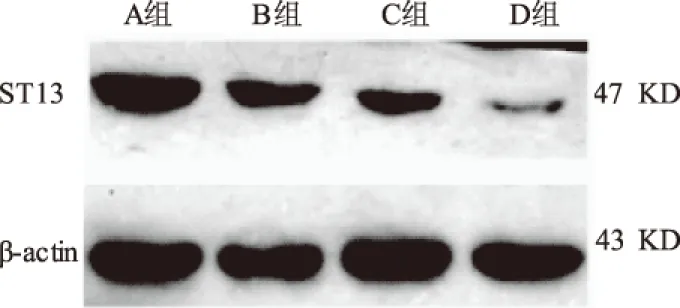
图3 Western blotting法检测ST13蛋白在4组组织中的表达
Fig 3 The level of ST13 protein detected by Western blotting
2.4 HSP70与Apaf-1之间的相关性采用Pearson方法检验腺瘤性息肉组、胃腺癌组中HSP70与Apaf-1的相关性。胃腺瘤性息肉组中,HSP70与Apaf-1的表达呈负相关(r=-0.817,P<0.05);胃腺癌组中,HSP70与Apaf-1的表达呈负相关(r=-0.816,P<0.05)。
2.5 HSP70与ST13之间的相关性采用Pearson方法检验腺瘤性息肉组、胃腺癌组中HSP70与ST13的相关性。胃腺瘤性息肉组中,HSP70与ST13的表达呈负相关(r=-0.818,P<0.05);胃腺癌组中,HSP70与ST13的表达呈负相关(r=-0.969,P<0.05)。
2.6 Apaf-1与ST13之间的相关性采用Pearson方法检验腺瘤性息肉组、胃腺癌组中Apaf-1与ST13的相关性。胃腺瘤性息肉组中,Apaf-1与ST13的表达呈正相关(r=0.830,P<0.05);胃腺癌组中,Apaf-1与ST13的表达呈正相关(r=0.865,P<0.05)。
3 讨论
随着消化内镜技术的发展与提高,对胃息肉的检出率逐渐增高,胃息肉作为胃癌癌前病变的一种形式也得到更多的关注。本研究主要以胃腺瘤与胃癌中相关蛋白的表达为切入点,探讨HSP70、Apaf-1和ST13蛋白表达的相关性。
HSP是Ritossa等[6]通过“热休克反应”发现的一类蛋白,在不改变靶蛋白结构的情况下陪伴蛋白分子在细胞内运输,并参与靶蛋白的折叠、伸展及多聚复合体的组装,被称为“分子伴侣”。HSP70是进化上高度保守的一类蛋白,分子量约70 KD,蛋白可分为3个结构域:水解ATP的ATP结合域(ATP binding domain,ATP-BD)在N端、可结合新生肽段及受损蛋白的肽结合部位(peptide binding domain,PBD)及影响HSP70 mRNA翻译数量的具有高度保守末端顺序的C端。其可参与细胞周期,促进细胞增殖,参与DNA损伤与修复、抗原的加工与提成,可增加细胞对自身免疫因子攻击的耐受性。肿瘤是机体内具有无限增殖及生长不协调的异常增殖群,由于其基因稳定性下降,导致错误折叠蛋白的增多,使得作为“分子伴侣”HSP70需求量增多,而HSP70具有参与细胞周期及抗细胞凋亡的生物学功能,从而进一步助长了肿瘤细胞的无限增殖。本研究发现,HSP70蛋白在正常胃黏膜、胃增生性息肉、胃腺瘤性息肉及胃癌组织中的蛋白表达呈递增趋势,差异均有统计学意义。与目前国内外相关研究结果相符[7-8]。胃腺瘤性息肉属于上皮内瘤变,其蛋白质的合成增加,则需要更多的“分子伴侣”参与,这也进一步证实腺瘤性息肉是癌前病变的一种,需及时采取治疗措施。
Apaf-1是核苷酸结合寡聚化结构域家族(NOD)成员之一,是一种抑癌基因,分子质量约为130 KD,表达于细胞质中,主要有3个结构域:与Caspase9形成凋亡复合体的半胱氨酸蛋白酶寡集域(CARD)为N端,中间部分为核苷酸结合寡聚化结构域(NOD)及可与细胞色素c(cytochromec,Cyt c)结合得12-13 WD40重复结构域的C端[9]。其分布于人类胚胎、人体多种组织器官及外周血白细胞。Apaf-1可影响胚胎发育,并与化疗耐药性及预后相关,但其最重要的生物功能是参与线粒体凋亡途径。当机体受到应激及DNA损伤等刺激后,线粒体膜间腔的Cyt c和线粒体源性Caspase的第二激活因子(SMAC)释放进入细胞质,Cyt c可与Apaf-1 C端结合形成Apaf-1/Cyt c复合物,提高Apaf-1与ATP/dATP结合力,形成Apaf-1寡聚化七聚体[10],暴露CARD、激活Caspase9、活化Caspase3、激活下游成分诱导细胞凋亡[11-12]。肿瘤的发生发展与细胞凋亡缺陷相关,Apaf-1线粒体凋亡通路中任何一环节受到抑制都会使得细胞凋亡无法发生,如HSP70可直接或间接阻止Apaf-1与Cyt c及proCaspase9结合。Tanase等[13]提出,Apaf-1可与其他重要的凋亡因子(如P53)一样成为良好的肿瘤标志物。本研究发现,Apaf-1蛋白在正常胃黏膜、胃增生性息肉、胃腺瘤性息肉及胃癌组织中的蛋白表达呈递减趋势,提示Apaf-1蛋白参与的线粒体凋亡途径可能受到一定程度的抑制,使得癌细胞不能凋亡。这与国内外研究相似[14]。临床上也通过使Apaf-1表达活性增高的方法来达到抑制肿瘤细胞增长的目的[15]。以Apaf-1作为肿瘤治疗的靶点目标,不但成为临床肿瘤治疗的新方向,也为抗肿瘤药物的研制提供了新思路。
ST13被认为是HSP70的分子共伴侣,分子质量约为130 KD,主要有3个结构域:参与分子同源聚合的N端、与HSP70的ATP酶区域的结合的三十四肽重复单位(Tetratricopeptide repeats,TPR)功能区及可能与HSP70的多肽结合区相互作用的GGMP重复序列和Stil区。ST13的TPR功能区与HSP70的ATP酶结构域结合后可稳定ADP构象,增强分子伴侣与多肽底物的亲和力,促进HSP70发挥作用,保证蛋白质的加工过程。本研究也发现,ST13蛋白在正常胃黏膜、胃增生性息肉、胃腺瘤性息肉及胃癌组织中的蛋白表达呈递减趋势,差异均有统计学意义,证实了ST13在胃癌及胃息肉组较正常胃黏膜组表达降低,具体机制不明确,可能与ST13在胃癌组织中参与其他凋亡途径致消耗过多或表达受到抑制相关,也可能是自身的表达缺陷,其生物学功能仍有待被发现和完善。
本研究发现,胃腺瘤性息肉组及胃腺癌组HSP70与Apaf-1的表达呈负相关。“分子伴侣”HSP70不但在蛋白质加工方面为细胞无限增殖提供了条件,也可与Apaf-1的N端的CARD结构域直接结合,阻止Caspase9与之结合,阻止了凋亡复合体Apaf-1/Caspase9的形成,无法激活Caspase3。此外,完整表达的HSP70可抑制从线粒体中释放Cyt c的过程,故HSP70在某种程度上也阻止Apaf-1/Cyt c复合体的形成。由此可见,HSP70能在Cyt c的释放和Caspase起始活化两个水平发挥作用,阻止了Apaf-1线粒体凋亡途径的启动激活,影响凋亡通路及Apaf-1的表达,阻止细胞凋亡。HSP70与ST13在胃腺瘤性息肉组及胃腺癌组的表达呈负相关,提示HSP70与ST13可能在肿瘤形成的过程中存在潜在相互关系。HSP70的过度表达是人体各组织恶性肿瘤形成的前提条件,是胃癌发生、发展过程中的重要影响因子之一。ST13 TPR结构域与HSP70结合可稳定HSP70的ADP构象,使HSP70更好地发挥功能。ST13作为分子共伴侣对HSP70起着稳定和正调控的作用。但本研究结果观察到胃腺癌组中HSP70与ST13呈负相关,与ST13分子共伴侣的生物学功能不相符,而此结果与我们之前研究[16]结果相同。Wang等[17]在研究结肠癌时发现ST13在结肠癌组织中的表达要显著低于癌旁正常黏膜组织,说明在癌变后ST13表达缺陷。以上研究结果可能提示,在胃癌组织中HSP70可能对其分子共伴侣ST13产生直接或间接下调作用,ST13也可能与其他癌基因或抑癌基因在胃癌组织及癌前病变中产生拮抗作用。Apaf-1与ST13在胃腺瘤性息肉组和胃腺癌组表达呈正相关。ST13分子具介导蛋白质与蛋白质相互作用的重要分子元件的TPR功能区,故ST13可与多种蛋白质结合,其中Apaf-1与HSP70的ATP序列有局部同源性,则ST13可能与Apaf-1的ATP结合区直接作用,由此推测其可能参与Apaf-1控制的细胞凋亡相关。在胃癌组织中,Apaf-1表达降低,继而可能下调ST13的表达。目前对ST13在肿瘤中的表达差异研究刚刚起步,还有许多分子生物学功能尚未阐明,仍需进一步探究二者的相互调节机制。
总之,HSP70、Apaf-1和ST13在胃息肉-胃癌演变过程中有明显的异常表达,且彼此之间具有相关性。对HSP70、Apaf-1和ST13进行监测将有助于筛选出胃癌高危患者,尤其是ST13蛋白在胃癌中低表达的特点,更有助于潜在胃癌的诊断。本课题检测出3种因子在人体组织中的表达及表达趋势,与众多体外细胞培养及动物模型实验检测结果相似,利于探索基础实验研究与临床人体组织研究的异同,也可成为日后研究靶向治疗的潜在靶分子。
[1]Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012 [J]. Int J Cancer, 2015, 136(5): E359-E386.
[2]Isobe Y, Nashimoto A, Akazawa K, et al. Gastric cancer treatmemnt in Japan: 2008 annual report of the JGCA nationwide registry [J]. Gastric Cancer, 2011, 14(4): 301-316.
[3]叶玲, 刘霆, 冷爱民, 等. 胃息肉的临床特征分析与治疗决策[J]. 中国现代医学杂志, 2011, 21(5): 659-664. Ye L, Liu T, Leng AM, et al. Analysis of clinical characteristics and treatment strategy for gastric polyps [J]. China Journal of Modern Medicine, 2011, 21(5): 659-664.
[4]Ahn JY, Son DH, Choi KD, et al. Neoplasms arising in large gastric hyperplastic polyps: endoscopic and pathologic features [J]. Gastrointest Endosc, 2014, 80(6): 1005-1013.
[5]Sun CK, Yang KC, Liao CS. Endoscopic management of gastric polyp with outlet obstruction without polypectomy [J]. Case Rep Gastroenterol, 2011, 5(2): 267-271.
[6]Ritossa FM. A new puffing pattern induced by heat shock and DNP in Drosophilia [J]. Experientia, 1962, 18(12): 571-573.
[7]Lee HW, Lee EH, Kim SH, et al. Heat shock protein 70 (HSP70) expression is associated with poor prognosis in intestinal type gastric cancer [J]. Virchows Arch, 2013, 463(4): 489-495.
[8]吴永梅, 居来提, 谢会忠. 慢性萎缩性胃炎热休克蛋白70(HSP70)表达的相关研究[J]. 中国现代医学杂志, 2010, 20(2): 179-182. Wu YM, Jv LT, Xie HZ. Expression of heat shock protein 70 in patients with chronic atrophic gastritis [J]. China Journal of Modern Medicine, 2010, 20(2): 179-182.
[9]Reubold TF, Wohlgemuth S, Eschenburg S. Crystal structure of full-length Apaf-1: how the death signal is relayed in the mitochondrial pathway of apoptosis [J]. Structure, 2011, 19(8): 1074-1083.
[10]Zhou M, Li Y, Hu Q, et al. Atomic structure of the apoptosome: mechanism of cytochrome c and dATP-mediated activation of Apaf-1 [J]. Genes Dev, 2015, 29(22): 2349-2361.
[11]Yuan S, Topf M, Reubold TF, et al. Changes in Apaf-1 conformation that drive apoptosome assembly [J]. Biochemistry, 2013, 52(13): 2319-2327.
[12]Hu Q, Wu D, Chen W, et al. Molecular determinants of Caspase-9 activation by the Apaf-1 apoptosome [J]. Proc Natl Acad Sci U S A, 2014, 111(46): 16254-16261.
[13]Tanase C, Albulescu R, Codrici E, et al. Decreased expression of APAF-1 and increased expression of cathepsin B in invasive pituitary adenoma [J]. Onco Targets Ther, 2015, 8: 81-90.
[14]殷舞, 莫祥兰, 韦海明, 等. Survivin、Apaf-1和Caspase-9在胃癌腹膜转移中的表达及意义[J]. 广东医学, 2014, 35(2): 221-223. Yin W, Mo XL, Wei HM, et al. Expression and significance of Survivin, Apaf-1 and Caspase-9 in process of peritoneal metastasis of gastric cancer [J]. Guangdong Medical Journal, 2014, 35(2): 221-223.
[15]Tan W, Lu J, Huang M, et al. Anti-cancer natural products isolated from Chinese medicinal herbs [J]. Chin Med, 2011, 6(1): 1-15.
[16]陈吉, 牛昊书. ST13和HSP70在胃息肉及胃癌中的表达及相关性[J]. 世界华人消化杂志, 2013, 21(29): 3059-3066. Chen J, Niu HS. Expression of ST13 and HSP70 in gastric polyps and gastric cancer [J]. World Chin J Digestol, 2013, 21(29): 3059-3066.
[17]Wang LB, Zheng S, Zhang SZ, et al. Expression of ST13 in colorectal cancer and adjacent normal tissues [J]. World J Gastroenterol, 2005, 11(3): 336-339.
(责任编辑:马 军)
Expressions and correlation of HSP70, Apaf-1 and ST13 in gastric polyps and gastric carcinoma
CHEN Ji, JIA Mingxu
Department of Gastroenterology, Inner Mongolia Medical Baogang Hospital, Baotou 014010, China
Objective To explore the expressions and relationship of HSP70, Apaf-1 and ST13 in the normal gastric mucosa, gastric polyps and gastric cancer, to provide research basis and a new way for gastric cancer in the early diagnosis and clinical treatment. Methods Gastric mucosa samples of 72 patients who suffered from surgery in the Inner Mongolia Medical Baogang Hospital by gastroscopy from Dec. 2014 to Sep. 2015 were selected, and divided into normal gastric mucosa, gastric polyps, gastric adenomatous polyps and gastric carcinoma. The levels of HSP70, Apaf-1 and ST13 proteins were detected by the Western blotting. Results The average IOD of HSP70 expressions were 0.33±0.05, 0.46±0.05, 0.77±0.07, 0.93±0.04 in normal gastric mucosa group, gastric polyps group, adenomatous polyps group, gastric carcinoma group, the difference was statistically significant among four groups (P<0.05). The average IOD of Apaf-1 expressions were 0.74±0.03, 0.65±0.03, 0.49±0.06, 0.28±0.05, the difference was statistically significant among four groups except for normal gastric mucosa and gastric polyps (P<0.05). The average IOD of ST13 expressions were 0.85±0.11, 0.64±0.07, 0.31±0.06, 0.14±0.01, the difference was statistically significant among four groups (P<0.05). The expressions of HSP70 and Apaf-1 proteins were negatively correlated in the adenomatous polyps (r=-0.817,P<0.05) and gastric carcinoma (r=-0.816,P<0.05). The expressions of HSP70 and ST13 proteins were negatively correlated in the adenomatous polyps (r=-0.818,P<0.05) and gastric carcinoma (r=-0.969,P<0.05). The expressions of Apaf-1 and ST13 proteins were positively correlated in the adenomatous polyps (r=0.830,P<0.05) and gastric carcinoma (r=0.865,P<0.05). Conclusion The expression of HSP70 is increased progressively from normal gastric mucosa to gastric polyps to gastric carcinoma suggests that high expression of HSP70 in gastric polyps can be regarded as one of the indicators of early diagnosis of gastric cancer. The expressions of Apaf-1 and ST13 are decreased progressively from normal gastric mucosa to gastric polyps to gastric carcinoma suggest that Apaf-1 and ST13 can be used as diagnostic indicators for gastric cancer. The expressions of HSP70 and Apaf-1, HSP70 and ST13 proteins are negatively correlated, Apaf-1 and ST13 protein are positively correlation in the adenomatous polyps and gastric carcinoma. The detection of HSP70, Apaf-1 and ST13 may be helpful in early diagnosis of gastric cancer.
HSP70; Apaf-1; ST13; Gastric polyps; Gastric cancer
10.3969/j.issn.1006-5709.2017.03.004
陈吉,主任医师,博士,研究方向:消化系统疾病诊治。E-mail:chenji2847@163.com
贾明旭,硕士研究生,医师,研究方向:消化系统疾病诊治。E-mail:jiamx2005@163.com
R735.2
A 文章编号:1006-5709(2017)03-0256-05
2016-06-20
