儿童BCR/ABL融合基因阳性急性淋巴细胞白血病临床分析〔1〕
2017-06-05陆海燕郝国平
陆海燕,郝国平
(山西省儿童医院,山西 太原 030013)
论 著
儿童BCR/ABL融合基因阳性急性淋巴细胞白血病临床分析〔1〕
陆海燕,郝国平*
(山西省儿童医院,山西 太原 030013)
目的:研究儿童BCR/ABL融合基因阳性急性淋巴细胞白血病临床特点、遗传学特征、治疗反应及转归。方法:分析2008年8月—2015年4月在山西省儿童医院血液科治疗的16 例BCR/ABL融合基因阳性急性淋巴细胞白血病患儿的临床特点、遗传学特征、治疗反应及转归,比较其与同期住院的BCR/ABL融合基因阴性急性淋巴细胞白血病患儿,在年龄、性别、初诊时外周血白细胞绝对值、免疫分型、染色体、融合基因、诱导治疗第15天、第33天骨髓状态及转归等方面的异同。结果:BCR/ABL融合基因阳性组16 例患者均为初诊患者,男性所占比例与同期住院BCR/ABL阴性组比较,差异无统计学差异;与BCR/ABL融合基因阴性组比较年龄偏大;初诊时外周血白细胞更高。16 例患儿免疫分型均为B细胞型,融合基因均为BCR/ABLP190阳性,15 例行染色体检查,8 例为正常染色体,4 例仅有Ph染色体异常,另3 例还有次要染色体异常。16 例均采用高危化疗方案治疗,泼尼松治疗反应、诱导治疗第15天骨髓常规、第33天骨髓、3 个月MRD与BCR/ABL融合基因阴性组比较,差异有统计学意义(P<0.05)。随访1~79 个月,3 年无事件生存率为20%,而同期住院BCR/ABL阴性组为82%,差异有统计学意义。结论:儿童BCR/ABL阳性急性淋巴细胞白血病为儿童高危型白血病,化疗疗效差。伊马替尼等酪氨酸激酶抑制剂对于儿童BCR/ABL阳性急性淋巴细胞白血病治疗评价还有待进一步研究。
BCR/ABL融合基因;急性淋巴细胞白血病;儿童
急性淋巴细胞白血病是儿童常见恶性肿瘤,近年来随着诊疗技术的提高,儿童急性淋巴细胞白血病的预后有很大改善,5 年无事件生存率(EFS)达80%。BCR/ABL融合基因阳性急性淋巴细胞白血病约占小儿急性淋巴细胞白血病的3%~5%[1],这一类型白血病依靠化疗,5 年EFS仅20%~30%,第一次完成缓解后(CR1)行人类白细胞抗原(HLA)相合同胞骨髓移植可达到60%左右,是儿童急性淋巴细胞白血病的高危型[2]。现就我科近年来收治的16 例BCR/ABL融合基因阳性急性淋巴细胞白血病临床特点、遗传学特征、治疗反应及转归进行分析,旨在总结经验,指导今后的工作。
1 资料与方法
1.1 一般资料
实验组为2008年8月—2015年4月我科收治的BCR/ABL融合基因阳性急性淋巴细胞白血病患儿16 例,均为初诊患者,其中男11 例,发病年龄5~12 岁。对照组为同期住院的BCR/ABL融合基因阴性急性淋巴细胞白血病患儿242 例,也均为初诊患者。
1.2 研究方法
分析实验组及对照组患儿年龄、性别、初诊时外周血白细胞绝对值、免疫分型、染色体、融合基因、诱导治疗第15天、第33天骨髓状态及转归。
1.3 统计学方法
采用SPSS13.0统计软件,计量资料进行t检验,计数资料进行χ2检验,寿命表法进行生存分析。
2 结 果
2.1 临床资料
2008年8月—2015年4月我科共收治BCR/ABL融合基因阳性急性淋巴细胞白血病16 例,占同期住院急性淋巴细胞白血病6.2%(16/258)。16 例均为初诊患者,其中男11 例(68.8%),与同期住院BCR/ABL阴性组的53.3%(129/242)比较,χ2=0.887,P=0.346,差异无统计学差异。BCR/ABL融合基因阳性组发病年龄5~12 岁,中位年龄8.2 岁,≥10 岁5 例;BCR/ABL融合基因阴性组年龄≥10 岁21 例,两组比较,χ2=8.438,P=0.004,差异有统计学意义,阳性组发病年龄高于阴性组。初诊时白细胞数(2.48~344)×109/L,其中>50×109/L者7 例;BCR/ABL融合基因阴性组,初诊时白细胞数(1.05~754)×109/L,其中>50×109/L者38 例,两组发病外周血白细胞计数比较,χ2=8.199,P=0.004,差异有统计学意义,阳性组发病时外周血白细胞更高(见表1)。
2.2 免疫学及遗传学检查结果
16 例患儿免疫分型均为B细胞型,5 例伴有髓系表达。融合基因均为BCR/ABLP190阳性,其中1 例伴有HOX11阳性。16 例中1 例因故未做染色体检查,8 例为正常染色体,4 例仅有Ph染色体异常即t(9;22)(q34;q11),另3 例还有次要染色体异常,分别为45,-20,-21,+mar;45,idem,der(16)t(1;16)(q22;q21)以及45,idem,t(2;19)(q24;q13),-16。

表1 两组患者临床资料 例(%)
2.3 治疗反应
16 例均采用高危化疗方案治疗,治疗第8天外周血幼稚细胞计数5 例>1×109/L,与同期住院BCR/ABL阴性组(16/242)比较,χ2=12.185,P=0.000,差异有统计学意义。第15天骨髓完全缓解(CR)率62.6%(10/16),与同期住院BCR/ABL阴性组(第15天骨髓CR率92.1%),比较χ2=5.471,P=0.019,差异有统计学意义。16例诱导治疗中1例合并感染死亡,15例参与分析。同期住院BCR/ABL阴性组诱导治疗期5 例失防,237 例参与分析,BCR/ABL阳性组第33天骨髓CR率86.7%(13/15),与同期住院BCR/ABL阴性组[第33天骨髓CR率96.6%(229/237)]比较,χ2=1.523,P=0.217,差异无统计学意义;BCR/ABL阳性组第33天骨髓MRD(微小残留病)≥10-38 例(53.3%),而同期住院BCR/ABL阴性组,第33天骨髓MRD≥10-340 例(16.9%),两者比较,χ2=8.251,P=0.004,差异有统计学意义。治疗3 个月时,BCR/ABL阳性组1 例失访,14 例参与分析;同期住院BCR/ABL阴性组16 例失访,221 例参与分析,BCR/ABL阳性组骨髓MRD≥10-49 例(64.3%),同期住院BCR/ABL阴性组27 例(12.2%),两者比较,χ2=6.180,P=0.013,差异有统计学意义(见表2)。
2.4 治疗结果
BCR/ABL组16 例患者随访1~79 个月,随访2 年以上仅4 例,其中1 例化疗后骨髓持续缓解,BCR/ABLP190持续阴性,随访79 个月;2 例诱导治疗半个月后加用伊马替尼,1 例口服16 个月,因经济原因停用,1 例口服2 年后停用,目前仍处于缓解中;1 例治疗2 年后BCR/ABLP190再次转阳,继续维持治疗,同时口服伊马替尼治疗后复查BCR/ABLP190转阴,仍随访中。余12 例中,5 例失访,7 例治疗中因复发及并发症死亡。3 年EFS BCR/ABL阳性组为20%,而同期住院BCR/ABL阴性组为82%(见图1)。

表2 两组患者临床资料 例(%)
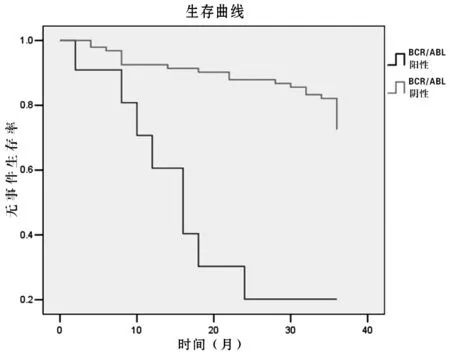
图1 BCR/ABL阳性组及阴性组3 年EFS比较
伊马替尼的使用:16 例中8 例口服伊马替尼,均为不规律使用,剂量260~340 mg/m2。目前3 例骨髓持续缓解,余5 例中3 例死亡,2 例失访。
3 讨 论
BCR/ABL融合基因是由ph染色体即t(9;22)(q34;q11)异位后产生的,其转录后形成的BCR/ABL融合蛋白具有酪氨酸激酶活性,可干扰细胞正常调控,抑制细胞凋亡,从而可引起白血病发生,是BCR/ABL融合基因白血病发生的机制之一[3-4]。由于BCR断裂点不同可形成3 种分子量的蛋白:P190、P210、P230[4]。儿童ALL中BCR/ABL融合基因阳性者占3%~5%,而成年人可达15%~25%[1,5]。此型多见于年长儿,发病时外周血白细胞数常高于其他类型的白血病。免疫分型主要为B细胞型,可伴有髓系表达。BCR/ABL融合基因阳性ALL除具有ph染色体即t(9;22)(q34;q11)异常外,2/3具有次要染色体异常,多见类型有假二倍体、亚二倍体、超二倍体、+ph染色体以及9P缺失,部分与预后相关[6-7]。本研究16 例发病年龄比同期住院BCR/ABL融合基因阴性组年长,且发病时白细胞数高于BCR/ABL融合基因阴性组。16 例免疫分型均为B细胞型,5 例伴有髓系表达。15 例行染色体检查,3 例伴有次要染色体异常,均为亚二倍体。BCR/ABL融合基因阳性急性淋巴细胞白血病预后差,依靠化疗,5 年无事件生存率仅20%~30%,是影响预后的独立危险因素。在取得CR1后行匹配的造血干细胞移植是此型的主要治疗选择,5 年EFS可达到50%~60%[2]。本研究中16 例因条件限制均未行骨髓移植治疗,给予高危方案化疗,3 年EFS为20%。近年来资料表明强化疗+酪氨酸激酶抑制剂可成为BCR/ABL融合基因阳性急性淋巴细胞白血病治疗的选择。美国COG AALL0031方案将伊马替尼应用于儿童ph+ALL的治疗,取得3 年EFS(88±11)%,长期生存率的研究仍在观察中[8]。本研究中有8 例口服伊马替尼治疗,均为不规律治疗,其疗效有待进一步总结。儿童BCR/ABL阳性急性淋巴细胞白血病为儿童高危型白血病,化疗疗效差。伊马替尼等酪氨酸激酶抑制剂对于儿童BCR/ABL阳性急性淋巴细胞白血病治疗评价还有待今后进一步研究。
[1]PUI C H,EVANS W E.Treatment of acute lymphoblastic leukemia[J].N Engl J Med,2006,354:166-178.
[2]Schultz K R,Prestidge T,Camitta B,et al.Philadelphia chromosomepositive acute lymphoblastic leukemia in children:new and emerging treatment options[J].Expert Rev Hematol,2010,3(6):731-742.
[3]LUGO T G,PENDERGAST A M,MULLER A J,et al.Tyrosine kinase activity and transformation potency of bcr-abl oncogene products[J].Science,1990,247(4 946):1 079-1 082.
[4]NASHED A L,RAO K W,GULLEY M L.Clinical applications of bcr/abl molecular testing in acute leukemia[J].J Mol Diagn,2003,5(2):63-72.
[5]ARIC M,SCHRAPPE M,HUNGER S P,et al.Clinical outcome of children with newly diagnosed Philadelphia chromosome-positive acute lymphoblastic leukemia treated between 1995 and 2005[J].J Clin Oncol,2010,28(41):4 755-4 761.
[6]HEEREMA N A,HARBOTT J,GALIMBERTI S,et al.Secondary cytogenetic aberrations in childhood Philadelphia chromosome positive acute lymphoblastic leukemia are nonrandom and may be associated with outcome[J].Leukemia,2004,18(4):693-702.
[7]YANADA M,TAKEUCHI J,SUGIURA I,et al.Karyotype at diagnosis is the major prognostic factor predicting relapse free survival for patients with Philadelphia chromosome-positive acute lymphoblastic leukemia treated with imatinib-combined chemotherapy[J].Haematologica,2008,93(2):287-290.
[8]SCHULTZ K R,BOWMAN W P,ALEDO A,et al.Improved early event-free survival with imatinib in philadelphia chromosome-positive acute lymphoblastic leukemia:a children′s oncology group study[J].J Clin Oncol,2009,27(31):5 175-5 181.
(本文编辑:张红)
BCR/ABL gene positive childhood acute lymphoblastic leukemia:report of 16 cases
LU Haiyang,HAO Guoping
(Shanxi Children′s Hospital,Taiyuan 030013,China)
Objective:The study was purposed to analyze the clinical and genetic features,therapeutic response and prognosis of childhood acute lymphoblastic leukemia with BCR/ABL fusion gene transcript and to guide clinical practice.Methods:A total of 100 patients with limb fractures were enrolled in the study from September 2012 to December 2015.The patients were divided into two groups according to the intervention group:routine group and conventional group (n=50).The conventional group was given routine functional exercise intervention,the conventional group on this basis to give early passive functional intervention.The quality of life was assessed by the activities of daily living(ADL).The follow-up period was 6 months.The activity of the elbow,ulnar joint,knee joint and the quality of life before and after the intervention were observed.Results:Compared with BCR/ABL negative,BCR/ABL positive pediatric acute lymphoblastic leukemia patients had older age and higher white blood cell counts.All of 16 cases were B immunology.8 of 15 patients had normal chromosome,4 had philadelphia chromosome,3 had secondary aberrations.All of 16 cases received chemotherapy of high risk scheme.Compared with BCR/ABL negative ALL on the rate of CR on day 15,the MRD on day 33 and 3 months(P<0.05).Follow-up period was 1~79 months,the 3 years event free survival was 20%,on the contrary,82% in BCR/ABL negative pediatric acute lymphoblastic leukemia patients.Conclusion:BCR/ABL positive pediatric acute lympholastic leukemia patients have older age,higher white blood cel,poor prognosis The advantage of tyrosine kinase inhibitor to BCR/ABL gene positive childhood acute lymphoblastic leukemia still need study.
BCR/ABL fusion gene transcript;acute lymphoblastic leukemia;children
1671-8631(2017)05-0323-04
〔1〕本项目为山西省卫生和计划生育委员会科研课题(项目编号:201301037)
R725
B
2016-09-14
*本文通讯作者:郝国平
