乙酸乙酯的制备要点透析
2017-06-05山东省莘县实验高级中学
■山东省莘县实验高级中学 徐 帆
乙酸乙酯的制备要点透析
■山东省莘县实验高级中学 徐 帆
乙酸乙酯的制备实验是有机化学中重要的实验之一。该实验很典型,它全面、具体地体现了有机实验的特点。乙酸乙酯的制备实验在各类测试题中经常被考查到,近几年在高考题中也频频出现。因此,我们需要对乙酸乙酯的制备实验进行全面、具体的分析,总结出其中的特点,归纳该实验中的要点。这样我们才能更加深刻地理解、掌握该实验。
要点1:反应条件及实质
反应的条件:浓硫酸、加热。反应的实质:羧酸脱羟基,醇脱羟基氢,其余部分相互结合成酯,CH3COO CH2CH3+H2O。
【要点辨析】
(1)浓硫酸在此实验中起催化剂和吸水剂的作用。以浓硫酸作催化剂,提高反应速率。以浓硫酸作吸水剂,提高乙醇、乙酸的转化率。
(2)加热时要用小火均匀加热,防止乙醇和乙酸大量挥发,防止液体剧烈沸腾。
(3)酯化反应中,酸脱羟基,醇脱氢,如果乙醇中氧原子为18O,反应的化学方程式为:反应。下列叙述中不正确的是( )。
A.生成的乙酸乙酯中含有18O
B.生成的水分子中不含18O
C.可能生成摩尔质量为88g·mol-1的乙酸乙酯
D.反应后的混合物中有两种物质含18O
分析:将1mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应,乙酸脱羟基,乙醇脱氢,生成乙酸乙酯,由反应原理和“要点辨析”中的化学方程式知:生成的乙酸乙酯中含有18O,生成的水分子中不含18O;产物乙酸乙酯中存在用18O标记的氧,所以乙酸乙酯的摩尔质量为90g·mol-1;由于酯化反应是可逆反应,反应后乙醇仍存在,产物乙酸乙酯中存在用18O标记的氧,故18O只存在于乙醇和乙酸乙酯中。
答案:C
要点2:反应装置(如图1)


图1
(4)酯化反应属于取代反应。
(5)该反应为可逆反应,不能进行到底。将1mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分
【要点辨析】
(1)盛反应液的试管要倾斜,与桌面约成45°角,增大受热面积,不能竖直加热。
(2)装置中的长导管起导气和冷凝回流的作用。
(3)导管不能插入到Na2CO3溶液中,以防止倒吸回流现象的发生。
(4)事先可在试管中加入几片碎瓷片,以防止液体暴沸。某课外兴趣小组欲在实验室里制备少量乙酸乙酯,该小组的同学设计了以下四种制取乙酸乙酯的装置(如图2),其中正确的是( )。
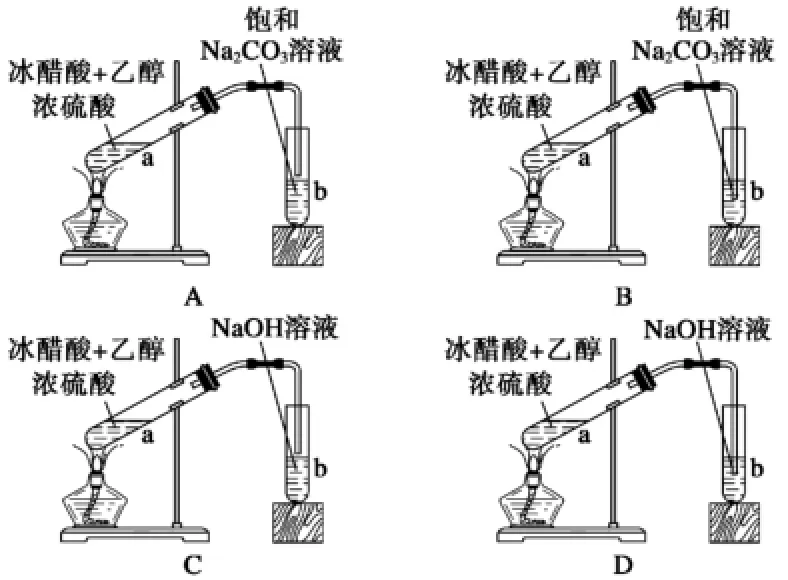
图2
分析:B和D中的导管插到试管b内液面以下,会引起倒吸,B、D错;C项试管b中的试剂NaOH溶液会与生成的乙酸乙酯反应。
答案:A
要点3:所用试剂及乙酸乙酯的提纯
所用试剂:乙醇、浓硫酸和冰醋酸。生成的乙酸乙酯(内含少量乙酸、乙醇等杂质)用饱和碳酸钠溶液提纯。
【要点辨析】
(1)反应物的加入顺序为:乙醇、浓硫酸和冰醋酸,不能先加浓硫酸。
(2)用盛饱和Na2CO3溶液的试管收集生成的乙酸乙酯,饱和Na2CO3溶液的作用为中和乙酸、溶解乙醇、降低乙酸乙酯在水中的溶解度。
(3)不能用NaOH溶液代替Na2CO3溶液,因为NaOH溶液碱性很强,会使乙酸乙酯水解。
(4)酯化反应是一个可逆反应。为了提高酯的产量,一般是使反应物酸和醇中的一种过量。在实验室里一般采用乙醇过量的办法。
(5)提纯试管中含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,乙酸的酸性强于碳酸钠,用饱和碳酸钠除去乙酸,还可以降低乙酸乙酯的溶解度使之析出,振荡后静置分液,即可得到乙酸乙酯(分液漏斗上口倒出)。请你与某小组的同学共同探究乙醇与乙酸的酯化反应实验。
(1)请你根据图3,补画实验室制取乙酸乙酯的装置图。
图3
(2)其中小试管中装入的物质是____;其主要作用是____、____、____。
(3)分离小试管中制取的乙酸乙酯应使用的仪器叫作____;分离完毕,应从该仪器____(填“下口放出”或“上口倒出”)。
(4)实验完毕,发现反应液有些变黑,其原因是____。
(5)该实验中,若用3mol乙醇和1mol乙酸在浓硫酸作用下加热,充分反应后,能否生成1mol乙酸乙酯?____(填“能”或“不能”),原因是____(不考虑原料损耗)。
(6)写出该反应的化学方程式:___。
分析:(1)乙酸乙酯的制取属于液体和液体之间通过加热制取,为了防止暴沸还需要加入碎瓷片,装置如图4所示。(2)由于生成的乙酸乙酯中会混入乙酸和乙醇,所以为了除去乙酸和乙醇,需要加入饱和碳酸钠溶液,作用是中和乙酸、溶解乙醇、降低乙酸乙酯在水中的溶解度。(3)乙酸乙酯不溶于水,可以通过分液进行分离。分液的主要仪器是分液漏斗。因为乙酸乙酯的密度小于水的密度,所以要从上口倒出。(4)由于浓硫酸具有脱水性,因此在反应过程中有可能将反应剩余的乙醇和乙酸炭化,从而使反应液变黑。(5)由于酯化反应是可逆反应,所以不可能生成1mol乙酸乙酯。(6)反应的方程式为
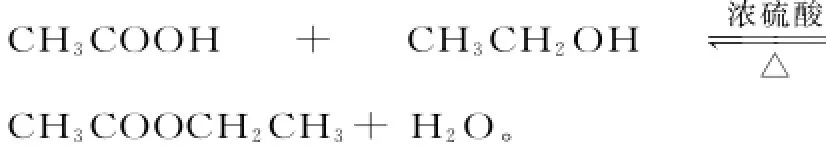
答案:(1)如图4。
(2)饱和Na2CO3溶液 中和乙酸 溶解乙醇
降低乙酸乙酯在水中的溶解度
(3)分液漏斗上口倒出

图4
(4)热浓硫酸将反应剩余的乙醇和乙酸炭化
(5)不能 该反应是可逆反应,转化率不能达到100%

【知识演练】
【根据2016年上海高考题改编】乙酸乙酯广泛应用于药物、染料、香料等工业。如图5所示,中学化学改进实验常用a装置来替代b装置制备乙酸乙酯。

图5
完成下列填空:
(1)加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是由于浓硫酸能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率。浓硫酸用量又不能过多,原因是____。
(2)饱和Na2CO3溶液的作用是____、____、___。
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,____、___,然后分液。
(4)若用b装置制备乙酸乙酯,其缺点有____、___。由b装置制得的乙酸乙酯粗产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有杂质乙醚(无色有机溶剂,与乙酸乙酯可互溶,沸点相差较大),分离乙酸乙酯与该杂质的方法是____。
分析:(1)由于浓硫酸具有强氧化性和脱水性,会使有机物炭化,降低酯的产率,所以浓硫酸用量又不能过多。
(2)由于生成的乙酸乙酯中含有乙醇和乙酸,所以饱和Na2CO3溶液的作用是反应乙酸、溶解乙醇、减少乙酸乙酯的溶解。
(3)乙酸乙酯不溶于水,因此反应结束后,将试管中收集到的产品倒入分液漏斗中,振荡、静置,然后分液即可。
(4)根据b装置可知由于不是水浴加热,温度不易控制,因此制备乙酸乙酯的缺点是原料损失较大、容易发生副反应。乙醚与乙酸乙酯的沸点相差较大,则分离乙酸乙酯与乙醚的方法是蒸馏。
答案:(1)浓硫酸具有强氧化性和脱水性,会使有机物炭化,降低酯的产率
(2)中和乙酸 溶解乙醇 降低乙酸乙酯在水中的溶解度
(3)振荡 静置
(4)原料损失较大 易发生副反应蒸馏
(责任编辑 谢启刚)
启事:随着高考制度的不断改革,全国参加高校自主招生的学生越来越多,为了更好地备战自主招生考试,本刊编辑部决定于今年5月份出版一期增刊,主要内容为全国部分高校自主招生面试、笔试典型题归类解析,定价6元,邮寄费1元。欢迎订阅。邮局汇款: (450004)郑州市顺河路11号《中学生数理化》(高中)编辑部。收款人:王福华。转账汇款:中国邮政储蓄,户名王福华,卡号6221884910016853274。
本刊编辑部
