用分液漏斗改进铜与稀硝酸的反应实验
2016-04-21王超贾同全
王超+贾同全
铜与稀硝酸的反应实验是高中化学课程中的重要演示实验。该实验装置复杂、耗时过长、污染环境。为适应课堂实验演示,对实验装置和实验方法进行了改进,使其省时、环保、简单。
铜与稀硝酸的反应是高中化学中的重要反应,是讨论硝酸性质的重要特征反应之一。该反应实验中产生的一氧化氮气体(无色)极易被空气中的氧气氧化成二氧化氮气体(红棕色),以致该实验按常规方法操作难以达到理想的实验演示效果。为了解决此问题,虽已有许多同行设计了不少改进方法或装置,但也没能解决诸如装置复杂、操作不方便、耗时过长、反应不容易控制等问题。为了简化实验装置,降低试剂用量,省时省力,并达到较好的实验效果,设计如下实验方法。
1实验用品
实验器材:铁架台(带铁圈)、烧杯(100 ml)、分液漏斗(60 ml)、注射器(50 ml)、玻璃导管、橡胶管、单孔橡皮塞、止水夹。
实验药品:铜丝(长约20 cm)、稀硝酸(浓度小于1︰1的体积比)。
2实验步骤
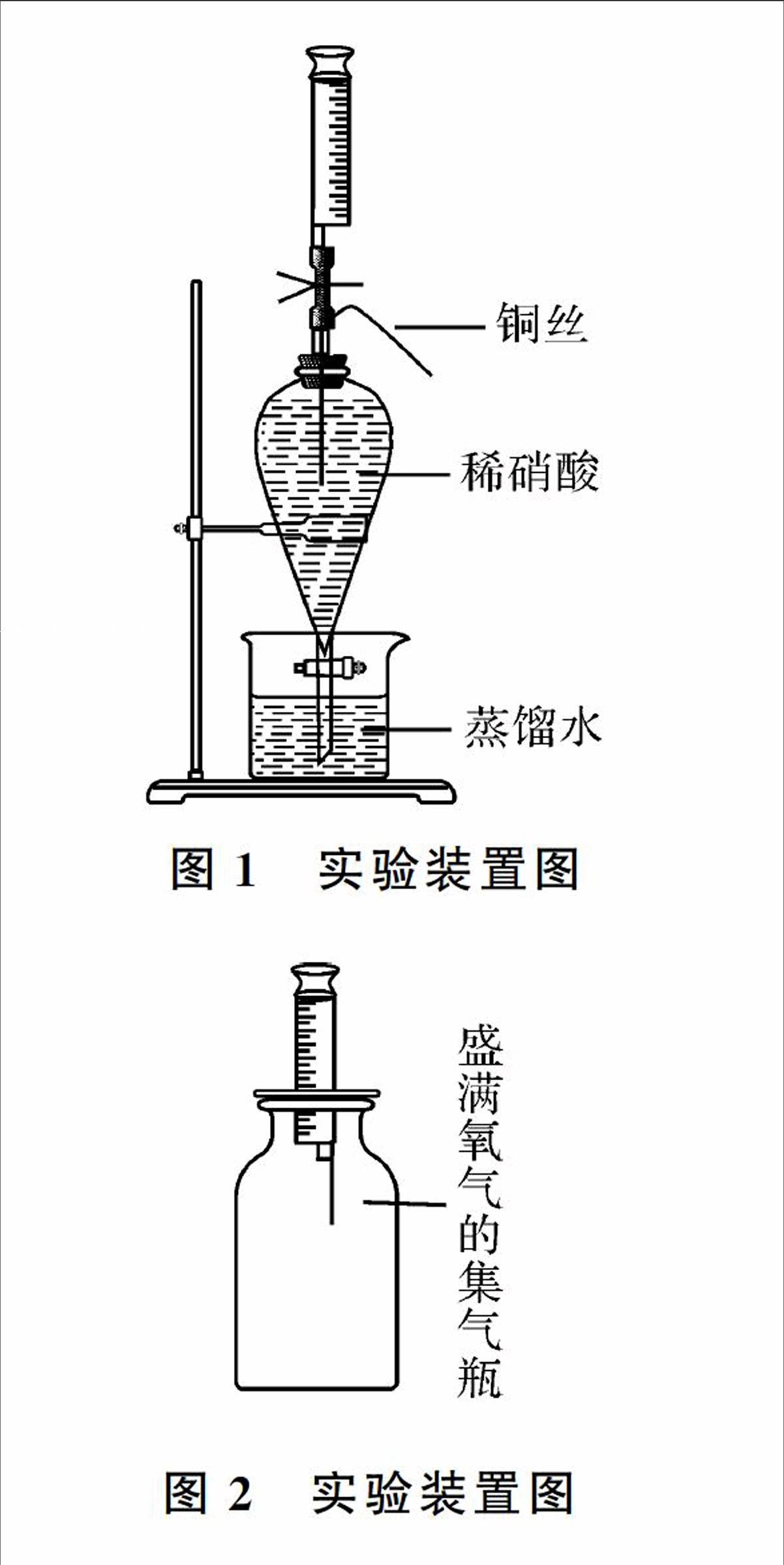
(1)在100 ml烧杯中注入50 ml蒸馏水(液面高度以能浸没分液漏斗末端为限)。图1实验装置图关闭分液漏斗的玻璃活塞,在分液漏斗中注满稀硝酸,塞上连有注射器的单孔橡皮塞,将其固定在铁架台上。用止水夹夹紧导管上的橡胶管,然后打开分液漏斗的玻璃活塞(如图1所示)。
(2)在橡胶管与玻璃导管接口处,将铜丝先插入橡胶管,再经过玻璃导管直至盛有稀硝酸的分液漏斗中。
3实验现象
铜丝一进入分液漏斗中,因为其与稀硝酸反应,溶液颜色变蓝,漏斗中的液面持续下降,而烧杯中的液面迅速上升,该现象表明有无色气体产生。当漏斗中收集20 ml左右的气体时,将铜丝缓缓抽出。此时,反应停止,关闭分液漏斗的玻璃活塞。
图2实验装置图将注射器取下,吸取20 ml氧气(见图2),再次连到橡胶管上。打开止水夹,缓缓向分液漏斗中注入10 ml左右的氧气,可看到分液漏斗中气体变为红棕色。待气体颜色变浅或无色时,关闭止水夹,打开分液漏斗的玻璃活塞,可看到漏斗中液面上升,烧杯中液面下降,说明漏斗中气体减少了。关闭分液漏斗的玻璃活塞,再次打开止水夹,缓缓向分液漏斗中注入5 ml左右的氧气,可看到分液漏斗中气体又变为红棕色。待气体颜色变为无色时,关闭止水夹,打开分液漏斗的玻璃活塞,可看到漏斗中液面上升,烧杯中液面下降,并可充满整个漏斗。
4改进后实验的优点
(1)装置简单。该实验设计未涉及大型或操作要求高的仪器设备,适宜课堂演示操作。
(2)反应快且易于控制。整个实验操作过程不超过3 min,气体的量的控制可通过将铜丝抽离稀硝酸而停止。
(3)实验装置气密性好。铜丝通过橡胶管和玻璃管直至分液漏斗的稀硝酸中,橡胶管会紧紧包裹和挤压铜丝,不会有气体泄露。
(4)绿色环保。该实验将一氧化氮的制取、验证与尾气处理一体化,没有气体的泄露。
