细胞壁降解酶在油茶炭疽病菌致病过程中的作用研究
2017-06-05周国英刘君昂何苑皞
金 勤, 周国英, 刘君昂, 何苑皞
(中南林业科技大学,森林有害生物防控湖南省重点实验室;经济林培育与保护省部共建教育部重点实验室, 长沙 410004)
细胞壁降解酶在油茶炭疽病菌致病过程中的作用研究
金 勤, 周国英*, 刘君昂, 何苑皞
(中南林业科技大学,森林有害生物防控湖南省重点实验室;经济林培育与保护省部共建教育部重点实验室, 长沙 410004)
为明确细胞壁降解酶在油茶炭疽病菌致病过程中的作用,本文研究了活体内外炭疽病菌产生的细胞壁降解酶活性及其对叶片的降解情况。结果表明,活体外以羧甲基纤维素钠(CMCNa)为诱导底物,羧甲基纤维素酶(Cx酶)和漆酶活性最高;以柑橘果胶为诱导底物,果胶酶活性最高;以油茶叶为诱导底物,纤维素酶、果胶酶和漆酶可产生较高活力;并且经5种诱导物诱导的酶液对叶片均有降解作用。发病叶片的各部位,以病健交界处细胞壁降解酶活性最高。接种4 d后开始发病,其细胞壁降解酶活性迅速增强; 6 d后滤纸酶(FPA)、β-葡萄糖苷酶和漆酶活性达最大值,分别为4.53、7.44、1.21 U/mg;而 Cx酶和果胶酶在第8天时酶活性最高,分别为15.79和25.49 U/mg;接种10~16 d,酶活性比较稳定。上述结果表明,纤维素酶、果胶酶和漆酶在油茶炭疽病菌致病过程中起重要作用。
油茶; 炭疽病菌; 细胞壁降解酶
油茶炭疽病是油茶Camelliaoleifera生产上的主要病害之一,其中以胶孢炭疽菌Colletotrichumgloeosporioides引起的炭疽病最为常见。该病原菌具有潜伏侵染的特性,可以感染花、叶、果实,引起严重的落花、落叶、落果。目前,国内关于油茶炭疽病病原的生物学特性、发生规律及生物防治菌剂的研究已有一些报道[1-5],但其致病机制尚不明确。了解细胞壁降解酶在炭疽病致病机理中的作用,对进一步针对性地控制病害具有重要意义。李宝聚等[6-7]发现黄瓜黑星病菌Cladosporiumcucumerinum在瓜条感病的病健交界处产生的细胞壁降解酶活性最高,且纤维素酶、果胶酶对黄瓜超微结构有影响,可迅速消解叶片组织,引起软腐。刘志恒等[8]报道接种黄瓜棒孢叶斑病菌Corynesporacassiicola后果胶酶活性先于纤维素酶达到高峰值,而且病菌在活体内和活体外产生的细胞壁降解酶的活性明显不同。陈晓林等[9]发现苹果树腐烂病菌Valsaceratosperma无论在活体组织内,还是在活体组织外,均能分泌一系列的细胞壁降解酶—多聚半乳糖醛酸酶(PG)、果胶甲基半乳糖醛酸酶(PMG)、纤维素酶、β-葡萄糖苷酶和木聚糖酶。杨媚等[10]研究表明内切葡聚糖酶β-1,4-葡聚糖酶以羧甲基纤维素钠为诱导物时活性最高,多聚半乳糖酵酸酶和果胶甲基半乳糖醛酸酶以果胶酶为诱导物时活性最高;通过酶处理叶片后发现细胞壁降解酶确实对水稻叶片组织造成损伤,并且随着酶浓度升高,损伤程度逐渐加重。
植物病原菌与寄主相互识别的过程中,病原菌分泌细胞壁降解酶,降解植物组织,更有利于病原菌的侵入、定殖与扩展。因此,细胞壁降解酶是植物病原真菌的重要致病因子[11-12]。本试验通过油茶炭疽菌活体外诱导培养和接种油茶叶片后,测定其产生的细胞壁降解酶活性,分析比较其变化规律,为深入了解其致病机制、制定油茶炭疽病的综合防治措施提供理论依据。
1 材料与方法
1.1 供试材料和培养基
供试菌株:胶孢炭疽菌,中南林业科技大学微生物实验室保存;供试油茶:‘湘林210’,两年生盆栽苗,购于湖南省林业种苗中心。
酶诱导培养基采用Czaper液体培养基[13]并稍作改良:KNO32.0 g,KCl 0.5 g,FeSO40.01 g,K2HPO41.0 g,MgSO4·7H2O 0.5 g,果胶10 g,水1 000 mL, pH 5.0。分别以相同质量的蔗糖、麸皮、羧甲基纤维素钠(CMCNa)和油茶叶片代替果胶得到不同诱导物的培养基。
1.2 离体培养条件下油茶炭疽病菌细胞壁降解酶的提取及纯化
将PDA培养基上活化好的炭疽菌用6 mm打孔器沿菌落边缘打取菌饼,挑取6块菌块接种至150 mL诱导产酶培养基中,置于28℃下连续振荡培养7 d,取出培养滤液经4层纱布过滤以除去菌丝,然后4℃下10 000 r/min离心15 min,弃去沉淀,上清液备用。
向滤液中加入饱和度为60%的(NH4)2SO4,在4℃下静置5 h,然后4℃、10 000 r/min离心20 min得到沉淀,用50 mmol/L醋酸-醋酸钠缓冲液(pH 5.0)溶解沉淀。在同样的缓冲液中,于4℃下透析24 h,每12 h换一次透析液,纯化的酶在-20℃下保存。
1.3 炭疽病菌产生细胞壁降解酶对油茶叶片的降解作用
采用离体叶片浸渍法,将1.2中得到的经5种诱导物诱导的酶液各20 mL,分别滴加在培养皿内的棉花上,使棉花完全润湿。取油茶嫩叶,平铺在棉花上(正面向下)。同时,接种炭疽菌菌块的叶片平放在垫有湿润棉花(无菌水浸湿)的培养皿中,20℃左右光照条件下培养,3 d后观察叶片变化情况,以煮沸灭活的酶液为对照处理。
1.4 活体内油茶叶片不同部位炭疽病菌细胞壁降解酶的提取
将活化好的炭疽病菌接种至新鲜的PDA培养基中央,在28℃恒温培养箱中培养3~5 d,再用灭菌的牙签将菌丝涂断,相同条件下继续培养5 d,菌落表面产生橘红色的分生孢子堆。无菌蒸馏水冲洗平板,制备孢子悬浮液,经血球计数板计数,调整孢子浓度至1×106个/mL。
采用喷雾法向油茶苗均匀地喷洒孢子悬浮液,每株接种20 mL,共接种100株,置于28℃培养箱中培养。从发病的油茶叶片病斑处、病健交界处、健处分别切取0.2 cm2的组织,取样时间为接种后 5 d,3次重复。按1 g鲜重加入5 mL浓度1 mol/L NaCl提取液(20 mmol/L Tris-HCl 缓冲液,pH 7.4),在4℃研磨、过滤,并8 000 r/min离心,上清液按照1.2的方法经提纯后备用。
1.5 人工接种发病叶细胞壁降解酶活性的动态变化
于接种后4、6、8、10、12、14、16 d取病健交界处组织,3次重复,细胞壁降解酶的提取方法同1.4,以接种无菌水处理为对照。
1.6 细胞壁降解酶活性测定及标准曲线制作
羧甲基纤维素酶(Cx)、滤纸酶(FPA)、果胶酶(PMG)活力测定参考李宝聚等[6]的方法;β-葡萄糖苷酶活力测定参考Douaiher等[14]的方法;漆酶活性测定参考詹旭等[15]的方法。
纤维素酶(羧甲基纤维素钠酶、滤纸酶和β-葡萄糖苷酶)和果胶酶1个酶活力单位(U)为每分钟催化底物产生1 μg还原糖所需的酶量。漆酶1个酶活力单位为1 min引起0.01个A值的增加所需的酶量。
蛋白质含量按Bradford的方法,以牛血清白蛋白为标准蛋白质,用考马斯亮蓝G-250显色测定。3,5-二硝基水杨酸法制作葡萄糖标准曲线和D-半乳糖醛酸标准曲线。所有的测定试验均重复3次。
1.7 数据分析
采用Excel 2007对数据进行处理和分析,采用SPSS 19.0统计分析软件对数据进行统计分析,所有数据为平均值±标准差。
2 结果与分析
2.1 活体外炭疽病菌产生的细胞壁降解酶活性
由表1可知,炭疽病菌在添加蔗糖、果胶、麸皮、CMCNa、油茶叶片5种诱导物的培养基上均能产生羧甲基纤维素酶、果胶酶和漆酶,但不同诱导物产生的酶活力存在较大差异。在以CMCNa为碳源的培养基中,Cx酶和漆酶活性分别为73.20 U/mg和4.50 U/mg,均显著高于其他诱导物产生的酶活性(P<0.05);而以蔗糖为碳源的培养基中,Cx酶活性最低。在以果胶为碳源的培养基中,果胶酶活性显著高于其他诱导物产生的果胶酶活性(P<0.05), CMCNa和蔗糖诱导产生的果胶酶活性较低。油茶叶片诱导培养基中均能检测出较高活性的Cx酶、果胶酶和漆酶,说明油茶叶片能够诱导炭疽病菌产生细胞壁降解酶。
1) 同列数据后具不同小写字母表示差异显著(P<0.05)。 Data followed by different letters in the same column are significantly different at 0.05 level.
2.2 炭疽病菌活体外诱导产生细胞壁降解酶的降解作用
以菌丝块和蔗糖、果胶、麸皮、CMCNa、油茶叶诱导产生的细胞壁降解酶(经提纯的)分别接种油茶叶片,图1结果显示:接种菌丝块的病叶初期呈黑色斑点,然后逐渐变成黑褐色病斑。接种灭活酶液的对照叶片在3 d内没有出现受害症状,仍然保持健康状态;而5种不同处理的酶液均对叶片有明显的降解作用,但有一定差异。蔗糖、果胶、油茶叶诱导产生的酶液对叶片降解程度轻,叶片局部褐变并有水渍化症状。麸皮诱导产生的酶液作用于叶片后,叶片大面积出现黑色,并有轻微的腐烂症状。CMCNa诱导产生的酶液对叶片降解程度高,整个叶片呈现黑色。叶片上病斑大小依次为CMCNa>麸皮>油茶叶片>果胶>蔗糖>菌丝块。(见图1)
2.3 活体内炭疽病菌产生的细胞壁降解酶活性
人工接种后发病的油茶叶片病斑处、病健交界处和健处3种酶活力如表2所示。Cx酶、果胶酶、漆酶在病叶不同部位的酶活性差异明显,以病健交界处酶活性最高,病斑处次之,健处最低,并且在健处检测不到果胶酶和漆酶活性。由此可见,在炭疽病菌的致病过程中,纤维素酶、果胶酶、漆酶这3种酶均起到了作用。
2.4 人工接种油茶叶片细胞壁降解酶活性的动态变化
油茶叶片发病后,纤维素酶活性变化见图2。Cx酶活性迅速增高,接种后第8天活性为15.79 U/mg,达到最高峰;然后酶活性降低,第10~16 天酶活性下降趋势平缓。接种后4~6 d,FPA酶和β-葡萄糖苷酶活性上升缓慢,均在第6 天酶活性最高,分别为4.53、7.44 U/mg;6~12 d酶活性比较稳定,12 d后开始下降,到16 d时仍可检测到FPA酶和β-葡萄糖苷酶活性。图3结果显示,接种后4~8 d,果胶酶活性呈近直线上升趋势,之后活性迅速降低,10 d后活性达到稳定状态,第16 天酶活性为21.95 U/mg。图4结果表明,接种4~6 d的时间里,漆酶活性增幅最大,6 d时酶活性为最大值1.21 U/mg;之后,随着接种时间的延长而逐渐降低;至第16 天时,漆酶活性为0.79 U/mg。从以上试验结果可知,随着病斑的逐渐扩展,各种酶活性呈现动态变化的过程,均在10 d后活性稳定。同时也表明,在整个发病过程中,细胞壁降解酶是油茶叶片组织变化的主要因素。

图1 炭疽病菌产生的细胞壁降解酶对油茶叶片的降解作用Fig.1 Degradation of Camellia oleifera leaves by cell wall-degrading enzymes produced by Colletotrichum gloeosporioides
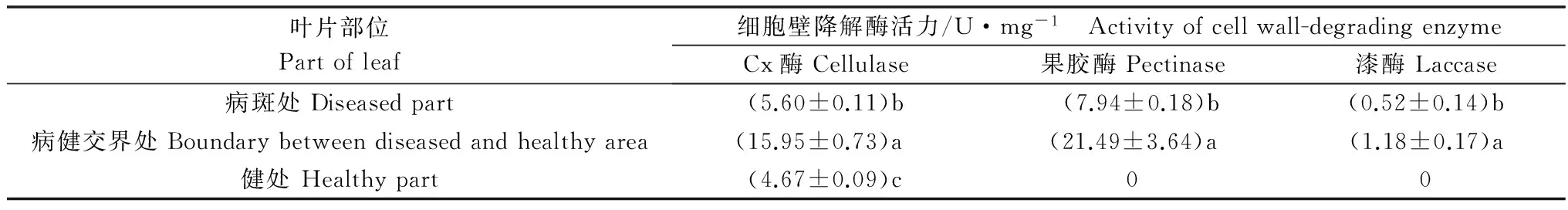
叶片部位Partofleaf细胞壁降解酶活力/U·mg-1 Activityofcellwall-degradingenzymeCx酶Cellulase果胶酶Pectinase漆酶Laccase病斑处Diseasedpart(5.60±0.11)b(7.94±0.18)b(0.52±0.14)b病健交界处Boundarybetweendiseasedandhealthyarea(15.95±0.73)a(21.49±3.64)a(1.18±0.17)a健处Healthypart(4.67±0.09)c00

图2 病健交界处纤维素酶活性的动态变化Fig.2 Changes of cellulase activity along the boundary between diseased and healthy area
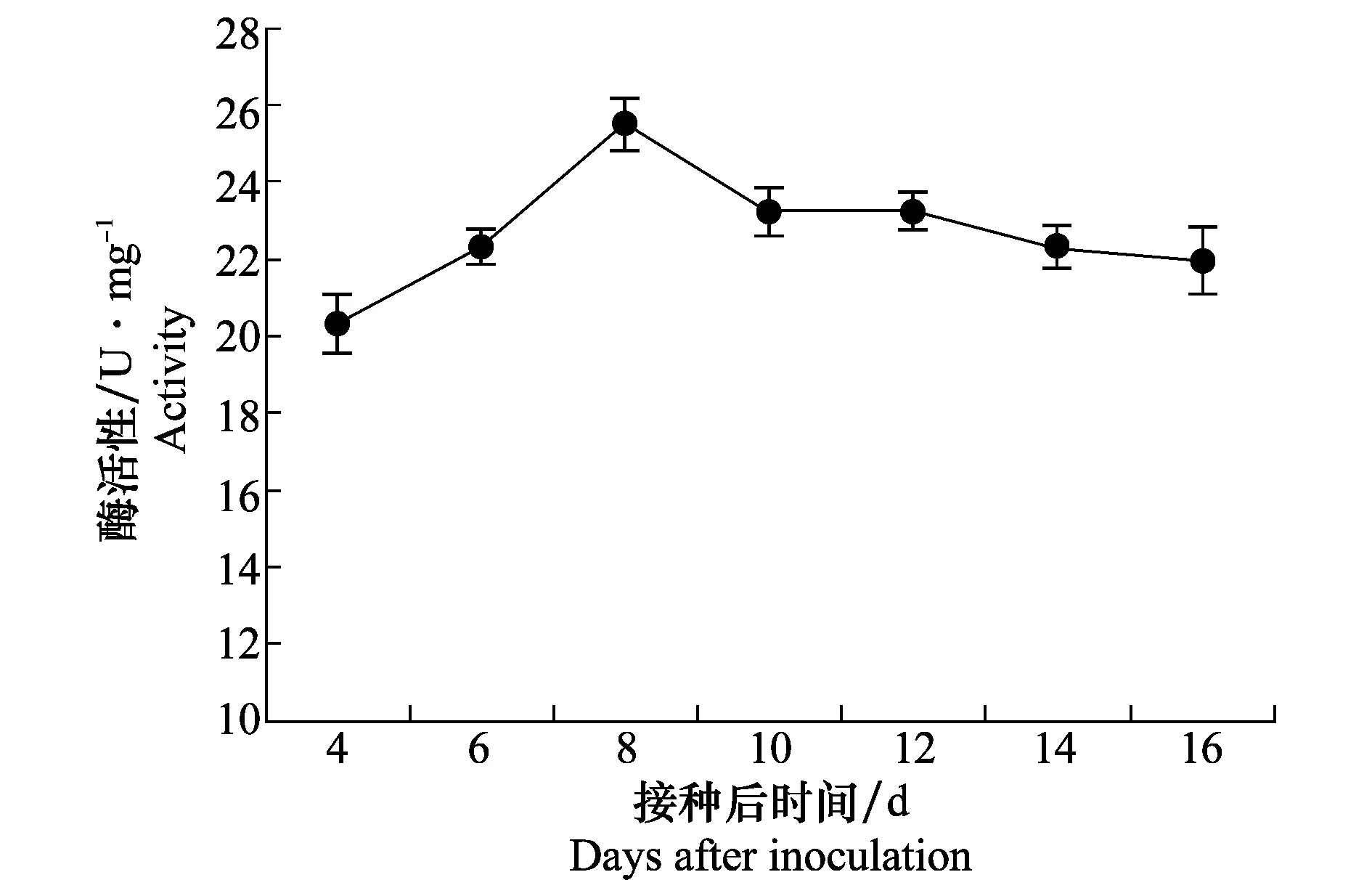
图3 病健交界处果胶酶活性的动态变化Fig.3 Changes of pectinase activities in boundary between diseased and healthy area

图4 病健交界处漆酶活性的动态变化Fig.4 Changes of laccase activity along the boundary between diseased and healthy areas
3 讨论
油茶炭疽病的致病机理问题至今少见相关报道。我们检测了活体内外炭疽病菌产生的细胞壁降解酶活性,结果发现,活体外试验中炭疽病菌在不同诱导物培养基产生的细胞壁降解酶活性差异明显,并且以蔗糖为诱导物时,纤维素酶、果胶酶、漆酶的活性均最低。这可能因为在以蔗糖为碳源的培养体系中,蔗糖对细胞壁降解酶的产生起阻遏作用[6]。接种5种不同碳源诱导产生的酶液后,新鲜健康的叶片都产生了病斑,接种灭活酶液的叶片无明显变化。由此推测,细胞壁降解酶是该病原菌致病的因子之一。随着接种时间的延长,5种酶活性均呈现“先增后降最后稳定”的趋势;发病初期酶活性升高,接种10 d后,酶活性稳定,说明细胞壁降解酶参与了病斑的扩展过程。本研究还发现,炭疽病菌在活体内产生的细胞壁降解酶活性明显低于活体外。活体内和活体外的环境因素不同,导致酶活性差异较大。活体外酶活性分析时,应多考虑温度、pH值、底物浓度等对酶活性的影响,但活体内产生的酶接近自然发病情况,具有实际研究意义[16-17]。
植物病原菌在对寄主植物侵染致病过程中可产生一系列的细胞壁降解酶,通过酶解植物多糖来破坏和分解细胞壁,以提供自身营养并促进其对寄主组织的侵入和扩展[18-19]。诸多研究表明,纤维素酶和果胶酶在病原菌致病过程中起重要作用[20-23]。本试验分析了主要的细胞壁降解酶活性的动态变化,包括Cx酶、FPA酶、β-葡萄糖苷酶、PMG酶、漆酶,这也是首次分析油茶叶片中漆酶的活性变化。漆酶是一种含铜的多酚氧化酶类,能够降解木质素纤维。最初发现于漆树漆液中,随后发现某些高等真菌也能分泌该酶[24]。这说明油茶叶片内可能含有能够诱导炭疽病菌产生漆酶的多酚类化合物,漆酶对这些物质的氧化加速了叶片组织的降解。
本试验仅考察了油茶炭疽病菌在活体内外产生的细胞壁降解酶的活性,从一个方面说明了这些酶在病原菌致病过程中的作用。但植物病原菌侵入寄主是一个复杂的过程,除了能向外分泌细胞壁降解酶外,往往还可以产生毒素、激素及胞外多糖等致病物质[25-26]。因此,究竟是哪一种致病因子起主导作用以及它们之间如何协调作用,有待进一步研究。另外,我们也可以尝试去探究病原菌纤维素酶、果胶酶、漆酶产生的分子基础,进而揭示炭疽病菌的致病机理。
[1] 朱辉, 覃伟权, 付登强,等. 海南省油茶炭疽病病原鉴定及生物学特性研究[J]. 广东农业科技, 2015(16):55-59.
[2] 李河, 周国英, 徐建平. 一种新油茶炭疽病原多基因序列鉴定[J]. 植物保护, 2015, 41(2):92-96.
[3] 刘伟. 油茶炭疽病的病原学、发病规律及防治技术[D]. 武汉:华中农业大学, 2012.
[4] 饶辉福, 丁坤明, 饶漾萍, 等. 油茶主要病害的发生与防治[J]. 植物医生, 2013, 26(3):16-17.
[5] 杨蕾. 油茶主要病害拮抗放线菌F10有效成分及菌剂研究[D]. 长沙:中南林业科技大学, 2011.
[6] 李宝聚, 周长力, 赵奎华, 等. 黄瓜黑星病菌致病机理的研究. Ⅱ. 细胞壁降解酶及其在致病中的作用[J]. 植物病理学报, 2000, 30(1): 13-18.
[7] 李宝聚, 周长力, 赵奎华, 等. 黄瓜黑星病菌致病机理的研究. Ⅲ. 细胞壁降解酶和毒素对寄主超微结构的影响及其协同作用[J]. 植物病理学报, 2001, 31(1): 63-69.
[8] 刘志恒,亓烨,黄欣阳,等.黄瓜棒孢叶斑病(褐斑病)病菌细胞壁降解酶产生条件及活性分析[J].中国蔬菜,2011(8):76-80.
[9] 陈晓林,牛程旺,李保华,等.苹果树腐烂病菌产生细胞壁降解酶的种类及其活性分析[J].华北农学报,2012,27(2):207-212.
[10]杨媚, 杨迎青, 郑丽, 等. 水稻纹枯病菌细胞壁降解酶组分分析、活性测定及其致病作用[J]. 中国水稻科学, 2012, 26(5): 600-606.
[11]Yang Yingqing, Yang Mei, Li Minghai, et al. Cloning and functional analysis of an endo-PG-encoding geneRrspg1 ofRhizoctoniasolani, the causal agent of rice sheath blight[J]. Canadian Journal of Plant Pathology, 2012, 34 (3): 43-47.
[12]李明海, 杨迎青, 杨媚, 等. 井冈霉素对水稻纹枯病菌细胞壁降解酶活性和可溶性蛋白产生的影响[J]. 华中农业大学学报, 2010, 29 (3): 272-276.
[13]方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998.
[14]Douaiher M N, Nowak E, Durand R, et al. Correlative analysis ofMycosphaerellagraminicolapathogenicity and cell wall-degrading enzymes producedinvitro: the importance of xylanase and polygalacturonase [J]. Plant Pathology, 2007,56(1): 79-86.
[15]詹旭, 曹志艳, 邢继红, 等. 植物病原真菌产漆酶菌株的筛选[J]. 中国农业科学, 2011, 44(4): 723-729.
[16]Marcus L, Barash I, Sneh B, et al. Purification and characterization of pectolytic enzymes produced by virulent and hypovirulent isolates ofRhizoctoniasolaniKühn [J]. Physiological and Molecular Plant Pathology, 1986,29(3): 325-336.
[17]Lunsden R D. Pectolytic enzymes ofSclerotiniasclerotiorumand their localization in infected bean [J]. Canadian Journal of Botany 1976,54(23): 2630-2641.
[18]Hematy K, Cherk C, Somerville S. Host-pathogen warfare at the plant cell wall [J]. Current Opinion in Plant Biology, 2009, 12(4): 406-413.
[19]Cantu D, Vicente A R, Labavitch J M, et al. Strangers in the matrix: plant cell walls and pathogen susceptibility [J]. Trends in Plant Science, 2008, 13(11): 610-617.
[20]Tadashi S,Hideo N,Kinjiro T.Occurrence and some properties of cellulase in the filtrates of conidiospores and mycelia ofPyriculariaoryzaeCavara[J]. Agricultural and Biological Chemistry, 1973, 37(7): 1651-1659.
[21]Eshel D, Miyara I, Ailing T, et al. pH regulates endoglucanase expression and virulence ofAlternariaalternatain persimmon fruit [J]. Molecular Plant-microbe Interactions, 2002, 15(8): 774-779.
[22]Koganezawa H, Sakuma T.Possible role of breakdown products of phloridzin in symptom development byValsaceratosperma[J]. Japanese Journal of Phytopathology,1982,48(4):521-528.
[23]Natsume H, Seto H, ōtake N. Studies on apple canker disease. The necrotic toxins produced byValsaceratosperma[J]. Agricultural Biological Chemistry, 1982, 46(8): 2101-2106.
[24]Bertrand T, Jolivalt C, Caminade E, et al. Purification and preliminary crystallographic study ofTrametesversicolorlaccase in its native form [J]. Acta Crystallographica Section D-Biological Crystallography, 2002, 58: 319-321.
[25]Comstock J C, Martinson C A, Gengenback B G, et al. Host specificity of a toxin fromPhyllostictamaydisfor Texas cytoplasmically male-sterile maize [J]. Phytopathology, 1973, 63(11): 1357-1361.
[26]Bailiss K W. The relationship of gibberellin content to cucumber mosaic virus infection of cucumber [J]. Physiological P1ant Pathology, 1974, 4(1): 73-79.
(责任编辑:田 喆)
The role of cell wall-degrading enzymes in the pathogenic process ofCamelliaoleiferadisease caused byColletotrichumgloeosporioides
Jin Qin, Zhou Guoying, Liu Jun’ang, He Yuanhao
(Hunan Provincial Key Laboratory for Control of Forest Diseases and Pests;Key Laboratory ofCultivation and Protection for Non-wood Forest Trees of Ministry of Education, CentralSouth University of Forestry and Technology, Changsha 410004, China)
The research aims to estimate the role of cell wall-degrading enzymes(CWDEs) in the pathogenic process ofCamelliaoleiferaanthracnose caused byColletotrichumgloeosporioides. CWDEs produced byC.gloeosporioidesbothinvitroandinvivowere studied. The results showed that, with carboxymethyl cellulose sodium(CMCNa)as the inducer substrate, the activities of carboxymethyl cellulase and laccase were the highest, whereas citrus pectin was the best for pectinase.C.gloeosporioidescould produce highly active cellulase, pectinase and laccase induced byC.oleiferaleaves, and all enzyme liquids produced by the 5 inducers had degradation activity against leaves. Among each part of the diseased leaves, the activity of the CWDEs along the boundary between diseased and healthy areas was the highest. The activities of the CWDEs rapidly increased 4 days after inoculation when the leave symptoms emerged. The activities of filter paper enzyme (FPA),β-glucosidase and laccase with a maximum value in the 6th day after inoculation, were 4.53 U/mg, 7.44 U/mg, and 1.21 U/mg, respectively. But carboxymethyl cellulase(Cx)and pectinase reached at the peak in the 8th day after inoculation. The activities of the CWDEs were very stable from the 10th to 16th days after inoculation. These results demonstrated that cellulase, pectinase and laccase played an important role in the pathogenic processes ofC.oleiferaanthracnose caused byC.gloeosporioides.
Camelliaoleifera;Colletotrichumgloeosporioides; cell wall-degrading enzyme
2016-06-26
2016-08-28
“十二五”国家科技支撑计划(2012BAD19B0803)
Q 939.9
A
10.3969/j.issn.0529-1542.2017.03.016
* 通信作者 E-mail:zgyingqq@163.com
