抑制干扰素诱导蛋白16表达减少人主动脉外膜成纤维细胞凋亡
2017-06-05肖燕宋方吴强黄晶
肖燕,宋方,吴强,黄晶
抑制干扰素诱导蛋白16表达减少人主动脉外膜成纤维细胞凋亡
肖燕,宋方*,吴强,黄晶
目的:研究干扰素诱导蛋白16(IFI16)表达抑制后对人主动脉外膜成纤维细胞(HAAFs)凋亡的影响。
方法:应用IFI16基因小干扰RNA(siRNA)转染HAAFs使IFI16基因沉默(IFI16-siRNA组),以非特异性siRNA转染作为其转染阴性对照组(Con-siRNA组),未经处理的HAAFs作为未干预阴性对照组(Neg组)。应用流式细胞仪检测细胞周期及凋亡, 实时定量逆转录-聚合酶链反应(Realtime qRT-PCR)检测细胞中IFI16 mRNA表达变化,蛋白免疫印迹(Western blotting)检测IFI16、抑癌因子(p53)、细胞周期依赖性蛋白激酶抑制因子p21WAF(p21)、B细胞淋巴瘤-2(Bcl-2)相关X蛋白(Bax)及Bcl-2蛋白表达。
结果:IFI16-siRNA组与Con-siRNA组、Neg组相比,细胞凋亡率[(3.33±0.41)% vs (7.42±1.51)%、(6.49±1.10)%,P<0.05]与G0/G1期细胞比例[(56.64±4.77)% vs (69.67±3.54)%、(68.29±4.14)%,P<0.05]减少;而S期细胞比例[(25.23±5.19)% vs (13.76±2.07)%、(14.04±3.00)%,P<0.05]增加;伴随着IFI16mRNA表达减少(P<0.05),以及IFI16-siRNA组IFI16、p53、p21、Bax蛋白表达量减少(P<0.05);同时Bcl-2蛋白表达量增加(P<0.05)。
结论:抑制IFI16表达可减少HAAFs细胞凋亡,促进细胞周期G1/S转换,其机制部分与抑制p53/p21信号通路及调控Bax/Bcl-2表达有关。
干扰素诱导蛋白16;成纤维细胞;细胞凋亡
(Chinese Circulation Journal, 2017,32:511.)
随着人们生活水平的不断提高和社会老龄化程度的日趋加剧,高血压、动脉粥样硬化、动脉粥样硬化性狭窄及其介入治疗术后再狭窄等心脑肾血管增殖性疾病的发病率、致死(残)率逐渐增高,已成为目前占用较多社会卫生资源的严重的健康和社会问题[1]。血管外膜成纤维细胞(VAFs)作为构成血管壁的重要成分,其生长和凋亡失衡是血管增殖性疾病发生发展的重要病理生理基础[2,3]。人干扰素诱导蛋白16(IFI16)是干扰素诱导蛋白p200家族成员之一,具有抑制细胞增殖与促进细胞凋亡的作用[4]。前期研究发现IFI16在人脑血管外膜成纤维细胞(HBVAFs)存在丰富的表达,抑制IFI16表达能促进HBVAFs的增殖及迁移[5],但IFI16对人主动脉外膜成纤维细胞(HAAFs)凋亡的影响尚少见文献报道。本研究进一步通过IFI16小干扰RNA(siRNA)转染使IFI16基因沉默从而抑制IFI16蛋白表达,观察其对HAAFs凋亡及细胞周期的影响,探讨其可能机制,为治疗血管增殖、重构性疾病提供新的理论依据。
1 材料与方法
1.1 材料
原代人主动脉成纤维细胞(HAAFs)、胎牛血清(2% fetal bovine serum)、成纤维细胞培养基(fibroblast medium)及成纤维细胞生长因子(1% fibroblast growth supplement)均购自美国Sciencell公司;X-tremeGENE siRNA转染试剂购自Roche中国(上海)公司;IFI16-siRNA(sc-35633)、阴性对照siRNA(sc-37007)、异硫氰酸荧光素(FITC)结合的阴性对照siRNA(sc-36869)及IFI16抗体(sc-8023)购自美国Santa Cruz公司;总RNA极速抽提试剂盒(220010)购自上海飞捷生物技术有限公司;定量逆转录-聚合酶链反应(RT-PCR)试剂盒(RR047A)、实时PCR荧光染料试剂盒(RR420A)购自大连TakaRa公司;PCR扩增引物由铂尚生物技术(上海)有限公司合成,引物序列(IFI16:F 5'-AGGACCGTTCATGACCAGZATAG-3',R 5'-TGCGTTCAGCACCATCACTTC-3';GAPDH: F 5'-ACCACAGTCCATGCCATCAC-3',R 5'-TCCACCACCCTGTTGCTGTA-3');抑癌因子(p53)抗体(10442-1-AP)购自美国Proteintech公司;细胞周期依赖性蛋白激酶抑制因子p21WAF(p21)抗体(ab92675)购自英国Abcam上海分公司;B细胞淋巴瘤-2(Bcl-2)抗体(2870S)和Bcl-2相关X蛋白(Bax)抗体(2772S)购自美国Cell Signaling公司;甘油醛-3-磷酸脱氢酶(GAPDH)内参抗体(sc-25778)及细胞周期与细胞凋亡检测试剂盒(C1052)购自上海碧云天公司;膜联蛋白V-PE细胞凋亡检测试剂盒(Annexin V-PE Apoptosis Detection Kit I)(559763)购自美国BD生物科学公司。
1.2 HAAFs的培养和分组
HAAFs的培养按Sciencell公司HAAFs细胞培养说明书的方法,取3~5代细胞用于实验。实验细胞分为3组,即IFI16特异性siRNA转染使IFI16基因沉默组(IFI16-siRNA组)、非特异性siRNA转染作为其转染阴性对照组(Con-siRNA组),未经处理的HAAFs作为未干预阴性对照组(Neg组)。
1.3 siRNA转染
取对数生长期细胞接种于六孔板中,1×105个/孔,用不含双抗的培养液培养,观察待细胞密度达30%~50%时进行siRNA转染。按X-tremeGENE siRNA转染试剂说明书操作,添加siRNA转染复合物干预6 h后,换正常含双抗的培养液48 h后收集细胞,使用荧光素共轭的阴性对照-siRNA检测转染效率在80%~90%之间。每组3 复孔,实验重复3次。
1.4 实时定量RT-PCR
提取各分组细胞总RNA后按TaKaRa公司定量RT-PCR试剂盒(RR047A)说明逆转录成cDNA。按TakaRa公司实时 PCR荧光染料试剂盒(RR420A)说明检测各样本mRNA的表达,PCR反应条件为:起始模板预变性(95 ℃ 30 s),PCR循环模板变性(95℃ 5 s)+退火(60℃ 30 s)+延长(72℃30 s)循环40次。以GAPDH为内参照,2-ΔΔCt法计算各组IFI16 mRNA的相对表达量。
1.5 蛋白免疫印迹(Western blotting)
提取细胞总蛋白,每孔上样80 μg蛋白样品进行聚丙烯酰胺凝胶电泳(SDS-PAGE)。湿法转膜转移蛋白条带至聚偏氟乙烯(PVDF)膜,Western封闭液中室温下封闭1 h;加入IFI16一抗工作液,室温下孵育15 min后置4 ℃冰箱过夜;TBST缓冲液(pH=7.4)洗膜,室温下孵育稀释的二抗1 h;TBST洗膜,电化学发光。PVDF膜应用Western一抗二抗去除液处理后,同法封闭、孵育p53、p21、Bax、Bcl-2、GAPDH一抗及二抗。ImageJ软件分析IFI16、p53、p21、Bcl-2及Bax与内参条带的吸光度值之比。
1.6 流式细胞术
按BD生物科学公司膜联蛋白V-PE细胞凋亡检测试剂盒(Annexin V-PE Apoptosis Detection Kit I)(559763)试剂盒说明书操作收集、重悬及染色细胞后通过流式细胞仪检测细胞凋亡和坏死;按碧云天公司细胞周期与凋亡检测试剂盒(C1052)说明书操作进行细胞收集、染色后通过流式细胞仪进行细胞周期G0/G1及S期DNA含量分析。
1.7 统计学处理
应用SPSS19.0统计软件对各组数据进行正态性及方差齐性检验,计量数据用均数±标准差表示,采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 IFI16-siRNA转染效率
在6孔板中转染FITC-结合的阴性对照siRNA 6 h后,在荧光显微镜下可见转染成功的HAAFs细胞发出绿色荧光,转染效率为80 %~90 %。与Neg组和Con-siRNA组比较,IFI16-siRNA组的IFI16 mRNA表达沉默效果明显(0.31±0.10 vs 1.17±0.23、0.98±0.20,P<0.05)。
2.2 IFI16表达抑制对HAAFs凋亡和细胞周期的影响(表1)
与Neg组和Con-siRNA组比较,IFI16-siRNA组的细胞凋亡率减少(P<0.05),G0/G1期细胞减少及S期细胞增多(P<0.05),以上指标在Neg组和ConsiRNA组间差异无统计学意义。
表1 IFI16基因表达沉默对HAAFs凋亡和细胞周期的影响
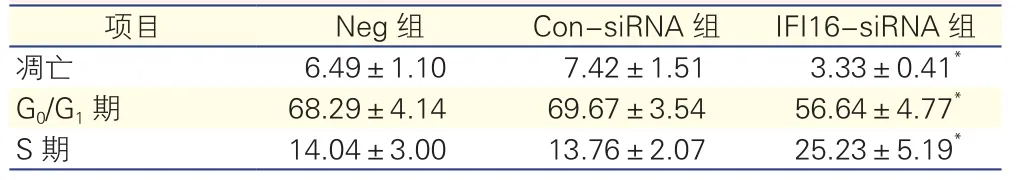
表1 IFI16基因表达沉默对HAAFs凋亡和细胞周期的影响
注:IFI16:人干扰素诱导蛋白16;HAAFs:人主动脉外膜成纤维细胞;Neg组:未干预阴性对照组;IFI16-siRNA组:IFI16基因沉默组;Con-siRNA组:转染阴性对照组。与Neg组和Con-siRNA组比较*P<0.05
?
2.3 抑制IFI16表达后p53/p21和Bcl-2/Bax蛋白表达变化
Western blotting结果显示,与Neg组和ConsiRNA组比较,IFI16-siRNA组IFI16蛋白表达下调(P<0.05),p53、p21、Bax蛋白表达量减少(P<0.05),Bcl-2蛋白表达量的增加(P<0.05)(图1)。IFI16、p53、p21、Bax和Bcl-2蛋白表达在Neg组和ConsiRNA组间差异无统计学意义。
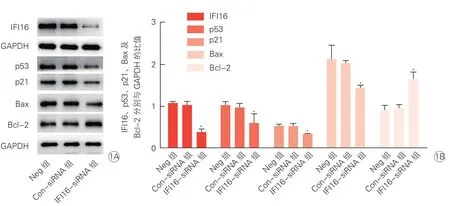
图1 IFI16基因表达沉默对HAAFs中IFI16、p53/p21、Bax/Bcl-2蛋白表达的影响
3 讨论
血管重构是血管增殖性疾病的主要病理生理机制,血管外膜的重构是整个血管重构的重要组成部分,VAFs是血管外膜的主要细胞,有效地抑制VAFs的增殖,促进其凋亡对防治血管增殖性疾病有重要意义[2,3]。
IFI16通过与转录因子如p53等结合,广泛参与调节细胞增殖和分化、衰老和凋亡[6,7]。我们前期的研究亦发现抑制IFI16表达能促进HBVAFs的增殖及迁移[5];且p200家族蛋白中与人IFI16高度同源的鼠p204过表达可抑制大鼠VAFs增殖与迁移[8]。在培养的人正常前列腺上皮细胞进入衰老进程时其IFI 16表达增加了4倍,而在前列腺肿瘤细胞PC-3中过表达IFI16会抑制克隆形成,出现细胞衰老现象[9]。本研究结果表明,通过siRNA技术下调IFI16的表达,能减少HAAFs细胞凋亡,促进细胞周期G1/S转换。
p53是重要的肿瘤抑制基因,p21基因是p53基因最重要的下游基因之一,p21基因编码的p21蛋白是目前已知的具有最广泛激酶抑制活性的细胞周期抑制蛋白,p53通过其抑制细胞周期进程,促进细胞凋亡与衰老[10]。IFI16通过其200X结构域中的保守模序MF/LHATVAT/S与p53蛋白直接结合,调节p53介导的转录调控是其抑制细胞周期及增殖的主要机制之一[11]。同时Xin等[9]对前列腺肿瘤细胞PC-3(缺失功能性的p53蛋白)的研究表明IFI 16过表达能上调p21表达、抑制细胞周期,故以上作用不完全依赖于p53。本研究证实IFI16表达沉默后,p53及p21表达亦减少,提示IFI16促进HAAFs细胞凋亡的作用至少部分与p53/p21信号通路有关。
Bcl-2蛋白家族在线粒体介导的细胞凋亡中起着至关重要的作用,Bax和Bcl-2分别是Bcl-2家族中主要的促进凋亡和抑制凋亡蛋白,细胞凋亡在很大程度上取决于细胞内Bcl-2/Bax蛋白的比例[12]。本研究显示,抑制IFI16的表达能下调Bax表达,同时Bcl-2的表达上调。因p53亦可以通过上调Bax的表达,同时下调Bcl-2的表达来促进细胞凋亡[13],故IFI16是直接调控了Bcl-2/Bax信号通路亦或是通过p53来间接调控仍需进一步通过沉默或失活p53来明确,但我们的研究至少提示IFI16参与了Bax及Bcl-2介导的细胞凋亡调控。
综上所述,通过特异性siRNA下调IFI16表达可抑制HAAFs细胞凋亡,其机制至少部分与抑制p53/p21信号通路及调控Bax/Bcl-2表达有关。
[1] 李建军. 再狭窄发生的相关研究是冠心病介入治疗的长期课题.中国循环杂志, 2008, 23: 401-403.
[2] 刘平, 张运, 胡维成. 血管外膜及其成纤维细胞在血管增殖性病变中的作用. 中华老年医学杂志, 2005, 24: 936-938.
[3] Tieu BC, Ju X, Lee C, et al. Aortic adventitial flbroblasts participate in angiotensin-induced vascular wall inflammation and remodeling. J Vase Res, 2011, 48: 261-272.
[4] Mazibrada J, De Andrea M, Ritt M, et al. In vivo growth Inhibition of head and neck squamous cell carcinoma by the interferon-inducible gene IFI16. Cancer Lett, 2010, 287: 33-34.
[5] 黄晶, 宋方, 龙向淑, 等. 干扰素诱导蛋白16对人脑血管外膜成纤维细胞增殖与迁移的影响及其机制. 中国病理生理杂志, 2013, 29: 584-589.
[6] Ludlow LE, Johnstone RW, Clarke CJ. The HIN-200 family: more than interferon-inducible genes?. Exp Cell Res, 2005, 308: 1-17.
[7] Gugliesi F, Mondini M, Ravera R, et al. Up-regulation of the interferon-inducible IFI16 gene by oxidative stress triggers p53 transcriptional activity in endothelial cells. J Leukoc Biol, 2005, 77: 820-829.
[8] 宋方, 田茂波, 肖燕, 等. 干扰素诱导蛋白p204过表达抑制大鼠主动脉血管外膜成纤维细胞增殖与迁移. 中国循环杂志, 2015, 30: 1110-1114.
[9] Xin H, Curry J, Johnstone RW, et al. Role of IFI16, a member of the interferon-inducible p200-protein family, in prostate epithelial cellular senescence. Oncogene, 2003, 22: 4831-4840.
[10] Vousden KH, Prives C. Blinded by the light: the growing complexity of p53. Cell, 2009, 137: 413-431.
[11] Liao JC, Lam R, Brazda V, et al. Interferon-inducible protein 16: insight into the interaction with tumor suppressor p53. Structure, 2011, 19: 418-429.
[12] Wong WW, Puthalakath H. Bcl-2 family proteins: the sentinels of the mitochondrial apoptosis pathway. IUBMB Life, 2008, 60: 390-397.
[13] Haupt S, Berger M, Goldberg Z, et al. Apoptosis-the p53 network. J Cell Sci, 2003, 116: 4077-4085.
Inhibition of Interferon-inducible Protein 16 Expression Reduces the Apoptosis in Human Aortic Adventitial Fibroblasts
XIAO Yan, SONG Fang , WU Qiang, HUANG Jing.
Department of Cardiology, Guizhou Provincial People’s Hospital, Guiyang (550002), Guizhou China
WU Qiang, E-mail: gzgywq@126.com
Objective: To study the impact of interferon-inducible protein 16 (IFI16) inhibition on apoptosis of human aortic adventitial fi broblasts (HAAFs).
Methods: Our research included 3 groups:①IFI16-siRNA group, specif i c small interference RNAs (siRNAs) of IFI16 were transfected into HAAFs in vitro to make IFI16 gene silence,②Con-siRNA group, non-specif i c siRNAs were transfected into HAAFs as negative control and③Untreated HAAFs group, blank control. HAAFs cell cycle and apoptosis rate were examined by f l ow cytometry, IFI16 mRNA expression was measured by real time qRT-PCR, protein expressions of IFI16, p53, p21, Bax and Bcl-2 were detected by Western blot analysis.
Results: Compared with Con-siRNA group and Untreated HAAFs group, IFI16-siRNA group showed decreased apoptosis rate of HAAFs (3.33±0.41) % vs (7.42±1.51) % and (6.49±1.10) %, P<0.05, reduced ratio of G0/G1phase cells (56.64 ± 4.77 ) % vs (69.67±3.54) % and (68.29±4.14) %, P<0.05, while increased ratio of S phase cells (25.23±5.19) % vs (13.76±2.07) % and (14.04±3.00) %, P<0.05. Meanwhile, IFI16-siRNA group presented down-regulated IFI16 mRNA and protein expressions, decreased protein levels of p53, p21, Bax and increased protein level of Bcl-2, all P<0.05.
Conclusion: Inhibited IFI16 expression could decrease HAAFs apoptosis, promote cell cycle transition fromG1 to S phase which might be related to the suppression of p53/p21 signaling pathway and regulation of Bax/Bcl-2 expression.
Interferon-inducible protein; Adventitial fi broblast; Apoptosis
2016-07-01)
(编辑:汪碧蓉)
国家自然科学基金资助项目(81260030);贵州省科技合作计划项目(黔科合LH字 [2015] 7159号)
550002 贵州省贵阳市,贵州省人民医院 贵州医科大学附属人民医院 心内科
肖燕 住院医师 硕士 主要研究方向为血管重构 Email:397694152@qq.com 通讯作者:吴强 Email: gzgywq@126.com*为共同第一作者
R541
A
1000-3614(2017)05-0511-04
10.3969/j.issn.1000-3614.2017.05.021
