血管钙化大鼠模型肾脏β-Klotho及成纤维细胞生长因子受体1表达研究
2017-06-05史雨晨柳景华
史雨晨,柳景华
血管钙化大鼠模型肾脏β-Klotho及成纤维细胞生长因子受体1表达研究
史雨晨,柳景华
目的:观察血管钙化对大鼠肾功能的损伤情况,及其与肾脏组织局部β-Klotho[成纤维细胞生长因子21(FGF21)的辅助因子]、成纤维细胞生长因子受体1(FGFR1)表达变化关系,探讨β-Klotho及FGFR1在血管钙化肾脏损伤中的作用和意义。
方法:实验动物按电脑随机数字表法分为正常对照组和钙化组,每组6只。钙化组采用维生素D3联合尼古丁诱导大鼠血管钙化模型。以肌氨酸氧化酶法检测大鼠血清肌酐浓度,以紫外-谷氨酸脱氢酶法检测大鼠血清尿素氮浓度,以生化法检测大鼠血钙及血磷浓度,以碱性磷酸酶(ALP)试剂盒检测大鼠肾脏组织ALP活性,以酶联免疫吸附法检测大鼠肾脏组织β-Klotho及FGFR1蛋白含量。
结果:与正常对照组比较,血管钙化组大鼠血清肌酐及尿素氮水平升高[(35.200±4.087)μmol/L vs(26.000±5.0990)μmol/L,(P<0.05); (6.900±0.623)mmol/L vs(5.400±0.803)mmol/L,(P<0.05)];大鼠肾脏组织局部ALP活性升高[(60.510±31.090)U/g vs(26.590±8.664)U/g,(P<0.05)];肾脏组织β-Klotho蛋白表达量增加[(9.052±1.238)ng/mg vs(6.860±1.036)ng/mg,(P<0.05)],而血钙及血磷浓度及大鼠肾脏组织FGFR1蛋白含量较正常对照组未见明显变化。
结论:大剂量维生素D3肌肉注射联合尼古丁灌胃可导致大鼠肾脏组织局部钙超载及微血管钙化形成,并导致肾功能不全,出现早期慢性肾脏病(CKD)临床表现。同时病变肾脏组织局部β-Klotho表达量上调,而FGFR1在肾脏组织局部未见明显变化,提示FGF21在血管钙化大鼠肾脏组织局部的调节作用可能不是通过增加其受体FGFR1的数量,而是通过上调其结合辅助因子β-Klotho的表达而实现的。同时提示β-Klotho参与了血管钙化肾脏损伤的早期调节过程,可能为预测机体钙超载情况及CKD早期的预警信号,对CKD的早期诊断具有一定价值。
β-Klotho;受体,成纤维细胞生长因子;血管钙化
(Chinese Circulation Journal, 2017,32:507.)
血管钙化是指血管壁钙磷的过度沉积,其主要成分是羟磷灰石Ca5(PO4)3OH[1]。新近观点认为,血管钙化与生理性骨骼形成过程相类似,是在各种刺激因素介导下,钙磷沉积于血管壁的一个可预防和可逆转的高度可调控生物学过程[2]。
慢性肾脏病(CKD)是各种肾脏疾病的终末阶段,临床研究发现,CKD患者血管钙化率明显高于正常同龄人[3]。同时,血管钙化导致的高血压、肾小球囊内压升高及肾脏微血管钙化又将加速CKD的发生与发展[4]。
新近研究提示,成纤维细胞生长因子21(FGF21)在CKD中发挥一定作用[5]。本实验室先期实验已经证明,FGF21与血管钙化肾脏损伤存在一定关系。同时既往研究已经证明,FGF21必须通过FGF21-成纤维细胞生长因子受体1(FGFR1)-β-Klotho三聚体方可发挥作用[6]。因此,本实验旨在通过研究血管钙化大鼠模型肾脏损伤过程中β-Klotho及FGFR1的变化情况,初步探究β-Klotho及FGFR1在血管钙化肾脏损伤过程中的作用,并为进一步研究FGF21在血管钙化肾脏损伤过程中的作用机制提供实验基础。
1 材料与方法
材料:成年雄性SD大鼠[约8周龄,(190±10)g] 12只,由北京大学医学部实验动物中心提供。β-Klotho ELISA试剂盒、FGFR1 ELISA试剂盒为Cloud-Clone Corp.公司(武汉优尔生)产品。维生素D3、尼古丁为美国Sigma公司产品。碱性磷酸酶(ALP)检测试剂盒为南京建成生物公司产品。其余为进口或国产分析纯试剂。
钙化动物模型建立及实验分组:参照Niederhoffer等[7]方法建立血管钙化动物模型:选用体重180~200 g雄性SD大鼠,适应环境饲养7天后以电脑随机数字表法随机分为两组,每组6只,自由饮水饮食。血管钙化组第1天9:00给予维生素D3(300 000 IU/kg)肌肉注射,尼古丁溶于花生油(25 mg/kg,5 ml/kg)灌胃;18:00尼古丁溶于花生油重复灌胃一次;第14天9:00重复给予维生素D3(300 000 IU/kg)肌肉注射一次。正常对照组给予等量生理盐水溶液肌肉注射和单纯花生油灌胃,方法同血管钙化组。两组动物常规饲养4周后予2%戊巴比妥钠麻醉,心脏取血,4℃离心分离血清,-80℃储存待测。摘取大鼠肾脏组织,冰生理盐水溶液冲洗后,保存于-80℃待测。
总蛋白提取及测定:动物处死后迅速摘取待测组织,以每10 mg组织加入100 μl蛋白裂解缓冲液的比例在冰浴条件下剪碎组织,后应用玻璃匀浆器匀浆。4℃条件下2 680 g离心15 min,取上清液行蛋白定量,加入原液1/4体积的5×蛋白上样缓冲液,100℃煮沸15 min后置于冰上,按BCA法测定蛋白浓度[8]。
肾脏组织碱性磷酸酶活性测定:取肾脏组织约50 mg,按ALP检测试剂盒操作,并依据样品中蛋白克数,计算单位蛋白中ALP活性[9]。
β-Klotho及FGFR1的酶联免疫吸附法测定:取标准化浓度组织蛋白样品按ELISA试剂盒说明书操作。
血清尿素氮浓度测定:动物麻醉后心脏取血,4℃ 1 000 g离心分离血清,采用紫外-谷氨酸脱氢酶法检测大鼠血清尿素氮水平[10]。
血清肌酐浓度测定:动物麻醉后心脏取血,4℃1 000 g离心分离血清,采用肌氨酸氧化酶法检测大鼠血清肌酐水平[5]。
血钙及血磷浓度测定:动物麻醉后心脏取血,4℃ 1000 g离心分离血清,血钙及血磷水平检测在日本东芝TBA-40FR全自动生化仪上完成。
统计学分析:应用SPSS 17.0统计软件对实验数据进行统计分析。计量资料以均数±标准差表示。计量资料两组间比较采用t检验分析。以P<0.05为差异具有统计学意义。
2 结果
大鼠血清肌酐及尿素氮浓度测定 (图1,图2):血管钙化组大鼠血清肌酐及尿素氮浓度较正常对照组升高,差异有统计学意义[(35.200±4.087)μmol/L vs(26.000±5.099)μmol/L,(P<0.05);(6.900±0.623)mmol/L vs(5.400±0.803)mmol/L,(P<0.01)]。
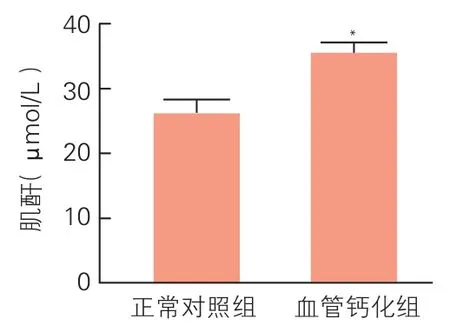
图1 两组大鼠血清肌酐浓度(n=5)
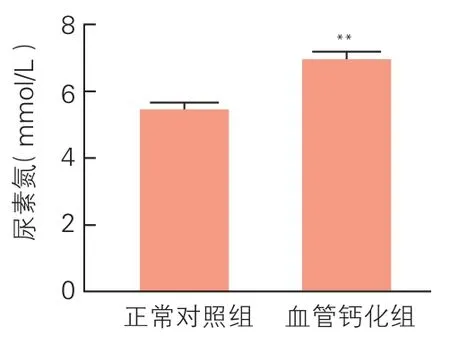
图2 两组大鼠血清尿素氮浓度(n=6)
两组大鼠血钙及血磷浓度测定:使用维生素D3和尼古丁诱导后,血管钙化组大鼠血钙及血磷浓度较正常对照组未见明显变化,差异无统计学意义[(1.727±0.629)mmol/L vs(2.098±0.185)mmol/L,(P>0.05);(1.708±0.165)mmol/L vs(1.690±0.160)mmol/L,(P>0.05)]
肾脏组织局部ALP活性测定(图3):血管钙化组大鼠肾脏组织局部ALP活性较正常对照组增加,差异有统计学意义[(60.510±31.090)U/g vs(26.590±8.664)U/g,(P<0.05)]。
酶联免疫吸附法检测β-Klotho蛋白在肾脏组织表达情况(图4):取大鼠肾脏组织匀浆进行蛋白定量后做酶联免疫吸附检测发现,血管钙化组大鼠肾脏组织中β-Klotho蛋白含量较正常对照组升高,差异有统计学意义[(9.052±1.238)pg/mg vs(6.860±1.036)pg/mg,(P<0.05)]。
酶联免疫吸附法检测FGFR1蛋白在大鼠肾脏表达情况:血管钙化组大鼠肾脏组织FGFR1蛋白含量较正常对照组未见明显变化,差异无统计学意义[(0.186±0.047)ng/mg vs(0.184±0.039)ng/mg,(P>0.05)]。

图3 大鼠肾脏组织局部碱性磷酸酶活性(n=6)
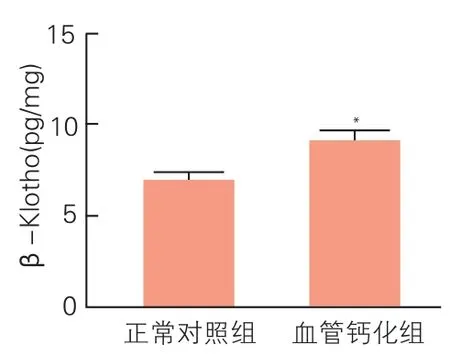
图4 酶联免疫吸附法分析显示血管钙化组大鼠肾脏组织β-Klotho蛋白含量(n=5)
3 讨论
血管钙化作为一种全身性血管病变,可累及大、中、小各级动脉,引起系统动脉压升高,从而导致肾小球动脉收缩、硬化及缺血性肾损害。肾动脉及其分支血管钙化的形成又可进一步加速肾脏损害的进展[11]。同时,血管钙化将导致全身炎症反应的发生,肾脏组织的炎症反应及免疫复合物沉积将促进肾脏疾病的发生发展[12]。已有临床研究表明,血管钙化与CKD患者的死亡率及心血管事件的发生率密切相关。因此,血管钙化与CKD互为促进因素。研究血管钙化与肾脏损伤的内在联系及相关机制,发现其预测因子乃至研发其治疗药物,对防治血管钙化及CKD具有重要意义。
我实验室先前已经证明,FGF21在血管钙化大鼠肾脏组织局部表达量有所升高,并与肾脏钙超载相关因子ALP具有一定相关性,提示FGF21可能在血管钙化肾脏损伤中发挥一定调节作用,但其具体机制尚有待进一步研究[13]。既往研究显示,β-Klotho及FGFR1作为FGF21的效应受体,FGF21必须通过FGF21-FGFR1-β-Klotho三聚体方可发挥作用[14]。基于此我们设想,肾脏组织中β-Klotho及FGFR1对FGF21可能有一定调节作用,决定着FGF21的作用发挥。
本实验结果显示,大剂量维生素D3肌肉注射联合尼古丁灌胃可导致大鼠肾脏组织局部ALP活性上调。ALP是细胞成骨样变早期分化的重要标志,为检测早期组织钙化的金标准之一[15]。故该结果说明,肾脏组织局部钙超载形成,并导致大鼠肾脏功能改变,血肌酐及尿素氮水平较正常对照组升高,出现早期CKD临床表现。从而提示,严重血管钙化患者都可能存在一定程度的肾脏损伤。同时临床研究证实,未经治疗的CKD患者血钙磷水平一般要到CKD 4~5期方会发生变化[16]。本实验模型中未见大鼠血钙磷水平发生变化,再次从侧面验证血管钙化肾脏损伤模型为肾脏损伤早期模型。并且证明,维生素D3并不是通过改变机体血钙磷水平从而导致血管钙化的发生发展的[17]。相较于5/6肾脏切除模型等CKD大鼠模型,本模型造成的CKD程度较轻,相当于人类CKD早期。我实验室先前研究发现,FGF21在血管钙化肾脏损伤大鼠肾脏组织局部表达量有所升高,并与肾脏钙超载相关因子ALP具有一定相关性。既往实验已经证明,β-Klotho及FGFR1作为FGF21的效应受体,FGF21必须通过FGF21-FGFR1-β-Klotho三聚体方可发挥作用[6]。本实验结果显示,β-Klotho在肾脏钙超载模型大鼠中升高,可能参与了对FGF21作用的辅助调节过程。同时FGFRs作为FGFs的特异性受体,其组织特异性决定了FGFs的作用特异性。因此我们也检测了与FGF21亲和力最强的FGFR1在大鼠肾脏组织中的变化情况[18]。然而实验结果显示,FGFR1在肾脏组织局部未见明显变化。从而提示,FGF21在血管钙化大鼠肾脏组织局部的调节作用可能不是通过增加其受体FGFR1的数量而是通过上调其结合辅助因子β-Klotho的表达而实现的。β-Klotho作为FGF21与FGFR1结合的辅助因子,其升高可以增加FGF21与其受体FGFR1结合的稳定性,从而提高FGF21与FGFR1的结合能力,进而增加FGF21的生物效能。
FGF21-FGFR1-β-Klotho三聚体作为新近发现的内分泌型成纤维生长因子,其作用途径在各种代谢性疾病中均发挥重要调节作用,但其具体机制还有待进一步研究[19]。本研究报道了β-Klotho在血管钙化肾脏损伤大鼠肾脏组织局部表达增加,而FGFR1表达则未见明显变化,从而提示,β-Klotho可能在血管钙化肾脏损伤早期即可发挥一定调节作用。为进一步深入研究FGF21-FGFR1-β-Klotho在血管钙化肾脏损伤中的具体机制提供了一定基础。同时提示肾脏组织β-Klotho表达水平可能为预测机体钙超载情况及CKD早期的预警信号,对CKD的早期诊断具有一定提示作用。
[1] 郑韵仪, 曾庆春, 詹琼, 等. 钙化性主动脉瓣疾病患者血清免疫球蛋白E水平的变化. 中国循环杂志, 2016, 31: 263-266.
[2] Moldovan D, Rusu C, Kacso IM, et al. Mineral and bone disorders, morbidity and mortality in end-stage renal failure patients on chronic dialysis. Clujul Med, 2016, 89: 94-103.
[3] Smith ER. Vascular calcification in uremia: new-age concepts about an old-age problem. Methods Mol Biol, 2016, 1397: 175-208.
[4] Chen HC, Chou CY, Jheng JS, et al. Loss of residual renal function is associated with vascular calcification in hemodialysis patients. Ther Apher Dial, 2016, 20: 27-30.
[5] Fu T, Kim YC, Byun S, et al. FXR primes the liver for intestinal FGF15 signaling by transient induction of beta-Klotho . Mol Endocrinol, 2016, 30: 92-103.
[6] Feve B, Bastard C, Fellahi S, et al. New adipokines. Ann Endocrinol (Paris), 2016, 77: 49-56.
[7] Niederhoffer N, Bobryshev YV, Lartaud-Idjouadiene I, et al. Aortic calcification produced by vitamin D3 plus nicotine. J Vasc Res, 1997, 34: 386-398.
[8] 吕媛, 马钰, 冯志明, 等. 二喹啉甲酸法在牛奶蛋白质定量中的应用. 食品科学, 2010, 31: 151-154.
[9] Parhami F, Morrow AD, Balucan J, et al. Lipid oxidation products have opposite effects on calcifying vascular cell and bone cell differentiation. A possible explanation for the paradox of arterial calcification in osteoporotic patients. Arterioscler Thromb Vasc Biol, 1997, 17: 680-687.
[10] 陈澍, 刘雪芳. 链脲佐菌素诱导大鼠糖尿病肾病模型的建立. 实用医学杂志, 2006: 1239-1240.
[11] Cianciolo G, Capelli I, Cappuccilli M, et al. Calcifying circulating cells: an uncharted area in the setting of vascular calcification in CKD patients. Clin Kidney J, 2016, 9: 280-286.
[12] Moldovan D, Rusu C, Kacso IM, et al. Mineral and bone disorders, morbidity and mortality in end-stage renal failure patients on chronic dialysis. Clujul Med, 2016, 89: 94-103.
[13] 史雨晨, 柳景华. 血管钙化大鼠肾脏损伤及其FGF21表达变化.中华医学杂志, 2016, 96: 3741-3744.
[14] Kim JH, Hwang KH, Park KS, et al. Biological role of anti-aging protein klotho . J Lifestyle Med, 2015, 5: 1-6.
[15] Sheen CR, Kuss P, Narisawa S, et al. Pathophysiological role of vascular smooth muscle alkaline phosphatase in medial artery calcification. J Bone Miner Res, 2015, 30: 824-836.
[16] Kestenbaum B. Con: Phosphate binders in chronic kidney disease. Nephrol Dial Transplant, 2016, 31: 189-194.
[17] 邱翠婷, 郑海军, 余文军, 等. 自噬在高磷诱导的大鼠血管平滑肌细胞钙化过程中的作用研究. 中国循环杂志, 2016, 31: 484-488.
[18] Parish A, Schwaederle M, Daniels G, et al. Fibroblast growth factor family aberrations in cancers: clinical and molecular characteristics. Cell Cycle, 2015, 14: 2121-2128.
[19] Degirolamo C, Sabba C, Moschetta A. Therapeutic potential of the endocrine fibroblast growth factors FGF19, FGF21 and FGF23. Nat Rev Drug Discov, 2016,15:51-69.
Expressions of Kidney β-Klotho and Fibroblast Growth Factor Receptor 1 in Experimental Rats Model With Vascular Calcification
SHI Yu-chen, LIU Jing-hua.
28thWard, Beijing Anzhen Hospital, Capital Medical University, Beijing (100029), China
LIU Jing-hua, Email: liujinghua@vip.sina.com
Objective: To observe the impact of vascular calcif i cation on kidney injury rats with the expressions of β-Klotho, fibroblast growth factor receptor 1 (FGFR1) in kidney tissue in order to find the predictor for early chronic kidney disease (CKD), to provide the prevention and investigation basis of vascular calcif i cation and CKD.
Methods: Vascular calcif i cation model was induced by vitamin D3 and nicotine injection in experimental rats and the animals were divided into 2 groups: Normal control group and Calcif i cation group. n=6 in each group. Serum levels of creatinine and urea nitrogen were examined by sarcosine oxidase method and UV-glutamate dehydrogenase method respectively; blood levels of calcium and phosphorus were detected by biochemistry method; kidney tissue alkaline phosphatases (ALP) activity was measured by ALP detection kit, protein expressions of β-Klotho and FGFR1 were assessed by ELISA.
Results: Compared with Normal control group, Calcif i cation group showed increased serum levels of creatinine (35.200±4.087) umol/L vs (26.000±5.0990) umol/L and urea nitrogen (6.900±0.623) mmol/L vs (5.400±0.803) mmol/ L, both P<0.05; elevated kidney tissue ALP activity (60.510±31.090) U/g vs (26.590±8.664) U/g and β-Klotho protein expression (9.052±1.238) ng/mg vs (6.860±1.036) ng/mg, both P<0.05. Blood levels of calcium, phosphorus and kidney tissue FGFR1 protein content were similar between 2 groups.
Conclusion: Large dose vitamin D3 and nicotine injection may induce vascular calcification and early CKD symptom in experimental rats; β-Klotho protein expression was signif i cantly increased suggesting that β-Klotho had been involved in the early regulation of vascular calcif i cation and it could be used for the early diagnosis of CKD at certain point.
β-Klotho; Receptor, fi broblast growth factor; Vascular calcif i cation
2016-09-06)
(编辑:汪碧蓉)
国家自然科学基金(81570388);国家重点基础研究发展计划(973计划)课题(2015CB554404);北京市自然科学基金项目(7142048)
100029 北京市,首都医科大学附属北京安贞医院 北京市心肺血管疾病研究所 心内科28病房
作者单位:史雨晨 住院医师 硕士研究生 主要从事心血管内科研究 Email:shiyuchen0111@163.com 通讯作者:柳景华 Email:liujinghua@vip.sina.com
R541
A
1000-3614(2017)05-0507-04
10.3969/j.issn.1000-3614.2017.05.020
