芫花素对模式生物秀丽隐杆线虫的毒性作用
2017-06-05阮秦莉纪蕾蕾吴晨曦
许 云,阮秦莉,纪蕾蕾,嵇 晶,吴晨曦,王 梦
(南京中医药大学1.江苏省中药资源产业化过程协同创新中心,2.药物安全性评价研究中心,江苏南京 210023)
芫花素对模式生物秀丽隐杆线虫的毒性作用
许 云1,2,阮秦莉1,2,纪蕾蕾2,嵇 晶2,吴晨曦2,王 梦2
(南京中医药大学1.江苏省中药资源产业化过程协同创新中心,2.药物安全性评价研究中心,江苏南京 210023)
目的应用模式生物秀丽隐杆线虫研究中药芫花的主要成分之一芫花素的毒性作用及机制。方法分别以芫花素0.1,1,10和100 μmol·L-1处理野生型或转基因型秀丽隐杆线虫(简称线虫)24,48和72 h,显微镜下观察野生型线虫头部摆动次数、身体弯曲次数、存活天数、后代数目、平均排泄循环长度和咽泵行为,并观察转基因型线虫γ-氨基丁酸(GABA)能神经元荧光强度,计数神经元数目。结果①野生型线虫:与正常对照组比较,芫花素处理24 h后,芫花素1~100 μmol·L-1组线虫头部摆动和身体弯曲次数显著减少(P<0.05,P<0.01);48 h后,芫花素0.1 μmol·L-1组身体弯曲次数显著减少(P<0.05),1~100 μmol·L-1组头部摆动和身体弯曲次数显著减少(P<0.01),100 μmol·L-1组平均排泄循环长度显著增加(P<0.05)且咽泵行为显著减少(P<0.01);72 h后,芫花素0.1~100 μmol·L-1组头部摆动和身体弯曲次数均显著减少(P<0.05,P<0.01),平均排泄循环长度显著增加(P<0.05,P<0.01),咽泵行为显著减少(P<0.05,P<0.01)。②转基因型线虫:与正常对照组比较,芫花素处理24 h后,芫花素1~100 μmol·L-1组转基因型线虫GABA能神经元荧光强度显著降低(P<0.05,P<0.01);48 h后,芫花素1~100 μmol·L-1组GABA能神经元荧光强度显著降低(P<0.05,P<0.01)且VD神经元数目显著减少(P<0.01);72 h后,芫花素0.1~100 μmol·L-1组GABA能神经元荧光强度显著降低(P<0.05,P<0.01),1~100 μmol·L-1组AVL神经元数目显著减少(P<0.05,P<0.01),10和100 μmol·L-1组VD神经元数目显著减少(P<0.05,P<0.01)。结论芫花素对秀丽隐杆线虫具有一定的毒性作用,主要表现为运动行为抑制,其毒性机制可能与GABA能神经元损伤有关。
秀丽隐杆线虫;芫花素;毒性
芫花(Daphne genkwaSieb.et Zucc.)属瑞香科植物,味苦、辛,性温,有毒,为传统的泻下逐水药。现代医学研究认为,芫花能够用于中晚期妊娠引产和抗早孕,同时具有镇咳祛痰的作用[1],可用于慢性支气管炎。但是,芫花在临床上使用时产生多种不良反应,患者口服芫花制剂可出现轻度头痛、头晕及四肢酸痛等神经系统症状;出现口干、恶心呕吐、胃部灼烧感、腹痛腹泻等胃肠道症状;用于引产时,多数孕妇在用药后除出现胃肠道不适及头痛心悸等症状外,还会产生体温升高和白细胞数升高的不良反应。本实验室前期通过高效液相法发现芫花水提物中主要包含芫花素(genkwanin)、木犀草素和芹菜素等,曾应用秀丽隐杆线虫(Caenorhab⁃ditis elegans,C.elegans)对芫花水提物的毒性进行了初步研究。结果显示,芫花水提物对线虫运动行为具有抑制作用[2]。芫花素是芫花中一个主要的黄酮类成分,也是芫花主要功效成分,它可刺激肠黏膜引起剧烈的腹痛水泻,可引起子宫收缩,还具有镇咳祛痰等作用。芫花素在芫花中的含量也常作为评价芫花质量的主要指标之一,有文献报道,其在芫花水提物中含量可达0.11%[3]。由芫花分离化学成分时,在分离得到的23个化合物中芫花素得率最高,约占总质量的80%[4]。鉴于药物的主要有效成分有时也会是其主要毒效成分,为了深入了解芫花毒性作用的物质基础,本文研究了其主要成分芫花素的毒性作用及机制。
C.elegans是目前应用广泛的替代模式动物,具有繁殖周期短、后代繁多、通体半透明、结构简单等特点,易于在实验室中培养和观察。C.elegans的神经系统、生殖系统和消化系统结构简单而完善,与人类具有高度同源性,在毒理学研究中具有极大优势,被广泛应用于化合物毒性评价和机制研究[5-6]。本研究应用C.elegans观察芫花素对其运动行为、寿命、生殖、排泄行为和咽泵行为的影响,并通过观察分析γ-氨基丁酸(γ-aminobutyric acid,GABA)能神经元的损伤,探讨芫花素毒性作用机制。
1 材料与方法
1.1 秀丽隐杆线虫的来源与培养
野生型秀丽隐杆线虫(N2)和转基因型秀丽隐杆线虫{EG1285〔unc-47∶∶绿色荧光(GFP)〕}(以下简称野生型线虫和转基因型线虫)均来源于美国秀丽隐杆线虫遗传中心。所有线虫培养于含有大肠杆菌OP50的线虫生长介质琼脂培养基上,20℃恒温培养[7]。按照Donkin等[8]的方法同步化,获得大量L4期线虫,本研究中所有实验均使用L4期线虫进行药物处理。
1.2 药品、主要试剂与仪器
芫花素标准品,购于江苏省食品药品监督检验研究院,纯度94.2%。胰蛋白胨、琼脂、酵母提取物、多聚蛋白胨和琼脂糖均购于英国OXOID公司。5-氟尿嘧啶(5-fluorouracil,5-FU)购于美国Sigma公司。正置荧光显微镜(Axio ScopeA1),德国蔡司;连续变倍体视显微镜(XTZ-E),上海光学仪器六厂。
1.3 实验分组及药物处理
在表面涂布有OP50的直径30 mm的琼脂培养基上,分别加入含芫花素0.1,1,10和100 μmol·L-1的溶液200 μL或等体积溶剂,使其均匀分布于培养基表面,并晾干。将野生型和转基因型线虫随机分组,分别移入经不同药物处理过的培养基上,于20℃培养箱中分别培养24,48或72 h。寿命实验中每组50条线虫,其余实验中每组10条。
1.4 野生型线虫头部摆动行为观察
野生型线虫经芫花素0.1,1,10和100 μmol·L-1分别处理24,48或72 h后,转移至滴有M9缓冲液的单凹载玻片上,待其恢复1 min后,于体视显微镜下记录其在30 s内头部摆动次数。线虫头部摆动行为定义为头部摆动方向改变,且改变角度大于90度[9-10]。
1.5 野生型线虫身体弯曲行为观察
野生型线虫药物处理同1.4。处理后的线虫转移至不含OP50的琼脂培养基上,待其恢复1 min后,于体视显微镜下记录其在30 s内身体弯曲次数。一次成功的弯曲定义为以身体形成的S型中轴线为轴,向前行进一个正弦波形的过程[9-10]。
1.6 野生型线虫寿命观察
在经芫花素0.1,1,10和100 μmol·L-1处理后的培养基中分别加入5-Fu 12.5 mg·L-1以抑制线虫子代的孵化,同时不影响成虫寿命[11]。以此培养基处理野生型线虫72 h,从处理当天(实验第0天)开始,每天记录线虫的死亡数目和丢失数目,并计算存活率。存活率(%)=〔(线虫总数-死亡数目-丢失数目)/(线虫总数-丢失数目)〕×100%。线虫存活率减少至50%时的天数即为中位生存期;最后一条线虫死亡时的天数即为最长寿命。用铂丝轻触虫体,无任何反应即为死亡[2];线虫出现囊样变化或爬出培养皿即为丢失。本实验中,各组线虫丢失数目均为0。
1.7 野生型线虫繁殖力观察
每个培养皿中喂饲1条野生型线虫,药物处理同1.6。从药物处理开始,每天记录每只线虫的产卵数,并将线虫移至新的培养基中继续饲养,直至线虫丧失繁殖力。将每天产卵数目相加便得到该线虫的总子代数目[12]。
1.8 野生型线虫排泄行为观察
野生型线虫药物处理同1.4,药物处理后观察记录线虫排泄循环长度。一个排泄循环长度定义为2次尾部肌肉收缩的间隔时间,每条线虫观察3个循环,取平均值[12-13]。
1.9 野生型线虫咽泵行为观察
野生型线虫药物处理同1.4。药物处理后,采用数码显微系统,于500倍放大镜头下拍摄30 s线虫咽泵运动的视频,然后0.5倍慢速播放,计数30 s内咽泵运动次数,每段视频计数3次,取平均值[12-13]。
1.10 转基因型线虫GABA能神经结构观察
线虫的表皮透明,在荧光显微镜下,转基因型线虫EG1285(unc-47∶∶GFP)可见以GFP形式存在的GABA能神经元。转基因型线虫药物处理同1.4,药物处理后,将线虫转移至滴加了50 μL叠氮化钠(500 mmol·L-1)的琼脂糖薄层上,待线虫死亡后轻轻盖上盖玻片,使用荧光显微镜拍照,与线虫神经结构模式图比对后确认特定神经元位置,然后使用Image pro plus 6.0软件分析各组线虫GABA能神经元平均荧光强度,并计数每条线虫特定神经元数目[13]。
1.11 统计学分析
采用SPSS 19.0软件进行实验结果数据分析,寿命实验中存活率数据采用时序检测(log-rank test),以P<0.05为有统计学差异;其余数据均用x±s表示,采用单因素方差分析(one-way ANOVA),在方差齐时两组间比较采用LSD检验,在方差不齐时两组间比较采用Dunnettt检验,以P<0.05为有统计学差异。
2 结果
2.1 芫花素对野生型线虫头部摆动行为的影响
与正常对照组比较,经芫花素处理24和48 h后,芫花素1~100 μmol·L-1组线虫头部摆动次数显著减少(P<0.05,P<0.01);72 h后,芫花素0.1~100 μmol·L-1组线虫头部摆动次数均显著减少(P<0.01)(图1)。
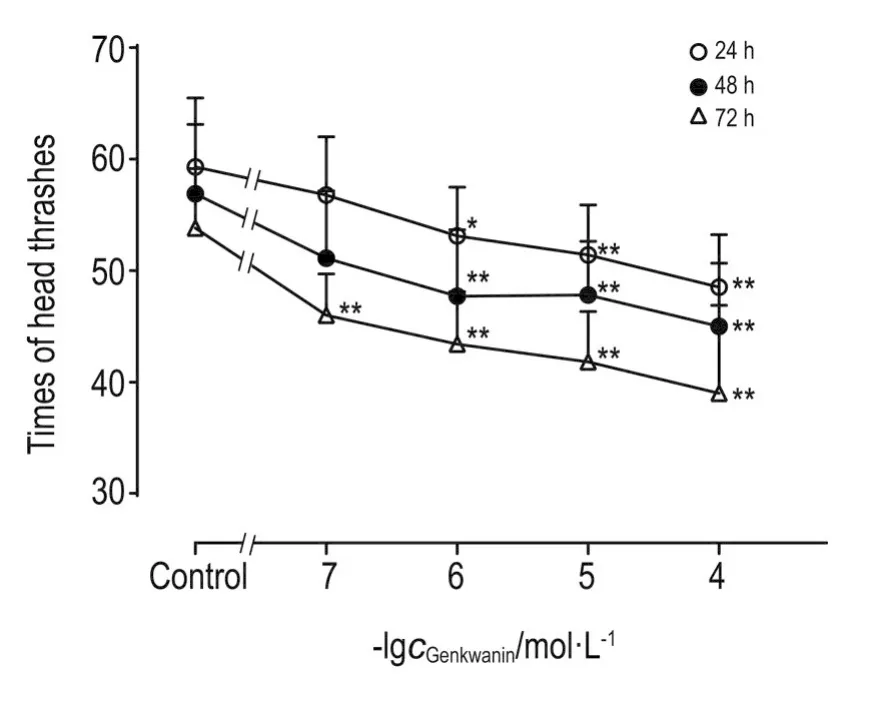
Fig.1 Effect of genkwanin on times of head thrashes in wild-type Caenorhabditis elegans(C.elegans).Wild-type C.elegans were treated with genkwanin 0.1,1,10 and 100 μmol·L-1for 24,48 and 72 h,respectively.The times of head thrashes were counted for 30 s under a stereomicroscope.,n=10.*P<0.05,**P<0.01,compared with control group.
2.2 芫花素对野生型线虫身体弯曲行为的影响
与正常对照组比较,线虫经芫花素处理24 h后,芫花素1~100 μmol·L-1组线虫身体弯曲次数显著减少(P<0.01);48和72 h后,芫花素0.1~100 μmol·L-1组线虫身体弯曲次数均显著减少(P<0.05,P<0.01)(图2)。
2.3 芫花素对野生型线虫存活率与中位生存期的影响
野生型线虫经芫花素处理72 h后,正常对照组线虫最长寿命为25 d,芫花素0.1~100 μmol·L-1组线虫存活率均为100%。与正常对照组比较,芫花素0.1~100 μmol·L-1组线虫存活率和中位生存期均无显著差异(图3)。
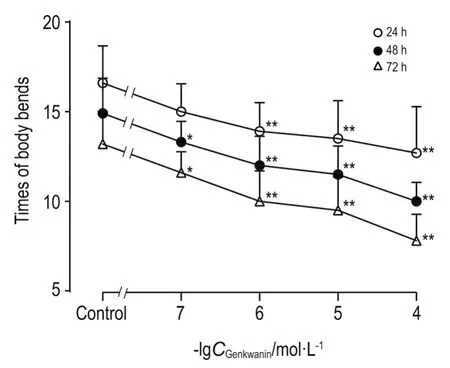
Fig.2 Effect of genkwanin on times of body bends in wild-type C.elegans.See Fig.1 for the C.elegans treat⁃ment.The number of body bends was counted for 30 s.n= 10.*P<0.05,**P<0.01,compared with the control group.
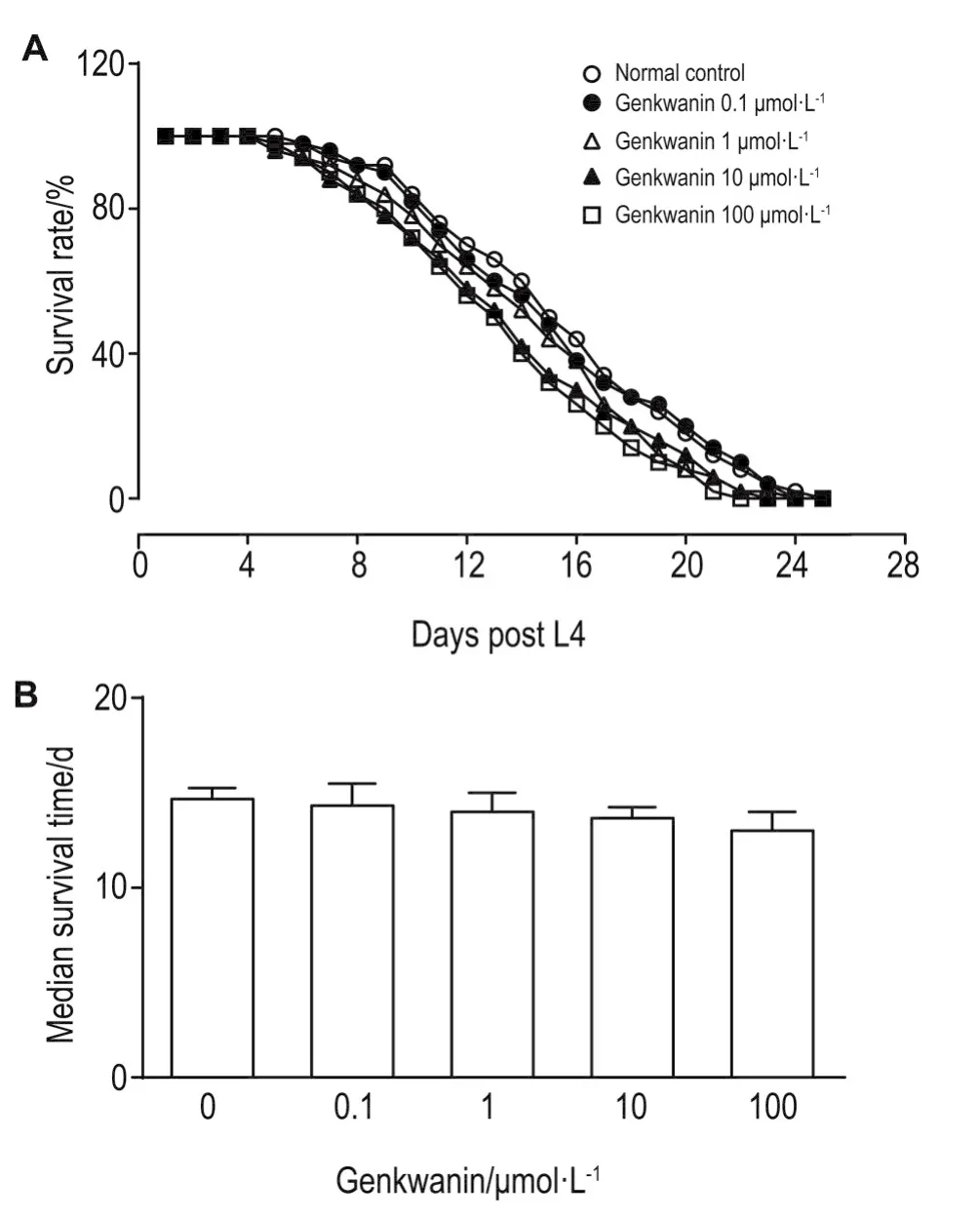
Fig.3 Effect of genkwanin on lifespan of wild-type C.elegans.C.elegans were treated with genkwanin 0.1,1,10 and 100 μmol·L-1for 72 h.n=50.
2.4 芫花素对野生型线虫子代数目的影响
与正常对照组比较,野生型线虫经芫花素处理72 h后,芫花素0.1~100 μmol·L-1组线虫子代数目均无显著差异(图4)。
2.5 芫花素对野生型线虫排泄循环长度的影响
与正常对照组比较,经芫花素处理24 h后,芫花素0.1~100 μmol·L-1组线虫平均排泄循环长度均无显著差异;48 h后,芫花素100 μmol·L-1组平均排泄循环长度显著延长(P<0.05);72 h后,芫花素0.1~100 μmol·L-1组平均排泄循环长度均显著延长(P<0.05,P<0.01)(图5)。

Fig.4 Effect of genkwanin on brood size of wild-type C.elegans.See Fig.3 for the C.elegans treatment.n=10.
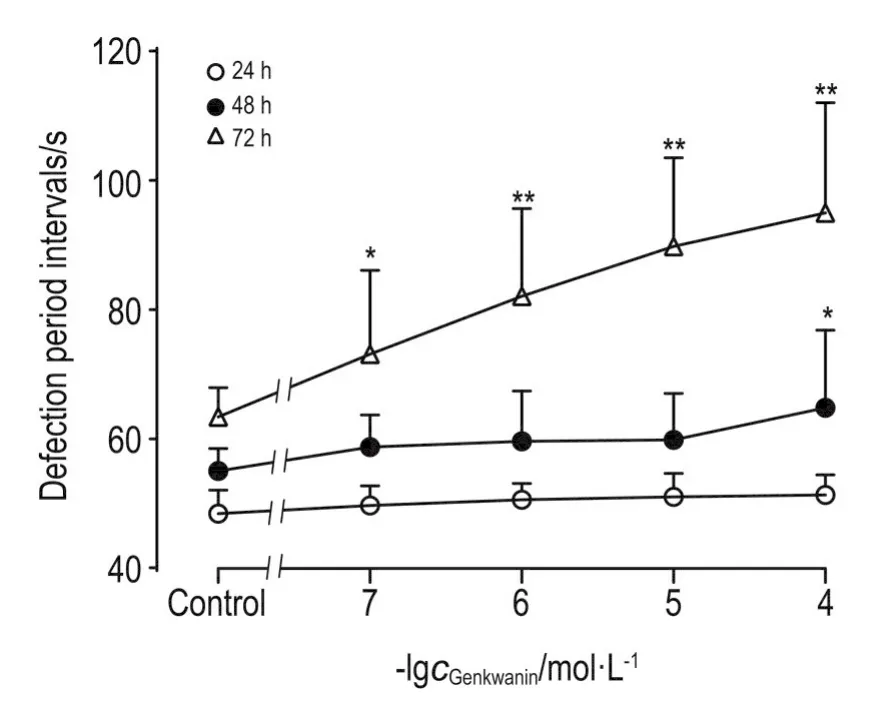
Fig.5 Effect of genkwanin on defecation cycle length of wild-type C.elegans.See Fig.1 for the C.elegans treat⁃ment.n=10.*P<0.05,**P<0.01,compared with control group.
2.6 芫花素对野生型线虫咽泵运动次数的影响
与正常对照组比较,芫花素处理24 h后,芫花素0.1~100 μmol·L-1组线虫咽泵运动次数无显著差异;48 h后,芫花素100 μmol·L-1组咽泵运动次数显著减少(P<0.01);72 h后,芫花素0.1~100 μmol·L-1组咽泵运动次数均显著减少(P<0.05,P<0.01)(图6)。
2.7 芫花素对转基因型线虫GABA能神经元荧光强度的影响
与正常对照组比较,芫花素处理24 h和48 h后,芫花素1~100 μmol·L-1组线虫神经元荧光强度显著降低(P<0.05,P<0.01);72 h后,芫花素0.1~100 μmol·L-1组神经元荧光强度均显著降低(P<0.05,P<0.01)(图7)。提示芫花素对线虫GABA能神经元具有损伤作用。
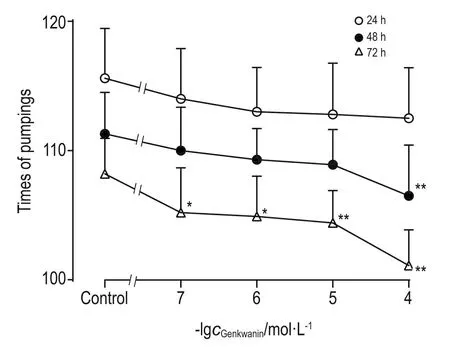
Fig.6 Effect of genkwanin on times of pumpings in wild-type C.elegans.See Fig.1 for the C.elegans treatment.s,n=10.*P<0.05,**P<0.01,compared with the control group.

Fig.7 Effect of genkwanin on fluorescent intensity of GABAergic neurons in transgenic C.elegans.See Fig.1 for the C.elegans treatment.n=10.*P<0.05,**P<0.01,compared with the control group.
2.8 芫花素对转基因线虫GABA能神经元数目的影响
如图8所示,芫花素处理72 h后,每组随机取1条转基因型线虫在不同照明系统下成像,可见各浓度芫花素组线虫GABA神经元均出现不同程度缺失,图中红色箭头代表该位置神经元缺失。
神经元计数结果显示(表1),与正常对照组比较,芫花素处理24 h后,芫花素0.1~100 μmol·L-1组线虫各类GABA能神经元数目均无显著性差异;48和72 h后,芫花素0.1~100 μmol·L-1组线虫DD、RME、RIS和DVB神经元数目无显著性差异(数据略)。与正常对照组比较,芫花素处理48 h后,芫花素100 μmol·L-1组VD神经元数目显著减少(P<0.01);72 h后,芫花素10和100 μmol·L-1组VD神经元数目显著减少(P<0.05,P<0.01),芫花素1~100 μmol·L-1组AVL神经元数目显著减少(P<0.05,P<0.01)。

Fig.8 Morphology of GABAergic neurons in transgenic C.elegans.C.elegans were treated with genkwanin 0.1,1,10 and 100 μmol·L-1for 72 h.After being executed and sealed,C.elegans were photographed with a fluorescence microscope under bright-field(column A)and fluorescent-field(column B)illumination system,respectively.Photos of column C were the merge of A and B. Photos of each line were taken from the same C.elegan of each group.The red arrows indicate the main positions of neuronal loss and abnormality.
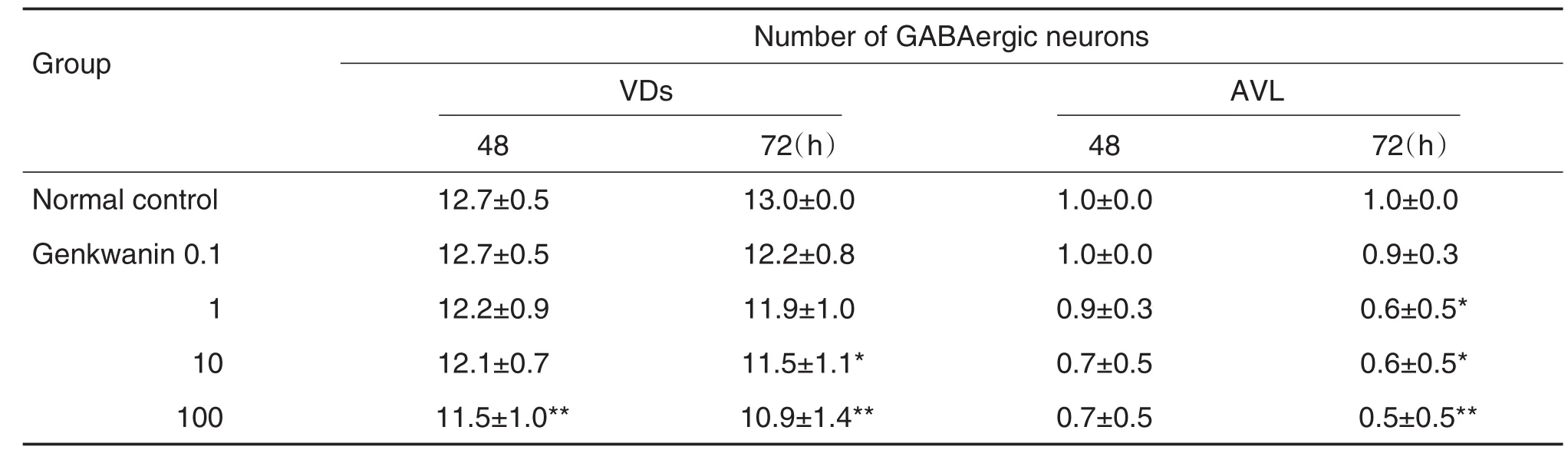
Tab.1 Effect of genkwanin on number of GABAergic neurons in transgenic C.elegans
3 讨论
本研究结果显示,芫花素处理能明显影响野生型线虫的行为学指标。随芫花素处理浓度和时间的增加,线虫头部摆动和身体弯曲次数均显著减少;排泄周期延长;咽泵运动次数减少。本实验室前期发现芫花水提物对野生型线虫繁殖力具有抑制作用[2],而本研究中,芫花素0.1~100 μmol·L-1处理72 h对野生型线虫子代数目无显著影响,故其生殖毒性作用物质基础有待探讨。野生型线虫的运动、排泄以及咽泵行为主要受神经系统控制,结果提示芫花素可能对线虫神经系统起抑制作用。
神经系统是机体在结构和功能上最为复杂的系统之一,由于该系统自身的特点,神经毒性表现往往呈现为全身效应。线虫具有神经元结构简单,基因功能与哺乳动物同源,并具有与哺乳动物类似的神经递质(如GABA、乙酰胆碱、多巴胺、5-羟色胺、谷氨酸和神经肽等)的特点,因而在研究神经毒理学方面具有极大优势。一条雌雄同体的成虫有959个体细胞和302个神经元,且每一根神经的走向都清晰明确,其半透明的身体为观察细胞的变化和虫体中荧光标记蛋白的表达提供了便捷的研究手段[15-16]。
GABA是哺乳动物中枢神经系统中最重要的抑制性神经递质,约50%的中枢神经突触部位以GABA为递质[17]。而线虫体内GABA能神经元的结构与功能均已进行了深入系统的研究,已具有绿色荧光蛋白标记GABA 26个神经元的转基因型线虫EG1285(unc-47∶∶GFP),荧光显微镜下可以清晰观察到神经元的数量和结构。线虫中26个GABA神经元主要分为6大类,其中13个VD神经元、6个DD神经元、1个AVL神经元、1个DVB神经元和4个RME神经元,它们都属于运动神经元,直接和肌肉连接并支配其运动;还有1个RIS神经元属于中间神经元[14,18]。运动神经元中,VD和DD末梢分别延伸入线虫背部和腹部的肌肉中,抑制肌肉收缩,调控线虫运动;本研究中,线虫经过芫花素处理后VD神经元出现缺失,导致GABA释放下降,不正常的肌肉收缩可能是引起线虫身体弯曲次数下降的主要原因。AVL和DVB神经元末梢延伸到线虫肠部肌肉,促进肠部肌肉兴奋,使肠道肌肉收缩,从而调控线虫的排泄行为;本研究中线虫经过芫花素处理后AVL神经元出现缺失,这可能是线虫排泄行为受到抑制的主要原因[19-21]。根据文献[22-23],正常对照组亦会出现少数神经元缺失情况,但不影响整体实验结果。
综上,本研究表明,芫花素对线虫具有一定的毒性作用,主要表现为运动行为抑制,其机制可能与损伤GABA能神经元有关,该结果将为中药芫花的毒性物质基础研究以及芫花素进一步的哺乳动物毒性研究提供依据。
[1]Zhao Y,Yuan ST,Li AY,Zhang BX,Wang ZJ. Effects of processing on toxicity and pharmacological action of Flos Genkwa[J].China J Chin Mater Med(中国中药杂志),1998,23(6):344-347,382-383.
[2]Qiao Y,Zhao YL,Wu QL,Sun LM,Ruan QL,Chen YY,etal.Fulltoxicityassessmentof Genkwa Flos and the underlying mechanism in nematodeCaenorhabditis elegans[J].PLoS One, 2014,9(3):e91825.
[3]Wu CE.Study on genkwanin content in different processedDaphe genkwaproducts[J].World J Int Tradit West Med(世界中西医结合杂志),2014,9(10):1054-1055,1077.
[4]Chen YY,Duan JA,Tang YP,Guo S.Chemical constituents from flower buds ofDaphne Genkwa[J].Chin Tradit Herb Drugs(中草药),2013,44(4):397-402.
[5]Rankin CH.From gene to identified neuron to behaviour inCaenorhabditis elegans[J].Nat Rev Genet,2002,3(8):622-630.
[6]Leung MC,Williams PL,Benedetto A,Au C,Helmcke KJ,Aschner M,et al.Caenorhabditis elegans:an emerging model in biomedical and environmental toxicology[J].Toxicol Sci,2008,106(1):5-28.
[7]Brenner S.The genetics ofCaenorhabditis elegans[J].Genetics,1974,77(1):71-94.
[8]Donkin SG,Williams PL.Influence of developmental stage,salts and food presence on various end points usingCaenorhabditis elegansfor aquatic toxicity testing[J].Environ Toxicol Chem,1995,14(14):2139-2147.
[9]Wang DY,Xing XJ.Pre-treatment with mild UV irradi⁃ation suppresses reproductive toxicity induced by subsequent cadmium exposure in nematodes[J].Ecotoxicol Environ Saf,2010,73(3):423-429.
[10]Ruan QL,Qiao Y,Zhao YL,Xu Y,Wang M,Duan JA,et al.Beneficial effects of Glycyrrhizae Radix extract in preventing oxidative damage and extending the lifespan ofCaenorhabditis elegans[J].J Ethnopharmacol,2016,177:101-110.
[11]Cai WJ,Zhang XM,Huang JH.Effect of epimedium flavonoids in retarding aging ofC.elegans[J].Chin J Integrated Tradit Chin West Med(中国中西医结合杂志),2008,28(6):522-525.
[12]Wu QL,Li YP,Tang M,Wang DY.Evaluation of environmental safety concentrations of DMSA coated Fe2O3-NPs using different assay systems in nema⁃todeCaenorhabditiselegans[J].PLoSOne,2012,7(8):e43729.
[13]Zhao YL,Wu QL,Tang M,Wang DY.Thein vivounderlying mechanism for recovery response forma⁃tion in nano-titanium dioxide exposedCaenorhabditis elegansafter transfer to the normal condition[J].Nanomedicine,2014,10(1):89-98.
[14]McIntire SL,Jorgensen E,Kaplan J,Horvitz HR. The GABAergic nervous system ofCaenorhabditis elegans[J].Nature,1993,364(6435):337-341.
[15]Wang YH.Caenorhabditis elegance-a simplest model for the study of nervous system[J].Chin J Neurosci(中国神经科学杂志),2000,16(1):60-64.
[16]Ren CH,Zhang CG.Application ofCaenorhabditis elegansin neuroscience research[J].Bull Acad Mil Med Sci(军事医学科学院院刊),2008,32(6):575-578.
[17] Krnjevic′K.Role of GABA in cerebral cortex[J].Can J Physiol Pharmacol,1997,75(5):439-451.
[18]Schuske K,Beg AA,Jorgensen EM.The GABA nervous system inC.elegans[J].Trends Neurosci,2004,27(7):407-414.
[19]Shen Y,Wen Q,Liu H,Zhong C,Qin YQ,Harris G,et al.An extrasynaptic GABAergic signal modu⁃lates a pattern of forward movement inCaenorhab⁃ditis elegans[J].Elife,2016,5:e14197.
[20]White JG,Southgate E,Thomson JN,Brenner S. The structure of the nervous system of the nema⁃todeCaenorhabditis elegans[J].Philos Trans R Soc Lond B Biol Sci,1986,314(1165):1-340.
[21]Thomas JH.Genetic analysis of defecation inCaenorhabditis elegans[J].Genetics,1990,124(4):855-872.
[22]Ju JJ,Ruan QL,Li XB,Liu R,Li YH,Pu YP,et al.Neurotoxicological evaluation of microcystin-LR exposure at environmental relevant concentrations on nematodeCaenorhabditis elegans[J].Environ Sci Pollut Res Int,2013,20(3):1823-1830.
[23]Du M,Wang DY.The neurotoxic effects of heavy metal exposure on GABAergic nervous system in nematodeCaenorhabditiselegans[J].Environ Toxicol Pharmacol,2009,27(3):314-320.
Toxic effect of genkwanin on model organism Caenorhabditis elegans
XU Yun1,2,RUAN Qin-li1,2,JI Lei-lei2,JI Jing2,WU Chen-xi2,WANG Meng2
(1.Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, 2.Center for Drug Safety Evaluation and Research,Nanjing University of Chinese Medicine, Nanjing 210023,China)
OBJECTIVE To explore the toxicity and mechanisms of genkwanin,one of the main components ofFlos Genkwa,using the model organismCaenorhabditis elegans(C.elegans)assay system.METHODSBoth wild-type and transgenic strains ofC.eleganswere treated with genkwanin 0.1,1,10 and 100 μmol·L-1for 24,48 and 72 h,respectively.The head thrashes,body bends,lifespan,brood size,mean defecation cycle length and pumping behavior of the wild-typeC.elegansas well as the fluo⁃rescence intensity and the number of GABAergic neurons of the transgenicC.eleganswere observed under microscopes.RESULTS① Wild-typeC.elegans:Compared with the normal control group,after treatment with genkwanin for 24 h,the times of head thrashes and body bends ofC.elegansshowed significant decreases(P<0.05,P<0.01)in genkwanin 1-100 μmol·L-1groups.After treatment with genk⁃wanin for 48 h,the times of body bends showed a significant decrease(P<0.05)in genkwanin 0.1 μmol·L-1group,the times of head thrashes and body bends showed a significant decrease(P<0.01)in genkwanin 1-100 μmol·L-1groups,but a significant increase of mean defecation cycle length(P<0.05)and a decrease of pumping behavior(P<0.01)were observed in genkwanin 100 μmol·L-1groups.After treat⁃ment with genkwanin for 72 h,a decrease in the times of head thrashes and body bends(P<0.05,P<0.01),an increase of mean defecation cycle length(P<0.05,P<0.01),and a decrease of pumping behavior (P<0.05,P<0.01)inC.eleganswere observed in genkwanin 0.1-100 μmol·L-1groups.②TransgenicC.elegans:Compared with the normal control,after treatment with genkwanin for 24 h,the fluores⁃cence intensity of GABAergic neurons of the transgenicC.elegansshowed significant decreases(P<0.05,P<0.01)in genkwanin 1-100 μmol·L-1groups.After treatment with genkwanin for 48 h,the fluores⁃cence intensity of GABAergic neurons(P<0.05,P<0.01)and the number of VD neurons(P<0.01)showed significant decreases in genkwanin 1-100 μmol·L-1groups.After treatment with genkwanin for 72 h,thefluorescence intensity of GABAergic neurons(P<0.05,P<0.01)decreased in genkwanin 0.1-100 μmol·L-1groups,so did the number of AVL(P<0.05,P<0.01)and VD neurons(P<0.05,P<0.01)in genkwanin 1-100 μmol·L-1and 10-100 μmol·L-1groups,respectively.CONCLUSIONGenkwanin has certain toxicity inC.elegansmainly by inhibiting the locomotion behaviors.The underlying mechanism may be related to the impairment of GABAergic neurons.
Caenorhabditis elegans;genkwanin;toxicity
The project supported by National Natural Science Foundation of China(81202981);and Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization(ZDXM-2-7)
WANG Meng,E-mail:w-m65@163.com,Tel:(025)85811244-808
R285.1
:A
:1000-3002-(2017)05-414-08
10.3867/j.issn.1000-3002.2017.05.006
2016-05-12 接受日期:2017-05-02)
(本文编辑:赵 楠)
国家自然科学基金(81202981);江苏省中药资源产业化过程协同创新中心开放课题(ZDXM-2-7)
许 云,女,硕士研究生,从事药物毒理学研究。
王 梦,E-mail:w-m65@163.com,Tel:(025)85811244-808
