二乙烯砜-谷胱甘肽系列加合物的制备及其与体外DNA加合反应活性
2017-06-05吕姗姗高中才赵玉梅张雅姣吴剑峰谢剑炜
吕姗姗,徐 斌,高中才,赵玉梅,张雅姣,徐 华,吴剑峰,谢剑炜
(军事医学科学院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
二乙烯砜-谷胱甘肽系列加合物的制备及其与体外DNA加合反应活性
吕姗姗,徐 斌,高中才,赵玉梅,张雅姣,徐 华,吴剑峰,谢剑炜
(军事医学科学院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
目的合成制备芥子气(SM)的重要氧化代谢产物二乙烯砜(DVS)的谷胱甘肽(GSH)加合物,并研究其体外与DNA的加合反应活性。方法以SM为起始原料,通过两步氧化反应制备芥子亚砜(SMO)和芥子砜(SMO2),在碱性条件下通过“脱氯”反应合成并纯化获得DVS,进而采用制备液相色谱纯化获得了DVS-GSH单加合物及其与鸟嘌呤或腺嘌呤形成的2种DVS双加合物,并通过超高效液相色谱串联质谱(UPLC-MS/MS)技术研究DVS-GSH与体外DNA的加合反应活性。核磁共振谱和高分辨质谱鉴定DVS加合物表征和结构。结果在水溶液中DVS与GSH的反应活性显著高于SM,且生成的DVS-GSH单加合物也具有较强的反应活性,可与DNA的腺嘌呤和鸟嘌呤生成系列新的加合物,且与腺嘌呤加合物的丰度高于与鸟嘌呤加合物。结论SM的氧化代谢产物DVS的二相代谢产物(DVS-GSH)与DNA体外仍具有较强的加合反应活性,其对DNA的损伤效应值得关注。
二乙烯砜;谷胱甘肽加合物;DNA加合物
芥子气(sulfur mustard,SM)是一种难防难治的糜烂性化学战剂,由于其制备简单,使用门槛低,毒性大,作用持续时间长,已被多次用于战争、恐怖袭击等。我们前期的研究结果表明,SM暴露后在体内易发生氧化反应,其中大部分转化为芥子亚砜(mustard sulfoxide,SMO),SMO还可进一步氧化成芥子砜(mustard sulfone,SMO2)[1]。而SMO2在弱碱性(pH 7.3~7.7)条件下会自发发生两步“脱氯”反应,转化为反应活性更高的二乙烯砜(divinylsul⁃fone,DVS)[2-3]。同时,DVS还是SM在氧化型洗消液中的主要终产物;工业上DVS还作为交联剂被广泛使用,如与透明质酸交联形成水凝胶等[4]。近年来,DVS常被用作修饰聚合物发生“点击”反应(click reaction)的反应试剂,用来修饰标记蛋白等[9]。已有文献报道,SMO属于低毒性分子,而SMO2和DVS却具有类SM的糜烂性毒性作用,且DVS的反应活性较SMO2更强,能与氨基酸、巯基化合物和蛋白等发生反应[5-7],其主要是由于DVS的双烯键属于缺电子型官能团,易与亲核试剂发生迈克尔加成反应(Michael addition reaction)。而体内诸多重要活性物质,如一些功能蛋白、谷胱甘肽(glutathione,GSH)、氨基酸和DNA等均含有较多的富电子官能团,DVS极易与其发生加成反应,产生一系列的机体损伤效应。如Dearfield等[8]用DVS染毒小鼠淋巴瘤细胞,诱变遗传毒性试验结果为阳性,表明DVS存在一定的基因毒性。有研究表明,DVS的双烯键与一分子的亲核试剂发生加成反应生成单加合物后,裸露的另一烯键反应活性会得到增强,更易生成交联加合物[10-12]。我们前期研究数据还表明[13],DVS与GSH具有很高的反应性,可生成DVS与GSH的单加合物(DVS-GSH)和双加合物(GSH-DVS-GSH),其中DVS-GSH单加合物的穿透细胞膜(核)的能力也显著增加。推测其可能具有基因毒性,能与细胞核内的DNA形成加合物,并产生DNA损伤效应。因此,深入研究DVS及DVSGSH加合物与DNA的单加合反应活性,对了解其DNA损伤效应具有重要意义。
1 材料与方法
1.1 主要试剂和仪器
SM(防化学院提供,纯度>98%);GSH(美国Acros公司);腺苷(北京伊诺凯有限公司);鸟苷(中国Alfa Aesar公司);鲑鱼精DNA(北京索莱宝科技有限公司);甲醇和乙腈(色谱纯)(德国Merck公司);实验用水为超纯水(18.2 MΩ),由MilL-Q 10超纯水机(美国Millipore公司)制备;其余试剂均为分析纯(国药集团北京化学试剂公司)。
Xevo G2超高效液相色谱-四极杆飞行时间质谱(ultra-performance liquid chromatography-quadru⁃pole time-of-fight mass spectrometry,UPLC-QTOF/ MS)联用仪(美国Waters公司);Qtrap质谱仪和Agilent 5975气相色谱质谱(gas chromatographymass spectrometry,GC-MS)联用仪(美国Agilent公司);LC 3000型半制备型高效液相色谱仪(北京创新通恒科技有限公司);ECA 400超导脉冲傅里叶变换核磁共振谱(nuclear magnetic resonance,NMR)仪(日本JEOL公司);DL 203电子天平(瑞士MettlerToledo公司);旋转蒸发仪RE-52AA(上海亚荣生化仪器厂)。
1.2 芥子亚砜和芥子砜的制备
将SM用少量乙腈溶解后缓慢滴入浓硝酸中[14],室温下反应约3 h,待反应液由棕红色逐渐转变为深绿色时,用GC-MS监测反应液至SM反应完全,反应液用二氯甲烷萃取3次(20 mL×3),合并有机相,用无水硫酸钠干燥过夜后,旋转蒸发除去有机溶剂得到白色固体,即为SMO粗品。
将上述制备的SMO粗品,用少量乙腈溶解后,转移至三颈瓶中,加入适量KMnO4和浓硫酸[15-16],120℃下加热回流反应6 h,GC-MS监测至SMO反应完全即停止反应。冷却至室温后,反应液用二氯甲烷提取3次(20 mL×3),合并有机相,用无水硫酸钠干燥过夜,旋转蒸发除去溶剂即可得到SMO2粗品。
1.3 二乙烯砜的制备
将上述制备的SMO2用少量乙腈溶解后转移至三颈瓶中,加入碳酸钙水溶液,室温下反应3 h,再升温至120℃回流反应6 h,GC-MS监测反应,待SMO2粗品全部转化为DVS后,即停止反应,冷却至室温,用二氯甲烷提取3次后,合并有机相,无水硫酸钠干燥后,旋转蒸发除去有机溶剂,获得无色油状液体即为DVS。经GC-MS和NMR表征,其纯度≥95%,可以满足后续实验要求。
SM和DVS均为糜烂性毒剂,所有操作必须在通风橱内进行。操作完毕后的溶液和所使用的器皿均需要以醇碱溶液进行洗消处理。
1.4 DVS-GSH单加合物制备
称取适量DVS,用少量乙腈溶解,转移至三颈瓶中,加入10 mL超纯水,搅拌至DVS溶解后,按摩尔比1∶1.2加入GSH,冰浴下反应20 min,高分辨质谱监测至GSH反应完全。用制备液相色谱分离纯化获得单加合物,分离条件为:A相为水,B相为甲醇;0 min:1%B,10 min:20%B,20 min:20% B,收集5~6 min流份。用NMR及超高效液相色谱-高分辨质谱(UPLC-high resolution mass spec⁃trometry,UPLC-HRMS)对产物的结构进行鉴定。
有杕之杜,其叶菁菁。 独行睘睘。 岂无他人?不如我同姓。 嗟行之人,胡不比焉?人无兄弟,胡不佽焉?(睘,孤独。)[3]111-112
1.5 DVS-GSH与嘌呤加合物的制备
称取适量DVS-GSH加合物溶于PBS缓冲液中(pH=7.4),冰浴下以摩尔比1∶1.5加入鸟苷或腺苷,室温下搅拌1 h后,停止反应,用等体积1 mol·L-1盐酸溶液60℃酸解1 h,酸解液用制备液相色谱分离纯化,分离条件与1.4描述相同,收集23~25 min流份,合并所收集的流份后旋转蒸发除去部分溶剂,剩余组分经冷冻干燥得白色固体。用NMR及UPLC-HRMS对产物加以鉴定。
1.6 UPLC-HRMS分析条件
液相色谱条件:色谱柱Waters ACQUITY UPLC BEH C18柱(2.1 mm×100 mm,1.7 μm);柱温40℃;流动相A:0.1%甲酸水溶液,流动相B:甲醇;流速0.25 mL·min-1;梯度:0~2 min,1%B;2~7 min,1%~50%B;7~12 min,50%~95%B;进样量2 μL。
Q-TOF质谱条件:电离模式:电喷雾电离(elec⁃trospray ionization,ESI)正离子模式;采集模式:全信息串联(MSE)模式;毛细管电压,3 kV;锥孔电压,15 V;萃取电压,4 V;源温,100℃;脱溶剂温度,300℃;碰撞能量:低碰撞能量为6 eV,高碰撞能量为10~40 eV;一级质谱分辨率10 000 FWHM。
1.7 建立生物样品中DVS-GSH与嘌呤加合物的检测方法
为了有效表征生物样品中加合物,采用检测特异性和灵敏度好的三重四极杆超高效液相色谱-串联质谱(UPLC-MS/MS)技术,应用多反应监测模式(multiple reaction monitoring,MRM),基于实验1.5中所获得GSH-DVS-嘌呤加合物参考品,选取特异性母离子与子离子,建立用以检测生物样品中的GSH-DVS-嘌呤加合物的方法。
色谱条件:Waters ACQUITY UPLC BEH C18柱(2.1 mm×50 mm,1.7 μm);柱温40℃;流动相A:水B:甲醇;流速0.35 mL·min-1;梯度0~4 min,5%~35%B;4.1~4.5 min,35%~80%B;进样量3 μL。
质谱条件:电离模式:ESI正离子源;采集模式:MRM;电喷雾电压:5.5 kV;离子源温度:550℃;雾化气(Gas1)35 psi;辅助加热干燥气(Gas2)60 psi,分解电压(declustering potential,DP)、碰撞电压(colli⁃sion energy,CE)、碰撞室出口电压(collision cell exit potential,CEX)、入口电压(entrance poten⁃tial,EP)参数见表1。
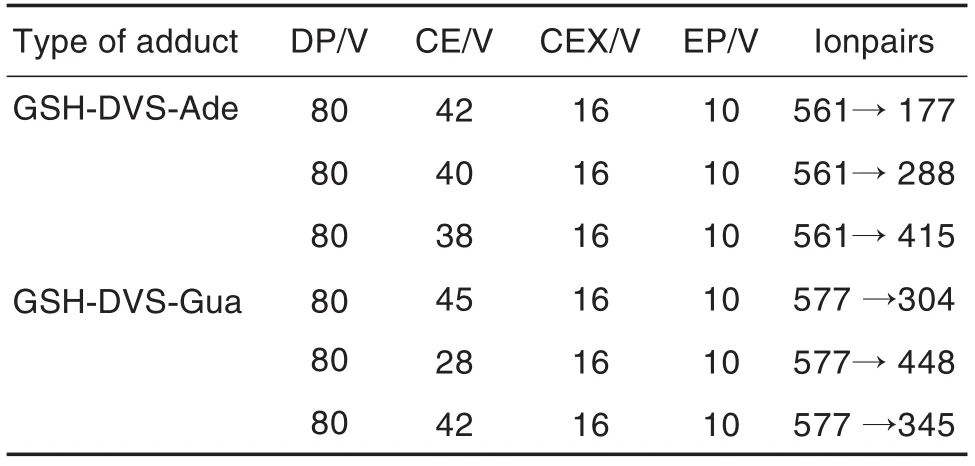
Tab.1 Mass spectroscopic parameters for determina⁃tion of DNA adducts
称取1mg的DVS-GSH,加至含有5 mg双链鲑鱼精的DNA溶液中,室温下搅拌反应数小时后,停止反应,用2.5倍体积的冷乙醇进行沉淀,高速离心后,弃去上清液,下层沉淀用适量70%乙醇洗2~3次后,挥干乙醇,加入等体积15%甲酸水溶液75℃进行酸化,酸化时间约为0.5 h,将酸解液旋至近干,用少量水-甲醇混合液复溶后,再用LC-MS/MS检测DNA加合物的生成。
2 结果
2.1 SMO,SMO2和DVS的合成和鉴定
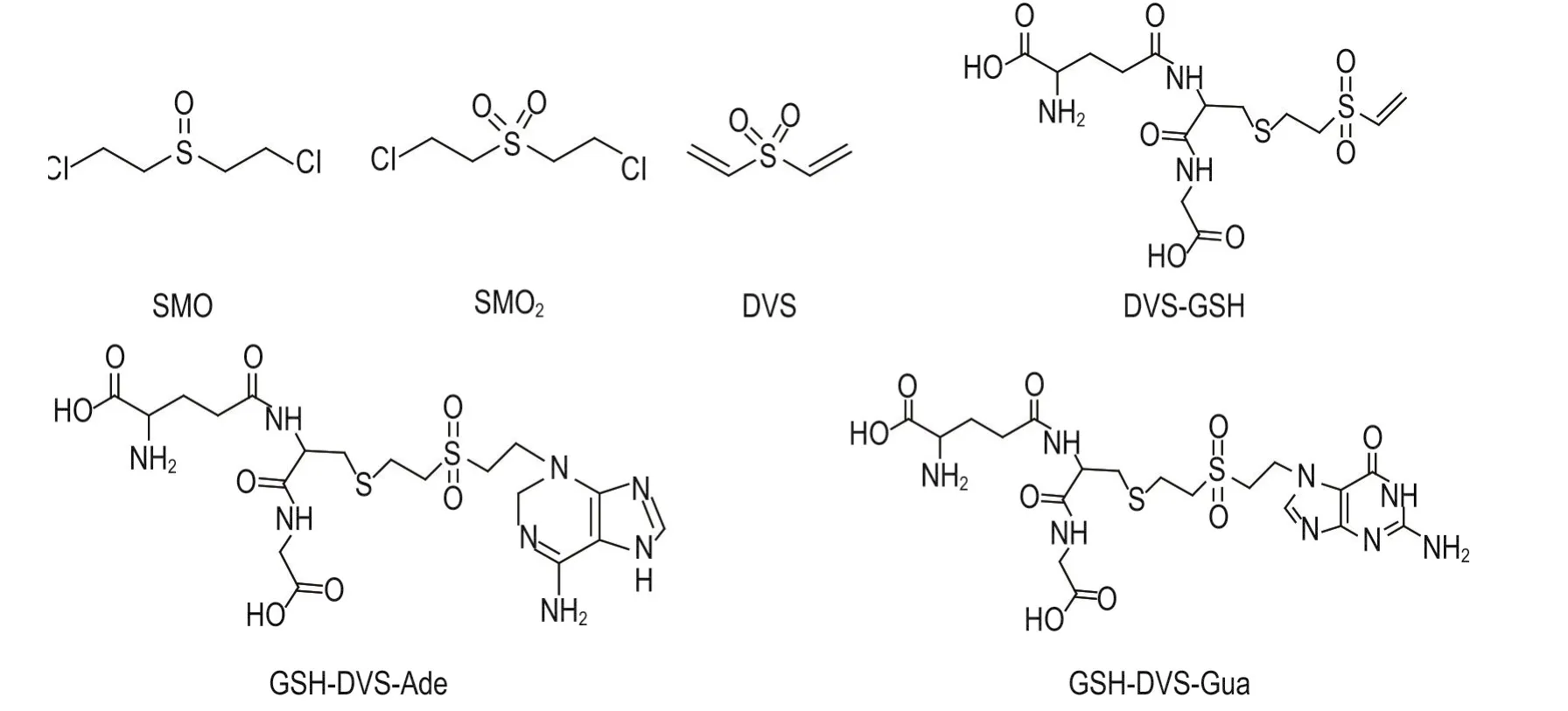
Fig.1 Structures of synthesized chemicals.SMO:mustard sulfoxide;SMO2:mustard sulfone.
本实验所合成化合物的结构式如图1所示,包括3种SM氧化产物和3种DVS加合物,气相色谱图见图2,SMO(tR=9.5 min)、SMO2(tR=9.4 min)及DVS(tR=5.9 min),图中箭头所指为几种氧化产物的转化关系。合成所得终产物DVS的纯度>97%(纯度由峰面积归一化法测得),可以满足后续实验要求。
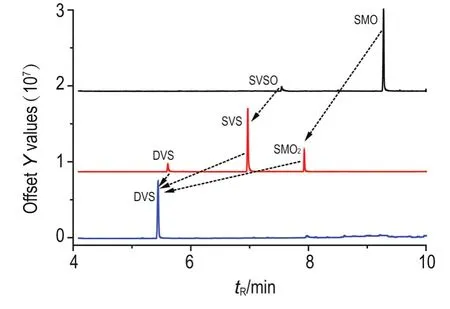
Fig.2 GC-MS chromatogram of SMO,SMO2and DVS. Arrows indicate transformation of several oxidative products of sulfur mustard(SM).
2.2 DVS-GSH单加合物的分析和鉴定
制备液相色谱分离获得的化合物DVS-GSH用NMR和LC-HRMS进行分析。在ESI+模式下可检测到准分子离子峰[M+H]+的质荷比(m/z)=426.1002,与理论值426.1005(C14H23N3O8S2)一致(质量偏差0.7 ppm)。二级碎裂离子m/z297.0576为DVSGSH单加合物GSH部分上谷氨酸与半胱氨酸链接的肽键处(-CO-NH-)断裂,丢失C5H8NO3碎片形成。1HNMR和质谱分析结果如下,表明制备的化合物即为目标产物DVS-GSH,总产率为62%,纯度>97%。液相色谱图及质谱图分别见图3A和图3B。
ESI+-HRMS:m/z426.1002[M+H]+→297.0576[M+H-C5H8NO3]+。1HNMR(D2O,400 MHz)δ6.69(q,2H),6.31(q,H),4.43(t,H),3.58(m,3H),3.36(t,2H),2.93(m,H),2.75(m,3H),2.34(m,2H),1.98(m,2H)。
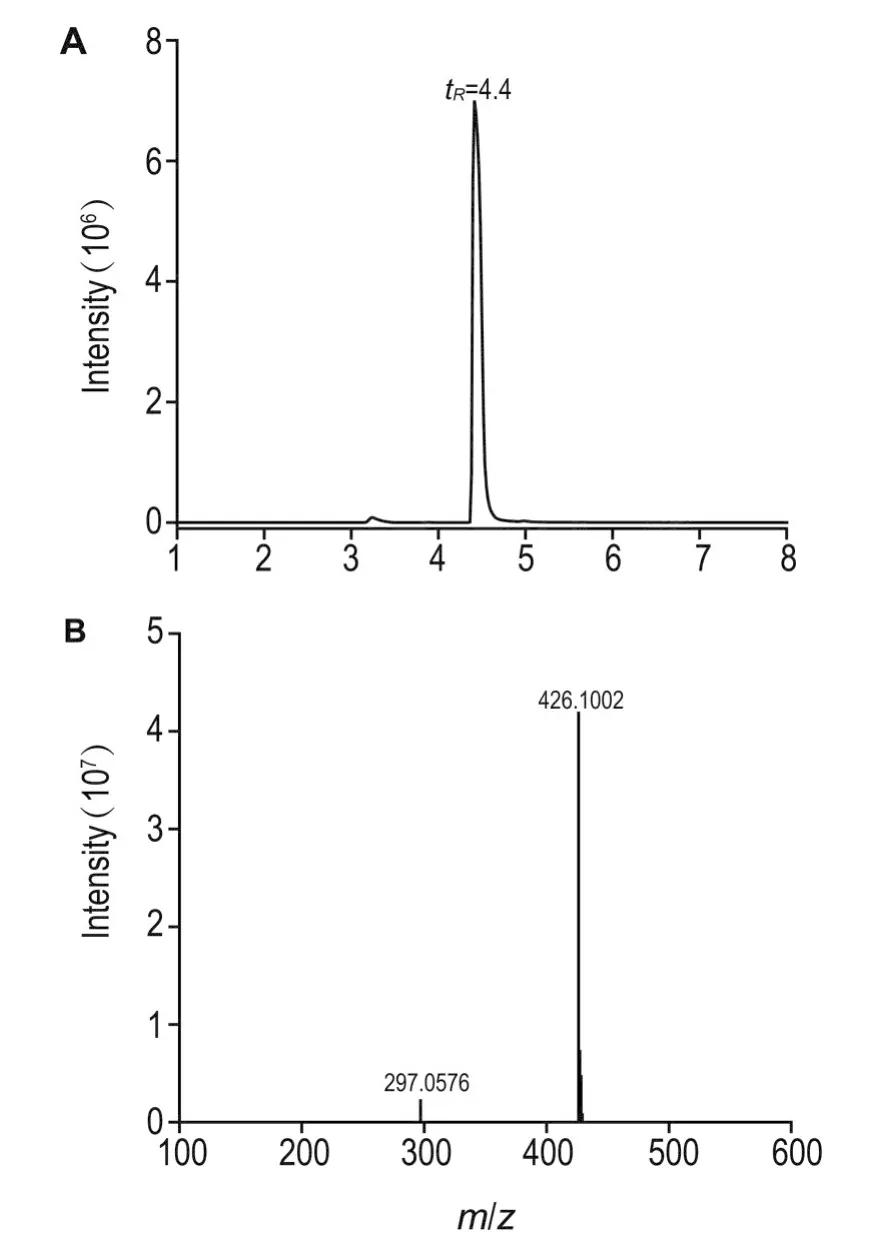
Fig.3 HPLC chromatogram(A)and mass spectrum (B)of DVS-GSH.
2.3 DVS-GSH-嘌呤双加合物的分析和鉴定
液相色谱分离纯化所得的双加合物用LC-HRMS和NMR进行分析。2种化合物的液相色谱图如图4A和4B所示,质谱图如图4C和4D所示,其中GSH-DVS-Ade的分子式为C19H28N8O8S2,在ESI+模式下可检测到GSH-DVS-Ade准分子离子峰[M+ H]+的m/z=561.1570(质量偏差3.56 ppm)。但仅根据准分子离子峰不能确定加合物的具体结构,其二级碎裂离子m/z为 434.1120,330.0753和130.0519,分别是DVS侧链上S-O双键断裂和GSH部分肽键(-CO-NH-)断裂形成。同样,GSHDVS-Gua质谱图如图4D所示,其准分子离子峰[M+H]+的m/z=577.1472(质量偏差4.68 ppm),计算分子式为C19H28N8O9S2,二级碎裂离子信号强度较强的m/z分别为 448.1049,345.0784和130.0500,分别是由GSH部分上谷氨酸与半胱氨酸链接的肽键(-CO-NH-)断裂和C-C键断裂形成的。双加合物的1HNMR和质谱检测结果均表明,制备的化合物即为目标产物,2种加合物的合成产率分别为71%和66%,纯度>96%。
ESI+-HRMS:m/z561.1570[M+H]+→434.1120[M+H-C5H9NO3]+,330.0753[M+H-C5H9NO3-C2H4NO2-2O]+,130.0519[M+H-C14H20N7O5S2]+。1HNMR(DMSO-d6,400 MHz)δ8.52(br,5H),7.85(s,H),7.39(s,H),7.26(s,2H),4.78(br,2H),4.53(br,H),3.89(m,1H),3.51(br,8H),3.11(m,1H),2.53(s,2H),1.29(m,3H)。
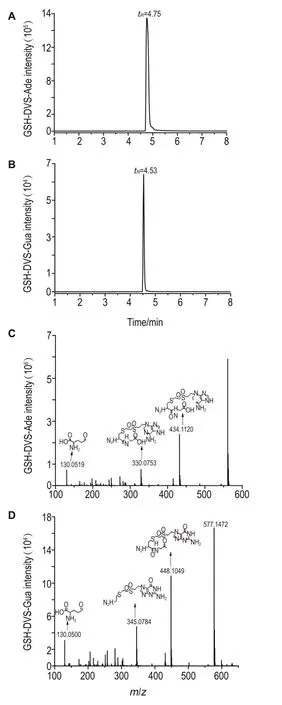
Fig.4HPLC chromatograms(A and B)and mass spectrum(C and D)of GSH-DVS-Ade(A and C)and GSH-DVS-Gua(B and D).
ESI+-HRMS:m/z577.1472[M+H]+→448.1049[M+H-C5H9NO3]+,345.0784[M+H-C5H9NO3-C3H4NO3]+,130.0500[M+H-C14H20N7O6S2]+。1HNMR(DMSO-d6,400 MHz)δ8.47(m,10H),7.48(br,2H),7.34(br,4H),4.72(br,2H),4.52(br,H),3.85(m,15H),3.09(m,2H),2.45(s,6H),1.98(br,3H),1.28(m,5H)。
2.4 生物样品中DVS-GSH与嘌呤加合物的分析
为了实现生物样品中GSH-DVS-嘌呤加合物(GSH-DVS-Ade和GSH-DVS-Gua)的分析。首先用2种加合物参考品获得其质谱图,并选择了其检测母离子和子离子对,采用MRM模式进行监测,如图5A和5B所示,GSH-DVS-Ade和GSH-DVSGua的色谱保留时间分别为1.21 min和1.01 min。
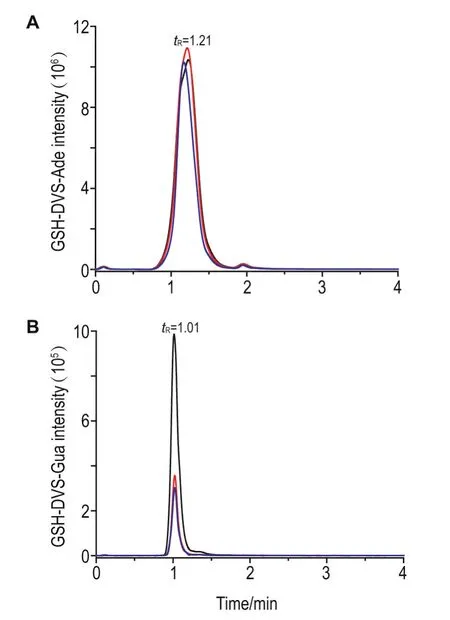
Fig.5 UPLC chromatograms of DVS-GSH-Ade and DVSGSH-Gua.Transition m/z:561→177,561→288,561→415; 577→304,577→448,577→345.
2.5 GSH-DVS-DNA加合物确证分析
直接以双链鲑鱼精DNA为底物与DVS-GSH反应数小时,经酸解后用QTOF/MS检测,提取离子的液相色谱如图6所示。通过保留时间和质谱图与2.3中所述的加合物参考品比较,tR=4.77 min和tR= 4.53 min的色谱峰分别为GSH-DVS-Ade和GSHDVS-Gua组分,可以确定DVS-GSH可与DNA上的腺嘌呤和鸟嘌呤发生加成反应,生成2种加合物。依据液相色谱图的峰面积估算GSH-DVS-Ade的量约是GSH-DVS-Gua的1.5倍,表明DVS-GSH更易与腺嘌呤生成加合物。
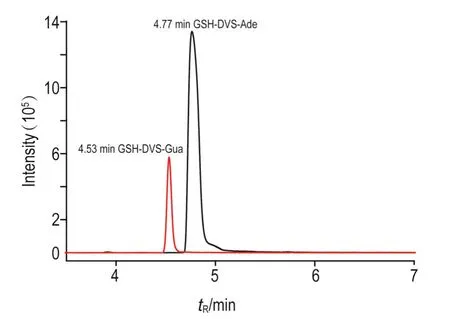
Fig.6HPLC chromatogram of DNA adducts from DVS-GSH.
3 讨论
依据SM系列氧化产物的特性,对DVS的合成路线进行了优化,仅通过一次“串联氧化”反应和一步“脱氯”反应即可获得较高纯度的DVS。具体如下:以SM为起始原料,实验中用GC-MS监测反应进程,发现用浓HNO3氧化过程中,除主要生成SMO外,还会伴随生成单乙烯亚砜(SVSO)和双乙烯亚砜(DVSO);而在以SMO粗品为原料制备SMO2时,SVSO和DVSO分别也被氧化成单乙烯砜(SVS)和DVS;但经过脱氯反应,SMO2及其副产物SVS均可转化为DVS。因此,制备DVS的过程中将中间体SMO和SMO2的纯化步骤省去,仅需用GC-MS分别监测至SM,SMO和SMO2反应完毕即可。优化后的合成路线减少了纯化步骤带来的产物损失,有效提升了合成效率。制备的DVS纯度>97%,总产率>80%,完全可以满足后续实验要求。
根据DVS自身的化学性质,DVS也可划归为双功能烷基化试剂,能与带有孤对电子的活性分子如GSH、半胱氨酸和氨基酸等发生亲电加成反应,加上DVS的水溶性较好(溶解度>100 g·L-1),因此DVS在水体系中,对上述活性分子的损伤效应可能会更加明显。本实验结果表明,SM与GSH在37℃下孵育30 min后,约有50%的SM与GSH反应生成SM-GSH单加合物,1 h后反应完成。相比于SM,DVS与GSH混合后,即使在冰浴条件下,数十分钟后DVS就基本可与GSH反应完全,主要生成单加合物DVS-GSH,伴随有少量GSH-DVS-GSH双加合物的生成。由此说明,在水体系中,DVS确实比SM对GSH的反应性更强。为获得满意产率的DVS-GSH单加合物,整个反应始终在冰浴下进行,反应20 min后即进行制备液相分离纯化,有效避免了交联和双取代加合物的生成。
为实现生物样品中GSH-DVS-DNA加合物的检测,建立相应定性检测方法,首先需制备出DVSGSH与嘌呤加合物的参考品。如直接以嘌呤为原料,由于其加合位点较多,在制备过程中易形成多种副产物,导致产率较低且后续分离很困难。而腺苷和鸟苷由于N9位的活性位点被糖基占据,一方面减少了可加合的位点,另一方面其空间位阻也可有效减少副反应的发生,且在加合反应后可用合适浓度的酸溶液脱去糖基即可方便获得所需的目标加合物。因此,实验中分别选用腺苷和鸟苷作为原料与DVS-GSH在室温下反应用以制备嘌呤加合物。
众所周知,DNA分子是以4种脱氧核苷酸为单位以链间、链内氢键的方式连接而成的长链。理论上,DNA链上任意亲核基团都能与亲电化合物形成DNA加合物。但DNA加合物的形成受多种因素的影响,包括特定的电化学、立体化学和碱基序列特异性等。目前,DNA加合物研究最多的为DNA链上的碱基A(腺嘌呤)与G(鸟嘌呤)的加合物[17-18]。因此,为评价DVS-GSH是否具有DNA损伤效应,实验中重点考察了DVS-GSH直接与鲑鱼精双链DNA室温下孵育数小时后的加合物种类。液质分析结果表明,DVS-GSH可与DNA形成GSH-DVSAde和GSH-DVS-Gua 2种加合物,且与腺嘌呤的加合物含量高于鸟嘌呤加合物。形成的加合物丰度存在差异的原因可能是由于DNA的立体选择性,DNA链上碱基对A-T与G-C形成特定的双螺旋结构,腺嘌呤的N3位电负性较大,空间位阻较小,成为活性物质DVS-GSH最主要的攻击位点。但实验中未检测到胞嘧啶和胸腺嘧啶加合物,这与胞嘧啶和胸腺嘧啶质谱响应较差或不易与DVS-GSH发生加合反应有关。
基于上述体外实验结果初步表明,SM体内重要氧化代谢产物的二相代谢产物DVS-GSH有DNA损伤效应,且DVS-GSH更易与DNA链上的腺嘌呤形成加合物。
[1]Qi M,Xu B,Wu J,Zhang Y,Zong C,Chen J,et al. Simultaneous determination of sulfur mustard and related oxidation products by isotope-dilution LC-MS/ MS method coupled with a chemical conversion[J].J Chromatogr B Analyt Technol Biomed Life Sci,2016,1028:42-50.
[2]Stahmann MA,Golumbic C,Stein WH,Fruton JS. Chemical reactions of mustard gas and related compounds.1Ⅶ.The chemistry of bis(β-chloro⁃ethyl)-sulfone,divinylsulfone and divinylsulfoxide[J].J Org Chem,1946,11(11):719-735.
[3]Tilley RI,Leslie DR.ChemInform abstract:rates of reaction of the sulfoxides and sulfones of sulfur mus⁃tard and 2-chloroethyl ethyl sulfide with hydroxide ion in water[J].Aust J Chem,1995,48(10):1781-1786.
[4]Lutolf MP, Lauer-Fields JL, Schmoekel HG,Metters AT,Weber FE,Fields GB,et al.Synthetic matrix metalloproteinase-sensitive hydrogels for the conduction of tissue regeneration:engineering cell-invasion characteristics[J].Proc Natl Acad Sci USA,2003,100(9):5413-5418.
[5]Kinsey VE,Grant WM.Action of mustard gas and other poisons on yeast cells.Ⅳ.Study of the effects of divinyl sulfone and their reversal[J].J Cell Physiol,1947,29(2):95-108.
[6]Kinsey VE,Grant WM.Action of mustard gas and other poisons on yeast cells;correlation between the quantity of glutathione bound by mustard and divinyl sulfone and their effect on growth rate[J].J Cell Comp Physiol,1947,29(3):289-299.
[7]Francis GE,Richards DE,Wormall A.The mecha⁃nism of the reaction between di-(2-chloroethyl)sulphone(mustard-gas sulphone)and amino acids[J].Biochem J,1957,66(1):142-144.
[8]Dearfield KL, Harrington-Brock K, Doerr CL,Rabinowitz JR,Moore MM.Genotoxicity in mouse lymphoma cells of chemicals capable of Michael addition[J].Mutagenesis,1991,6(6):519-525.
[9]Yu Y,Chau Y.One-step"click"method for generating vinyl sulfone groups on hydroxyl-containing watersoluble polymers[J].Biomacromolecules,2012,13(3):937-942.
[10]González FS,Mateo FH,Jaramillo FJL,González RS,González DG,Sanfrutos JM.Single-labelling agents based on vinyl sulphone[P].USA.12/920,033.[2009-2-19].
[11]Gonzalez FS,Mateo FH,Jaramillo FJL,González RS,González DG,Sanfrutos JM.Double-labelling agents based on vinyl sulphone[P].USA.12/920,042.[2009-2-19].
[12]Ortega-Muñoz M, Morales-Sanfrutos J,Megia-Fernandez A,Lopez-Jaramillo FJ,Hernandez-Mateo F,Santoyo-Gonzalez F.Vinyl sulfone functional⁃ized silica:a"ready to use"pre-activated material for immobilization of biomolecules[J].J Mater Chem,2010,20(34):7189-7196.
[13]Qi ML.Research on metabolism of sulfur mustard and oxidation productsin vivoandin vitro(芥子气及其砜类毒性代谢产物体内外转化机制研究)[D].Beijing:Academy of Military Medical Sciences(军事医学科学院),2016.
[14]Goud DR,Sharma M,Suryanarayana MVS.A simple and efficient chemical decontamination of sulfur mustard(HD)using 1,8-diazabicyclo[5,4,0]undec-7-ene hydrobromide-perbromide[J].Phosphorus,Sulfur Silicon Relat Elem,2012,187(2):205-212.
[15]Gusarova NK,Voronkov MG,Trofimov BA.Divinyl sulfoxide:synthesis,properties,and applications[J].Sulfur Rep,1989,9(9):95-141.
[16]Black RM,Brewster K,Harrison JM,Stansfield N. Chemistry of 1,1′-thiobis(2-chloroethane)(sulfur mustard).Part I.Some simple derivatives[J].Phosphorus,Sulfur Silicon Relat Elem,1992,71(1-4):31-47.
[17]Fahrer J,Kranaster R,Altmeyer M,Marx A,Bürkle A.Quantitative analysis of the binding affinity of poly(ADP-ribose)to specific binding proteins as a function of chain length[J].Nucleic Acids Res,2007,35(21):e143.
[18]Rosidi B,Wang M,Wu W,Sharma A,Wang H,Iliakis G.Histone H1 functions as a stimulatory factor in backup pathways of NHEJ[J].Nucleic Acids Res,2008,36(5):1610-1623.
Preparation of divinylsulfone-glutathione adducts and their reactive activities with DNA in vitro
LYU Shan-shan,XU Bin,GAO Zhong-cai,ZHAO Yu-mei,ZHANG Ya-jiao,XU Hua,WU Jian-feng,XIE Jian-wei
(State Key Laboratory of Toxicology and Medical Countermeasures,Laboratory of Toxicant Analysis, Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing 100850,China)
OBJECTIVETo prepare the glutathione adducts of divinylsulfone(DVS),which is an important oxidative metabolism product of SMin vivo,and to investigate their reactive capability with DNAin vitro.METHODSThe mustard sulfoxide(SMO)and mustard sulfone(SMO2)were prepared by oxidation reaction using HNO3and KMnO4as oxidants,respectively.Then,DVS was prepared through dechlorination reaction using CaCO3under alkaline conditions.Furthermore,the DVS-GSH adduct and DVS-GSH-purine adducts were prepared and identified using ultra-performance liquid chromatographymass spectrometry(UPLC-MS/MS)and nuclear magnetic resonance(NMR).Finally,the adduct reac⁃tion process of DVS with GSH was monitored using UPLC-MS/MS.RESULTSThe DVS-GSH and GSH-DVS-purine adducts were obtained through preparative HPLC and characterized using NMR and high-resolution MS.In aqueous solution,the reactive activity of DVS with GSH was significantly higher than that of SM,and the DVS-GSH adduct had high or reactive activity,which could produce a series of adducts with adenine and guanine in DNA,and the abundance of the adenine adducts was higher than that of the guanine.CONCLUSIONDVS-GSH adducts still have high reactive activity with DNA, and more attention should be paid to its potential damage to DNA.
divinylsulfone;glutathione adduct;DNA adduct
WU Jian-feng,Tel:(010)66930621,E-mail:ammswjf@163.com;XIE Jian-wei,Tel:(010) 68225893,E-mail:xiejwbmi@163.com
R917
:A
:1000-3002-(2017)05-0422-07
10.3867/j.issn.1000-3002.2017.05.007
2017-03-17 接受日期:2017-05-10)
(本文编辑:贺云霞)
吕姗姗,硕士研究生,主要从事毒物分析研究。
吴剑峰,E-mail:ammswjf@163.com,Tel:(010)66930621;谢剑炜,E-mail:xiejwbmi@163.com,Tel:(010)68225893
