黄芪预处理对大鼠肠系膜缺血再灌注损伤后细胞凋亡的影响及其机制研究
2017-06-05李晓东
李晓东
(冀中能源峰峰集团有限公司总医院,河北 邯郸 056200)
黄芪预处理对大鼠肠系膜缺血再灌注损伤后细胞凋亡的影响及其机制研究
李晓东
(冀中能源峰峰集团有限公司总医院,河北 邯郸 056200)
目的:研究黄芪预处理对大鼠肠系膜缺血再灌注损伤后细胞凋亡的影响,并探讨其可能的作用机制。方法:选取120只实验用大鼠随机分假手术组、模型组、银杏叶提取物(3.15 mg/kg)预处理组与黄芪(5、10和20 g/kg)预处理组;术前7天开始腹腔注射给药(1次/d),假手术组和模型组给予等体积生理盐水。采用剥离并夹闭肠系膜上动脉45min的方法建立大鼠肠系膜缺血再灌注损伤模型;再灌注2 h后,测定肠组织含水量,TUNEL法观察肠系膜细胞凋亡状况并计算凋亡指数(Apoptosis Index,AI);RT-PCR法测定肠组织中AKT mRNA、Bcl-2 mRNA、Bax mRNA表达;测定肠组织中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性与丙二醛(MDA)含量,Western blot法测定肠组织中NF-κB蛋白表达并进行半定量分析。结果:与模型组比较,黄芪(10、20 g/kg)预处理组大鼠肠组织含水量显著降低;黄芪预处理组大鼠肠细胞凋亡状况较模型组均明显改善,其中10、20 g/kg预处理组AI显著降低;黄芪(10、20 g/kg)预处理组大鼠肠组织中Bcl-2 mRNA表达显著升高而Bax mRNA显著降低、Bcl-2/Bax比值显著升高,SOD和CAT活性显著升高、MDA含量显著降低,NF-κB蛋白表达显著上调;黄芪(20 g/kg)预处理组AKT mRNA表达显著升高;上述差异均具有统计学意义(P<0.05,P<0.01)。结论:黄芪预处理可能通过调节凋亡相关基因(AKT、Bcl-2、Bax)和蛋白(NF-κB)表达而对肠系膜缺血再灌注损伤后细胞凋亡具有一定的抑制作用。
黄芪预处理;肠系膜缺血再灌注;凋亡;机制
肠系膜缺血再灌注损伤是肠道手术中常见的并发症之一,是严重创伤、休克、心肺功能不全等救治过程中共有的病理过程。肠系膜缺血再灌注损伤病理机制非常复杂,病理机制尚不明确。近年来,褚薇薇等[1]与王鹏等[2]研究发现,肠系膜细胞凋亡是肠系膜缺血再灌注损伤的重要病理机制,也是新型药物研发的切入点之一。黄芪为豆科植物蒙古黄芪或膜荚黄芪的根,始载于《神农本草经》,具有补气固表、利尿托毒,排脓、敛疮生肌之功效,为常用中药之一。现代药理学研究发现,黄芪对大鼠脑缺血再灌注后神经细胞凋亡和心肌缺血再灌注后心肌细胞凋亡均具有抑制作用[3-7],但仍未见报道黄芪是否对肠系膜缺血再灌注后细胞凋亡具有影响。本实验采用黄芪预处理7天后,采用剥离并夹闭肠系膜上动脉45 min的方法建立大鼠肠系膜缺血再灌注损伤模型,探讨黄芪预处理对肠系膜缺血再灌注大鼠细胞凋亡的影响及其机制。
1 材料与方法
1.1 试验药物与试剂
黄芪注射液(成都地奥九泓制药厂,20 g∶10 ml,批号20141209);银杏叶提取物(神威药业集团有限公司,17.5 g∶5 ml,批号140725); 末端标记法(TUNEL)试剂盒(北京博奥森生物工程有限公司);超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和丙二醛(MDA)试剂盒(南京建成生物工程研究所);RNA提取液TRIzol试剂盒(北京TransGen公司);AKT、Bcl-2、Bax、β-actin的上下游引物(上海博亚生物公司);NF-κB单抗(碧云天公司)。
1.2 动物
实验用Wistar大鼠(SPF级,8周龄,雄性,体质量180~220 g)购自河北省实验动物中心,许可证号:SCXK(冀)2013-1-003,动物批次号:201503021。
1.3 分组与模型制备
将实验用Wistar大鼠按随机数字表法随机分为6组:假手术组、模型组、银杏叶提取物(3.15 mg/kg)预处理组和黄芪(5、10和20 g/kg)预处理组;各预处理组于术前7天开始腹腔注射给药,每天1次,其中假手术组和模型组分别给予等体积的生理盐水。模型的制备[8]:术前12 h禁食,麻醉后仰位固定,开腹并游离大鼠肠系膜上动脉、夹闭45 min后恢复血流灌注,建立大鼠肠系膜缺血再灌注模型。
1.4 肠组织含水量的测定
再灌注2 h后,实施麻醉、开腹取回盲部10 cm以上的相同部位4 cm的肠管,秤量为湿重;于107℃烘烤72 h后称量为干重。
肠组织含水量计算公式:
含水量(%)= [(湿重-干重)/ 湿重]×100%
1.5 细胞凋亡状况的观察及AI的测定
参照1.4方法取各组大鼠肠管,依次经4%多聚甲醛溶液固定、石蜡包埋、切片、脱蜡水化处理后,遵照末端标记法(TUNEL)试剂盒说明步骤进行操作,通过光学显微镜观察各组大鼠肠系膜细胞凋亡状况。计算AI:计数每张染色切片中总细胞数和阳性细胞数。
AI值计算公式:
AI(%)=(阳性细胞数/总细胞数)×100%
1.6 肠组织中凋亡相关基因表达的分析
通过基因文库查询并设计AKT、Bcl-2、Bax、β-actin基因上下游引物;参照1.5方法取各组大鼠肠管,用生理盐水冲洗干净后研磨匀浆,加入适量TRIzol试剂提取总RNA,测定总RNA浓度,反转录为cDNA后进行PCR反应,扩增完毕后取PCR产物于琼脂糖凝胶电泳,最后通过凝胶成像仪观察并照相;以β-actin为内参,半定量分析AKT mRNA、Bcl-2 mRNA、Bax mRNA表达并计算Bcl-2/Bax表达比值。
1.7 肠组织中抗氧化酶活性及MDA含量的测定
参照1.4方法取肠管组织,用0.9%生理盐水制备1%肠组织匀浆液,3 500 rpm离心10 min后取上清液,按照各试剂盒说明书通过紫外-可见分光光度计测定抗氧化酶(SOD、CAT)活性和MDA含量。
1.8 肠组织中NF-kB蛋白表达的检测
取肠组织匀浆液,低温离心(4℃,12 000 rpm,20 min)后取上清液,采用BCA法测定蛋白浓度,进行蛋白变性(沸水浴加热5 min)、上样(每孔上样30 μg),经SDS-PAGE凝胶电泳后转PVDF膜、室温下5%脱脂奶粉封闭2 h,一抗(NF-κB,β-actin)4℃过夜,洗膜、二抗(1∶100)室温孵育1 h后经ECL系统显影;以β-actin为内参,以条带灰度值测定NF-κB表达相对量。
1.9 统计学处理
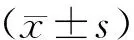
2 结果
2.1 黄芪预处理对肠系膜缺血再灌注损伤大鼠肠组织含水量的影响
模型组大鼠肠组织含水量较假手术组显著升高(P<0.01);与模型组比较,黄芪(10、20 g/kg)预处理组大鼠肠组织含水量显著降低(P<0.05,P<0.01),结果见表1。
2.2 黄芪预处理对肠系膜缺血再灌注损伤大鼠肠系膜细胞凋亡及AI的影响
经TUNEL染色后通过显微镜观察,结果如图1所示:模型组肠系膜缺血再灌注损伤大鼠肠系膜凋亡细胞数量较假手术组明显增多;而经黄芪预处理7天能够显著抑制肠系膜缺血再灌注损伤大鼠肠系膜细胞凋亡数量。计算AI结果如表1所示,发现模型组大鼠肠系膜细胞AI较假手术组显著升高(P<0.01);而与模型组比较,黄芪(10、20 g/kg)预处理组大鼠AI显著降低(P<0.05,P<0.01)。
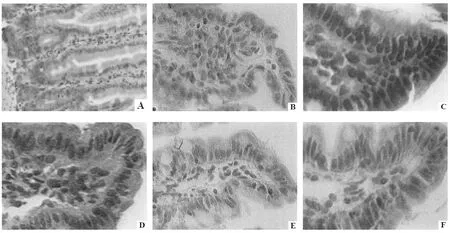
图1 各组大鼠肠系膜细胞凋亡状况(TUNEL×400)注:A:假手术组;B:模型组;C:黄芪5 g/kg预处理组;D:黄芪10 g/kg预处理组;E:黄芪20 g/kg预处理组;F:银杏叶提取物3.15 mg/kg预处理组。

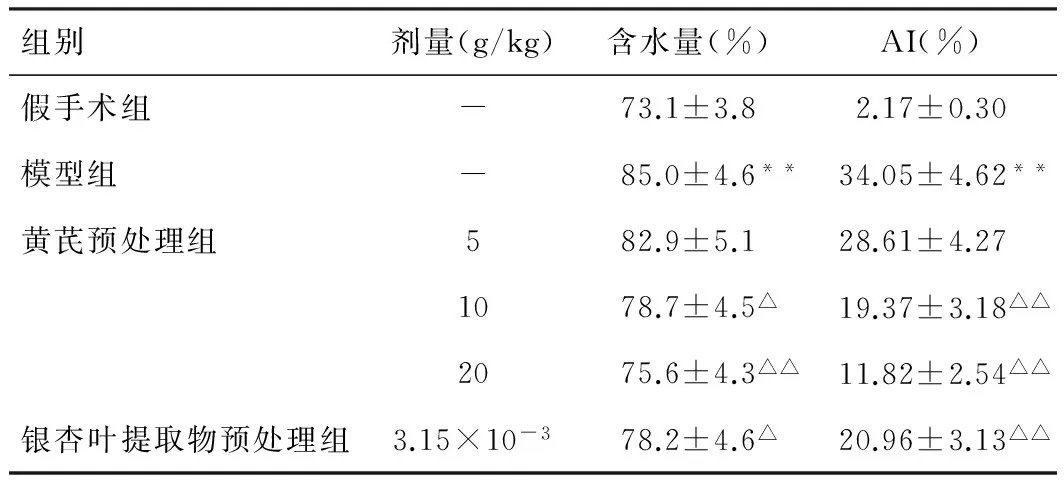
组别剂量(g/kg)含水量(%)AI(%)假手术组-73.1±3.82.17±0.30模型组-85.0±4.6**34.05±4.62**黄芪预处理组582.9±5.128.61±4.271078.7±4.5△19.37±3.18△△2075.6±4.3△△11.82±2.54△△银杏叶提取物预处理组3.15×10-378.2±4.6△20.96±3.13△△
注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较:△P<0.05,△△P<0.01。
2.3 黄芪预处理对肠系膜缺血再灌注大鼠肠组织中凋亡相关基因的影响
结果如表2所示:模型组大鼠肠组织中凋亡相关基因(AKT mRNA、Bcl-2 mRNA、Bax mRNA)表达较假手术组显著升高,Bcl-2/Bax比值显著降低,差异均具有统计学意义(P<0.05,P<0.01);与模型组比较,黄芪(10、20 g/kg)预处理组Bcl-2 mRNA显著升高而Bax mRNA显著降低、Bcl-2/Bax比值显著升高(P<0.05,P<0.01);20 g/kg组AKT mRNA表达显著升高(P<0.05)。
表2 各组大鼠肠组织中凋亡相关基因表达
注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。
2.4 黄芪预处理对肠系膜缺血再灌注损伤大鼠肠组织中抗氧化酶活性和MDA含量的影响
结果如表3所示,模型组大鼠肠组织中抗氧化酶(SOD、CAT)活性较假手术组显著降低而MDA含量较假手术组显著升高(P<0.01);而黄芪(10、20 g/kg)预处理组SOD、CAT活性较模型组显著升高且MDA含量较模型组显著降低(P<0.05,P<0.01)。

表3 各组大鼠肠组织中SOD、CAT活性和MDA含量
注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。
2.5 黄芪预处理对肠系膜缺血再灌注损伤大鼠肠组织NF-κB蛋白表达的影响
与假手术组比较,模型组大鼠肠组织NF-κB蛋白表达显著升高(P<0.01);与模型组比较,黄芪(10、20 g/kg)预处理组大鼠NF-κB蛋白表达显著降低,差异具有统计学意义(P<0.05,P<0.01),结果见图2和表4。
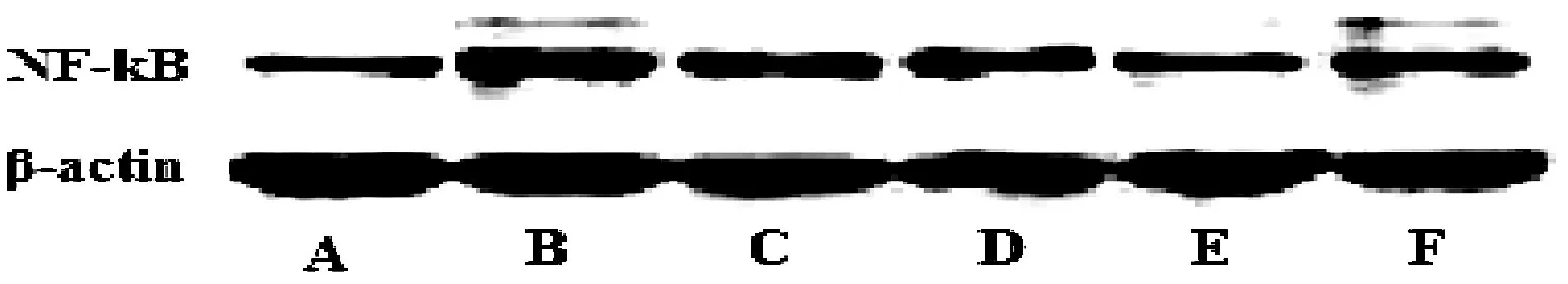
图2 各组大鼠肠组织NF-κB蛋白表达注:A:假手术组;B:模型组;C:黄芪5 g/kg预处理组;D:黄芪10 g/kg预处理组;E:黄芪20 g/kg预处理组;F:银杏叶提取物3.15 mg/kg预处理组
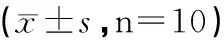

组别剂量(g/kg)NF-κB/β-actin假手术组-0.17±0.04模型组-0.53±0.12**黄芪预处理组50.44±0.10100.38±0.09△200.25±0.07△△银杏叶提取物预处理组3.15×10-30.36±0.09△
注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。
3 讨论
近年来,随着病理生理学研究的深入,发现继发性细胞凋亡是肠系膜缺血再灌注损伤的重要病理机制[1-2]。细胞凋亡是一种程序化死亡过程,其中Bcl-2家族基因在细胞凋亡过程中发挥着非常重要的调控作用,其中Bcl-2能够抑制线粒体破裂,可直接与Apaf-1结合而抑制Caspase-3激活,抑制促凋亡蛋白Bax细胞毒性作用,调节细胞内钙浓度,从而起到抑制细胞凋亡的作用[9];Bax属于Bcl-2基因家族成员,具有诱导线粒体渗透性改变而释放细胞色素C、激活促凋亡蛋白Caspase-9,而表现出促细胞凋亡作用[10]。此外,Bax能够与Bcl-2聚合成二聚体,从而抑制Bcl-2活性而促进细胞凋亡,所以Bax/Bcl-2比值更加能够体现Bcl-2基因家族对细胞凋亡的调控作用[11]。此外,Kim JY等研究发现AKT基因参与细胞凋亡的启动及整个调控过程[12]。
细胞凋亡具有多种诱发因素,氧化应激损伤便为其中非常重要的因素之一[13]。体内活性氧自由基代谢(ROS)紊乱是导致机体氧化应激损伤的病理基础。抗氧化酶(SOD、CAT)在维持体内ROS动态平衡方面发挥着非常重要的作用[14];而再灌注后ROS大量生成和过剩而攻击细胞膜造成脏器的脂质过氧化损伤,因此,脂质过氧化终产物MDA的含量也能够间接反映氧化应激损伤程度[15]。氧化应激损伤是细胞凋亡最重要的诱发因素之一,NF-κB被称为连接氧化应激损伤和细胞凋亡的“桥梁”[16-19],常态下NF-κB以无活性状态存在,当细胞受到ROS攻击时NF-κB将被活化而促进巨噬细胞活化和浸润,诱导促凋亡信号释放而导致细胞凋亡。
本研究发现,黄芪预处理能够有效降低肠组织含水量,改善肠系膜组织形态和肠系膜细胞结构病变、抑制细胞凋亡;进一步研究发现,黄芪预处理能够上调抑凋亡基因(AKT、Bcl-2)表达、下调促凋亡基因(Bax)、提高Bcl-2/Bax比值,改善抗氧化酶(SOD、CAT)活性、降低氧化应激损伤并下调NF-kB蛋白表达。结果提示黄芪预处理具有改善肠系膜缺血再灌注损伤大鼠组织病变、抑制肠系膜细胞凋亡的作用,作用机制可能与黄芪预处理调节凋亡相关基因表达和凋亡信号通路有关。
[1] 褚薇薇,聂蕾,和新盈,等.细胞色素c在后处理抗大鼠肠缺血-再灌注损伤细胞凋亡中的变化[J].生理学报,2010,62(2):143-148.
[2] 王鹏,陈嘉勇,袁勇.肠缺血再灌注损伤与肠粘膜细胞凋亡的关系[J].昆明医学院学报,2009,30(3B):285-289.
[3] 阮长武,张代富,汪姗姗,等.黄芪对缺血再灌注心肌细胞凋亡的影响[J].同济大学学报(医学版),2003,24(3):182-184.
[4] 冯津萍,卢奕,赵炳让,等.黄芪抑制家兔心肌缺血再灌注时细胞凋亡的实验研究[J].中国中西医结合急救杂志,2001,8(1):13-15.
[5] 裴志萍,牛文革,柴静波,等.黄芪预处理对大鼠肠系膜缺血再灌注损伤保护作用的研究[J].中医药信息,2016,33(3):20-25.
[6] 曹明明,高彦宇,马育轩,等.黄芪化学成分及对心肌缺血再灌注损伤保护作用的研究进展[J].中医药信息,2015,32(3):120-123.
[7] 李冀,王秀珍,李在斯,等.中药治疗心肌缺血再灌注损伤的研究进展[J].中医药学报,2015,43(2):107-109.
[8] 陈良金,石孟琼,贺海波,等.珠子参总皂苷对H2O2诱导新生大鼠心肌细胞凋亡的抑制作用[J].中国临床药理学与治疗学,2012,17(8):860-867.
[9] Ogura T,Tanaka Y,Tamaki H,et al.Docetaxel induces Bcl-2-and pro-apoptosis caspase-independent death of human prostate cancer DU145 cells[J].Int J Oncol, 2016, 48(6):2330-2338.
[10] Farhadi F,Jahanpour S,Hazem K,et al.Garlic (Allium sativum) fresh juice induces apoptosis in human oral squamous cell carcinoma: the involvement of caspase-3,Bax and Bcl-2[J].J Dent Res Dent Clin Dent Prospects,2015,9(4):267-273.
[11] Saeedi Borujeni MJ,Hami J,Haghir H,et al.Evaluation of Bax and Bcl-2 Proteins Expression in the Rat Hippocampus due to Childhood Febrile Seizure[J].Iran J Child Neurol,2016,10(1):53-60.
[12] Kim JY,Lee JS,Han YS,et al.Pretreatment with Lycopene Attenuates Oxidative Stress-Induced Apoptosis in Human Mesenchymal Stem Cells[J].Biomol Ther,2015,23(6):517-524.
[13] 陈良金,石孟琼,贺海波,等.珠子参总皂苷对H2O2诱导新生大鼠心肌细胞凋亡的抑制作用[J].中国临床药理学与治疗学,2012,17(8):860-867.
[14] Lartigue A,Burlat B,Coutard B,et al.The megavirus chilensis Cu,Zn-superoxide dismutase: the first viral structure of a typical cellular copper chaperone- independent hyperstable dimeric enzyme[J].J Virol,2015,89(1):824-832.
[15] 刘秀芳,李婷婷,蔡光明,等.小叶黑柴胡茎叶总黄酮体外抗氧化活性的研究[J].中南药学,2011,9(3):173-175.
[16] 杨帆,王永青,彭余江,等.NF-κB在颅脑损伤后继发氧化应激及细胞凋亡之间的关系研究[J].浙江创伤外科,2014,19(6):899-904.
[17] 马爱萍,李萍.益气清热解毒方联合蒙脱石散对小儿急性感染性腹泻IL-8、IL-10及NF-κB表达的影响[J].中医药信息,2017,34(1):59-62.
[18] 郭乐,周赛男,蔺晓源,等.补阳还五汤对脑缺血后大鼠NF-κB/p50表达的影响[J].中医药信息,2014,31(4):98-101.
[19] Zhang Q,Huang WD,Lv XY,et al.Ghrelin protects H9c2 cells from hydrogen peroxide-induced apoptosis through NF-κB and mitochondria-mediated signaling[J].Eur J Pharmacol,2011,654(2):142-150.
Effect and Mechanism of Astragalus Pretreatment on Apoptosis in Intestinal Ischemia-reperfusion Rats
LI Xiao-dong
(General Hospital of Fengfeng Group, Handan 056200,China)
Objective:To investigate the effect and mechanism of Astragalus pretreatment on apoptosis in intestinal ischemia-reperfusion rats. Methods:One hundred and twenty experimental rats were randomly devided into six groups: sham operation group, model group, Ginkgo biloba extract(GB, 3.15 mg/kg) pretreatment group and Astragalus(5, 10, 20 g/kg) pretreatment groups. Severn days before surgery, the drugs were given by intraperitoneal injection, once a day. The rat models were made by clipping superior mesenteric artery; two hours later, the water content was detected; the apoptosis of intestinal cells was observed by TUNEL staining and the apoptosis index(AI) was calculated; the expressions of AKT mRNA, Bcl-2 mRNA, Bax mRNA were detected and the ratio of Bcl-2/Bax was calculated; the activity of SOD, CAT and the content of MDA in intestinal tissue were detected; the expression of NF-κB was detected by Western blot and was Semi-quantitatively analyzed. Results:Compared with those in model group, the water contents in Astragalus(10, 20 g/kg)pretreatement groups were significantly decreased; the intestinal cell apoptosis in Astragalus pretreatement groups was significantly improved, and the AI in Astragalus(10, 20g/kg)pretreatement groups was significantly decreased; the expressions of Bcl-2 mRNA were significantly increased and the Bax mRNA was significantly decreased; the ratio of Bcl-2/Bax was significantly increased; the activity of SOD, CAT in intestinal tissue was significantly increased and the content of MDA was significantly decreased; the expressions of AKT mRNA in Astragalus(20g/kg)pretreatement group were significantly decreased; all the above differences were significant(P<0.05,P<0.01). Conclusion:Astragalus pretreatment has inhibitive effects on apoptosis in intestinal ischemia-reperfusion rats, which may be related to its effects of regulating the expression of apoptosis-related genes and proteins.
Astragalus pertreatment; Intestinal ischemia-reperfusion; Apoptosis; Mechanism
李晓东(1973-),男,主管药师,主要研究方向:医院药学和药理学。
2016-06-30
R285.5
A
1002-2406(2017)03-0032-05
修回日期:2016-07-15
