熟地黄多糖对荷瘤小鼠肿瘤组织Cyt-C及Caspase-3基因表达的影响
2017-06-05梁颖李冀郭盛磊李大然徐放蔡文辉
梁颖,李冀,郭盛磊,李大然,徐放,蔡文辉
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
熟地黄多糖对荷瘤小鼠肿瘤组织Cyt-C及Caspase-3基因表达的影响
梁颖,李冀*,郭盛磊,李大然,徐放,蔡文辉
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
目的:探讨熟地黄多糖对荷瘤小鼠肿瘤组织细胞色素C(Cytochrome C,Cyt-C)及天冬氨酸特异性的半胱氨酸蛋白水解酶(cysteinyl aspartate specific proteinases,Caspase-3)基因表达的影响。方法:采用Real-time PCR法检测肿瘤组织中Cyt-C mRNA及Caspase-3 mRNA的表达情况,采用Western blot法检测Cyt-C及Caspase-3蛋白质的表达情况。结果:熟地黄多糖低剂量组、中剂量组、高剂量组、阳性对照组和联合用药组肿瘤组织中Cyt-C和Caspase-3 mRNA的表达量分别是模型对照组的0.46、0.76;4.82、1.26;0.43、0.60;13.91、4.65;20.17、9.23倍。Cyt-C和Caspase-3蛋白质的表达量分别是模型对照组的0.31、0.90;1.82、1.46;0.62、0.87;2.60、1.54;2.80、1.60倍。结论:熟地黄多糖能促进肿瘤组织中Cyt-C和Caspase-3基因的表达。
熟地黄多糖;细胞色素C;天冬氨酸特异性的半胱氨酸蛋白水解酶
扶正固本是中医学治疗肿瘤的治则之一,熟地黄是常用的补益药,具有补血养阴、填精益髓之功效。熟地黄多糖是熟地黄经水提醇沉的提取物,实验研究表明熟地黄多糖具有抑制肿瘤生长[1-4]、抗突变[5]、提高机体免疫力[6]等作用。本研究用不同浓度的熟地黄多糖作用于荷瘤小鼠的肿瘤组织,探讨熟地黄多糖对Cyt-C及Caspase-3表达的影响。
1 实验材料与仪器
S180细胞株(中国医学科学院肿瘤细胞库);熟地黄多糖(陕西慈缘生物技术有限公司);ICR小鼠(黑龙江中医药大学动物中心);TaKaRa PrimeScript®RT reagent KIT(日本TaKaRa公司);Power SYBR®Green Master Mix(Applied Biosystems公司);RNeasy@ Mini Kit(美国QIAGEN公司);Bicinchoninic Acid Kit for Protein Determination(Sigma); Goat anti Mouse IgM (Santa Cruze);The Mid/Low Protein Molecular Weight Markers(14.4kDa~97.4 kDa)(AMRESCO);WesternProTMHorseradish Peroxidase Chromogenic Detection Kit(Genlantis);Hybond蛋白杂交膜Hybond-P(低荧光PVDF膜)(GE Healthcare);Anti-Cytochrome C antibody(abcam);Western and IP cell lysate、PMSF(100 mM)、BCA蛋白质浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒(Beyotime);微量加样器(德国Eppendorf公司);光学发光八连管(美国Axygen公司);Applied Biosystems step one plus定量PCR仪(美国应用生物系统公司);微量掌式离心机(德国SIGMA公司);高速冷冻离心机sigma 3K30(德国SIGMA公司);引物设计软件Perkin Elmer ABI 7700 Sequence Detection System引物合成(中国上海捷瑞生物工程有限公司)。
2 实验方法
2.1 肿瘤模型的制备
无菌条件下抽取腹腔传代7天的小鼠腹水,生理盐水调节浓度为2×107个/ml,每只鼠于右腋下接种0.2 ml,4天后可以触到实体瘤,接瘤率100%。
2.2 实验分组及给药
将60只小鼠,雌雄各半,体质量(20±2)g随机平均分为6组:熟地黄多糖高剂量组、熟地黄多糖中剂量组、熟地黄多糖低剂量组、环磷酰胺阳性对照组、环磷酰胺熟地黄多糖联合用药组、模型组。各组接种24 h后给药,各组连续给药10 d。熟地黄多糖给药组分别按1.0 g/kg、0.5 g/kg、0.25 g/kg剂量灌胃给药;环磷酰胺组按40 mg/kg剂量腹腔注射给药,隔天1次;联合用药组按照熟地黄多糖中剂量组浓度给药,结合环磷酰胺腹腔注射;模型组给予0.2 ml生理盐水。
2.3 检测方法
末次给药24 h后处死小鼠,留取瘤组织。
2.3.1 Real-time PCR法检测Cyt-C和Caspase-3 mRNA的表达
引物序列:β-actin上游引物序列为5′-AAGGCCAACCGTGAAAAGATG-3′,下游引物序列为5′- AATGCCAGTGGTACGACCAGA -3′;Cyt-C上游引物序列为5′- AACTGGCCTCTGACAGGCAAT -3′,下游引物序列为5′- TCAGTGGTGAAAGGCAGCATC -3′;Caspase-3上游引物序列为5′-GAAACTGTACGCGCACAAGCT -3′,下游引物序列为5′-TTGCATGGAAAGTGGCGTC-3′。提取肿瘤组织总RNA,用反转录试剂盒用TaKaRa进行反转录反应,反应条件:42℃30 min,99℃ 5 min,5℃ 5 min,1个循环。SYBR®Green I嵌合荧光法进行PCR反应,反应条件:50℃ 2 min,95℃ 10 min,1个循环,95℃ 15 sec,60℃ 1 min,40个循环。Real-time PCR所有数据均采用2-ΔΔCt法计算[7]。
ΔΔCt=(对照组目的基因平均Ct值-对照组管家基因平均Ct值)-(处理组目的基因平均Ct值-处理组管家基因平均Ct值)
2.3.2 Western blot法检测Cyt-C和Caspase-3蛋白质的表达
将肿瘤组织剪成碎片,充分裂解后离心取上清液,用BCA试剂盒对蛋白质浓度进行测定,SDS-PAGE电泳。电泳后将蛋白质转移到PVDF膜上封闭过夜。一抗孵育、二抗孵育后用DAB试剂盒进行蛋白质显色,显色终止后避光放置20 min,将膜置于扫描仪中扫描,用凝胶图象处理系统分析条带分子量和净光密度值。
3 结果
3.1 Real-time PCR法对Cyt-C和Caspase-3的测定结果
如图1、图3和图5所示,Real-time PCR溶解曲线出现单一峰,扩增良好。图2、图4和图6显示扩增曲线重复性良好。实验各组的CT值对照管家基因β-actin进行均一化处理。经药物干预后中剂量组、阳性对照组和联合用药组的Cyt-C mRNA的表达量分别是模型对照组的4.82、13.91和20.17倍(见表1)。Caspase-3 mRNA的表达量模型组为1,低剂量组是0.76,中剂量组是1.26,高剂量组是0.60,阳性对照组是4.65,联合用药组是9.23(见表1)。即浓度为50 mg/ml的熟地黄多糖、环磷酰胺能提高荷瘤小鼠肿瘤组织中Cyt-C和Caspase-3 mRNA的表达,且二者联合使用表达率更高。
3.2 Western blot法检测Cyt-C和Caspase-3蛋白质的测定结果
利用凝胶图像处理系统对Western blot所得条带进行灰度测定,将待测蛋白条带的灰度值比上相应各组的内参蛋白β-actin的灰度值作为蛋白质的相对表达量,模型对照组的比值设为“1”,计算各组小鼠肿瘤细胞的Cyt-C和Caspase-3蛋白表达量。结果如图7、图8,Cyt-C蛋白熟地黄多糖低剂量组表达量是模型组小鼠的0.31倍,中剂量组是模型组的1.82倍,高剂量组是模型组的0.62倍,阳性对照组是模型组的2.60倍,联合用药组是模型组的2.80倍。Caspase-3蛋白表达量熟地黄多糖低剂量组是模型组的0.90倍,中剂量组是模型组的1.46倍,高剂量组是模型组的0.87倍,阳性对照组是模型组的1.54倍,联合用药组是模型组的1.60倍。

图2 β-actin扩增曲线
图3 Cyt-C溶解曲线

图4 Cyt-C扩增曲线

图5 Caspase-3溶解曲线

图6 Caspase-3扩增曲线
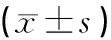
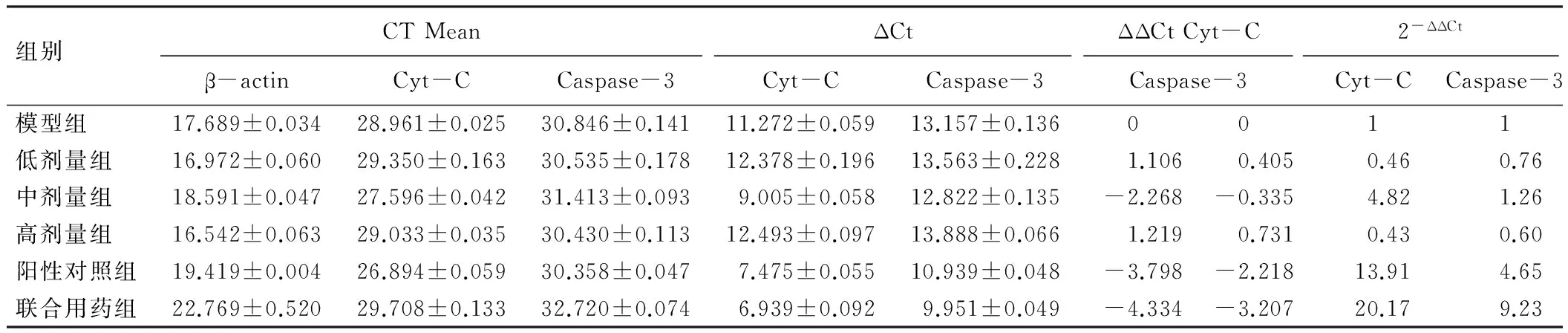
组别CTMeanΔCtΔΔCtCyt-C2-ΔΔCtβ-actinCyt-CCaspase-3Cyt-CCaspase-3Caspase-3Cyt-CCaspase-3模型组17.689±0.03428.961±0.02530.846±0.14111.272±0.05913.157±0.1360011低剂量组16.972±0.06029.350±0.16330.535±0.17812.378±0.19613.563±0.2281.1060.4050.460.76中剂量组18.591±0.04727.596±0.04231.413±0.0939.005±0.05812.822±0.135-2.268-0.3354.821.26高剂量组16.542±0.06329.033±0.03530.430±0.11312.493±0.09713.888±0.0661.2190.7310.430.60阳性对照组19.419±0.00426.894±0.05930.358±0.0477.475±0.05510.939±0.048-3.798-2.21813.914.65联合用药组22.769±0.52029.708±0.13332.720±0.0746.939±0.0929.951±0.049-4.334-3.20720.179.23

图7 Cyt-C蛋白的表达情况
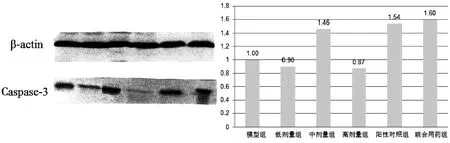
图8 Caspase-3蛋白的表达情况
4 讨论
细胞凋亡也称为细胞程序性死亡,是由基因决定的细胞主动结束生命的过程。细胞凋亡是一种生理性保护机制,能够清除体内多余、受损或危险的细胞而不对周围的细胞或组织产生损害。细胞凋亡主要有三个途径:死亡受体途径、线粒体途径和内质网途径。
Cyt-C是位于线粒体膜间腔中构成电子传递呼吸链的组成成分之一,负责将电子由复合物Ⅲ传递给复合物Ⅳ。Cyt-C由核基因编码的多肽及线粒体编码的亚铁血红素组成。多种凋亡刺激造成线粒体外膜通透化(mitochondrial outer membrane permeabilization,MOMP),MOMP导致膜间腔中的可溶性蛋白扩散到细胞质中,其中与凋亡关系最密切的是Cyt-C。Cyt-C由线粒体释放到细胞质是线粒体途径诱导细胞凋亡的关键性步骤。在ATP供能的情况下,扩散到细胞质中的Cyt-C与细胞凋亡蛋白酶活化因子-1(apoptotic protease activating factor-1,Apaf-1)结合,并将其活化。Apaf-1空间结构包含与Caspase结合的结构域及与核苷酸结合的结构域。Apaf-1自身与ATP/dATP结合力弱,当Apaf-1与Cyt-C结合成复合物后,该复合物与ATP/dATP结合的能力大大提高。此时结合有ATP/dATP的Apaf-1/Cyt-C复合物暴露出与Caspase-9的结合位点,并与Caspase-9前体结合,形成称为凋亡体的Apaf-1、Cyt-C、Caspase-9复合物。活化的Caspase-9进一步激活下游的Caspase,进而引起细胞凋亡作用[8]。Caspase是细胞凋亡的指挥中枢之一。通过切断细胞与周围的联络、重组细胞骨架、解体核纤层、破坏DNA结构、关闭DNA复制与修复、诱导细胞形成凋亡小体等方式,在细胞凋亡中发挥重要作用。Caspase家族成员分为三类:参与细胞凋亡起始类,如Caspase-9;参与细胞凋亡执行的,如Caspase-3;辅助促炎症反应的,如Caspase-1;Caspase-3在细胞凋亡中发挥关键的作用,Caspase-3的最重要的作用底物是多聚(ADP-核糖)聚合酶(poly(ADP-ribose)polymerase, PARP),PARP与DNA的修复、基因完整性监护有关。当细胞凋亡启动时,Caspase-3将PARP水解成31 kD和85 kD的两个片段,PARP与DNA结合的锌指结构与羧基端的催化区域分离,不能发挥正常功能。进而使受PARP负调控的核酸内切酶活性增高,裂解核小体间的DNA,引起细胞凋亡。
本实验研究以S180肉瘤小鼠为模型,给予熟地黄多糖灌胃给药。结果发现,与模型对照组相比较,浓度为0.5 g/kg的熟地黄多糖能够提高Cyt-C、Caspase-3基因的转录和翻译。其转录水平分别是模型对照组的4.82和1.26倍,蛋白质翻译的量分别是模型对照组的1.82和1.46倍。说明熟地黄多糖的抗肿瘤作用可能是通过促进诱发肿瘤细胞发生线粒体途径的细胞凋亡而实现的。另外,熟地黄多糖与环磷酰胺联合用药组的Cyt-C、Caspase-3的基因表达情况高于环磷酰胺阳性对照组,说明熟地黄多糖与化疗药物环磷酰胺联合使用可以加强肿瘤细胞的凋亡作用。
[1] 吴勃岩,王雪,王君龙,等.熟地黄多糖对H22、S180荷瘤小鼠抑瘤作用及存活时间的影响[J].中医药信息,2012,29(6):19-21.
[2] 吴勃岩,车艳新,孙阳,等.熟地黄多糖对H22荷瘤小鼠细胞色素C和Caspase-3蛋白的影响[J].中医药学报,2015,43(6):34-36.
[3] 王雪.熟地黄多糖对荷瘤小鼠细胞凋亡相关蛋白的实验研究[D].哈尔滨:黑龙江中医药大学,2015.
[4] 董静,吴勃岩,车艳新,等.熟地黄多糖诱导H22荷瘤小鼠细胞凋亡作用的研究[J].中医药信息,2015,32(4):32-34.
[5] 梁颖,徐绍娜.熟地黄多糖对环磷酰胺诱导小鼠的抗突变作用研究[J].中医药信息,2010,27(4):110-112.
[6] 郑小珂,侯委位.熟地黄提取物体外免疫调节作用实验研究[J].中国药学杂志,2012,47(24):1995-1999.
[7] Schmittgen TD,Livak KJ.Analyzing real-time PCR data by the comparative C(T) method[J].Nat Protoc,2008,3(6):1101-1108.
[8] 谢洪婷,沈阳,曾常茜.蛇床子素对海人酸致痫大鼠神经元Caspase-3和Caspase-9蛋白表达的影响[J].中医药信息,2015,32(2):16-18.
Effect of Radix Rehmanniae Polysaccharide on the Expression of Cyt-C, Caspase-3 Genes in Tumor Tissue of Tumor-bearing Mice
LIANG Ying, LI Ji*, GUO Sheng-lei,LI Da-ran,XU Fang,CAI Wen-hui
(Heilongjiang University of Chinese Medicine, Harbin 150040, China)
Objective: To study the effect of radix rehmanniae polysaccharide on the expression of Cytochrome c (Cyt-C) and cysteinyl aspartate specific proteinases (Caspase-3) genes in tumor-bearing mice. Methods: Real Time-PCR was used to analyze the expression of Cyt-C and Caspase-3 mRNA in tumor tissue. Western blot was used to analyze the expression of Cyt-C and Caspase-3 proteins in tumor tissue. Results: The mRNA expression of Cyt-C and Caspase-3 in the mice treated by low-, mid-, high-dose Radix rehmanniae polysaccharide, positive control and drug combination was 0.46, 0.76; 4.82, 1.26; 0.43, 0.60; 13.91, 4.65; 20.17, 9.23 times respectively than that of control mice. The protein expression of Cyt-C and Caspase-3 in these five groups was 0.31, 0.90; 1.82, 1.46; 0.62, 0.87; 2.60, 1.54; 2.80, 1.60 times higher than that of control mice. Conclusion:Radix rehmanniae polysaccharide can promote the expression of Cyt-C and Caspase-3 mRNA and proteins in tumor tissues.
Radix rehmanniae polysaccharide; Cyt-C; Caspase-3
国家重点研发计划子课题(No.2016YFC0500303-10);黑龙江省博士后资助项目(No.LBH-Z12251);黑龙江省中医药科研项目(No.ZHY10-W13))
梁颖(1978-),女,黑龙江中医药大学在站博士后,副教授,主要从事中药抗突变、中药抗肿瘤、免疫调节的研究工作。
李冀*(1960-),男,教授,博士研究生导师,主要从事中医方剂学研究工作。
2016-11-20
R285.5
A
1002-2406(2017)03-0024-04
修回日期:2016-11-30
