炮制前后淫羊藿对实验动物基础和能量代谢的影响
2017-06-05杨晓旭韩贞爱王宇董婉茹刘树民
杨晓旭,韩贞爱,王宇,董婉茹,刘树民
(黑龙江中医药大学药物安全性评价中心,黑龙江 哈尔滨 150040)
中 药 研 究
炮制前后淫羊藿对实验动物基础和能量代谢的影响
杨晓旭,韩贞爱,王宇,董婉茹,刘树民*
(黑龙江中医药大学药物安全性评价中心,黑龙江 哈尔滨 150040)
目的:通过研究淫羊藿炮制前后对实验动物基础和能量代谢影响,探求炮制作用对淫羊藿药性的影响。方法:KM小鼠30只随机分成空白组、生品组和炮制组,生品组和炮制组分别给予相应药物灌胃(175.5 mg/kg),空白组用等体积蒸馏水代替,连续7天后,通过实验动物监测系统对给药前后动物产热量(HEAT)、能量转化率(RER)、O2吸入量和CO2呼出量、自主活动次数进行检测。SD大鼠30只随机分为空白组、生品组和炮制组,分别给予相应药物灌胃(175.5 mg/kg),连续7天后测定血清中与物质能量代谢相关指标TT3、TT4、TSH、TAOC、SDH、ATPase的含量,从而探讨炮制前后淫羊藿水煎液对实验动物基础代谢和能量代谢的影响来进行药性研究。结果:从小鼠基础代谢实验结果得到,与空白组比较,炮制组的体质量和耳温均有所升高,生品组的自主活动系数明显下降(P<0.05),炮制组小鼠产热量显著升高(P<0.05),生品组小鼠氧气吸入量与二氧化碳呼出量均显著降低(P<0.01);大鼠能量代谢实验结果得到,生品组可显著降低TT4与TSH的水平(P<0.01),对TT3含量无影响,炮制组对TT3、TT4、TSH含量均有显著性升高(P<0.01)。此外,生品组和炮制组对TAOC、SDH、ATPase含量均有显著性差异(P<0.01)。结论:淫羊藿炮制后对实验动物的基础代谢与能量代谢均有促进作用,且炮制淫羊藿的药性由寒性转为温性可能是由于炮制所致。
淫羊藿;炮制;基础代谢;能量代谢
淫羊藿(EpimediumbrevicornuMaxim)是临床上常用的一味补肝肾、强筋骨的中药,其来源于小檗科植物淫羊藿(EpimediumbrevicornuMaxim)、箭叶淫羊藿(Epimediumsagittatum(Sieb.et Zucc.)Maxim.)或朝鲜淫羊藿(EpimediumkoreanumNakai)等品种的干燥叶[1]。除此之外,各地民间还有用淫羊藿属的其他品种作为常用的药材使用。本实验以此为研究对象,开展淫羊藿炮制前后对实验动物基础和能量代谢的研究,初步探讨炮制前后淫羊藿的药性改变。
1 材料与方法
1.1 仪器
AL204电子天平(梅特勒-托利多仪器有限公司(上海));NC9800红外线电子体温计(耳温式,深圳市贝利斯科技发展有限公司);Z2-6小鼠自主活动测试仪(成都泰盟科技有限公司);实验动物监测系统(CLAMS Columbus Instruments);AL204电子天平(梅特勒-托利多仪器有限公司(上海));Anthos2010酶标仪(奥地利安图斯公司);Eppendorff移液器(Eppendorff 公司);KDC-160HR台式高速冷冻离心机(科大创新股份有限公司中佳分公司);TT3、TT4、TAOC、SDH、ATPase、TSH酶联免疫等六个分析试剂盒(美国AD公司)。
1.2 药品与试剂
根据2015版《中国药典》记载,淫羊藿的临床用药量为6~10 g/d,取用药量的上限10 g为考察对象,淫羊藿生品和羊油拌炒品的出膏率约为21%,换算出淫羊藿生品和羊油拌炒品水煎液冻干粉的成人给药剂量为2.1 g/d。根据人和动物间按体表面积折算的等效剂量比值计算得出,生品组和炮制组小鼠给药剂量每天约为0.26 g/kg,给药体积为0.1 ml/10 g;大鼠给药剂量每天约为0.36 g/kg,给药体积为1 ml/100 g,空白组代以等量的生理盐水。
1.3 实验动物
昆明种小鼠(基础代谢实验使用),雄性,体质量18~22 g;清洁级SD大白鼠(能量代谢实验使用),雄性,体质量(200±20)g,均由黑龙江中医药大学动物实验中心提供,许可证编号:SCXK(黑)2013-004。实验小鼠放入笼中,铺有垫料,温度18~22℃,相对湿度为40%~50%,严格12 h交替光照,给予充足的水源和饲料,置于屏障环境动物室内标准条件下,所有实验动物在环境下适应1周后进行实验。实验动物监测系统环境为通风,避光,隔音,屏蔽系统,采用自动定时光控系统对实验动物的生活环境实行L/D:12 h/12 h的明暗(即7:00-19:00光照,19:00-次日7:00黑暗)的明暗光照周期处理;室温(24±3)℃,湿度:40%~70%,噪声≤40 dB,光照强度:300 lnx。
2 方法与结果
2.1 炮制前后淫羊藿对小鼠基础代谢影响的研究
2.1.1 基础代谢影响实验分组及观察指标
KM小鼠30只,雄性,随机分为空白组、生品组和炮制组,每组10只,每日上午9时分别给予175.5 mg/kg的淫羊藿生品和淫羊藿炮制品药物各一次,空白组用等体积蒸馏水代替,给药体积均为1ml/100g,连续灌胃7 d,并测量每组小鼠的体质量,耳温,饮水量,饮食量,观察毛皮精神,活动等并记录。于第8天进行小鼠自动活动(站立次数+活动次数)测试,并放入实验动物监测系统中24 h,测各组实验小鼠的CO2呼出量,O2吸入量,产热量,呼吸交换率实验指标。
2.1.2 一般行为学观察检测结果
空白对照组小鼠从实验开始至结束,活动情况、精神状况等均未见异常。与空白对照组比较,生品组小鼠鼠笼内潮湿,排泄物少,毛发没有光泽。炮制组小鼠鼠笼内较干燥,毛发稍有光泽,排泄物多;与生品组比较,给药7天后炮制组的体质量和耳温均有所升高;与空白组比较,生品组对小鼠自主活动系数有显著下降(P<0.05)。结果见表1~表5。
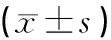
表1 淫羊藿炮制前后对各组小鼠体质量的影响
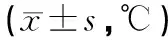
表2 淫羊藿炮制前后对各组小鼠耳温变化的影响
表3 淫羊藿炮制前后对各组小鼠饮水量的影响(±s,ml)
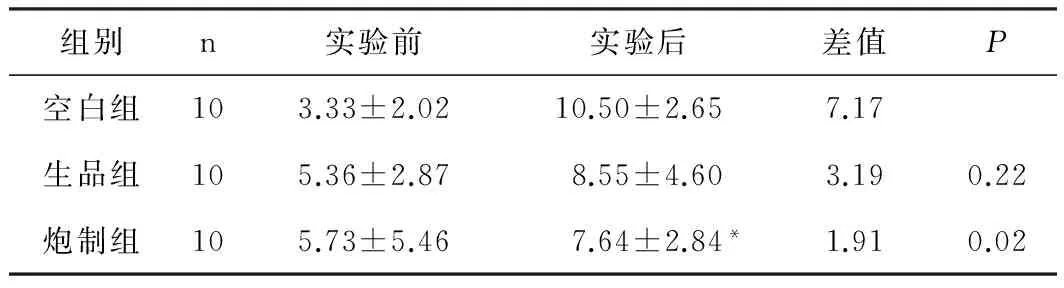
表3 淫羊藿炮制前后对各组小鼠饮水量的影响(±s,ml)
组别n实验前实验后差值P空白组103.33±2.0210.50±2.657.17生品组105.36±2.878.55±4.603.190.22炮制组105.73±5.467.64±2.84*1.910.02
注:与空白组比较,*P<0.05。
表4 淫羊藿炮制前后对各组小鼠摄食量的影响(±s,g)

表4 淫羊藿炮制前后对各组小鼠摄食量的影响(±s,g)
组别n实验前实验后差值P空白组105.64±0.896.28±0.790.64生品组105.36±1.286.92±1.811.560.28炮制组105.35±1.765.06±1.76*-0.290.04
注:与空白组比较,*P<0.05。
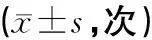
表5 淫羊藿炮制前后对各组小鼠自主活动次数的影响
注:与空白组比较,#P<0.05。
2.1.3 淫羊藿炮制前后对小鼠基础代谢的影响
与空白组相比,给药7天后炮制组小鼠产热量显著升高(P<0.05),生品组小鼠氧气吸入量与二氧化碳呼出量均显著降低(P<0.01)。结果见表6。
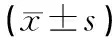
X表6 淫羊藿炮制前后对小鼠O2、CO2、RER、HEAT的影响
注:与空白组比较,*P<0.05,#P<0.01。
2.2 炮制前后淫羊藿对大鼠能量代谢影响的研究
2.2.1 能量代谢影响实验分组及观察指标
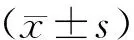
2.2.2 淫羊藿炮制前后对大鼠能量代的影响
由表7可知,与空白对照组相比,生品组可显著降低TT4含量和升高TSH水平(P<0.01),对TT3含量无统计学意义,炮制组对TT3、TT4、TSH均有显著性升高(P<0.01)。由表8可知,生品组和炮制组均可使TAOC、SDH、ATPase水平升高(P<0.01)。
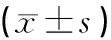
表7 淫羊藿炮制前后对大鼠血清TT3、TT4、TSH含量的影响
注:与空白组比较,##P<0.01。
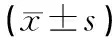
表8 淫羊藿炮制前后对大鼠血清TAOC、SDH、ATPase含量的影响
注:与空白组比较,##P<0.01。
3 讨论
3.1 炮制前后淫羊藿对实验动物基础代谢的研究
在基础代谢中,体温可以作为最基本的指标,也是寒热体征变化最重要的依据。有专家学者指出,药物作用于机体引起的体温变化可以可观性地反映中药性质的强弱[2]。在基础的条件下,动物体内的氧气消耗主要用于两大功能,服务功能和维持功能[3]。代谢率的产生由体内的解偶联反应引起的,依据产热的途径又分为非线粒体产热、ATP周转和质子漏[4]。基础代谢的功能是在基础条件下的动物在没有储存能量,也没有对外作功消耗的氧气全部用来驱动静止细胞内的代谢反应和对细胞内代谢进行调控的过程。在本部分实验研究中,通过测定基础代谢指标,来探讨辅料羊脂油对淫羊藿药性的影响。体温是判断基础代谢的最基本的指标,从实验结果可以看出,通过7天对实验动物进行灌胃,生品组耳温下降,炮制组耳温升高产热量(HEAT)增高,生品组耳温降低产热量(HEAT)降低;饮水量、摄食量和自主活动次数的结果上来看,生品组比炮制组要高,即生理状态下的动物为了维持身体能量,通过摄入多量的水和食物和增加运动次数才能维持体内代谢平衡,从而得到正常代谢。从而间接得到淫羊藿经过辅料羊油拌炒后药性可能发生了由辛寒向辛温的改变,从而具有了温肾壮阳、强壮筋骨的作用。
3.2 炮制前后淫羊藿对实验动物能量代谢的研究
中医的寒热证与机体的能量代谢有着密切的关系。机体的物质代谢必然伴随着能量的变化而导致机体不同的状态,淫羊藿也可能通过影响能量代谢的某些环节实现对其的调节作用。大鼠血清中与能量代谢有关的递质和酶类有TT3、TT4、TSH、SDH、TAOC、ATPase等。甲状腺是人体中最大的分泌腺,功能是合成分泌甲状腺激素,其作用是促进物质与能量代谢[5]。影响能量代谢是甲状腺激素(T3,T4)的主要作用之一,机体中的物质代谢必然伴随着能量的变化而导致机体的状态存在差异。促甲状腺激素(TSH)也是调节甲状腺功能的主要激素,刺激甲状腺细胞分泌T3和T4,而血液中的T3和T4浓度还能通过负反馈作用调节TSH的合成和释放,使得血中的T3、T4含量达到相对稳定[6]。TSH的分泌量与T3、T4的量有关,甲状腺素可以诱导ATP酶生成,促进ATP的氧化分解产生能量,调节着机体内的能量代谢水平。TAOC也可能与中药的寒热温凉药性有着一定的关系。生理状态下反应机体能量生成及利用的平衡关系主要是ATP的生成、利用和产热作用。SDH是线粒体内膜标志性的酶,其活性能够直接影响到线粒体氧化磷酸化的过程。因此,SDH的活性也与实验动物大鼠线粒体呼吸链的恢复功能有着直接的关系。对于探讨淫羊藿炮制前后对实验动物机体的能量代谢有着十分重要的价值。本部分实验研究中,各组TT3含量无显著性差异,TT4、SDH、TSH、TAOC、ATPase均有显著性差异,炮制组的各个成分含量显著高于生品组,即淫羊藿通过羊脂油炮制拌炒后对大鼠血清中各成分均有影响。
3.3 炮制方法对淫羊藿性能的影响
淫羊藿性甘,补肝肾,多用于风寒湿痹[7]。淫羊藿最早记载于《神农本草经》:“主阴痿绝冷、茎中痛,利小便,益气力,强志”,没有任何的原药材处理方法的记载,可见当时多用全草鲜品或生品,淫羊藿炮制记载始于南北朝,最早出现于《雷公炮炙论》:“夹去叶四畔花枝,每一斤用羊脂四两拌炒,待脂尽为度[8]”,概括了淫羊藿的炮制使用方法。先后经历至现代,其炮制方式经过更新发展至今,近有20余种炮制方式[9]。羊脂油拌炒是学者公认的炮制方式,还能提高淫羊藿的药理功效。临床上多作为补药使用,且经常使用炮制药物,生品少用。中药炮制辅料的品质优劣也直接影响着中药饮片的质量,而中药炮制辅料的品质要求必须遵循相关药用标准[10]。羊脂油是常用的液体炮制辅料,具有增强炮制药物疗效的作用,用来增强淫羊藿补肾壮阳的作用。其来源于牛科动物山羊(Capra hircus linnaeus)或绵羊(Ovis aries linnaeus)的脂肪油。其性温味甘,具有补虚、润燥、解毒的功效,主要用于治疗肌肤皲裂、虚劳羸瘦、久痢等症[11]。现代书籍记载“先将羊脂油置锅内,加热熔化,然后倒入淫羊藿丝,用文火炒至微黄色,取出放凉。每100公斤淫羊藿,用羊脂油20公斤。”[12]经过羊脂的拌炒,不但淫羊藿的性发生变化,其作用也随之发生显著的变化,与羊脂油本身性温有着很大的作用。因此,淫羊藿的药性发生变化的原因可能是由于炮制所致,利用羊脂油的本身特性促进有效成分的溶出,提高炮制后淫羊藿的补肾壮阳的作用,从而达到炮制增效的目的。炮制能够提高中药疗效,能够降低或者消除药物的毒副作用,从而改变其性味、功能和临床疗效。中药炮制研究的核心就是探讨中药炮制减毒、增效或者产生新的药效的原理[13-17]。中药炮制的研究近些年来也取得了许多成果,在中药炮制前后药性和归经的变化方面还需要进一步研究探讨,阐明从古至今的炮制方法,探索新的炮制对药性改变的机理。本实验结果为进一步阐明炮制淫羊藿的炮制机理及作为辅料羊脂油的研究提供了初步的实验理论基础,为炮制淫羊藿饮片的临床有效应用提供合理的依据。
[1] 国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2010.
[2] 程彬彬.中药四性广义狭义定性定量分析设想[J].国医论坛,2001,16(2):17-19.
[3] Baldwin RL,Smith NE,Taylor J,et al.Manipulating metabolic parameters to improve growth rate and milk secretion[J].J Anim Sci,1980,51:1416-1428.
[4] 宋志刚,基础代谢产热的分子机制[J].生理科学进展,2001,32(4):356-358.
[5] 黄江荣,李祥华.六味地黄丸对甲状腺功能亢进肾阴虚型小鼠基础代谢的影响[J].中药药理与临床,2011,27(5):1-3.
[6] 徐珊,张凡.黄柏及其酒和盐炙品改善热证大鼠能量代谢及其机制的研究[J].现代药物与临床,2014,12(29):1334-1339.
[7] 陈彦,贾晓斌,丁安伟.淫羊藿炮制机理研究回顾与新思路[J].中华中医药杂志,2010,17(21):224-229.
[8] 雷斅.雷公炮炙论[M].上海:上海中医学院出版社,1986:11.
[9] 姜波,焦方霞.淫羊藿炮制历史沿革[J].实用中医内科杂志,2015,29(4):164-165.
[10] 李寅超,何永侠.比较以不同品质的羊脂油炙淫羊藿的温肾阳作用[J].中国实验方剂学杂志,2013,10(19):197-202.
[11] 国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1998:716.
[12] 徐楚江.中药炮制学(高等医药院校教材)[M].上海:上海科学技术出版社,1985:128.
[13] 夏艺.醋制甘遂降低毒性机制研究[D].武汉:湖北中医药大学,2010.
[14] 李亭亭,徐新房,王子健,等.牵牛子生品、炒品酚酸类成分的HPLC-MS分析[J].中医药学报,2016,44(1):11-14.
[15] 刘江亭,林永强,张学兰,等.白术麸炒前后饮片和水煎液中总糖、多糖含量测定比较[J].中医药学报,2016,44(5):15-17.
[16] 王嘉伦,王培杰,易智威,等.诃子的化学成分、药理作用及炮制配伍应用研究进展[J].中医药信息,2016,33(3):123-126.
[17] 管勇舟,王秋红,严光玉,等.雅连酒炙多糖成分转化及免疫活性比较的研究[J].中医药信息,2016,33(5):12-14.
Comparison of the Crude and Processing Epimedium with the Effect on Basal and Energy Metabolism of Laboratory Animals
YANG Xiao-xu,HAN Zhen-ai,WANG Yu, DONG Wan-ru,LIU Shu-min*
(Drug Safety Evaluation Center, Heilongjiang University of Chinese Medicine, Harbin 150040, China)
Objective: To compare the effect of crude and processing epimedium on basal and energy metabolism and to explore the alteration of medical nature of epimedium during the processing procedure. Method: 30 KM mice were randomly divided into a blank group, a crude group and a processing group. The crude group and the processing group was given 175.5 mg/kg once a day, and the blank group was given the same volume of distilled water instead. After seven days,the heat output(HEAT), energy transformation ratio(RER), the amount of O2inhalation and CO2exhalation were measured by the Comprehensive Laboratory Animal Monitoring System. 30 SD rats were randomly divided into a blank group,a crude group and a processing group, respectively, and were given the distilled water and the corresponding drug 175.5 mg/kg once a day. After seven days, the contents of TT3,TT4,TSH,TAOC,SDH and ATPase in serum were determined to explore the effect of crude and processing epimedium aqueous solution on basal and energy metabolism of laboratory animals,and the medical nature of epimedium was studied.Results: Results of mice basal metabolic test suggested that compared with those in the blank group, the body weight and ear temperature of the processing group were increased, and the coefficiency of autonomic activity in the crude group was significantly decreased (P<0.05), and the calorie production in the processing group was significantly increased (P<0.01), and the amount of O2inhalation and CO2exhalation of crude group was significantly decreased (P<0.01). Results of rat basal metabolic test demonstrated that the level of TT4 and TSH was significantly decreased (P<0.01) and did not have any impact on the level of TT3 in crude group. There was no significant difference in TT3, TT4 and TSH contents in the processing group (P<0.01). In addition, the contents of TAOC, SDH and ATPase were significantly different between the crude group and the processing group (P<0.01).Conclusion: The processing epimedium can promote the basal and energy metabolism of laboratory animals and the processing procedure may alter the medical nature from cold to lukewarm.
Epimedium; Processing; Basal metabolism; Energy metabolism
国家重点基础研究发展计划973计划课题(No.2013CB531804);黑龙江中医药大学科研基金(No.201419)
杨晓旭(1987-),女,博士研究生,主要从事中药药效与性味理论研究工作。
刘树民*(1963-),男,教授,博士研究生导师,主要从事中药性味理论研究、临床中药学研究工作。
2017-01-20
R285.5
A
1002-2406(2017)03-0001-04
修回日期:2017-02-01
