454测序方法对人参种子内生真菌种类的研究
2017-06-05马伟刘振鹏孙丽英张开雪徐姣温东赵锐刘秀波
马伟,刘振鹏,孙丽英,张开雪,徐姣,温东,赵锐,刘秀波
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
454测序方法对人参种子内生真菌种类的研究
马伟,刘振鹏,孙丽英*,张开雪,徐姣,温东,赵锐,刘秀波
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
目的:研究人参内生真菌的生物多样性。方法:采用454测序技术对人参种子内生真菌进行分析。结果:测试的样品中,样品4与其他样品内生真菌区系差异较大,而其他四份样品之间存在的差异较小。子囊菌门真菌在人参种子内生真菌中占有绝对优势,平均百分比为32.7%;针对归类到属而言,共鉴定到属的种类为46个属,其中镰刀菌属序列数所占比列最大,为优势菌属。结论:人参种子中的内生真菌具有多样性,内生菌的分布在种子个体中也存在差异性。
人参种子;454测序技术;宏基因组学;内生菌;生物多样性
人参是名贵中药材[1-2],药食用价值和经济价值并存,人们对于人参上品的追求,自古有之。清代以后,东北地区已成为我国野生人参的主要产地,更有“东北三宝”之称,可见野山参的珍贵性。
内生菌与寄主植物种类有一定的专一性[3-5]。这种专一性可能是因为内生菌在人参的生长发育过程中起到了重要作用[6]。目前研究可以证明植物内生菌可以括加快植物生长、固氮、提高寄生植物抗病、虫害、抗盐、旱等作用[7-13]。
454测序法作为一种高通量的测序方法,近年来已被广泛应用于内生菌测序等微生物研究中。人参作为一种名贵中药材,内生菌能够影响人参的生长发育,454测序技术能够对人参内生菌有更加深入的了解,有利于人参的进一步研究。
1 材料与方法
1.1 植物材料
取样人参种子来自抚松人参种植基地,由黑龙江中医药大学药学院马伟研究员课题组鉴定,保存于-80℃冰箱中待用。
1.2 DNA的提取,PCR和焦磷酸测序
采用天根植物基因组DNA提取试剂盒进行DNA 提取。在紫外分光光度计条件下对DNA进行浓度及纯度检测,然后根据浓度检测结果,在电压120 V,电泳时间约20 min的条件下,采用0.8%琼脂糖凝胶电泳检测DNA样品的完整性。
以DNA为模板,对内生真菌18S V4区进行测序,真菌18S V4区全长rDNA通用引物序列为F:5′-GGCAAGTCTGGTGCCAG-3′;R:5′-ACGGTATCTRATCRTCTTCG-3′,合成融合引物为:F:5′-454adapter-mid-GGCAAGTCTGGTGCCAG-3′;R:5′-454adapter-ACGGTATCTRATCRTCTTCG-3′,引物PAGE纯化。本实验PCR扩增条件:循环数为27cycles,模板为2 μl,退火温度55℃。
使用AMPure Beads或胶回收试剂盒对PCR产物进行纯化,使用PicoGreen dsDNA Assay Kit在酶标仪上对文库进行定量。emPCR扩增,通过乳液滴定或测序滴定确定emPCR扩增中所需的DNA文库的量,使用DNA Capture Beads将DNA文库捕获,乳化,扩增,回收DNA Capture Beads,富集含DNA文库的DNA Capture Beads。Roche 454 GS FLX+测序仪上机测序。本实验的454测序工作由中国上海派森诺生物公司完成。
2 结果与分析
2.1 原始数据的整理、过滤及质量评估
为了保证分析结果的准确性,对有效序列运用Qiime[14](version 1.7.0,http://qiime.org/)进行序列过滤和运用mothur[15](version 1.31.2,http://www.mothur.org/)软件中uchime[16]的方法去除嵌合体序列,得到最终用于后续分析优质序列。
2.2 组装结果
五个样品组装的有效序列共151 694条,其中优质序列占78.37%,共118 879条。五个样品中样品2的有效序列最多为42 263条,样品1的有效秩序列中含有优质序列的比例最高为80.58%。具体数据见表1。组装产生的151 694条序列的长度分布在171~731 bp之间,集中分布的范围在333~704 bp之间,其中含有序列最多的长度是561 bp,此长度含有18 801条有效序列。具体见图1。
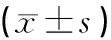
表1 样品序列数统计表
2.3 OTU聚类分析
OUT聚类分析采用Qiime软件平台,在Qiime中调用uclust[17]的方法对优质序列按相似度0.97进行聚类,对每类序列中的最长序列进行OTU的聚类分析;在Qiime中采用blast的方法对五个样品的序列信息进行比对,获得每个OTU分类学信息。

图1 优质序列长度分布图

图2 OTU 代表序列的系统发育树
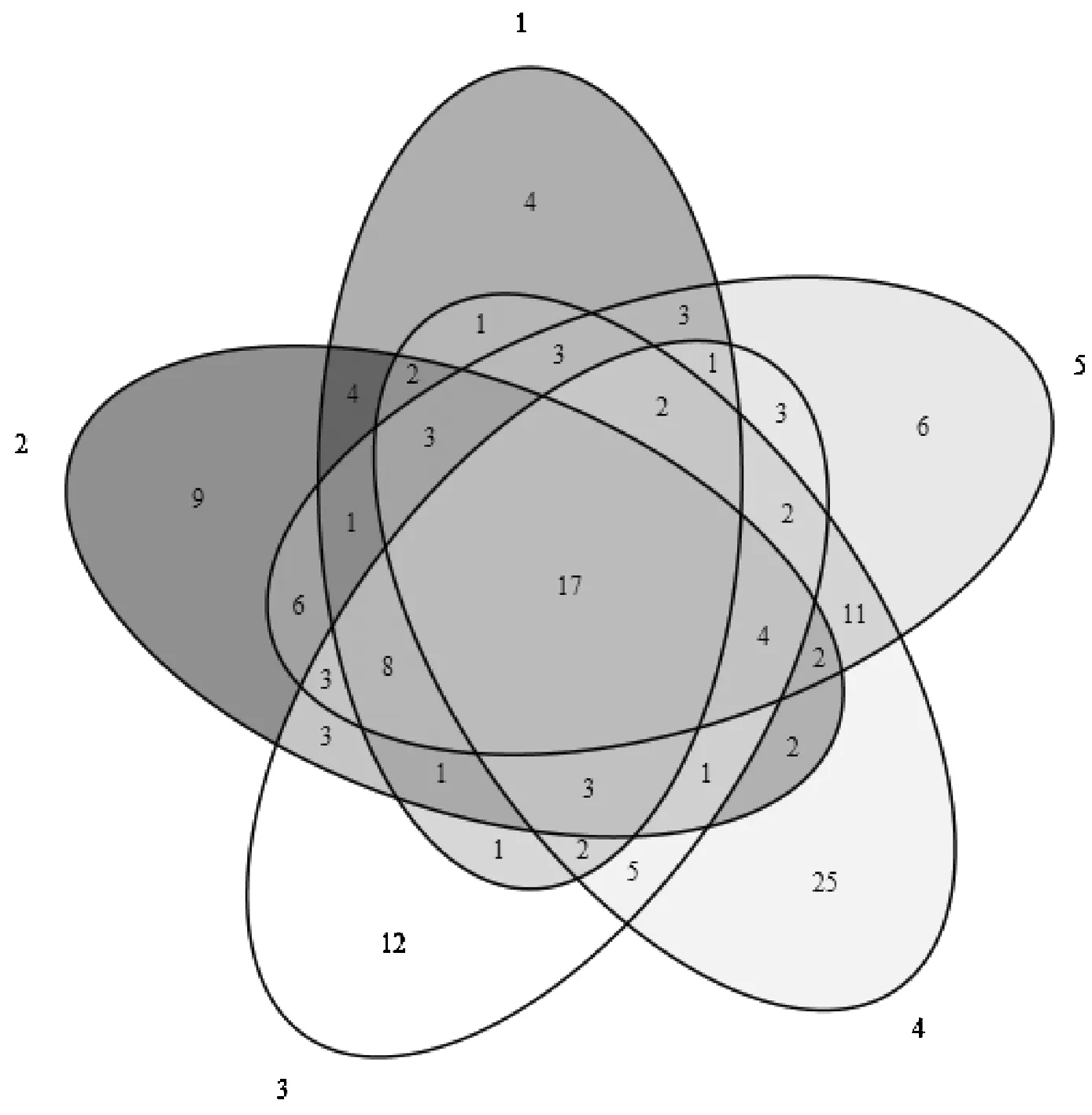
图3 OTU维恩图
通过对五个样品的151 694条序列进行分类,共分为149个OTU,对这149个OTU构建系统发育树,见图2。
由图3可知,共形成149个OTU分类单元,其中五个样品共有OTU有17个。说明5个样品间内生真菌区系差异较小。样品4有25个不同于其他四份样品的OTU,说明样品4的物种丰富度较高。
2.4 基于物种丰度分析结果
2.4.1 稀释曲线分析
稀释曲线[18]是指从每个样本中随机抽取一定数量的序列,统计这些序列所代表的OTU数目,以随机抽取的序列数与OTU数来构建的曲线。

图4 样品稀释曲线
由图4可知,随着对样品测序深度的增加,各样品曲线增长速度变缓,逐渐趋于饱和,数据量增加对于获得新的OUT效果已经不是很明显,说明曲线的数据量合理可信。有图可知样品1、2、3、5差异较小。而与样品4的区别较明显。
2.4.2 丰度分布曲线
样品丰度分布曲线将试验样品的物种分丰富度以及均匀度等信息反映出来,通过对比样品之间的信息,能够得出样品之间的差异性。

图5 样品丰度分布曲线
由图5可知:样品1的物种丰富度最差;样品2、3、5的物种丰富度和均匀程度相近;样品4的物种丰富度和均匀度最好。

表2 生物多样性指数表
注:Chao,Ace, Shannon,Simpson:分别表示各个指数;*_lci *_hci :分别表示统计学中的下限和上限值。
2.4.3 Alpha多样性分析
Alpha多样性指数是反映丰富度和均匀度的综合指标。因此,我们对内生菌的种类数目(丰富度)以及种类中个体分配上的均匀性作为Alpha多样性分析的指数。即为群落丰富度(Community richness)的指数和群落多样性(Community diversity)的指数。
由表2可知:样品1的物种丰富度最差;样品2、3、5的物种丰富度和均匀程度相近;样品4的物种丰富度和均匀度最好。
2.5 基于群落结果分析结果
2.5.1 样品群落组成分析
根据OTU表的结果,可以得到各个样品在分类水平上群落结构的比例情况,反映样品在不同分类学水平上的群落结构。
样品群落分析使用统计学的分析方法,观测样品在不同分类水平上的群落结构。样品群落组成分析通常使用较直观的饼图或柱状图等形式呈现[19]。对OTU表利用Qiime生成不同分类水平上(门、纲、目、科、属、种)的物种丰度表和多样品物种分布图。

图6 多样品物种分布图
由图6可知,五份样品中均含有子囊菌门真菌和接合菌门真菌,在样品3中含有担子菌门,而在其他样品中未发现。子囊菌门真菌在各样品内生真菌所占百分比的范围是8.3%~64.8%,平均百分比为32.7%,表明子囊菌门真菌在人参种子内生真菌中占有绝对优势。由于目前对真菌的研究较少,导致结果中未被鉴定的真菌平均占到总数的67%,表明还有很多内生真菌未被发现,有待接下来进一步的研究。
2.5.2 含进化树的物种丰度图分析结果
将实验中得到的内生菌,根据NCBI提供的分类信息学方法,采用进化树的方式对实验结果进行分析,利用应用软件MEGAN5[20](http://ab.inf.uni-tuebingen.de/software/megan/)得到物种进化及丰度信息图。由此可得到各内生菌的进化关系及丰度的差异性。

图7 物种进化及丰度信息图
由图7可知,在纲级别分类上,在座囊菌纲 (Dothideomycetes)中样本4的序列数最多,粪壳菌纲 (Sordariomycetes)和银耳纲 (Tremellomycetes)中样本3的序列数最多。在属级别分类上,在镰刀菌属(Fusarium)中的序列数最多且五份样品中均有分布,样品4和样品5中序列数所占比重最大,其次为样品1、样品2,样品3在镰刀菌属中所占比例最小;头囊菌(Cephalotheca)和柄孢壳菌属(Podospora)中的序列数较多且各样品之间序列数所占比例差异较小。
2.5.3 聚类分析结果
Heat map(热点图)根据需要将实验数据进行聚类分析,将分析结果用heat map图来进行呈现,通过heat map图来反映多个样品群落组成结构的相似性和差异性。图8表示在属的水平上,五份样品的真菌群落大致相似,但在这些样品的种类略有不同。图中一个色块代表一个样品的一个属的丰度,纵向是样品的聚类情况,反映多个样品在属水平上群落组成的相似性。

图8 聚类分析的热图
由图8可知,五份样品的相似程度总体较高。样品1、样品2和样品5三份样品相似程度最高,而样本3中沃德霉属(Wardomyces)的丰度较高,样本4中白赤壳属(Haematonectria)的丰度较高。这些结果可能是由于样品的个体差异造成的。
3 结论
五份样品中,都存在内生菌的多样性,而镰刀菌属序列数所占比列最大,为优势菌属。样品中各菌属的分布及丰度不同,说明内生菌在人参种子的分布存在差异性,镰刀菌属(Fusarium)中的序列数最多且五份样品中均有分布,且各样品中的分布差异较大,有可能是受到样品或者种子生存环境的影响;头囊菌(Cephalotheca)和柄孢壳菌属(Podospora)中的序列数较多且各样品之间序列数所占比例差异较小,可能是人参种子的专一性决定的,受到的影响较小。
4 讨论
人参为名贵中药材,各样品人参种子内生真菌存在大致相同,说明人参种子内的内生菌可能为专一性菌属,在人参的生长发育过程中起到了重要作用。本实验材料采用来自吉林抚松人参种植基地的人参种子,黑龙江人工种植人参的种子大部分来自吉林,由于经费的原因没有进行更多种子内生菌的测序工作。本实验通过454测序技术对人参种子进行内生菌进行鉴别,是对课题组前期研究工作的验证与补充。课题组前期在PDA培养基,高氏Ⅰ号培养基上对人参叶子进行内生真菌进行分离,分离出人参内生真菌18种,青霉属所占比例居多,5种,枝顶孢属4种,枝孢属、毛壳属各2种,曲霉属、棒囊壳属、黑球孢属、盾壳霉属、Zymonema各1种。与人参种子测序分析得到46个属相比较,测序得到的内生真菌属的覆盖面广,且二者未见重复的种属,其原因可能由人工分离方法的有限性,造成分离菌株总数较少,不能完全将人参内生真菌分离出来;这也是内生真菌寄主专一性所造成的。深入研究内生菌的生物多样性分析有利于进一步了解内生菌对人参的生长影响。
[1] 张薇.人参根际土壤真菌与内生真菌的多样性及人参皂苷生物催化活性菌株的筛选[D].大连:辽宁师范大学,2011:2.
[2] 张中朋,刘张林.2007年我国人参出口形势分析及展望[J].中国现代中药,2008,10(3):44-45.
[3] 陈晖奇.茶树内生真菌的初步研究[D].福州:福建师范大学,2007:11-12.
[4] 高剑.内生真菌多样性及其生态分布[D].湛江:广东海洋大学,2013:5-6.
[5] 袁志林.疣粒野生稻(Oryza granulate)内生真菌资源挖掘、系统发育分析和功能初探[D].杭州:浙江大学,2010:6-7.
[6] 吴令上.南方红豆杉内生真菌多样性、次生代谢产物及其与宿主的相关性研究[D].上海:第二军医大学,2012:71.
[7] 王卫霞.新疆几种典型荒漠植物根际微生物特征及内生固氮菌的分离、促生性能研究[D].乌鲁木齐:新疆农业大学,2009:8-9.
[8] 陈宝.内生细菌促进东南景天Zn/Cd的提取效应及其机制研究[D].杭州:浙江大学,2015:30-31.
[9] 周永强,程玉鹏,刘丹丹,等.药用植物内生真菌代谢产物的活性研究进展[J].中医药信息,2014,31(3):158-161.
[10] 程玉鹏,李天聪,林进华,等.内生真菌与药用植物宿主间的交流[J].中医药信息,2016,33(6):120-122.
[11] 杨中铎,魏博,薛鹏辉.一株半夏内生青霉属真菌次级代谢产物及生物活性的研究[J].中医药学报,2015,43(2):27-30.
[12] 孙景云,杨中铎,于海涛.雷公藤等10种植物分得49种内生真菌的发酵提取物杀虫活性研究[J].中医药学报,2016,44(6):9-12.
[13] 徐姣,常越,刘振鹏,等.5种人参内生真菌对6种人参病害拮抗作用的研究[J].中医药学报,2016,44(6):16-18.
[14] Caporaso JG, Kuczynski J,Stombaugh J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods,2010,7(5):335-336.
[15] Schloss PD,Westcott SL,Ryabin T,et al.Introducing mothur:Open-source, platform-independent, community-supported software for describing and comparing microbial communities[J].Appl Environ Microbiol,2009,75(23):7537-7541.
[16] Edgar RC,Haas BJ,Clemente JC,et al.UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics,2011,27(16):2194-2200.
[17] Edgar RC.Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics,2010,26(19):2460-2461.
[18] Amato KR,Yeoman CJ,Kent A,et al.Habitat degradation impacts black howler monkey (Alouatta pigra)gastrointestinal microbiomes[J].The ISME Journal,2013,7(7):1344-1353.
[19] Oberauner L,Zachow C,Lackner S,et al.The ignored diversity: complex bacterial communities in intensive care units revealed by 16S pyrosequencing[J].Scientific Reports,2013,3(3):1413.
[20] Huson DH, Mitra S,Ruscheweyh H,et al.Integrative analysis of environmental sequences using MEGAN4[J].Genome Research,2011,21(9):1552-1560.
Endophytic Fungi Diversity of Ginseng Seeds by Using 454 GS FLX
MA Wei,LIU Zhen-peng, SUN Li-ying*,ZHANG Kai-xue, XU Jiao,WEN Dong, ZHAO Rui, LIU Xiu-bo
(Heilongjiang University of Chinese Medicine,Harbin 150040,China)
Objective: To study the biodiversity of the endophytic fungi of ginseng seeds. Methods: Use 454 sequencing technology to analyze the diversity of endophytic fungi from the ginseng seeds. Results: Ascomycota had the overwhelming superiority,and its average percentage was 32.7%. 46 genera were identified and Fusarium was the dominant genera. Conclusion: Endophytic fungi of Ginseng seeds has the biological diversity, and the distribution of the endophytic fungi of ginseng seeds has some differences.
Ginseng seeds;454 GS FLX;Metagenomics;Endophytic fungi;Biodiversity
农业公益性行业科研专项(No.201303111-04);哈尔滨市优秀学科带头人基金项目(No.2014RFXXJ122);黑龙江省教育厅科学技术研究项目(No.12541743);国家自然科学基金项目(No.81274010);黑龙江中医药大学“优秀创新人才支持计划”项目(No.2012001)
马伟(1969-),女,研究员,博士研究生导师,主要研究方向:药用植物生物工程。
孙丽英*(1966-),女,研究员,硕士研究生导师,主要从事教学、科研及临床工作。
2016-11-18
R28
A
1002-2406(2017)03-0028-04
修回日期:2016-12-10
