长链非编码RNA SNHG7在胃癌中的表达及功能
2017-06-05费正华
费正华
(温州医科大学附属第一医院,浙江 温州325000)
·实验研究·
长链非编码RNA SNHG7在胃癌中的表达及功能
费正华
(温州医科大学附属第一医院,浙江 温州325000)
目的 了解长链非编码RNA SNHG7在胃癌组织中的表达情况,以及对胃癌细胞增殖和凋亡的影响。方法 采用实时荧光定量PCR(qRT-PCR)法检测SNHG7在82例胃癌、癌旁组织及胃癌细胞系中的表达情况,分析胃癌组织中SNHG7表达量与临床病理参数的相关性;用siRNA干扰人胃癌BGC823细胞SNHG7表达后,分别用CCK-8法、流式细胞术检测细胞增殖和凋亡。 结果 SNHG7在胃癌组织较癌旁组织中表达明显升高(P<0.01);胃癌组织中SNHG7的表达水平与肿瘤的浸润深度(P<0.01),临床分期(P<0.01)、区域淋巴结转移(P<0.05)有关。SNHG7表达被抑制后,BGC823细胞增殖能力下降,细胞凋亡率增加(P<0.01)。 结论 SNHG7在胃癌组织中显著高表达,有望成为预测胃癌预后的标记物。
胃癌;长链非编码RNA;SNHG7;增殖,凋亡
胃癌是一种严重危害人类生命安全的常见恶性肿瘤,晚期胃癌患者5年生存率不足10%,胃癌复发和转移是其致死的主要原因,故发现调控胃癌细胞侵袭和迁移的相关基因,并寻找新的胃癌特异性生物标志物和药物靶点迫在眉睫[1]。随着对长链非编码RNA(long non-coding RNA,lncRNA)了解的深入[2,3],越来越多的lncRNA被证实在胃癌中存在异常表达,具有甲基化、组蛋白修饰、染色体重塑、剪接、转录及翻译调控等多种生物学功能,与胃癌发生、发展密切相关。本课题组在对基因表达综合(Gene Expression Omnibus,GEO)数据库中的芯片数据GSE51575进行了基因重注释分析,发现差异表达在2倍以上的lncRNA有20个,其中异常表达的长非编码RNA SNHG7位于人类染色体9q34.3,转录出长为869bp的转录本。基于以上芯片结果,作者对SNHG7作为胃癌潜在分子标志物及其功能进行了初步研究。
1 材料与方法
1.1 组织标本 胃癌细胞系SGC7901、BGC823、MGC803、MKN45及正常胃黏膜上皮细胞GES-1由上海生物细胞库提供,并收集本院2013年1月~2014年12月手术切除并经病理确诊的胃癌标本82例,所有患者术前均未接受抗肿瘤治疗,年龄34~78岁,男49例,女33例。79例行D2淋巴结清扫的根治性胃切除手术,3例行姑息性手术。取距癌组织边缘5cm以上的癌旁组织作为对照组。
1.2 方法
1.2.1 主要试剂 胎牛血清、DMEM购自Gibco公司;Trizol、LipofectAmine2000试剂购自美国Invitrogen公司;RNA反转录试剂盒、荧光定量PCR试剂盒购自TaKa Ra公司,CCK-8试剂盒、凋亡试剂盒购自南通碧云天生物科技有限公司;PCR引物由上海生工生物工程公司按以下序列合成:SNHG7引物序列:上游引物5'-CTAGGGGACTGGGCTGCT-3',下游引物5'-AGGGTCTTAGGTTCCAGGCA-3';βactin引物序列:上游引物5'-CTCCATCCTGGCCTCGCTGT-3',下游引物5'-GCTGTCACCTTCACCGTTCC-3'。
1.2.2 qRT-PCR 按 Trizol说明书要求提取组织总RNA,按qRT-PCR说明书要求配制50μL反应体系,并采用以下条件进行反转录反应: 50℃反转录反应30分钟,92℃反应3分钟变性反转录酶。所得到的cDNA按如下条件进行PCR扩增反应:92℃变性10秒,55℃退火20秒,68℃延伸20秒,扩增40个循环。以β-actin基因作为内参,采用2-△△Ct法计算SNHG7 mRNA相对表达量。
1.2.3 细胞转染 取2×105对数期生长细胞接种于6孔板中,混匀。置于37℃、5%CO2培养箱孵育24小时,将si SNHG7和LipofectAmine2000分别加入Opti-MEM中,轻轻振摇5分钟后混匀,制成转染液,室温静置20分钟后,将转染液加入细胞中,轻轻混匀,孵育6小时后弃去转染液,加10%FBSDMEM继续培养。SNHG7干扰RNA(si SNHG7)及阴性对照 (si SNHG7-N)序列由上海生工公司合成,SNHG7特异性 siRNA (上游引物 5'-CCGATTCTTAAGTTCTGCTATTGTG-3',下游引物5'-GCTATTGTGGTATTCTGGTGGAGAA-3'。
1.2.4 CCK-8法检测细胞增殖 将转染SNHG7干扰序列和NC序列的BGC823细胞按5×103/孔接种于96孔板,每组设置6个复孔,于接种后24、48、72和96小时按照CCK8试剂盒说明检测细胞增殖。于450nm波长处测定每组细胞的吸光度值。取6孔平均值为结果(A值),以时间为横轴,A值为纵轴绘制细胞增殖曲线。
1.2.5 流式细胞仪检测细胞凋亡率 将2×105个细胞种于6孔板中,24小时后用不含EDTA的胰蛋白酶消化收集后,1000r/min离心5分钟,弃上清,用预冷的PBS洗涤2次后重悬于75%乙醇,并于-20℃固定过夜,洗涤离心后加入含有10mg/L溴化丙啶(PI)和0.1%R Nase A的PBS液500μL,室温避光染色10分钟后,用流式细胞仪测定细胞凋亡时消化收集细胞,分别加入5μL AnnexinV-FITC和10μL碘化丙啶(PI),混匀。在室温下,避光反应5~15分钟检测细胞凋亡率,以百分数表示细胞凋亡率。
1.3 统计学处理 采用SPSS17.0统计软件进行分析。计量资料以(±s)表示,组间比较采用t检验;计数资料采用χ2检验。
2 结果
2.1 GEO数据分析 芯片GSE51575分析显示一共有125条lncRNA在胃癌组织中存在差异表达,其中有20条表达升高或下降1倍以上,详见表1。
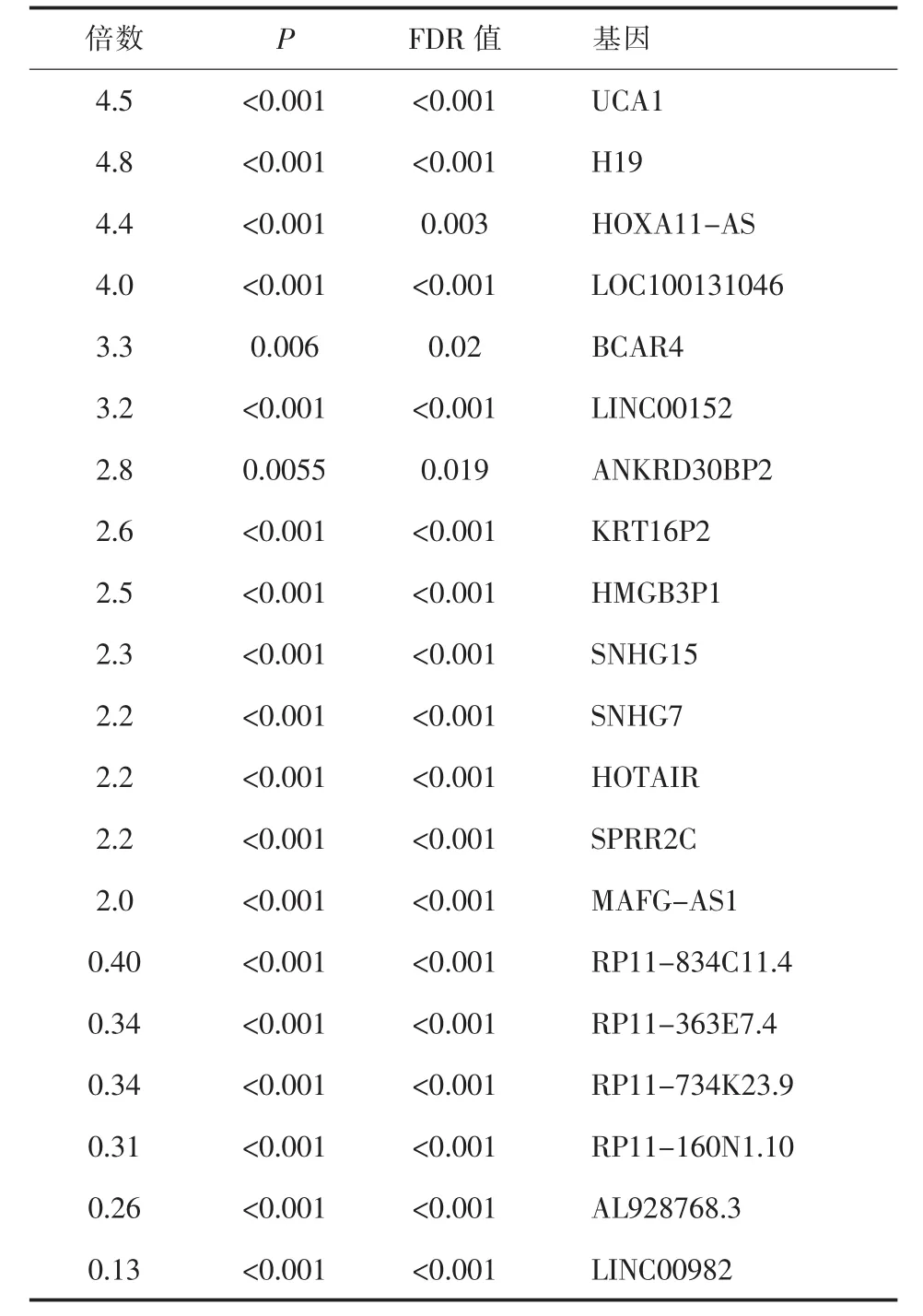
表1 芯片GSE51575中相对癌旁组织升高或下降1倍以上的lncRNAs
2.2 SNHG7在胃癌组织和胃癌细胞系中的表达SNHG7在胃癌组织中表达是其癌旁正常组织的2.2倍,基于以上结果,本文采用RT-PCR法检测82例胃癌患者癌组织和配对癌旁组织的SNHG7的表达差异。结果显示,SNHG7在胃癌组织中呈高表达,相对癌旁组织表达量的中位数为3.5倍,差异具有统计学意义(P<0.01),见图1。体外实验中,胃癌细胞系SGC7901,BGC823,MGC803和MKN45的SNHG7表达均明显高于胃上皮细胞系GES-1(P<0.01),见图2。其中BGC823细胞SNHG7表达较GES-1细胞升高4.5倍,故本文选择BGC823细胞进行进一步体外实验。

图1 SNHG7在胃癌和癌旁组织中表达

图2 SNHG7在胃上皮细胞和胃癌细胞系中表达
2.3 SNHG7表达水平与胃癌临床病理特征的关系根据SNHG7在胃癌组织中位表达量 (3.5倍),将82例胃癌组织分为SNHG7高表达组(41例)和低表达组(41例)。研究发现,SNHG7的表达与肿瘤的浸润深度、临床分期和区域淋巴结转移有关,而与患者的性别、年龄、肿瘤部位、远处转移及肿瘤大小无明显关系。浸润深度T3~T4患者的SNHG7表达水平明显高于T1~T2患者(P<0.01);存在区域淋巴结转移越多的患者SNHG7表达水平明显高于无转移患者 (P<0.05);TNMⅢ~Ⅳ期患者的SNHG7表达水平明显高于TNMⅠ~Ⅱ期(P<0.01),详见表2。
2.4 干扰SNHG7表达对胃癌细胞BGC823增殖和凋亡的影响 胃癌细胞BGC823在siRNA转染后,SNHG7下调明显 (P<0.01);与对照组相比,siRNA-SNHG7组细胞72、96小时增殖明显受到抑制 (P<0.05);siRNA-SNHG7组细胞凋亡比例为(15.27±2.54)%,明显高于对照组细胞的 (4.14± 0.87)%(P<0.01),详见图5。
3 讨论
LncRNA为一类长度超过200bp的转录本,由于其自身缺乏明显的开放阅读框架,不参与蛋白质的编码功能,起初lncRNA被认为是RNA聚合酶Ⅱ转录的副产物,是基因组转录的“噪音”,不具有生物功能。但后续研究显示,lncRNA可通过染色质修饰、转录激活与干扰等参与包括肿瘤在内的多种细胞内信号调控过程[4-5]。lncRNA FENDRR在胃癌组织中表达降低,低表达的患者肿瘤浸润更深,更容易发生局部淋巴结转移,并与FN1、MMP2/MMP9表达改变相关[6]。CCAT1在胃癌中表达上调,该lncRNA可能通过结合到C-Myc启动子区域,促进癌细胞的侵袭、转移能力[7]。以上研究表明LncRNA可能在胃癌的发生、发展中起重要调节作用。
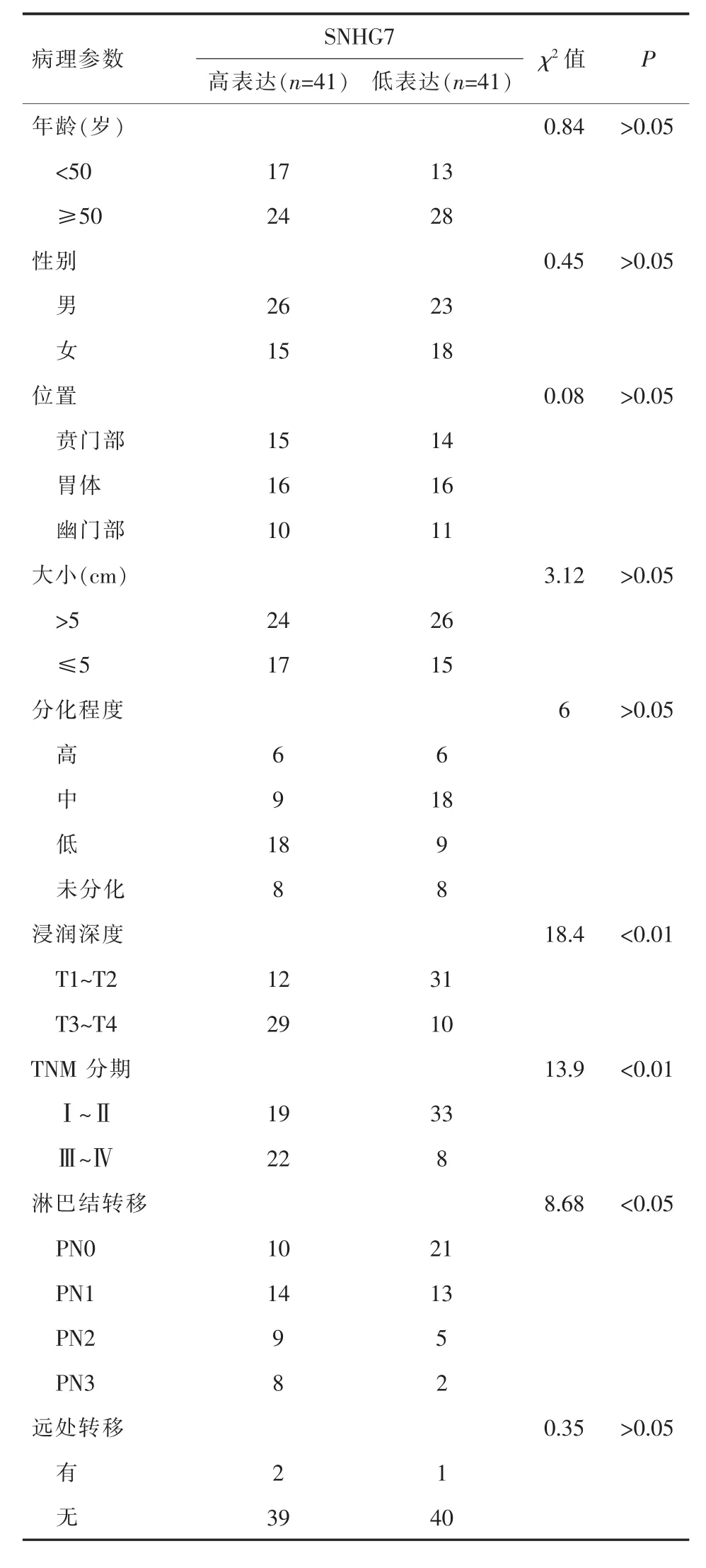
表2 胃癌组织中SNHG7表达与临床病理参数的关系

图3 RT-PCR检测SNHG7在BGC823细胞中的表达量

图4 CCK-8法检测SNHG7抑制后BGC823细胞的增殖
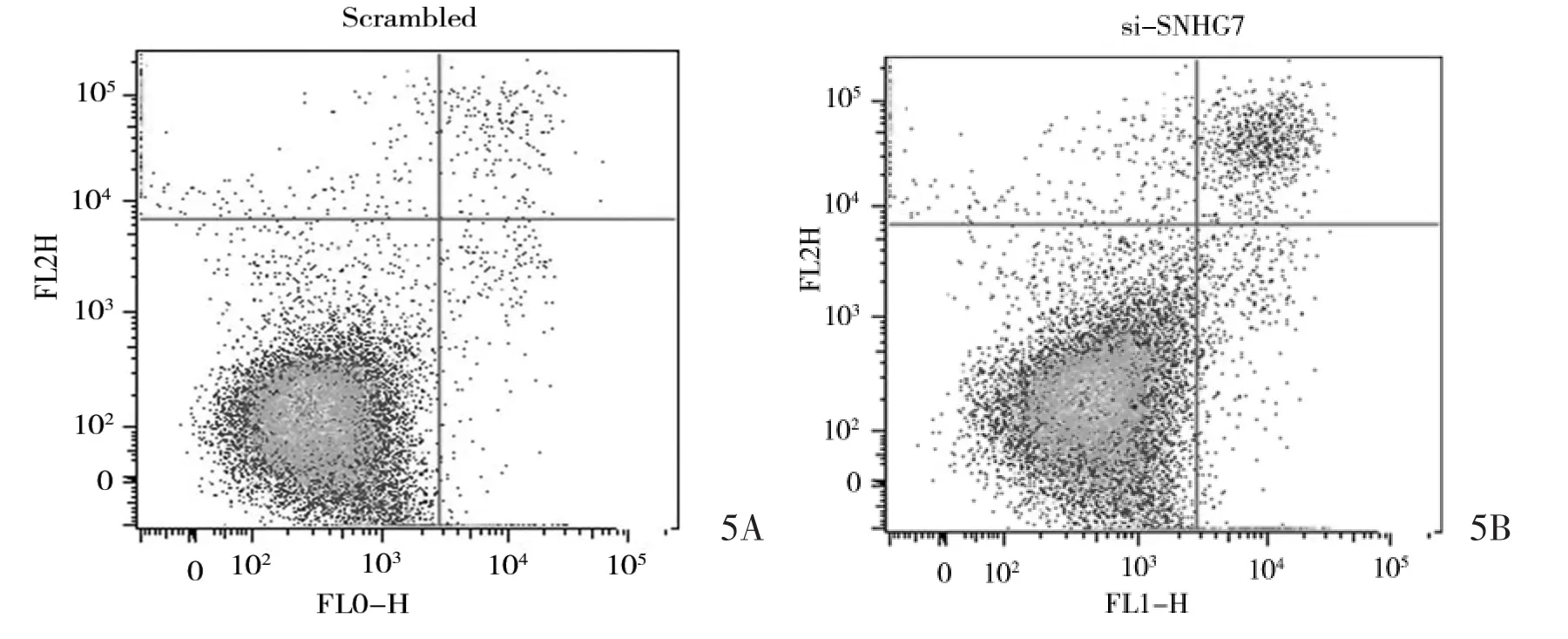
图5 流式细胞仪检测BGC823细胞凋亡(5A:空白载体组;5B:siRNA组)
本研究对芯片GSE51575数据进行了基因重注释分析,发现SNHG7在26例胃癌组织中高表达。本文用RT-PCR法检测了SNHG7在82例胃癌和癌旁组织中表达情况,发现SNHG7在胃癌组织中存在高表达,是癌旁组织表达量的3.5倍。SNHG7表达越高,肿瘤的浸润深度越深,并具有更高的临床分期和更多的区域淋巴结转移,而胃癌浸润至浆膜外、较多的区域淋巴结转移本身就是肿瘤恶性程度高的标志,提示胃癌组织中lncRNASNHG7较高表达患者术后随访和监测应更严密,以防复发。She等[8]研究发现,SNHG7在肺癌组织中存在高表达,抑制SNHG7表达后,可通过增加FAIM2蛋白表达,促进肺癌A549细胞凋亡。本研究体外实验表明,在不同胃癌细胞系中SNHG7表达均较正常胃黏膜上皮细胞GES-1高,与胃癌组织中表达一致。通过siRNA抑制胃癌细胞SNHG7表达后,72、96小时的细胞增殖能力明显下降,而流式细胞仪检测也进一步证明,BGC823细胞SNHG7表达抑制后,凋亡率明显增加,达(15.27±2.54)%,显著高于对照组的 (4.14±0.87)%。通过对GSE51575芯片中数据进行基因富集分析,发现细胞周期及细胞增殖相关的基因富集在SNHG7高表达的患者上,说明SNHG7可能通过抑制凋亡基因或促进增殖相关基因而调控胃癌细胞生长,为下一步研究SNHG7通过何种途径调控胃癌细胞增殖提供理论依据。
综上所述,本研究表明SNHG7在胃癌组织中表达上调,且与肿瘤的浸润深度、淋巴结转移密切相关,下调SNHG7能够增加胃癌细胞增殖和凋亡。综上所述,SNHG7在胃癌的发生发展中发挥癌基因的作用,有可能用于胃癌患者预后监测和发现新的治疗靶点。
[1] Bollschweiler E,Berlth F,Baltin C,et al.Treatment of early gastric cancer in the Western World.World JGastroenterol,2014,20(19):5672
[2] Qi P,Du X.The long non-coding RNAs,a new cancer diagnostic and therapeutic goldmine.Mod Pathol,2013,26(2):155
[3]Hu Y,Wang J,Qian J,et al.Long noncoding RNA GAPLINC regulates CD44-dependent cell invasiveness and associates with poor prognosis of gastric cancer.Cancer Res,2014,74(23):6890
[4] Gupta RA,Shah N,Wang KC,et al.Long non-coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis.Nature,2010,464(7291):1071
[5] Fei ZH,Yu XJ,Zhou M,et al.Upregulated expression of long non-coding RNA LINC00982 regulates cell proliferation and its clinical relevance in patients with gastric cancer.Tumour Biol,2016,37(2):1983
[6] Xu TP,Huang MD,Xia R,et al.Decreased expression of the long non-coding RNA FENDRR is associated with poor prognosis in gastric cancer and FENDRR regulates gastric cancer cellmetastasis by affecting fibronectin1 expression.J Hematol Oncol,2014,7:63
[7] Guo X,Hua Y.CCAT1:an oncogenic long noncoding RNA in human cancers.JCancer Res Clin Oncol,2017:143(4):555
[8]She K,Huang J,Zhou H,et al.lncRNA-SNHG7 promotes the proliferation,migration and invasion and inhibits apoptosis of lung cancer cells by enhancing the FAIM2 expression.Oncol Rep,2016,36(5):2673
温州市科技局计划项目(Y20160121)
