旋转中心设计优化土党参蛋白质提取工艺
2017-06-04陈致印刘广军李魏巍谭显胜
陈致印,罗 莹,刘广军,李魏巍,谭显胜
(湖南人文科技学院,湖南省农田杂草防控技术与应用协同创新中心∕农药无害化应用省高校重点实验室,湖南417000)
土党参为桔梗科植物羊乳(Codonopsis lanceolataTrautv.)的根,别名山海螺、四叶参、羊乳参等[1]。据谷红霞等[2]研究,土党参中主要含有生物碱、甾萜类、黄酮类、挥发油、多种氨基酸、微量元素、多糖和蛋白质等成分。蛋白质是构成人体细胞、组织、器官的重要成分[3-4]。本试验参照吕薇等[5]、杨志伟等[6]、张治强等[7]对蛋白质提取采用的设计方法,采用磷酸缓冲液代替传统的盐或碱提取液,通过Box-Behnken旋转中心组合试验优化土党参蛋白质微波辅助提取工艺,为土党参蛋白粉生产或其他参类植物蛋白质利用提供理论依据。
1 材料与方法
1.1 材料与试剂
土党参:娄底市新化县土党参试验田;牛血清白蛋白(生化试剂):国药集团化学试剂有限公司;溴甲酚绿、甲基红、考马斯亮蓝G-250:天津市光复科技发展有限公司;氢氧化钠、硫酸钾、硫酸铜、无水碳酸钠:国药集团化学试剂有限公司;盐酸、浓硫酸:湖南汇虹试剂有限公司;无水乙醇、硼酸、磷酸、石油醚、磷酸氢二钠、磷酸二氢钠均为分析纯:天津市化学试剂工厂。
1.2 主要设备
KDN系列凯氏定氮仪:上海洪纪仪器设备有限公司;雷磁25-S酸度计:上海仪电科学仪器股份有限公司;Mini-1240紫外分光光度:岛津公司;Anton Paar微波消解萃取仪:安东帕公司;SHIMADZU AUW120D分析天平:日本岛津公司;LDZ5-2低速自动平衡离心机:北京雷勃尔离心机有限公司。
1.3 试验方法
1.3.1 技术路线
土党参→预处理→50℃烘干至恒重→粉碎过80目筛→石油醚在35—40℃下回流90 min去脂→乙醇洗涤2—3次→在鼓风干燥箱中50℃烘干→加入提取剂在微波消解仪中提取→3 800 r∕min离心18 min→收集上清液→测定蛋白质含量。
1.3.2 单因素试验
准确称取1 g土党参粉,考察提取液分别为蒸馏水,磷酸缓冲溶液(0.2 mol∕L,pH 7),10%NaCl溶液,NaOH 溶液(0.2 mol∕L,pH 10);pH 为 6、7、8、9、10、11;提取时间(min)为 2、6、10、14、18、22;提取温度(℃)为 46、48、50、52、54、56;液料比(mL∕g)为 10∶1、15∶1、20∶1、25∶1、30∶1、35∶1时,固定微波功率为305 W,测定蛋白质含量,考察不同参数对土党参蛋白质提取率的影响。每个水平重复3次。
1.3.3 旋转中心设计优化
根据Box-Behnken中心组合设计原理,结合单因素影响试验结果,考虑到温度对提取率影响不大,且不好控制,温度不作为响应面法的影响因素。固定温度为50℃,选取pH、时间、液料比作响应面试验,因素和水平见表1。

表1 Box-Behnken试验设计因素水平Table 1 Factors and levels of Box-Behnken experimental design
1.3.4 蛋白质含量的测定
以牛血清蛋白为标品,采用考马斯亮蓝法测定可溶性蛋白质含量。以牛血清蛋白质量浓度(μg∕mL)为横坐标(x),吸光度为纵坐标(y)绘制浓度-吸光度标准曲线。用紫外分光光度计测定吸光度,代入蛋白质标准曲线中,计算得出土党参蛋白质含量。
蛋白提取率=提取的土党参蛋白含量∕土党参粉中总蛋白含量×100%
土党参粉中总蛋白含量,采用微量凯氏定氮GB 5 009.5—2010《食品中蛋白质的测定》的方法测定。
1.3.5 响应面分析
运用Design-Expert 8.05b数据统计分析对试验结果进行多元回归拟合,回归模型方差分析,回归系数显著性检验。
2 结果与分析
2.1 标准曲线的绘制
采用微量凯氏定氮GB 5 009.5—2010《食品中蛋白质的测定》的方法,测得土党参中总蛋白质的含量为7.29%。 当以牛血清蛋白质量浓度(μg∕mL)分别为0、20、40、60、80、100 时,得到标准曲线,见图 1。 标准曲线方程:y=0.0067x+0.0005,R2=0.9994。结果表明,牛血清蛋白标准溶液的质量浓度在0—100 μg∕mL范围内与吸光度具有良好的线性关系。
2.2 提取剂的选取
由图2可见,4种提取溶液对土党参中蛋白质的提取有明显的差异,其中磷酸缓冲溶液提取率最高,达到8.85%,蒸馏水提取率最低,为4.45%,而NaCl溶液和NaOH溶液提取率在两者之间。因此,后续试验以磷酸缓冲溶液为提取剂,进一步优化提取条件。

图1 牛血清蛋白标准曲线Fig.1 Standard curve of bovine serum protein

图2 不同提取液对土党参蛋白提取率的影响Fig.2 Effects of extracting solutions on extraction rate of lance asiabell root proteins
2.3 pH对提取率的影响
不同pH对蛋白质提取率的影响显著,与一般植物蛋白在碱溶条件下提取规律相符。如图3所示,随着pH的增加,提取率先增加后逐步下降后又上升,pH为8时达到最大。这可能是因为在pH为9及以后的溶液添加了强碱氢氧化钠,导致提取率有所上升,但考虑蛋白质的活性,当pH大于11时,其强碱作用对蛋白质活性有影响,降低其商业价值,故pH大于11后不再试验。所以综合考虑选取pH为8的缓冲溶液为响应面法中心点。
2.4 时间对提取率的影响
如图4所示,当微波时间在2—22 min时,随着时间的延长,蛋白质提取率有拐点出现,即在6 min时达到8.62%,随后大幅度降低。这可能是因为蛋白质随着时间延长溶出达到饱和,再延长时间蛋白质在微波消解仪的变性分解,使蛋白质提取率下降,或者是因为蛋白质和淀粉结合,使蛋白质难以溶出。所以选择6 min为响应面法中心点。
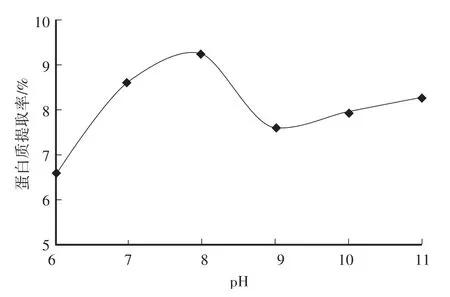
图3 pH对土党参蛋白质提取率的影响Fig.3 Effect of pH on extraction rate of lance asiabell root proteins
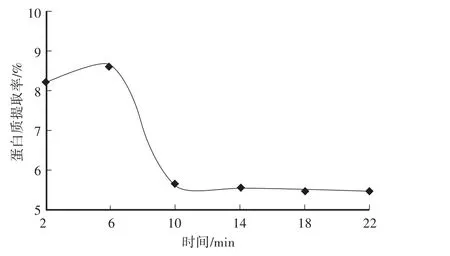
图4 提取时间对土党参蛋白质提取率的影响Fig.4 Effect of extracting time on extraction rate of lance asiabell root proteins
2.5 温度对提取率的影响
如图5所示,不同温度对蛋白质提取率的影响较小,在46—56℃范围内,随着温度的升高,蛋白质提取率变化的幅度不大,最高点为50℃时8.61%,而最小者在46℃时8.43%,说明在46—50℃这个温度区间内,由热变性而造成的提取率降低影响不大,50℃以上可能有部分蛋白质变性,导致提取率下降明显。考虑到温度对提取率影响不大,且不好控制,温度不作为响应面法的影响因素。
2.6 液料比对提取率的影响
不同液料比对蛋白质提取率的影响见图6。当液料比从10∶1增加到35∶1时,随着液料比的增大,蛋白质提取率逐渐增大,到25∶1的拐点时,达到最大值,后出现下降趋势。原因可能是蛋白质随溶剂分子的增多,相互作用力增强,不易析出。所以综合考虑选25∶1的液料比为响应面法中心点。
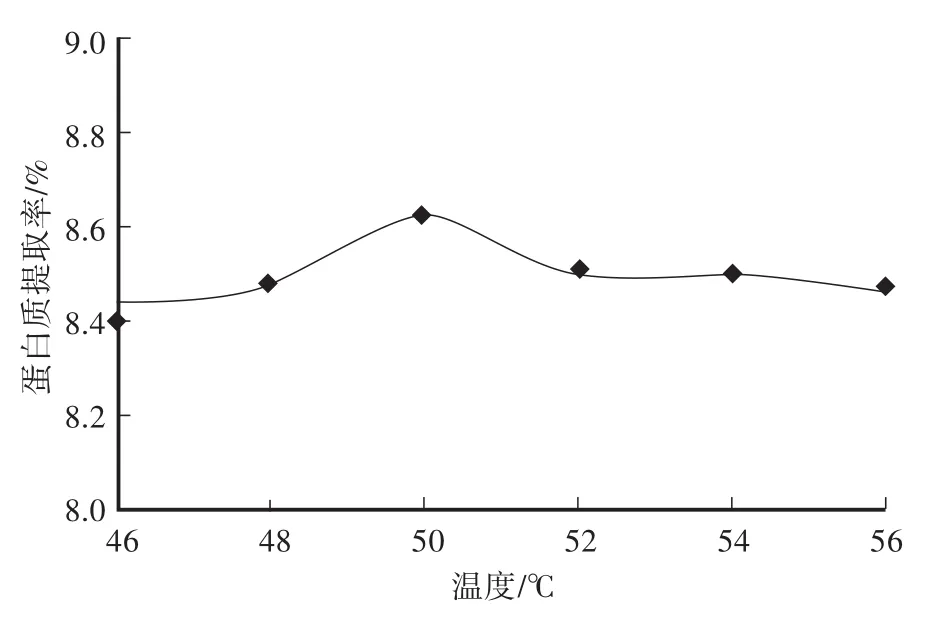
图5 提取温度对土党参蛋白质提取率的影响Fig.5 Effect of extracting temperature on extraction rate of lance asiabell root proteins
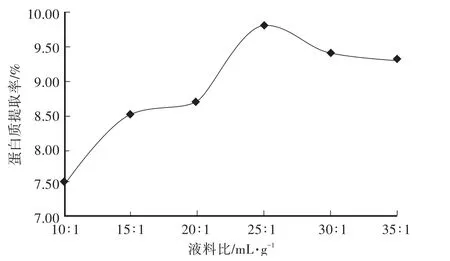
图6 液料比对土党参蛋白质提取率的影响Fig.6 Effect of liquid-material ratio on extraction rate of lance asiabell root proteins
2.7 数据分析
按照试验设计每个处理重复试验3次,提取率取平均值,试验结果见表2。对响应面法模型进行方差分析和回归系数显著分析,见表3。

表2 试验设计方案及结果Table 2 Experimental design and result
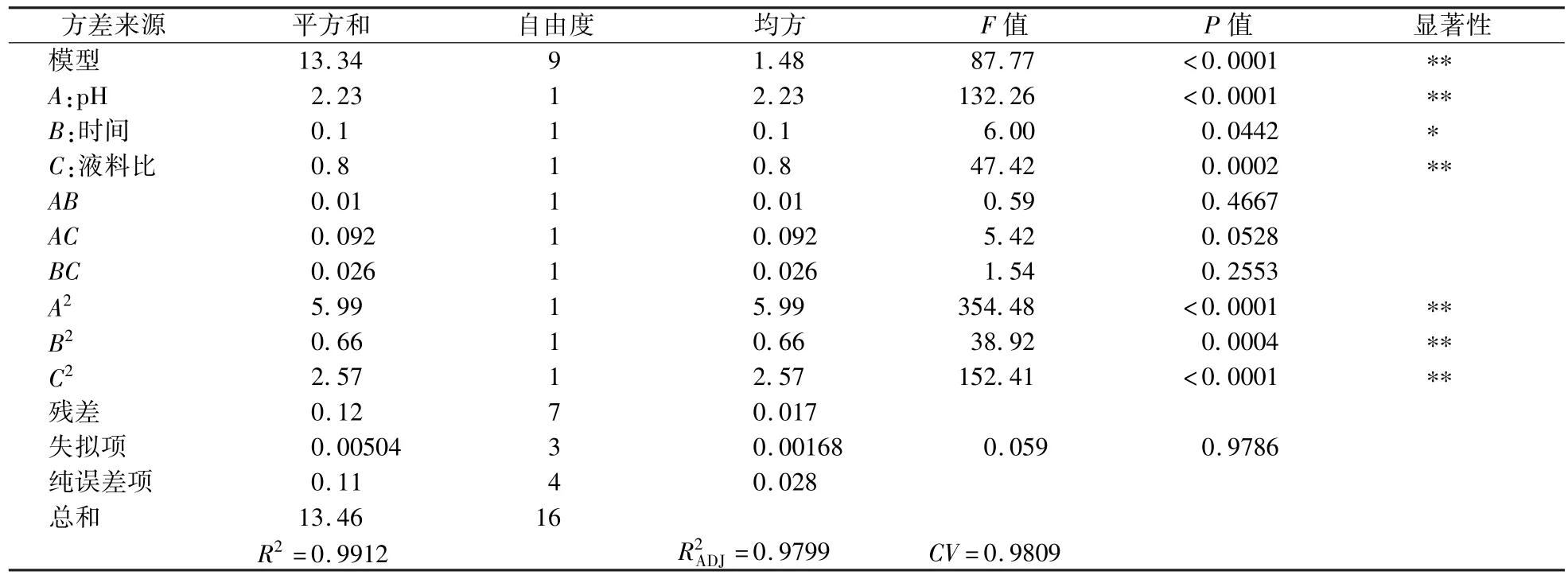
表3 回归模型的方差分析和回归系数的显著检验Table 3 Variance analysis of regression model and significance test for regression coefficients
对表2的试验结果采用Design-Expert 8.05b软件进行多元回归拟合,得到土党参蛋白质得率(Y)对pH(A)、时间(B)、液料比(C)的二元多项式回归模型为:
Y=10.52-0.53A+0.11B+0.32C+0.05AB-0.15AC-0.081BC-1.19A2-0.4B2-0.78C2
由表3方差分析可以检测该模型的拟合度。由表3可知,试验所选模型F=87.77,P=0.0001<0.01,表明模型极显著,模型P=0.0001,失拟项P=0.9786>0.05,表明该模型对试验的干扰仅0.01%,可以忽略不计,模型的决定系数R2=0.9912,说明该模型能解释99.12%响应面值的变化是由pH、时间、液料比引起的,说明该模型能较好地拟合提取率和实验因素之间的关系,并预测出最优的工艺条件组合。其中,当回归系数P<0.01时,表明该项回归系数差异极显著;当回归系数P<0.05时,表明该项回归系数显著。因此,A、C对土党参蛋白提取影响是极显著的,二次项A2、B2、C2对土党参蛋白提取的曲面效应极显著,B对土党参蛋白提取影响显著,而此3个因素的交互作用AB、AC、BC对提取的影响不显著。同时还可得出,影响土党参蛋白提取率的主次因素依次为A>C>B,即pH>液料比>时间。
2.8 响应面分析
根据回归模型作出响应面图和等高线图,考察拟合响应面形状,分析各因素对土党参蛋白提取率的影响,结果见图7—9。
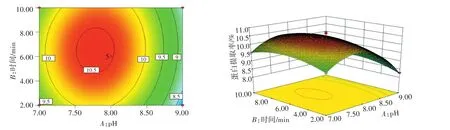
图7 pH和时间对土党参蛋白提取率的影响Fig.7 Effects of pH and extracting time on extraction rate of lance asiabell root proteins
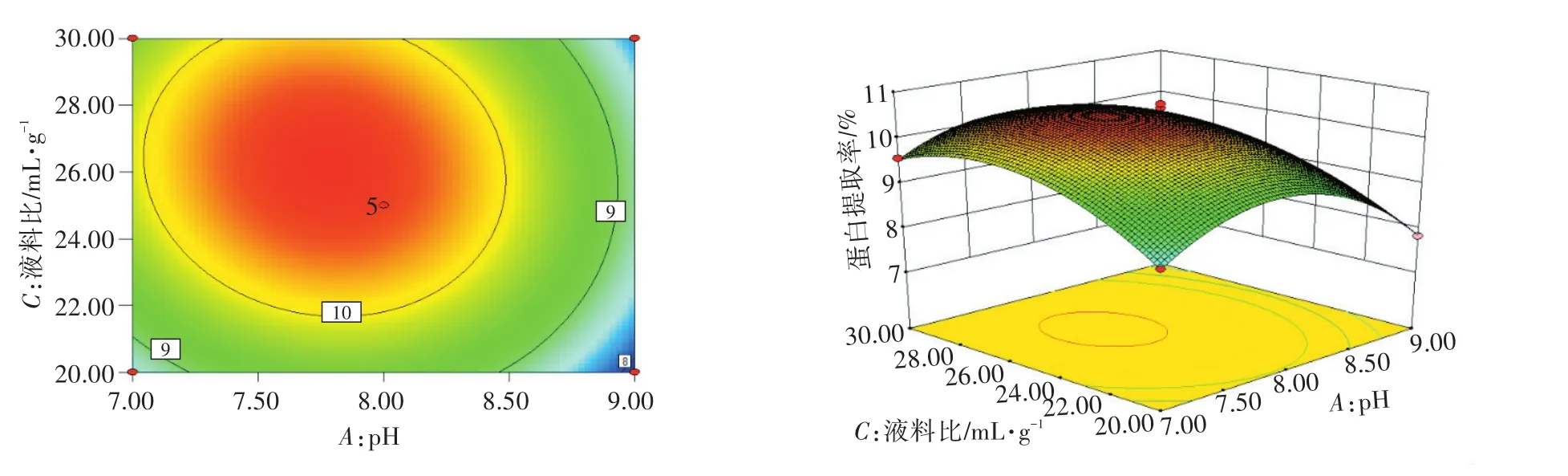
图8 pH和液料比对土党参蛋白提取率的影响Fig.8 Effects of pH and liquid-material ratio on extraction rate of lance asiabell root proteins
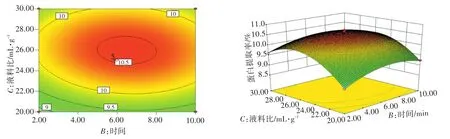
图9 时间和液料比对土党参蛋白提取率的影响Fig.9 Effects of extracting time and liquid-material ratio on extraction rate of lance asiabell root proteins
由图7可知,提取液料比为25∶1时,随着pH的升高,土党参蛋白提取率随时间的延长增加,然后下降。由图8可知,在时间为6 min时,随着pH的升高,土党参蛋白提取率随液料比的增加而增加。由图9可知,在pH为8时,随着时间的延长,土党参蛋白提取率随液料比的增加而增加,达到峰值后下降。
利用Design-Expert 8.05b软件结合回归模型,预测土党参蛋白提取率的最佳提取工艺参数为pH为7.77,提取时间为6.41 min,液料比为26.1∶1(mL∕g),土党参蛋白理论提取率达到10.62%。对优化参数进行3次重复验证,得到土党参蛋白提取率为10.58%,与理论值没有显著差异,进一步验证了回归模型的合理性。
3 结论
通过单因素试验,确定各因素的范围,利用旋转中心组合设计-响应面法分析对pH、液料比、时间3个因素对土党参蛋白提取率的影响进行分析。最终确定微波辅助最佳提取工艺参数为pH 7.77,提取时间6.41 min,液料比26.1∶1(mL∕g),温度50℃,微波功率为305 W,该工艺条件下的土党参蛋白提取率为10.58%。
曹川等[8]利用响应面优化微波辅助提取贻贝蛋白的工艺研究,最大的蛋白质回收率为74.83%。张治强等[7]利用响应面法优化苦瓜籽蛋白质提取工艺,采用了盐溶法提取苦瓜籽蛋白质,最后提取率为23.80%,较优化前提高了3.24倍。通过研究可以得出响应面分析是能优化蛋白质提取率的。本研究为提取土党参蛋白及其应用提供了理论依据,但试验只研究了土党参蛋白质的提取工艺,没有对其进行纯化和鉴定,也没有对其结构和性质进行探究,可以作为下一步研究方向。
[1]国家中医药管理局《中华本草》编委会.中华本草:第20卷[M].上海:上海科技出版社,1999.
[2]谷红霞,周茂金,苏美英,等.四叶参化学成分和药理作用研究进展[J].中药材,2009,40(8):1338-1340.
[3]刘长江,杨智超,许金光,等.响应面法优化软枣猕猴桃蛋白提取工艺[J].食品研究与开发,2011,32(3):1-5.
[4]贺伟,刘永乐,王发祥,等.响应面法优化莲子磨皮粉中蛋白质的提取工艺[J].食品科学,2015,36(8):24-28.
[5]吕薇,蒋剑春,徐俊明.蛋白质提取及分离纯化研究进展[J].精细石油化工进展,2010,11(11):52-57.
[6]杨志伟,沈旭,黄群,等.微波辅助提取杜仲翅果籽粕蛋白的工艺优化[J].食品与机械,2014,30(1):205-208.
[7]张治强,成兰英.响应面法优化苦瓜籽蛋白质的提取工艺[J].食品工业科技,2013(1):268-272.
[8]曹川,包建强.响应面法优化微波辅助提取贻贝蛋白的工艺研究[J].食品工业科技,2012(5):258-261.
