生防菌对黄瓜枯萎病防效及其对黄瓜诱导抗性测定
2017-06-01李书强李林会沈江洁张明珠杜晓端芦国嫣
李书强,李林会,沈江洁,景 焕 ,张明珠,杜晓端,芦国嫣
(1 河北省农垦事业发展中心,河北 石家庄,050021;2 河北科技师范学院;3 河北省易县西陵满族初级中学)
生防菌对黄瓜枯萎病防效及其对黄瓜诱导抗性测定
李书强1,李林会1,沈江洁2,景 焕3,张明珠2,杜晓端2,芦国嫣2
(1 河北省农垦事业发展中心,河北 石家庄,050021;2 河北科技师范学院;3 河北省易县西陵满族初级中学)
为确定生防菌对黄瓜枯萎病的防效及其对黄瓜诱导抗性,采用生物测定方法,测定了枯草芽孢杆菌(Bacillussubtilis)菌剂、粉红粘帚霉(Gliocladiumroseum)菌剂、棘孢木霉(Trichodemaasperellum)及嗜麦芽寡养单胞菌(Stenotrophomonasmaltophilia)对黄瓜枯萎病的防治效果及黄瓜叶片几种防御酶活性的影响。结果表明:经棘孢木霉菌对黄瓜枯萎病的防治效果达到70.24%。生防菌剂处理后的黄瓜叶片中4种防御酶的活性变化呈现一定的规律:经粉红粘帚霉、枯草芽孢杆菌和棘孢木霉处理的黄瓜叶片POD活性是空白对照的1.26倍、1.11倍和1.40倍;经嗜麦芽寡养单胞菌和棘孢木霉处理的黄瓜叶片SOD活性分别是空白对照的3.92倍和2.66倍;经粉红粘帚霉、枯草芽孢杆菌、棘孢木霉和嗜麦芽寡养单胞菌4种生防菌处理的黄瓜叶片PAL活性分别仅为空白对照处理的43.01%,69.11%,33.81%,34.70%;经枯草芽孢杆菌、粉红粘帚霉、棘孢木霉和嗜麦芽寡养单胞菌4种生防菌处理的黄瓜叶片CAT活性分别是空白对照的1.04倍、1.88倍、1.07倍和1.07倍。说明黄瓜经生防菌诱导处理后的一部分防御酶活性会升高。
生防菌;黄瓜枯萎病;防治效果;防御酶活性
黄瓜枯萎病是一种严重的土传病害,其病原菌为半知菌亚门镰孢属的尖孢镰刀菌黄瓜专化型(Fusariumoxysporiumf. sp.cucumerinumOwen),是影响黄瓜生产的最主要病害之一。病菌从幼根或伤口侵入,大量繁殖后,堵塞黄瓜木质部导管,阻碍水分沿着导管向地上部运输,使植株迅速萎蔫且病势发展迅速,很难控制。我国流行的菌系为生理小种4号[1],常年发病率10%~30%,重病年份可达80%~90%[2],使黄瓜大幅减产,严重影响了黄瓜生产,损失达几百亿美元[3]。
黄瓜枯萎病作为常见且危害最为严重的蔬菜真菌病害,其有效防治是目前设施蔬菜生产中的难题[4]。目前对黄瓜枯萎病的防治主要是化学方法,但防治效果不佳,且易造成环境污染、农药残留等问题。利用拮抗菌防治黄瓜枯萎病日益受到国内外重视[5,6]。生防菌的诱导抗性只是众多生防机制的一个方面,它和其它防病促生机制诸如抗生作用、重寄生作用、竞争作用以及植物生长促进等具有协同增效作用,加之具有广谱、非特异性的优点,可在植物病虫害综合防治中发挥重要作用,为植物病害生物防治提供了一种新思路。王伟等[7]用木霉菌测番茄枯萎病的防治效果为63.58%~74.26%,过氧化物酶(POD)活性提高了30%,超氧化物歧化酶(SOD)活性提高28%,PAL(苯丙氨酸解氨酶)活性提高35%。李晶等[8]在黄瓜根围土中分离得到1株枯草芽孢杆菌菌株B29,对黄瓜枯萎病的防效高达84.9%,PAL酶活性提高38%,POD为对照酶活的1.6倍。陈淼[9~11]研究表明,枯草芽孢杆菌B579菌株对黄瓜枯萎病的防治效果可达73.6%,POD酶活性提高40%,SOD酶活性提高25%。因此,笔者用木霉菌、嗜麦芽寡养单胞菌、枯草芽孢杆菌和粉红粘帚霉对黄瓜枯萎病进行生物活性及其对黄瓜体内防御酶活性生物诱导活性的测定,以期筛选出对黄瓜枯萎病有较高防效的生防菌,并明确其对黄瓜的诱导抗性机理。
1 材料与方法
1.1 生防菌
棘孢木霉(Trichodemaasperellum),枯草芽孢杆菌(Bacillussubtilis),粉红粉红粘帚霉菌(Gliocladiumroseum),嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia),均由河北科技师范学院生命科技学院蔬菜病害生物防治课题组提供。
1.2 供试病原菌
尖孢镰刀菌黄瓜专化型(Fusaruim oxyporiumf.sp. cucumerinum),由河北科技师范学院生命科技学院蔬菜病害生物防治课题组提供。
1.3 黄瓜品种
中农6号,引自中国农业科学院蔬菜研究所。
1.4 病原菌的培养
将尖孢镰刀菌黄瓜专化型(F. oxyporium)用无菌水制成孢子悬浮液后加入马铃薯葡萄糖培养液(PD)中,28 ℃ 120r/min震荡培养7d,滤液用双层纱布过滤,除去菌丝,将滤液经5 000r/min离心10min,其沉淀加适量无菌水稀释成孢子数为1×106个/mL的孢子悬浮液。
1.5 生防菌剂接种方法
将黄瓜种子经温汤浸种催芽后播种于10cm的营养钵中,每盆2粒种子。当黄瓜苗长到2~3个真叶时,按表1所述的浓度和方法向黄瓜苗根际注射棘孢木霉和嗜麦芽寡养单胞菌孢子悬浮液108cfu/mL,每株接入3mL孢子悬浮液。根据苗土的量将枯草芽孢杆菌和粉红粘帚霉稀释成300倍拌土使用,并设清水对照和空白对照。3d后接入尖孢镰刀菌孢子悬浮液106cfu/mL,接种前用小刀破坏根系,每株接入3mL孢子悬浮液作为清水对照。25d后调查病情指数并计算相对防治效果。

表1 生防菌的接种方法和浓度
黄瓜枯萎病病情指数分级标准为:
0级——健株,长势良好,无病症。
1级——病株叶片自下而上逐渐萎蔫,死缺水状,中午更为明显,早晚上能恢复。
2级——病株叶片萎蔫,仍为绿色,不能再恢复正常。
3级——整株叶片呈褐色枯萎下垂,不能再恢复正常,叶片干枯至整株死亡。


1.6 生防菌对黄瓜的诱导抗性测定
1.6.1 酶液的提取 于开花期(9~10叶)采集样品,取黄瓜叶片用自来水快速冲洗后,用滤纸吸干,每个样品称取相应的质量,装入自封袋,放入-70 ℃超低温冰箱中保存。每个处理3次重复取样。
1.6.2 叶绿素含量测定 黄瓜叶片用体积分数为0.95的乙醇与体积分数为0.80的丙酮按体积比1∶1的混合液浸泡,直至叶色完全变白即可在663,645 nm下比色[12]。
1.6.3 防御酶活性测定 采用马峙英方法[13]测定过氧化物酶(POD)活性,以每分钟OD450值改变0.1的酶用量为一个酶活单位;采用林植芳[14]的方法测定超氧化物歧化酶(SOD)活性,以每分钟抑制氮蓝四唑(NBT)50%的酶用量为一个酶活单位;采用王敬文等[15]的方法测定苯丙氨酸解氨酶(PAL)活性,以每分钟OD290值改变0.01的酶用量为一个酶活单位;参考潘汝谦等[16]的方法测定过氧化氢酶(CAT)活性,以每分钟OD值减少0.01的酶用量为一个酶活单位;蛋白质含量测定采用Brandford考马斯亮兰G-250法[17],酶的比活性以每毫克蛋白所含的酶单位数(Uprotein)。

表2 生防菌对黄瓜枯萎病的生防效果
注:同列不同字母表示经LSD法检验在0.05水平差异显著。
2 结果与分析
2.1 生防菌对黄瓜枯萎病的生防效果
棘孢木霉、枯草芽孢杆菌、粉红粘帚霉和嗜麦芽寡养单胞菌对黄瓜枯萎病的防效分别为70.24%,53.57%,64.29%,50.0%(表2)。
2.2 生防菌对黄瓜防御酶活性的影响
2.2.1 施用不同生防菌后黄瓜叶片叶绿素的变化 经枯草芽孢杆菌、粉红粘帚霉、棘孢木霉和嗜麦芽寡养单胞菌处理后,黄瓜叶片叶绿素质量分数比空白对照处理的低,分别是空白对照处理的73.82%,61.80%,74.68%,93.13%(图1);而经枯草芽孢杆菌、粉红粘帚霉、棘孢木霉菌和嗜麦芽寡养单胞菌处理后的黄瓜叶片叶绿素质量分数均比清水对照处理的高,分别是清水对照处理的1.77倍、1.48倍、1.79倍和2.23倍;经棘孢木霉菌和嗜麦芽寡养单胞菌处理的黄瓜叶绿素质量分数分别是经粉红粘帚霉处理的1.21倍和1.51倍。2.2.2 经不同生防菌处理后黄瓜叶片POD的变化 经粉红粘帚霉、枯草芽孢杆菌和棘孢木霉处理的黄瓜叶片POD活性稍高于空白对照处理的,分别是空白对照处理的1.26倍、1.11倍和1.40倍(图2);而经嗜麦芽寡养单胞菌处理的黄瓜叶片POD仅为空白对照处理的39.61%;经粉红粘帚霉、枯草芽孢杆菌、嗜麦芽寡养单胞菌和棘孢木霉菌处理的黄瓜叶片POD活性分别仅为清水对照处理的49.98%,44.01%,15.77%,55.57%。

图1 生防菌对黄瓜叶片叶绿素含量的影响 图2 生防菌对黄瓜叶片POD活性的影响
2.2.3 经不同生防菌处理的黄瓜叶片SOD的变化 经嗜麦芽寡养单胞菌和棘孢木霉处理的黄瓜叶片SOD活性高于空白对照,分别是空白对照的3.92倍和2.66倍(图3);经粉红粘帚霉、枯草芽孢杆菌和处理的黄瓜叶片SOD活性低于清水对照的,分别仅为经清水对照的63.92%和60.46%。
2.2.4 经不同生防菌处理的黄瓜叶片PAL的变化 经粉红粘帚霉、枯草芽孢杆菌、棘孢木霉和嗜麦芽寡养单胞菌等4种生防菌处理的黄瓜叶片PAL活性分别仅为空白对照处理的43.01%,69.11%,33.81%,34.70%。经粉红粘帚霉和枯草芽孢杆菌处理的黄瓜叶片PAL活性高于清水对照处理的,分别是清水对照处理的1.06倍和1.70倍(图4)。

图3 生防菌对黄瓜叶片SOD活性的影响 图4 生防菌对黄瓜叶片PAL活性的影响
2.2.5 经不同生防菌处理的黄瓜叶片CAT的变化 经枯草芽孢杆菌、粉红粘帚霉、棘孢木霉和嗜麦芽寡养单胞菌等4种生防菌处理的黄瓜叶片CAT活性均高于空白对照,分别是空白对照的1.04倍、1.88倍、1.07倍和1.07倍(图5);4种生防菌处理的黄瓜叶片CAT活性均低于清水对照的,仅为清水对照的53.13%,96.29%,54.59%,54.72%;枯草芽孢杆菌、棘孢木霉和嗜麦芽寡养单胞菌处理的黄瓜叶片CAT活性仅为粉红粘帚霉处理的55.17%,56.68%,56.82%(图5)。
2.2.6 经不同生防菌处理的黄瓜蛋白质质量分数的变化 经枯草芽孢杆菌、粉红粘帚霉、棘孢木霉和嗜麦芽寡养单胞菌处理的黄瓜蛋白质质量分数均高于空白对照处理的,分别是空白对照的1.69倍、2.72倍、4.46倍、4.03倍;经粉红粘帚霉和枯草芽孢杆菌处理的黄瓜蛋白质质量分数分别仅是清水对照处理的67.52%和42.04%;棘孢木霉菌处理的黄瓜蛋白质质量分数是清水对照处理的1.11倍;经嗜麦芽寡养单胞菌和棘孢木霉菌处理的黄瓜蛋白质质量分数分别是经粉红粘帚霉、枯草芽孢杆菌处理的1.48倍、2.38倍和1.64倍、2.64倍。4种生防菌对黄瓜蛋白质质量分数影响由大到小的顺序为:棘孢木霉菌,嗜麦芽寡养单胞菌,粉红粘帚霉,枯草芽孢杆菌(图6)。
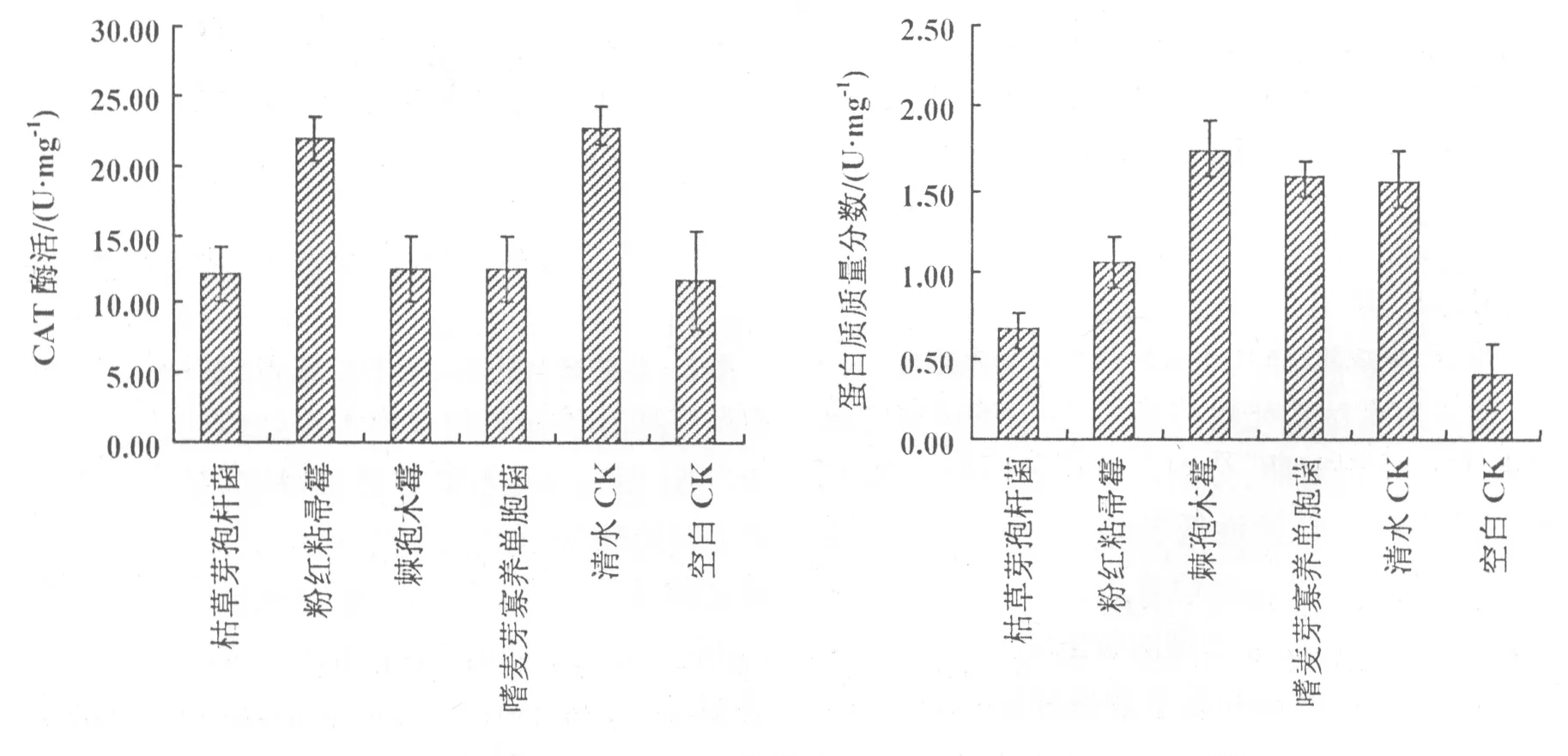
图5 生防菌对黄瓜叶片CAT活性的影响 图6 生防菌对黄瓜叶片蛋白质活性的影响
3 结论与讨论
本次研究测定了粉红粘帚霉、枯草芽孢杆菌、嗜麦芽寡养单胞菌和棘孢木霉等4种生防菌对黄瓜枯萎病的生防作用,并初步研究了4种生防菌对黄瓜体内不要防御酶活性的影响,其中以棘孢木霉对黄瓜枯萎病防效最高,达到70.24%,显著高于其他3种生防菌的防治效果。棘孢木霉防治黄瓜枯萎病后能够刺激黄瓜叶片内的POD,SOD,CAT酶的活性,但PAL酶活性呈现降低趋势。贺字典等[16]施用棘孢木霉56 d后对黄瓜枯萎病的防治效果为64.29%~76.81%。大量研究表明,棘孢木霉对真菌的防治主要是其重寄生、抗生及竞争作用[17],尤其对土传病原真菌具有显著的拮抗作用[18]。木质化是作物对镰刀菌的一个重要抗病反应,而这些抗病反应需要酶的催化才能实现,过氧化物酶(POD)和苯丙氨酸解氨酶(PAL)在细胞壁木质化过程中起着非常重要的作用。木质素的合成使细胞壁增厚,形成木质化的防御壁,从而抵御病原菌侵入。但不同的生防菌激发酶的种类可能不同,所以,就某一病害来说,今后明确病原菌侵染时植物体内各种酶的变化动态、机制及其相关性是进行抗性诱导研究的基础[19]。了解生防菌的防病机理,解决从实验室走向田间的复杂过程,将在今后持续农业发展中发挥重要的作用。
[1] 杨玉新,王纯立,谢志刚,等.微生物肥对土壤微生物种群数量的影响[J].新疆农业科学,2008,45(S1):169-171.
[2] 张树生.微生物有机肥缓解黄瓜枯萎病的生物学效应及其作用机制[D].南京:南京农业大学,2009.
[3] 李晶,杨谦,张淑梅,等.枯草芽孢杆菌B29菌株防治黄瓜枯萎病的田间效果及安全性评价初报[J].中国蔬菜,2009(2):30-33.
[4] Nobuyo Koike, Mitsuro Hyakumachi,Koji Kageyama,et al.Induction of systemic resistance in cucumber against several diseases by plant growthpromoting fungi lignifications and superoxide generation[J].European Journal of Plant Pathology, 2001,107(2):523-533.
[5] 潘彦彪,田永强,张阿强,等.5种精油和多抗霉素对黄瓜枯萎病原菌抑菌活性的研究[J].安徽农业科学,2015,43(15):117-120,158.
[6] 高玉亮,缪作清,孙漫红,等.延边地区抑制黄瓜枯萎病菌土壤放线菌的调查研究[J].延边大学农学学报,2015,37(4):321-325,339.
[7] 王伟,赵谦,杨微.木霉对土传病原尖孢镰刀菌的拮抗作用[J].中国生物防治,1997(1):46-47.
[8] 周魏,彭霞薇,李宝聚,等.绿色木霉菌糠发酵物对常见黄瓜土传病害的防治[J].广东农业科学.2012(14):78-81.
[9] 贺字典,高玉峰.生防菌在植物病害防治中的研究进展(综述)[J].河北职业技术师范学院学报,2003,17(2):56-59.
[10] 王晶.深绿木霉REMI突变菌株H6对黄瓜枯萎病的生物防治[D].保定:河北农业大学,2008.
[11] 李淼,产祝龙,檀根甲,等.木霉菌防治植物真菌病害研究进展[J].生物技术通讯,2009,20(2):286-290.
[12] 马峙英,刘叔倩,王省芬,等.过氧化物酶同工酶与棉花黄萎病抗性的相关研究[J].作物学报,2000,26(4):431-437.
[13] 林植芳,李双顺,林桂株,等.水稻叶片的衰老与超氧物歧化酶及脂质过氧化作用的关系[J].植物学报,1984,26(6):605-615.
[14] 王敬文,薛应龙.植物苯丙氨酸解氨酶研究 Ⅲ.玉米小斑病菌HelminthosporiummaydisT小种和大斑病菌Helminthosporiumturcicum毒素对苯丙氨酸解氨酶(PAL)的刺激作用[J].植物生理学报,1982,8(3):237-244.
[15] 潘汝谦,黄旭明,古希昕.活性氧清除酶类在黄瓜感染霜霉病过程中的活性变化[J].植物病理学报,1999,29(3):287-288.
[16] 贺字典,宋士清,高玉峰,等.棘孢木霉Trichoderma asperellum在土壤中定殖量的荧光定量PCR检测[J].植物保护学报,2016,43(4):552 -558.
[17] 魏岳荣,黄秉智,杨护,等.香蕉镰刀菌枯萎病研究进展[J].果树学报,2005,22(2):154-159.
[18] 游春平,刘任,肖爱萍,等.香蕉苗经生防菌处理后体内抗病性相关酶的变化[J].安徽农业科学,2008,36(9):3 524-3 525.
[19] 翟彩霞,马春红,秦君,等.植物诱导抗病性的常规鉴定——相关酶活性变化与诱导抗病性的关系[J].中国农学通报,2004,20(5):222-224.
(责任编辑:朱宝昌)
Efficacy of Biocontrol Agents to CucumberFusariumwiltand Their Induced Resistance
LI Shuqiang1, LI Linhui1, SHEN Jiangjie2, JING Huan3, ZHANG Mingzhu2, DU Xiaoduan2, LU Guoyan2
(1 Farm Career Development Center of Hebei Province, Shijiazhuang Hebei, 050021; 2 Hebei Normal University of Science & Technology; 3 Xiling Manchu Junior School of Yixian County; China)
Four biocontrol agents, includingBacillussubtilis,Gliocladiumroseum,TrichodemaasperellumandStenotrophomonasmaltophiliawere used to prevent from cucumberFusariumwilt, and the defense enzyme activities including PAL, SOD, CAT and POD in the cucumber leaves were studied in the paper. The results showed thatT.asperellumwas the best agent to cucumberFusariumwiltand the preventative efficacy could reach as high as 70.24%. POD activities in the cucumber leaves caused byB.subtilis,G.roseumandT.asperellumwere 1.26 times,1.11 times and 1.40 times as blank control, respectively. SOD activities activated byS.maltophiliaandT.asperellumwere 3.92 times and 2.66 times than that caused control. CAT activities were 1.04 times,1.88 times,1.07 times and 1.07 times as blank control. However, PAL activities incited by 4 biocontrol agents in the cucumber leaves were 43.01%, 69.11%, 33.81% and 34.70% as many as that of the control. Therefore, it was concluded that biocontrol agents could induce some defense enzyme activities in some degrees.
biocontrol agent; cucumberfusariumwilt; efficacy; defense enzyme activity
10.3969/J.ISSN.1672-7983.2017.01.011
河北省科技支撑农业关键共性技术攻关专项(项目编号:17226914D);秦皇岛市农业科学研究院项目(项目编号:2014-21);秦皇岛市科技支撑计划项目(项目编号:201402B028);2016年河北省大学生创新创业训练计划项目(项目编号:2016-11)。
2017-01-10
S436.421.1+3
A
1672-7983(2017)01-0053-06
李书强(1970-),男,硕士研究生。主要研究方向:植物病害生物防治。
