富氢盐水对高压电烧伤大鼠缺血再灌注损伤指标及炎性因子水平的影响
2017-06-01魏伟邵洪波张桂华李晰张庆
魏伟++邵洪波++张桂华++李晰++张庆富++冯建科
[摘要] 目的 探討富氢盐水对高压电烧伤大鼠缺血再灌注损伤指标、白细胞介素-8(IL-8)以及肿瘤坏死因子-α(TNF-α)水平的影响。 方法 选取SPF级雄性大鼠60只,采用随机数字表法分为四组,即使用生理盐水进行腹腔注射的高压电烧伤实验组、腹腔注射富氢盐水治疗高压电烧伤的治疗组、单纯腹腔注射生理盐且无高压电烧伤的空白对照组,以及腹腔注射罂粟碱治疗高压电烧伤的阳性对照组,每组15只。治疗后,检测血浆中6-酮-前列腺素F1α(6-Keto-PGF1α)、血栓素B2(TXB2)水平,并检测电烧伤组织黄嘌呤氧化酶(XOD)、丙二醛(MDA)、超氧化物歧化酶(SOD)、TNF-α及IL-8水平。 结果 治疗组大鼠血浆6-keto-PGF1α和TXB2水平显著高于空白对照组(P < 0.01),显著低于实验组和阳性对照组(P < 0.01)。治疗组大鼠组织SOD水平显著低于空白对照组(P < 0.01),显著高于实验组和阳性对照组(P < 0.01);治疗组大鼠组织XOD及MDA水平显著高于空白对照组(P < 0.01),显著低于实验组和阳性对照组(P < 0.01)。治疗组大鼠组织TNF-α及IL-8水平显著高于空白对照组(P < 0.01),显著低于实验组和阳性对照组(P < 0.01)。 结论 富氢盐水治疗高压电烧伤大鼠可有效保护受损区,最大限度地降低缺血再灌注损伤,且有效抑制细胞氧化应激,控制炎性因子表达可能是富氢盐水发挥生物学功能的主要机制。
[关键词] 富氢盐水;高压电烧伤大鼠;缺血再灌注损伤;白细胞介素-8;肿瘤坏死因子-α
[中图分类号] R-332 [文献标识码] A [文章编号] 1673-7210(2017)04(a)-0022-05
[Abstract] Objective To investigate influence of hydrogen rich saline on ischemia reperfusion injury indexes, IL-8, TNF-α levels in high voltage burn rats. Methods 60 male SPF rats were selected and divided into four groups by random number table method. There were intraperitoneal injection of saline as high-voltage burn experimental group, intraperitoneal injection of hydrogen rich saline as high voltage burn treatment group, injection of physiological saline without high voltage burn as blank control group, intraperitoneal injection of papaverine with high-voltage burn as positive control group. Each group had 15 rats. After treatment, plasma 6-Keto-PGF1α, TXB2 levels were detected. XOD, MDA, SOD, TNF-α and IL-8 levels of high voltage burn tissues were detected. Results Plasma 6-Keto-PGF1α, TXB2 levels in treatment group were significantly higher than those in blank control group (P < 0.01), which were significantly lower than those in experimental group and positive control group (P < 0.01). SOD level in treatment group was significantly lower than that in blank control group (P < 0.01), which were significantly higher than that in experimental group and positive control group (P < 0.01). XOD, MDA levels in treatment group were significantly higher than those in blank control group (P < 0.01), which were significantly lower than those in experimental group and positive control group (P < 0.01). TNF-α, IL-8 levels in treatment group were significantly higher than those in blank control group (P < 0.01), which were significantly lower than those in experimental group and positive control group (P < 0.01). Conclusion Hydrogen rich saline in the treatment of high voltage burn rats can effectively protect the damaged area and maximum degree of reduction ischemia reperfusion injury, which can also effective inhibition of cellular oxidative stress and control of inflammatory factor expression. Which may be the main mechanism of hydrogen rich saline.
[Key words] Rich hydrogen saline; High voltage burn rats; Ischemia reperfusion injury; IL-8; TNF-α
一般情况下,将流通过人体诱发的电接触烧伤、电弧烧伤以及闪电烧伤等统称为电烧伤,其中临床中最为常见的为电接触烧伤。电烧伤与传统意义上的烧伤存在明显的临床特征,常可在患者创口发现明显的诱发烧伤的电流出入口[1-2]。一般情况下,在患者电烧伤创面可见较为明显的平滑肌纤维变性坏死和小动脉中层弹力纤维断裂等病理性变化,造成炎性细胞在受损血管处大量聚集,改变微环境,甚至造成患者形成血栓[3-4]。有研究证实,在电烧伤患者患处其如细胞黏附分子、一氧化氮(NO)、内皮素(ET)、肿瘤坏死因子-α(TNF-α)等炎性因子等情况出现明显异常,导致血管进一步损伤,并可能诱发患处微循环障碍,造成组织缺氧缺血[5-7]。富氢盐水是在经脱气、低温、注入及加压处理后所制备的一类具有广泛生物活性的物质,Cai等[8]研究发现,富氢盐水可以预防并治疗由脑缺血诱发的脏器和组织功能障碍。但在使用富氢盐水对高压电烧伤进行治疗的作用机制仍有诸多空白。本文旨在探讨富氢盐水对高压电烧伤大鼠治疗后其缺血再灌注损伤指标、IL-8以及TNF-α的水平,为进一步的深入研究提供依据。
1 资料与方法
1.1 动物、仪器与试药
使用的60只SPF级体重为(220±34)g的雄性大鼠,均购买自河北医科大学实验动物中心,合格证号为DK103144,该研究经实验动物伦理委员会批准,全部大鼠均在室温24~26℃环境中进行培养。将全部大鼠依照随机数字表法分为四组,即高压电烧伤实验组(腹腔注射生理盐水,实验组)、高压电烧伤富氢盐水治疗组(腹腔注射富氢盐水,治疗组)、假高压电烧伤组(单纯腹腔注射生理盐水且不通电,空白对照组)和高压电烧伤罂粟碱治疗组(腹腔注射罂粟碱溶液,阳性对照组),每组15只。研究中使用的6-酮-前列腺素F1α(6-Keto-PGF1α)及血栓素B2(TXB2)均購买自南京生工生物有限公司,大鼠TNF-α及白细胞介素-8(IL-8)均购买自南京福麦斯生物技术有限公司。TC-30-20KVA型调压器、TDJ-10KVA型变压器均购买自得福电气有限公司,PG270A型电流表购买自申华仪表有限公司。
1.2 造模方法
实验组、治疗组及阳性对照组全部45只大鼠均采用如下方法进行高压电烧伤造模:用生理盐水稀释戊巴比妥钠粉剂和己酮可可碱粉剂,制作成1%注射液,备用,用75%乙醇擦拭大鼠腹部正中皮肤,用5 mL注射器吸取配置好的1%注射液,按照40 mg/kg给予大鼠腹腔注射,观察大鼠的麻醉程度,待大鼠完全麻醉后,用手术剪刀去除大鼠左上肢、右下肢和胸腹部的被毛,用电动剃须刀将残余被毛剃除,将准备好的大鼠固定于绝缘台面上,将2个1 cm ×1 cm电极铜片分别置于大鼠左上肢、右下肢的备皮区,将室内温度控制在20℃左右,适度控制在40%RH,穿戴好绝缘防护服后,确定高压电路连接无误,给予大鼠电击,电流入口与电流出口分别作为造模时的电流入口及出口,选择2 kV电压作为造模时的电击电压,(1.80±0.20)A作为造模的电击电流强度,通电时间3 s。造模过程中,大鼠电流出入口创伤面积为1 cm2。
造模成功条件如下:电击即刻,可见大鼠全身肌肉明显痉挛,关闭电路并接触电极后,可见电极固定区域毛皮和肌肉发生碳化为黑色,有灼焦气味,部分大鼠创口深度可达骨骼处,且部分大鼠甚至出现肢体脱落或断裂等,对少数心跳骤停大鼠立即开展心脏外按压复苏,以确保高压电烧伤大鼠造模成功。
1.3 方法
在0.4 MPa大气压下将氢气通入250 mL的袋装生理盐水中,在通入氢气4 h后达到过饱和状态,7 d后,抽出袋中气体后再次以相同条件下通入氢气以制备富氢盐水,并使用气相色谱法检测结果显示,富氢盐水浓度为0.6 mmol/L。
本研究中所有大鼠依照分组不同采用不用的干预方式。实验组:该组大鼠在造模成功后腹腔注射4 mL生理盐水,作为模型对照组即实验组。治疗组:该组大鼠在造模成功后依照Parkland公式进行换算,依照4 mL/kg剂量使用富氢盐水对大鼠进行腹腔注射。阳性对照组:该组大鼠在造模成功后依照3.18 mg/kg的剂量使用4 mL生理盐水溶解并进行腹腔注射。空白对照组:该组大鼠不进行造模,且仅腹腔注射4 mL生理盐水进行干预。
1.4 检测指标
在治疗1周后,去眼球取血,对血浆中的6-Keto-PGF1α、TXB2水平进行测定,由于两者性质较不稳定,因而采用放射免疫分析法对两项指标进行检测,严格参照试剂盒说明书进行操作检测,并由计算机系统自动处理结果。大鼠电烧伤组织的黄嘌呤氧化酶(XOD)、丙二醛(MDA)及超氧化物歧化酶(SOD)三项指标严格参照试剂盒说明书进行检测,测量吸光度并计算缺血再灌注组织的XOD、MDA及SOD活力。使用双抗夹心法(ABC-ELISA)检测组织中TNF-α及IL-8水平,其具体操作过程严格依照试剂盒说明书进行操作。
1.5 统计学方法
采用SPSS 19.0软件包对数据进行统计分析,以M(P25,P75)表示,采用秩和检验,以P < 0.05为差异有统计学意义。
2 结果
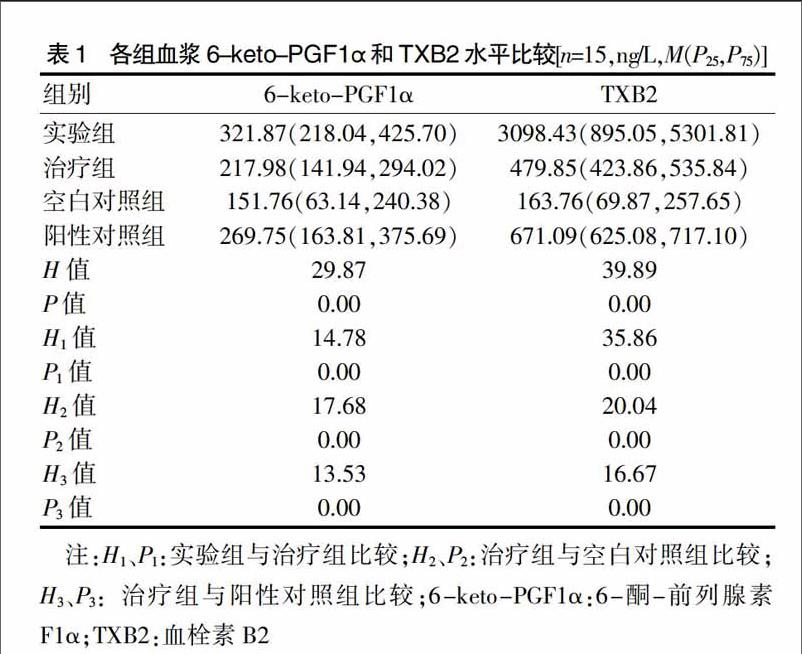
2.1 各组大鼠血浆6-keto-PGF1α和TXB2水平比较
四组大鼠血浆6-keto-PGF1α和TXB2水平比较,差异有高度统计学意义(P < 0.01);治疗组大鼠血浆6-keto-PGF1α和TXB2水平显著高于空白对照组(P < 0.01),显著低于实验组和阳性对照组(P < 0.01)。见表1。
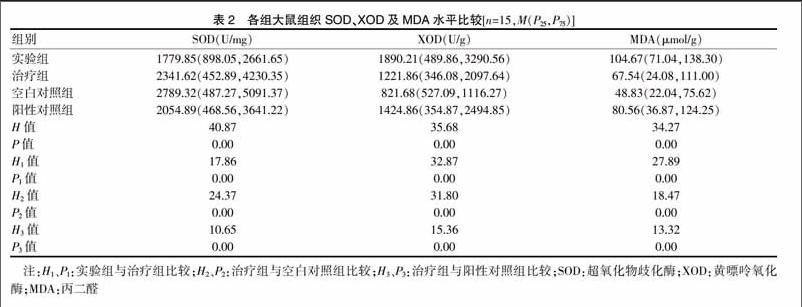
2.2 各组大鼠组织SOD、XOD及MDA水平比较
四组大鼠组织SOD、XOD及MDA水平比较,差异有高度统计学意义(P < 0.01);治疗组大鼠组织SOD水平显著低于空白对照组(P < 0.01),显著高于实验组和阳性对照组(P < 0.01);治疗组大鼠组织XOD及MDA水平显著高于空白对照组(P < 0.01),显著低于实验组和阳性对照组(P < 0.01)。见表2。
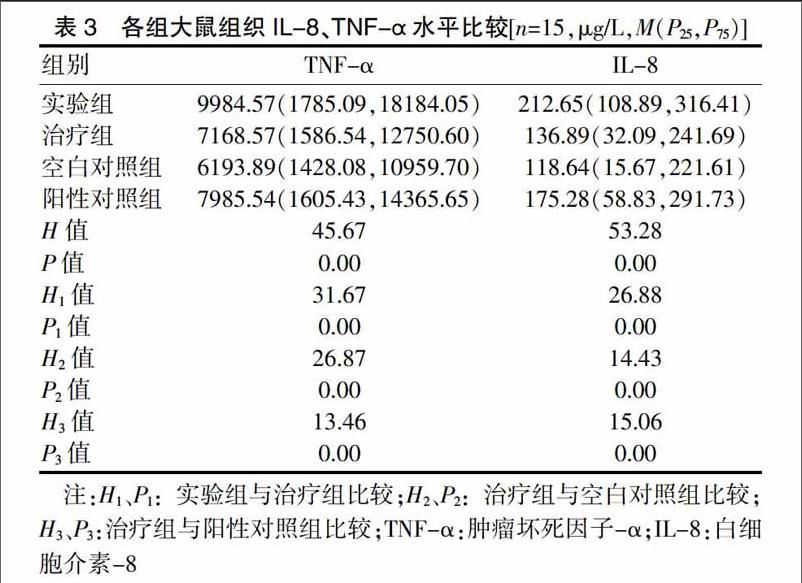
2.3 各组大鼠组织TNF-α及IL-8水平比较
四组大鼠组织TNF-α及IL-8水平比较,差异有高度统计学意义(P < 0.01);治疗组大鼠组织TNF-α及IL-8水平显著高于空白对照组(P < 0.01),显著低于实验组和阳性对照组(P < 0.01)。见表3。
3 讨论
当患者皮肤经电流通过后,由于物理学特性电流沿电阻最小路线运行,对患者的神经、血管、心脏、晶状体和肌肉等产生直接损害,此外电流可以迅速地通过血管,故对血管造成极其明显的损伤,特别是分散在身体各处的小动脉[9]。当电流通过血管时,造成患者血管内皮细胞受到严重损伤,甚至出现脱落和变性坏死。有研究发现,微循环障碍时高压电烧伤早期的主要临床症状,随着时间的延长患者出血以及微栓等数目明显增多[10-11]。现阶段电流损害机体的具体机制仍有诸多待解之谜,而微循环障碍时临床工作中公认的病理性变化,因而针对微循环障碍进行有效干预和治疗在高压电烧伤的临床实践中具有重要意义。本研究也证实高压电烧伤大鼠血清中TXB2和6-keto-PGF1α及组织中MDA、SOD、XOD、IL-8、TNF-α水平较正常大鼠均存在显著性差异,因而其电烧伤患处微环境出现明显变化[12]。
有研究指出,在血小板活化的生理过程中氧自由基扮演着重要的作用,其可大量生产TXA2并造成前列腺素I2(PGI2)的大量生产与释放,起到抑制血小板聚集和扩血管的生理学作用[13]。TXA2是一类主要由血小板合成并释放的一类强血管收缩物,还可以造成血小板聚集。在正常情况下,TXA2与PGI2处于动态平衡中,因而临床中常依据两者的比例分析患者血小板受损及活化程度[14]。本研究发现,使用富氢盐水对高压电烧伤大鼠进行干预治疗后,大鼠的TXB2(TXA2代谢产物)和6-keto-PGF1α(PGI2代谢产物)指标出现显著性改善,且其改善程度明显优于罂粟碱,但仍无法完全达到正常水平,这可能与治疗时间不足有关。分析认为,富氢盐水可以有效纠正血液中TXA2/PGI2的代谢失衡,并达到减轻细胞受损和降低炎性反应的目的,最大限度地起到维持细胞完整超微结构的目的。
SOD是机体内一类典型的具有清除自由基活性的酶,其在维持机体微环境平衡过程中起到十分重要的作用,其能够有效地将超氧阴离子清除以达到保护细胞的目的[15]。XOD是经典的脱氢酶类,其在自由基的产生过程中起十分重要的作用,而MDA则是可以有效直接反映脂质过氧化和间接反映组织受损程度的生物标志物[16-18]。本研究发现,在富氢盐水干预治疗后,高压电烧伤大鼠组织中SOD明显高于模型组和罂粟碱组,XOD和MDA水平明显低于模型组和罂粟碱组,但较正常大鼠组织中SOD水平仍偏低,XOD和MDA水平仍偏高。研究结果也反映,富氢盐水可以有效提高机体氧自由基的清除能力,显著降低炎性反应和脂质过氧化程度。有学者在对兔的肺部缺血再灌注模型进行研究时发现,富氢盐水可以有效降低MDA和MPO水平,并提高肺部组织的SOD水平,与本研究结果相似[19]。
IL-8是现阶段公认的一类中性粒细胞趋化因子,其在中性粒细胞的黏附、迁移和浸润等生理变化过程中起到重要作用[20]。单核巨噬细胞合成并分泌的TNF-α是典型的前炎性因子,其以血管内皮细胞作为其主要的靶点[21]。IL-8和TNF-α可以使血管内皮细胞出现功能异常,导致血管通透性、张力等失控,导致血栓生成。通过研究发现,富氢盐水治疗后,高压电烧伤大鼠组织中IL-8和TNF-α水平较模型组和罂粟碱组显著性降低,但与正常大鼠仍存在一定差别,其可能与治疗时间短有关,若延长治疗时间有可能恢复至正常水平。其可以表明富氢盐水治疗后,损伤区的炎性反应明显改善,已达到改善微环境并最终实现的治疗目的。此外,Zheng等[22]在对肠缺血再灌注损伤模型进行研究时发现,使用富氢盐水干预后患处的IL-6、IL-1β、TNF-α、MDA以及MPO均显著性降低,与本研究结果类似。
综上所述,在使用富氢盐水对高压电烧伤大鼠进行治疗后,可有效起到保护受损区,最大限度地降低缺血再灌注损伤,且有效地抑制细胞氧化应激,控制炎性因子表达可能是富氢盐水发挥生物学功能的主要机制,因而认为,富氢盐水可用于高压电烧伤患者的临床治疗,可能发挥良好的治疗效果。但此次研究也存在一定弊端,样本量较少,仍需要进一步扩大再研究。同时富氢盐水是否具有良好的安全性,是否会引发明显的不良反应,而影响到治疗效果,也是此次研究的继续。此次研究采用了腹腔注射是否为最佳的用药方案,也仍有待进一步探讨研究。
[参考文献]
[1] 栾夏刚,陈斓,柯玲玲,等.封闭负压创面治疗对猪肢体高压电烧伤炎性反应及创面血管化的影响[J].中华实验外科杂志,2015,32(2):277-280.
[2] 吴宏志,李晓,杨蒙,等.自体富血小板血浆凝胶对中老年电烧伤患者创面愈合的影响[J].中国老年学杂志,2015, 35(5):1182-1184.
[3] 张伟,谢卫国,闵维雄,等.胸腹腔开放性高压电烧伤并发过敏紫癜性肾炎的救治[J].中华烧伤杂志,2013,29(5):454-458.
[4] 刘泽世,呼瑞,刘二军,等.高压电烧伤对SD大鼠血栓调节蛋白、蛋白C、蛋白S及D二聚体的早期影响[J].实用医学杂志,2016,32(1):37-40.
[5] 刘德贵,王晓娟,杨勇,等.富氢盐水对重度燙伤延迟复苏大鼠肝脏的作用[J].中华烧伤杂志,2014,30(6):506-511.
[6] 高优,方勇,李晓光,等.富氢盐水对严重烫伤延迟复苏大鼠肠道损伤的影响[J].蚌埠医学院学报,2013,38(10):1241-1245.
[7] 蒋南红,谢卫国,王晖,等.低分子量肝素对电烧伤大鼠血管损伤与炎症反应的影响[J].中华烧伤杂志,2014,30(2):128-133.
[8] Cai J,Kang Z,Liu K,et al. Neuroprotective effects of hydrogen saline in neonatal hypoxia-ischemia rat model [J]. Brain Res,2009,1256:129-137.
[9] 劉俊玲,薛晓东,杨国虎,等.颈项、肩部高压电烧伤创面修复[J].中华创伤杂志,2013,29(8):780-781.
[10] 蔡建华,申传安,庹晓晔,等.电烧伤致腹膜后穿孔合并消化道大出血一例[J].中华烧伤杂志,2015,31(2):105-106.
[11] 蒋南红,谢卫国,王晖,等.低分子肝素对电烧伤大鼠组织血管内皮生长因子与血小板内皮细胞黏附分子表达的影响[J].中华损伤与修复杂志:电子版,2012,7(3):255-259.
[12] 张庆富,刘鹏,周慧敏,等.高压电烧伤大鼠血清内皮素1与一氧化氮变化及乌司他丁的干预作用[J].中华烧伤杂志,2012,28(3):190-192.
[13] 张庆富,周慧敏,王车江,等.高压电烧伤对兔心脏微循环的影响[J].中华烧伤杂志,2012,28(3):173-177.
[14] 文大江,陈永新,潘文东,等.负压封闭引流结合植皮治疗腹壁电烧伤合并肠穿孔一例[J].中华烧伤杂志,2014, 30(3):286-287.
[15] 张庆富,周慧敏,王车江,等.经颅高压电烧伤对大鼠肠系膜微血管白细胞流变行为的影响及乌司他丁干预作用[J].中华烧伤杂志,2011,27(5):375-380.
[16] 黄闻,李伟人,袁媛,等.重度电烧伤致肺外露的救治[J].中华医学杂志,2013,93(4):305-307.
[17] 陈旭,覃凤均,陈忠,等.颅骨全层高压电烧伤并脑挫裂伤及颅内感染的治疗[J].中华烧伤杂志,2012,28(2):116-118.
[18] 王车江,张庆富,吴泳泽,等.高压电烧伤大鼠坐骨神经微循环灌流量变化及己酮可可碱的干预作用[J].河北医科大学学报,2013,34(9):1023-1026.
[19] Li H,Zhou R,Liu J,et al. Hydrogen-rich saline attenuates lung ischemia-reperfusion injury in rabbits [J]. J Surg Res,2012,174(1):e11-e16.
[20] 吴有森,鲍海华,孙艳秋,等.CT血管成像在四肢高压电击伤中的应用[J].实用放射学杂志,2012,28(10):1595-1598.
[21] 沈余明,胡骁骅,宓惠茹,等.四肢高压电烧伤创面的早期处理[J].中华烧伤杂志,2011,27(3):173-177.
[22] Zheng X,Mao Y,Cai J et al. Hydrogen-rich saline protects against intestinal ischemia/reperfusion injury in rats [J]. Free Radic Res,2009,43(5):478-484.
(收稿日期:2016-12-19 本文编辑:李亚聪)
