磷脂组学二维检测平台的建立及其在血清中的应用研究
2017-06-01李丽,薛芸,王彦,闫超
李 丽,薛 芸,王 彦,闫 超
(上海交通大学药学院,上海 200240)
磷脂组学二维检测平台的建立及其在血清中的应用研究
李 丽,薛 芸,王 彦*,闫 超*
(上海交通大学药学院,上海 200240)
采用离线亲水/反相二维液相色谱-质谱联用(HILIC-RPLC-MS)技术分析血清中的磷脂。以HILIC柱为第一维色谱柱,乙酸铵缓冲液和乙腈为流动相;以C18柱为第二维色谱柱,甲酸铵缓冲液和甲醇为流动相;质谱采用电喷雾离子源,正、负离子扫描。结果表明,搭建的二维液相色谱的峰容量高于一维色谱,尤其是低丰度磷脂的分离效率得到明显提高。该方法减少了共流出峰,降低了电离抑制,可作为血清等生物复杂体系分离分析的有效手段,为磷脂代谢组学的研究奠定了基础。
磷脂;二维液相色谱-质谱联用;亲水作用色谱;代谢组学
磷脂(phospholipids,PLs)指结构中含有磷酸根的一大类脂质,由亲水的含磷酸基团的极性头基和疏水的含两条长脂肪酸链的非极性尾部组成。磷脂是细胞膜的主要组成成分,参与细胞信号转导、膜固定及底物转运等多种代谢活动[1-2]。研究表明,磷脂在很多疾病如恶性肿瘤[3-4]、阿尔兹海默症[5-6]和肥胖[7]等的发生发展中有着重要作用,可作为潜在生物标记物。磷脂可分为甘油磷脂和鞘磷脂两大类,其中甘油磷脂根据极性头基的不同,又可以分为磷脂酰胆碱(PC)、磷脂酰丝氨酸(PS)、磷脂酰乙醇胺 (PE )、磷脂酰甘油(PG)、甘油磷脂酸(PA)和磷脂酰肌醇(PI)等6大类[8]。
由于磷脂种类多且繁杂,给磷脂的分析增加了很大的难度。在以往的报道中,磷脂化合物的分离鉴定多采用液相色谱-质谱联用(LC-MS)技术。LC-MS主要分为正相色谱-质谱联用(NPLC-MS)、反相色谱-质谱联用(RPLC-MS)、亲水作用色谱-质谱联用(HILIC-MS)。NPLC可以实现磷脂化合物按极性头基的不同进行分离,但其需要较长的平衡时间。相比NPLC,HILIC兼顾了NPLC优点的同时还具有流动相简单、分离效率高、与质谱兼容性好等优势,尤为适合于极性化合物的分离。但是HILIC因其与NPLC机理的相似性,同样无法完成同一大类磷脂的组内分离[9]。在磷脂组学中,最常用的分析技术是RPLC。RPLC是根据磷脂化合物酰基链长度的不同导致的疏水性差异进行分离,但是不同种类的磷脂色谱峰重叠现象仍较为严重,容易在质谱中导致离子抑制,对低丰度磷脂定量可能会造成一定的影响。
鉴于磷脂是种类繁多的复杂体系,一维LC-MS分析方法已不能满足磷脂组学的需求。因此为了更大程度地实现对复杂组分的分析,人们越来越关注多维分离技术。多维液相色谱是将分离机理不同而又相互独立的两支或多支色谱柱串联起来构成的分离系统[10],它可以提高系统分离度,最大限度地减少色谱峰的重叠,有效改善低丰度组分被高丰度组分掩蔽的情况,提高脂类分子鉴定的准确性和信息量,已被应用于多种样品的脂类组学研究中。常见的二维脂类分析平台的连接多采用在线[11-13]或离线[14-15]方式,分离模式多采用NPLC-RPLC的二维组合[11-14],但由于NPLC所用的流动相与RPLC通常不兼容,需要去除溶剂等繁琐步骤,操作较麻烦。
HILIC与RPLC兼容性良好,配合多种质谱,如飞行时间质谱(TOF-MS)、离子阱质谱(IT-MS)或三重四级杆质谱(QqQ-MS)等构建的二维分离鉴定平台具有更好的系统相容性。作者建立了亲水/反相二维液相色谱-质谱联用(HILIC-RPLC-MS)的磷脂组学二维检测平台,同时实现不同类别磷脂化合物的分离和同类别中不同化合物的分离,并将其用于正常人血清中的磷脂分析,以期提供更为全面的磷脂信息,为找到与疾病相关的生物标记物或代谢规律奠定良好的基础。
1 实验
1.1 试剂与仪器
乙酸铵、甲酸铵、氯仿、异丙醇,色谱纯,德国CNW公司;甲醇、乙腈,质谱纯,德国Merck公司;磷脂标准品,磷脂酰胆碱:PC 14:0-14:0、PC 16:0-16:0、PC 16:0-18:1、PC 16:0-20:4、PC 18:0-18:0、PC 18:0-18:1、PC 18:0-22:6、PC 20:0-20:0、PC 17:0-17:0;溶血磷脂酰胆碱:LPC 16:0、LPC 18:1、LPC 18:0、LPC 17:0;甘油磷脂酸:PA 16:0-16:0、PA 16:0-18:1、PA 17:0-17:0;溶血甘油磷脂酸:LPA 16:0、LPA 17:0;磷脂酰丝氨酸:PS 16:0-16:0、PS 18:0-18:1、PS 17:0-17:0;溶血磷脂酰丝氨酸:LPS 18:0、LPS 17:1;磷脂酰肌醇:PI 16:0-16:0、PI 18:0-18:0、PI 16:0-18:1、PI 18:0-20:4;溶血磷脂酰肌醇:LPI 18:0、LPI 17:1;磷脂酰甘油:PG 14:0-14:0、PG 16:0-18:1、PG 15:0-15:0、PG 18:0-18:0;磷脂酰乙醇胺:PE 14:0-14:0、PE 16:0-16:0、PE 18:0-18:0、PE 17:0-17:0;溶血磷脂酰乙醇胺:LPE 16:0、LPE 18:0、LPE 17:1,美国Avanti Polar Lipids公司;正常人混合血清(Human Serum AB (Off the Clot),Gemini,Lot#:H04Q00F)。
Shimadzu LC-20AB型高效液相色谱仪,日本岛津公司;UM5000型蒸发光散射检测器,上海通微分析技术有限公司;超高效液相色谱-三重四级杆质谱系统(ACQUITYTMUPLC,美国Waters;SCIEX Triple QuadTM5500,美国AB SCIEX);Sartorius BT224S型电子天平,北京赛多利斯仪器系统有限公司;KQ5200DE型超声波清洗器,昆山超声仪器有限公司;XW-80A型涡旋混合器,上海青浦沪西仪器厂;Molcell 1805V型摩尔细胞型纯水机,重庆摩尔水处理设备有限公司。
1.2 血清样品的前处理
异丙醇法:取100μL血清加入到400μL 4 ℃预冷的异丙醇(IPA)溶液中,涡旋,4 ℃静置10 min后,低温高速(12 000 r·min-1)离心15 min。小心取出所有上清液并转移至新管中,氮气吹干后加入100μL初始流动相复溶,低温高速离心15 min,取上清液,待测。
优化的BD(Bligh and Dyer)法:取100μL血清,加入1 mL甲醇,超声30 s,再加入1 mL氯仿,超声30 s。加入500μL 18%NaCl溶液,涡旋,静置1 h。加入300μL 18%NaCl溶液和1 mL氯仿,涡旋后低温离心(3 500 r·min-1)10 min。小心将下层氯仿层转移至新管中,氮气吹干后加入100 μL初始流动相复溶,待测。
1.3 标准品溶液的配制
第一维HILIC磷脂混合标准品:配制成浓度范围在0.1~1.0μg·μL-1的磷脂混合储备溶液(PC 16:0-16:0,0.5μg·μL-1;PE 16:0-16:0,0.1μg·μL-1;PA 16:0-16:0,1μg·μL-1;PG 15:0-15:0,0.25μg·μL-1;PS 16:0-16:0,0.25μg·μL-1;LPC 16:0,1μg·μL-1),临用前稀释后进样。
第二维C18磷脂混合标准品:配制成浓度范围在0.01~1.00μg·mL-1的磷脂混合储备溶液(PC,0.01μg·mL-1;PE,0.2μg·mL-1;LPC,0.02μg·mL-1;LPE,1μg·mL-1;PA,0.25μg·mL-1;PG,0.375μg·mL-1;PS,1μg·mL-1;PI,0.1μg·mL-1;LPA,0.25μg·mL-1;LPS,1μg·mL-1;LPI,1μg·mL-1),临用前稀释后进样。
1.4 分离检测条件
第一维HILIC色谱条件:Halo HILIC色谱柱(150 mm×4.6 mm,5μm,美国AMT公司);柱温为室温;进样量10μL;流速1 mL·min-1;流动相 A:含15 mmol·L-1乙酸铵的乙腈-水(50∶50,体积比,下同)溶液,流动相B:含15 mmol·L-1乙酸铵的乙腈-水(95∶5)溶液,梯度洗脱:0~4 min,93%~88%B;4~16 min,88%~86%B;16~18 min,86%~74%B;18~19 min,74%~93%B。蒸发光散射检测器(ELSD)参数:蒸发管温度35 ℃;雾化气体空气;气体流速2.5 L·min-1;载气压力3.22 bar。
第二维C18色谱条件:UPLC BEH Shield RP C18色谱柱(100 mm×2.1 mm,1.7μm,美国Waters公司);柱温55 ℃;自动进样器温度4 ℃;进样量10μL;流速0.4 mL·min-1;流动相A:含20 mmol·L-1甲酸铵的甲醇-水(5∶95)溶液,流动相B:纯甲醇溶液,梯度洗脱:0.1~0.5 min,50%B;0.5~2.0 min,50%~65%B;2.0~10.5 min,65%~100%B;10.5~13.5 min,100%B;13.5~13.6 min,100%~50%B。
第二维质谱条件:离子源为电喷雾离子源(ESI),扫描方式为正、负离子扫描;检测方式为多反应监测(MRM);ESI离子源参数:正离子模式,气帘气压力(curtain gas,CUR)、雾化气压力(ion source gas1)和辅助气压力(ion source gas2)分别为20 psi、50 psi、50 psi,电子源电压(ion spray voltage)为5.5 kV,离子源温度为500 ℃;负离子模式,气帘气压力、雾化气压力和辅助气压力分别为15 psi、50 psi、50 psi,电子源电压为-4.5 kV,离子源温度为500 ℃。
1.5 二维系统构建
二维平台操作步骤:样品先进行第一维HILIC色谱分离,从进样开始按照色谱峰进行分段收集,重复进样5次并收集流分,将相同时间段内的流分合并,氮气吹干后加入100μL初始流动相复溶,涡旋混匀后进样至第二维RPLC-MS体系进行分析。对于含PC、LPC、PE和LPE的流分,需稀释5倍进行分析。
2 结果与讨论
2.1 血清样品前处理优化
为了从血浆中获取更为全面的磷脂信息,选择合适的前处理方法,尤其是提取溶剂对提高分析方法的性能具有重要意义。目前常用的磷脂提取方法包括液液萃取、蛋白沉淀法及固相萃取法。其中Zhu等[16]采用异丙醇代替甲醇沉淀蛋白[17],操作简单快速,对极性较低的磷脂,尤其是低丰度磷脂有很好的回收率。另据报道,高盐水溶液的加入有助于改善经典BD法对酸性磷脂的提取效率,尤其是LPA、PS等[14]。
分别采用优化的BD法(加入高盐水溶液)和异丙醇法提取磷脂,并进行对比,结果如图1所示。
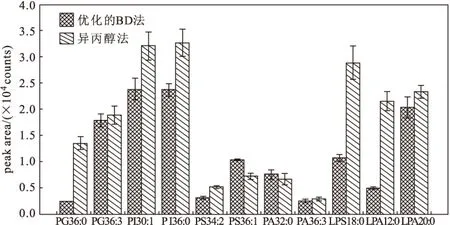
图1 优化的BD法和异丙醇法对11种磷脂提取效率的比较Fig.1 Comparison of extraction efficiencies of eleven phospholipids by modified BD method and isopropyl alcohol method
由图1可知,异丙醇法除了对部分酸性磷脂PS、PA的提取效果稍差之外,对大部分低丰度磷脂的提取效果均优于优化的BD法,因此选择操作简单、提取效率高的异丙醇法处理血清样品。
2.2 第一维HILIC色谱条件优化
HILIC分离磷脂的机理是根据磷脂极性头基的不同,将磷脂按PG、PC、PE等类别进行分离[16]。实验中首先比较了流动相中有机相改变对磷脂分离的影响,发现当有机相浓度增大时,极性化合物保留时间延长,符合HILIC的保留机理。
第一维HILIC色谱初始条件:流动相A为含10 mmol·L-1乙酸铵的乙腈-水(50∶50)溶液;流动相B为含10 mmol·L-1乙酸铵的乙腈-水(95∶5)溶液;梯度洗脱:0~4 min,93%~88%B;4~16 min,88%~80%B;16~18 min,80%~70%B;18~19 min,70%~93%B;流速为1 mL·min-1。
考察了流动相pH值对磷脂分离的影响,如图2所示。
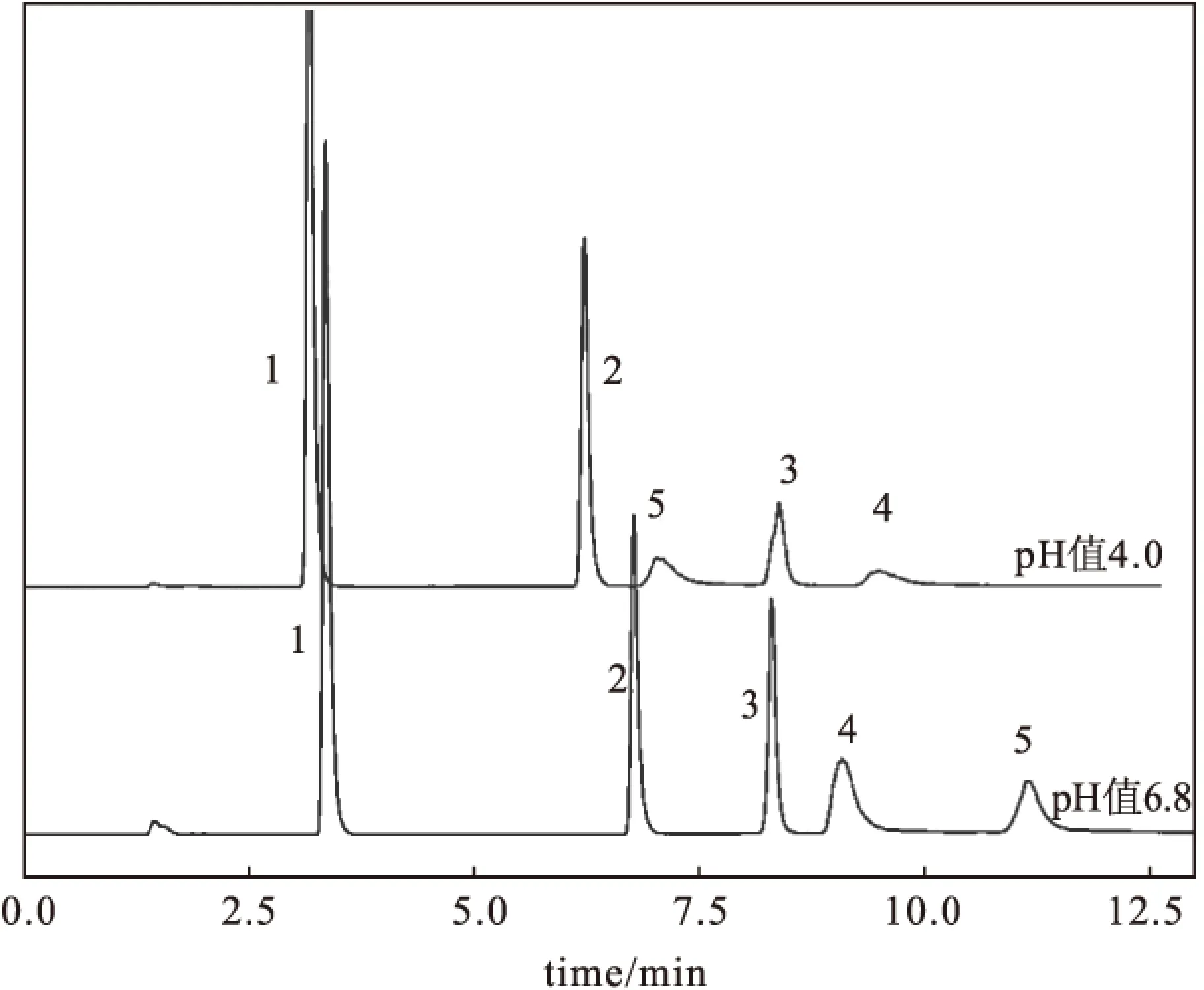
1~5:PG15:0-15:0,PE16:0-16:0,PC16:0-16:0,PS16:0-16:0,PA16:0-16:0,下同
由图2可知,当pH值为4.0时,PA(峰5)的保留时间缩短,与PE(峰2)邻近。考虑到实际血清中PE含量一般较高,会影响PA色谱峰的收集,故选择后续流动相的pH值为6.8。
考察了不同浓度的乙酸铵缓冲液对磷脂分离的影响,如图3所示。
由图3可知,随着缓冲液浓度的增大,PG(峰1)、PE(峰2)的保留时间未发生明显变化,PC(峰3)保留时间缩短,PS(峰4)保留时间略有延长,且峰形及分离度明显改善。故选择15 mmol·L-1乙酸铵缓冲液。
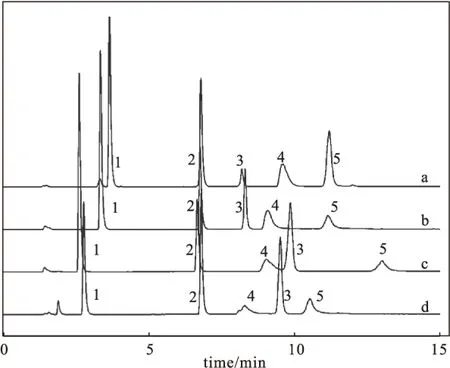
a~d,乙酸铵缓冲液浓度(mmol·L-1):15,10,8,5
确定第一维HILIC色谱条件后,通过梯度洗脱实现血清脂类提取物中磷脂化合物的组间分离,实际共分离得到21个峰,如图4所示。
根据图4分离情况,将血清脂类提取物在HILIC中分7段进行收集:F1(2.0~4.5 min)含PG;F2(4.5~7.5 min)含PI、PE;F3(7.5~9.0 min)含PC、LPE及少量PS;F4(9.0~12.0 min)含PS;F5(12.0~15.0 min)含PA;F6(15.0~18.5 min)含LPC;F7(18.5~24.0 min)含LPI、LPS、LPA等。
2.3 第二维RPLC-MS条件优化
在本研究中,第二维分离模式拟选用RPLC-MS平台。RPLC与第一维HILIC之间有很好的正交性,且它可依据磷脂尾部的长链脂肪酸对同一类磷脂中不同的磷脂化合物进行分离,MS将提供很好的定性和定量信息。
2.3.1 质谱参数优化
不同类的磷脂在正、负离子扫描模式下的裂解规律和响应不同。为建立MRM(multiple reaction monitoring)分析方法,实验首先确定了40种磷脂标准品在ESI+和ESI-模式下MRM分析离子对,并对离子源和化合物的质谱参数如反簇电压(DP)、碰撞电压(CE)进行一系列优化,以达到最高的灵敏度用于后续样品的检测。不同模式下的磷脂标准品的MRM离子对信息及其它参数见表1。
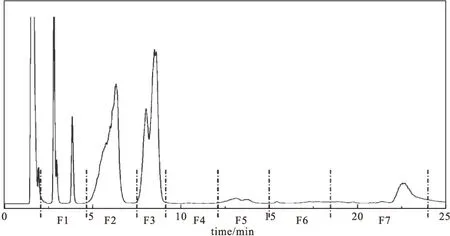
图4 血清脂类提取物的第一维HILIC分离色谱图Fig.4 Chromatogram of phospholipid extracts in serum by 1D HILIC-HPLC method
2.3.2 RPLC-MS液质分离
磷脂混合标准品在RPLC-MS正、负离子扫描模式下的分离图谱如图5所示。

图5 正、负离子扫描模式下磷脂混合标准品在RPLC-MS上的分离图谱Fig.5 Chromatograms of mixture phospholipid standards by RPLC-MS under ESI+mode and ESI- mode
由图5可知,ESI+模式下的磷脂标准品响应普遍要比ESI-模式下高2个数量级。而考虑到在血清提取样品中,高丰度磷脂PC在ESI+模式下更容易受同分异构体的干扰,ESI-模式下色谱峰更为纯净。因此低丰度磷脂的检测选择ESI+模式,高丰度磷脂选择ESI-模式。
表1 ESI+和ESI-模式下优化后磷脂MRM离子对信息及参数
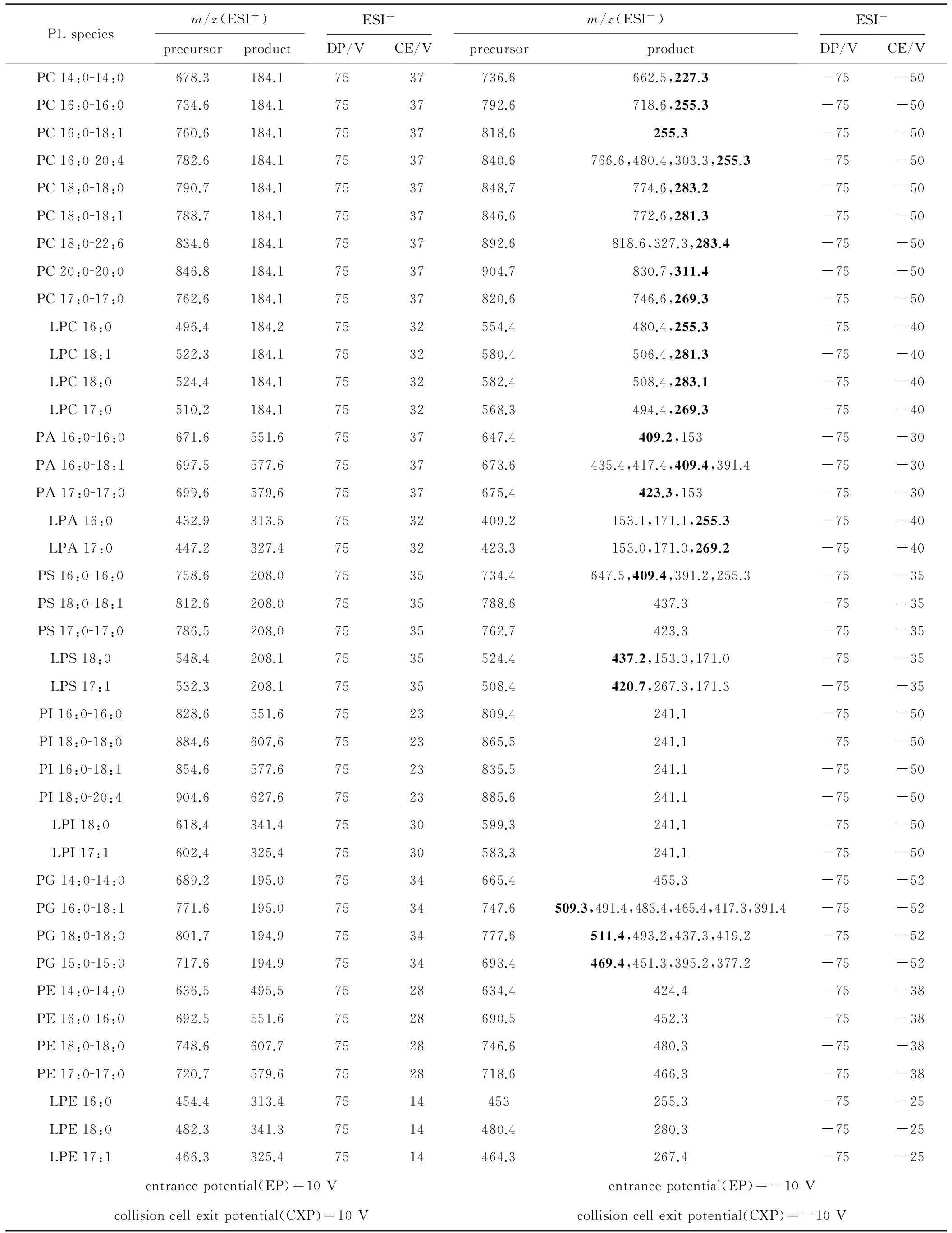
Tab.1 Optimized MRM pairs and parameters of phospholipids under ESI+ mode and ESI- mode
血清样品中磷脂组分复杂,需对更多的磷脂化合物进行分析鉴定,QqQ-MS需要在预设MRM离子对列表的前提下进行检测。根据上述各类磷脂标准品在正、负离子扫描模式下的裂解规律,并查阅LipidMaps数据库及文献调研[18-20]推断了每一大类磷脂中不同分子的母离子和子离子。以PS为例,在ESI+模式下,其母离子为[M+Na]+,子离子为母体丢失的磷酸丝氨酸与钠离子结合产生的碎片离子峰(m/z=208.1),因此PS这一类磷脂由在ESI+模式下的母离子和子离子即可确定。不同饱和度和链长的PI化合物和PC化合物的提取离子色谱图如图6、图7所示。
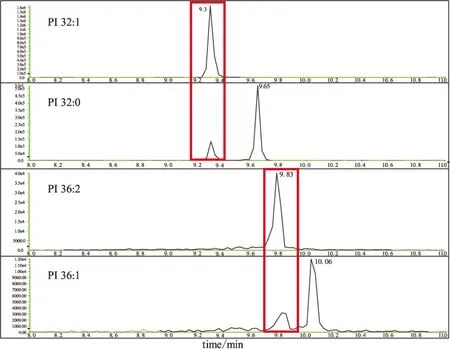
图6 不同饱和度和链长的PI化合物的提取离子色谱图Fig.6 Extracted ion chromatograms(XICs) of PI compounds with different saturations and chain lengths under ESI+ mode

图7 不同饱和度和链长的PC化合物的提取离子色谱图Fig.7 Extracted ion chromatograms(XICs) of PC compounds with different saturations and chain lengths under ESI- mode
由图6可知,以PI 36:1为例,其母离子和子离子分别设定为882.6和605.6,在其提取离子色谱图(XIC)中出现了2个响应峰,通过与PI 36:2的色谱峰对比,确定9.83 min处为PI 36:2的+2同位素峰,这是因为,PI 36:1比PI 36:2少一个双键,极性更小,保留时间应更靠后。标准品PI 18:0-18:0(PI 36:0)的响应峰为10.32 min。可见相同碳链数的磷脂,随不饱和度增加,保留时间以0.23 min递减。故初步判断10.06 min处为PI 36:1的响应峰。相同的现象也发现在PA、PC化合物的鉴别中。
图7中可以观察到同一类磷脂在C18柱上的保留时间随着碳链数和不饱和度的变化而有规律的变化。根据这些实验结果和数据库的搜索,对于血清样品的RPLC-MS分析,总共有386个MRM离子对被设定进入质谱方法。
2.4 二维系统构建
2.4.1 二维系统的正交性
为了保证理论上获得最好的峰容量,二维平台首先要考虑色谱模式的正交性,即这两维的分离机理应尽量不同,且第二维的分离不能降低前者的分辨率[18]。脂类化合物在HILIC柱上是按照化合物的种类进行洗脱,而RPLC则按照碳链的不饱和度及长度区别脂类化合物。由磷脂在第一维和第二维色谱的保留时间构建的二维散点图如图8所示。
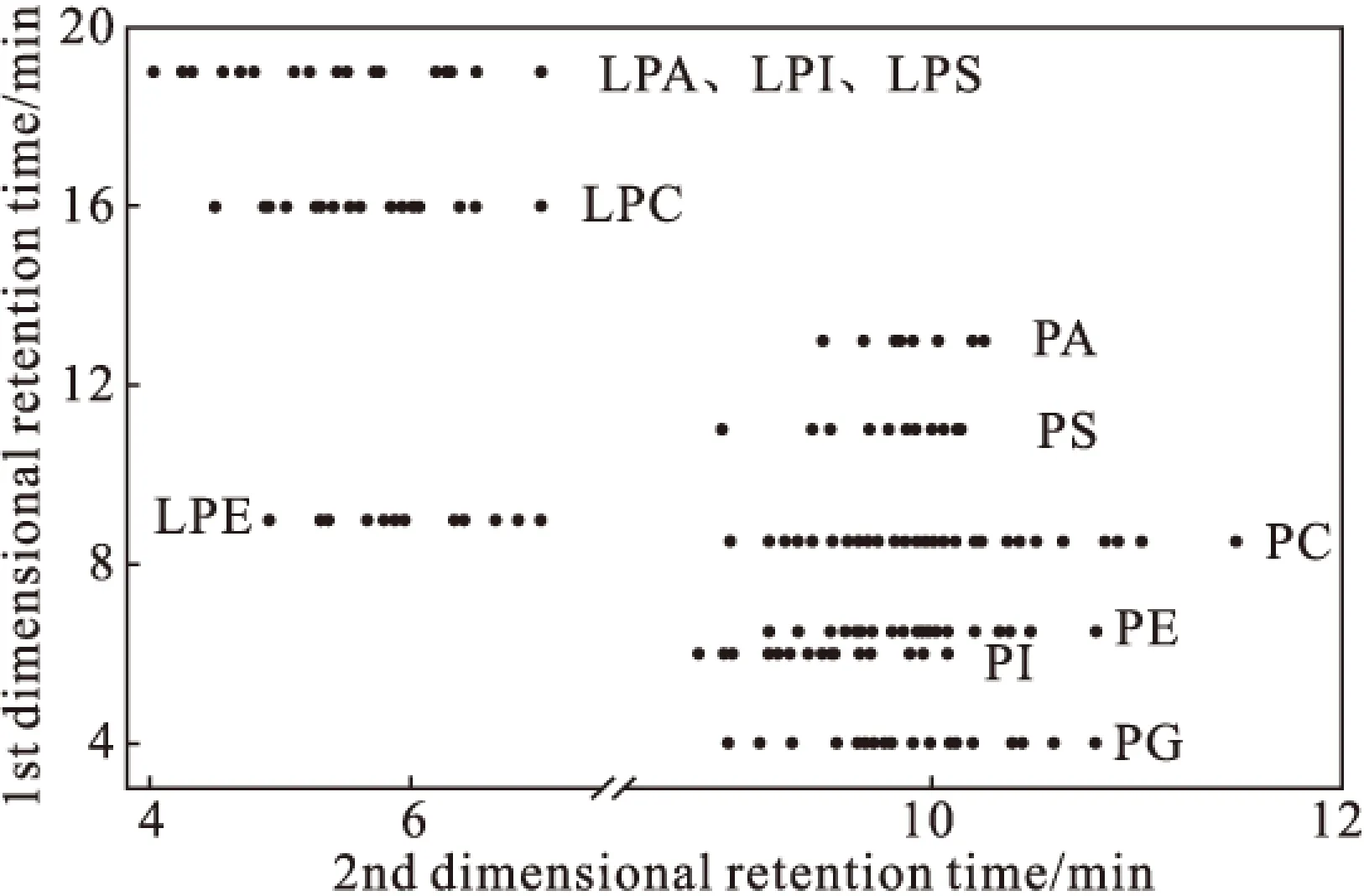
图8 二维保留时间构建的散点图Fig.8 Scatter diagram of two-dimensional retention time
由图8可知,该二维分离体系有很好的正交性,非常适合对磷脂种间和种内的分离分析,能够检测到更多亚类脂类化合物。
2.4.2 二维系统分离效率
血清中提取的磷脂化合物经过HILIC-RPLC-MS获得了很好的分离检测,第一维HILIC柱上收集的3个时间段流分F1、F3和F4在第二维RPLC-MS体系得到的分离色谱图如图9所示。
由图9可知,在每个不同时间段HILIC得到一大类化合物,如F1收集到的主要为PG化合物,这一大类在HILIC不能进行分离的物质在RPLC-MS得到了很好的分离。
二维平台第一维按磷脂极性头基的不同进行收集,第二维按某一类磷脂非极性尾部进行分离,避免了高丰度PC对低丰度PG、PA等离子化和检测的影响,提高低丰度磷脂的响应。PS 38:4、PA 40:6等在第二维RPLC-MS的检测响应信号和在HILIC-RPLC-MS二维平台的检测响应信号如图10所示。
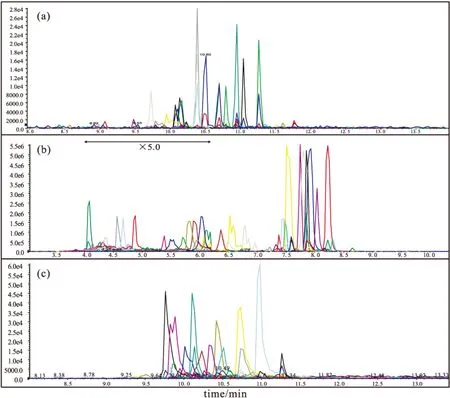
a.F1,ESI+ b.F3,ESI- c.F4,ESI+
由图10可知,在二维平台这些低丰度磷脂可以获得很好的检测。
磷脂作为很多疾病的潜在生物标记物,多数研究常集中于高丰度成分[19-21],而被掩蔽的很多低丰度成分同样值得关注,如LPA 16:0被证明与AFP呈正相关,即与肝细胞肝癌(HCC)密切相关[22]。因此提高低丰度磷脂的检出率至关重要。
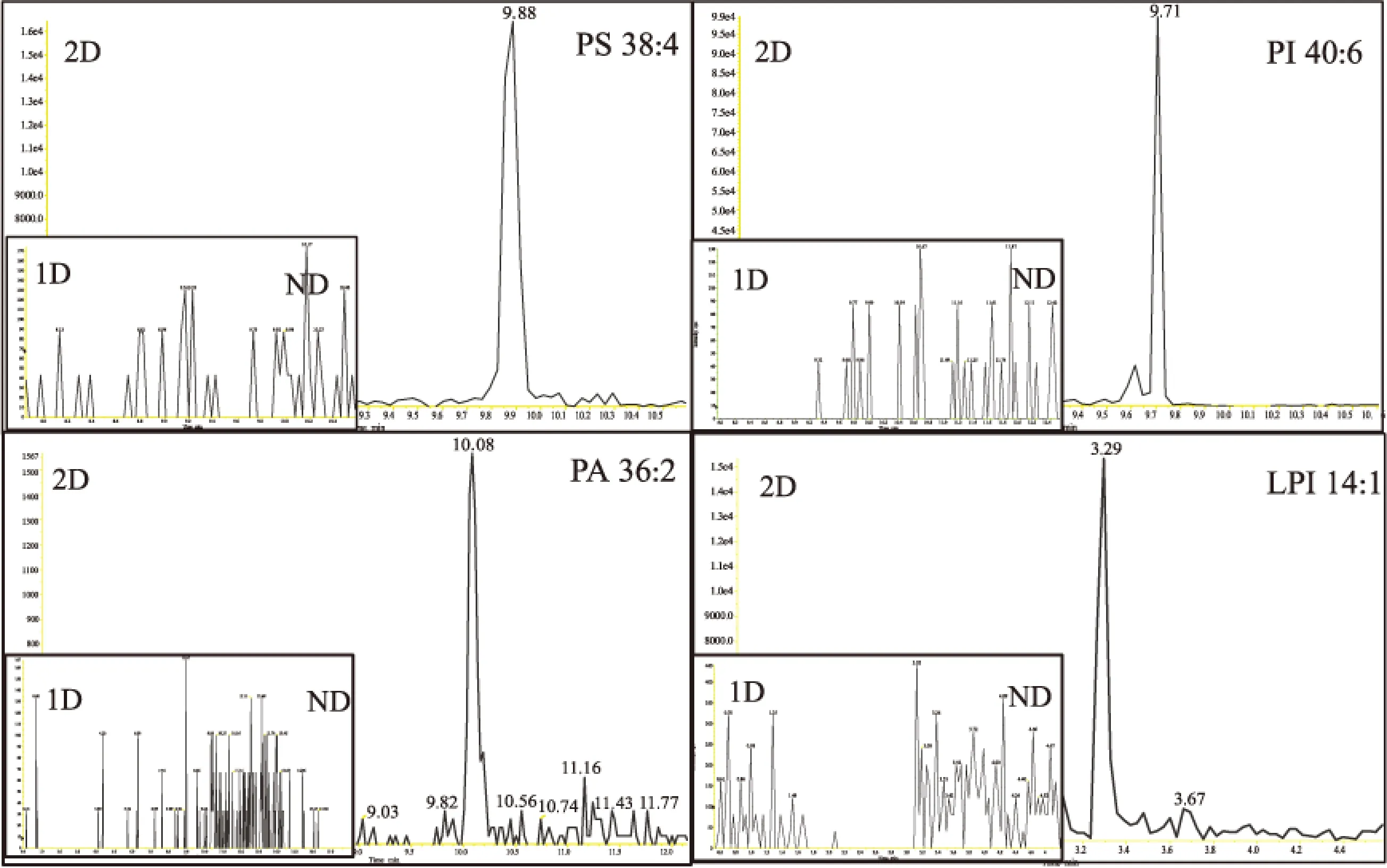
图10 一维RPLC-MS和二维HILIC-RPLC-MS下检测到的低丰度磷脂色谱图Fig.10 Chromatograms of some low abundance phospholipids detected by 1D RPLC-MS platform and 2D HILIC-RPLC-MS platform
一维液质和二维液质条件下检测到的磷脂种类分布见图11。
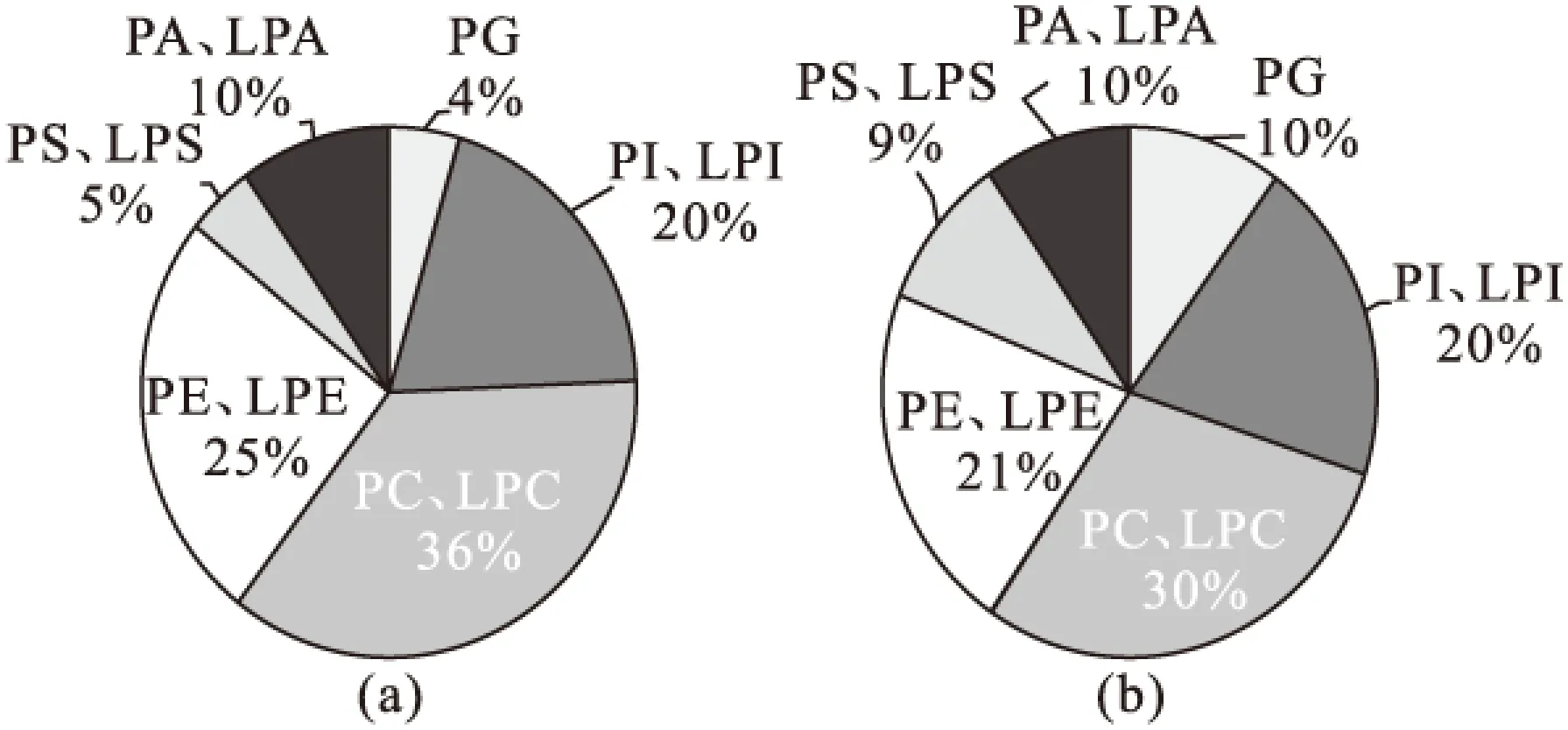
图 11 一维液质(a)和二维液质(b)条件下检测到的磷脂种类分布Fig.11 Species distribution of phospholipids detected by 1D LC-MS platform(a) and 2D LC-MS platform(b)
由图11可以看出,二维液质对低丰度磷脂的检出率较一维液质方法有了显著提升,尤其是PG、PS及LPS,所以该平台为筛选出更多有意义的磷脂标记物,尤其是低丰度磷脂打下了良好的基础。
3 结论
本实验建立了离线二维液相色谱-质谱联用方法,并用于分离分析血清中磷脂成分。二维液相色谱采用离线方式使各组分进行浓缩富集,解决了多维液相色谱联用时的溶剂不兼容性问题,提高了液相色谱的峰容量与选择性,一定程度上减少了共流出峰,降低了电离抑制,提高了低丰度磷脂的检出率;同时质谱提高了系统的检测能力。综上,该离线二维液相色谱-质谱联用方法可作为血清等生物复杂体系分离分析的有效手段,为磷脂代谢组学的研究奠定基础。
[1] WYMANN M P,SCHNEITER R.Lipid signalling in disease[J].Nature Reviews Molecular Cell Biology,2008,9(2):162-176.
[2] BERRY K A Z,MURPHY R C.Electrospray ionization tandem mass spectrometry of glycerophosphoethanolamine plasmalogen phospholipids[J].Journal of the American Society for Mass Spectrometry,2004,15(10):1499-1508.
[3] ANDRADE F D,de ASSIS S,JIN L,et al.Lipidomic fatty acid profile and global gene expression pattern in mammary gland of rats that were exposed to lard-based high fat diet during fetal and lactation periods associated to breast cancer risk in adulthood[J].Chemico-Biological Interactions,2015,239:118-128.
[4] YOU J C,YANG J,FANG R P,et al.Analysis of phosphatidylcholines (PCs) and lysophosphatidylcholines (LysoPCs) in metastasis of breast cancer cells[J].Progress in Biochemistry and Biophysics,2015,42(6):563-573.
[5] NAUDI A,CABRÉ R,JOVÉ M,et al.Lipidomics of human brain aging and Alzheimer′s disease pathology[J].International Review of Neurobiology,2015,122:133-189.
[6] WOOD P L,BARNETTE B L,KAYE J A,et al.Non-targeted lipidomics of CSF and frontal cortex grey and white matter in control,mild cognitive impairment,and Alzheimer′s disease subjects[J].Acta Neuropsychiatrica,2015,27(5):270-278.
[7] ANJANI K,LHOMME M,SOKOLOVSKA N,et al.Circulating phospholipid profiling identifies portal contribution to NASH signature in obesity[J].Journal of Hepatology,2015,62(4):905-912.
[8] BRÜGGER B.Lipidomics:analysis of the lipid composition of cells and subcellular organelles by electrospray ionization mass spectrometry[J].Annual Review of Biochemistry,2014,83:79-98.
[9] 朱超.基于液相色谱质谱联用技术的磷脂组学平台的建立、改进及应用[D].上海:华东理工大学,2011.
[10] DUGO P,CACCIOLA F,KUMM T,et al.Comprehensive multidimensional liquid chromatography:theory and applications[J].Journal of Chromatography A,2008,1184(1):353-368.
[11] WENG R,SHEN S,YANG L,et al.Lipidomic analysis ofp-chlorophenylalanine-treated mice using continuous-flow two-dimensional liquid chromatography/quadrupole time-of-flight mass spectrometry[J].Rapid Communications in Mass Spectrometry,2015,29(16):1491-1500.
[12] LI M,FENG B S,LIANG Y,et al.Lipid profiling of human plasma from peritoneal dialysis patients using an improved 2D (NP/RP) LC-QToF MS method[J].Analytical and Bioanalytical Chemistry,2013,405(21):6629-6638.
[13] YANG L,CUI X,ZHANG N,et al.Comprehensive lipid profiling of plasma in patients with benign breast tumor and breast cancer reveals novel biomarkers[J].Analytical and Bioanalytical Chemistry,2015,407(17):5065-5077.
[14] SATO Y,NAKAMURA T,AOSHIMA K,et al.Quantitative and wide-ranging profiling of phospholipids in human plasma by two-dimensional liquid chromatography/mass spectrometry[J].Analytical Chemistry,2010,82(23):9858-9864.
[16] ZHU C,DANE A,SPIJKSMA G,et al.An efficient hydrophilic interaction liquid chromatography separation of 7 phospholipid classes based on a diol column[J].Journal of Chromatography A,2012,1220:26-34.
[17] ZHAO Z,XU Y.An extremely simple method for extraction of lysophospholipids and phospholipids from blood samples[J].Journal of Lipid Research,2010,51(3):652-659.
[18] GIDDINGS J C.Two-dimensional separations:concept and promise[J].Analytical Chemistry,1984,56(12):1258A-1260A,1262A,1264A.
[19] LIM S,BANG D Y,RHA K H,et al.Rapid screening of phospholipid biomarker candidates from prostate cancer urine samples by multiple reaction monitoring of UPLC-ESI-MS/MS and statistical approaches[J].Bulletin of the Korean Chemical Society,2014,35(4):1133-1138.
[20] BOWERS J,HUGHES E,SKILL N,et al.Detection of hepatocellular carcinoma in hepatitis C patients:biomarker discovery by LC-MS[J].Journal of Chromatography B,2014,966:154-162.
[21] 刘悦,赵亮,李燕,等.肝细胞性肝癌代谢组学研究进展[J].药学实践杂志,2013,31(2):81-85.
Establishment of Offline Two-Dimensional Liquid Chromatography-Mass Spectrometry Method for Phospholipidomic and Its Application in Serum
LI Li,XUE Yun,WANG Yan*,YAN Chao*
(SchoolofPharmacy,ShanghaiJiaoTongUniversity,Shanghai200240,China)
A system of offline hydrophilic/reversed-phase two-dimensional liquid chromatography coupled with mass spectrometry (HILIC-RPLC-MS) was developed to analyze phospholipid in serum samples.A HILIC column was used in the first dimensional chromatography with gradient elution using ammonium acetate as a buffer and acetonitrile as mobile phase.A C18column was used in the second dimensional chromatography with gradient elution using ammonium formate as a buffer and methanol as mobile phase.The effluent was detected by mass spectrometry with electrospray ionization(ESI) under positive and negative scan modes.Results showed that,compared with 1D LC-MS system,the 2D LC-MS provided higher peak capacity and better separation efficiency,especially for low abundance phospholipid.And this method reduced coelution and ion suppression effect.It can be used to separate and analyze serum and other complex biological systems,and lays a foundation for phospholipidomic research.
phospholipid;two-dimensional liquid chromatography-mass spectrometry;hydrophilic interaction chromatography;metabolomics
上海市科委科研计划项目(15142200200,16142200300),中国博士后科学基金项目 (2015M581628),上海市引进技术的吸收与创新专项项目(XC-ZXSJ-02-2016-11)
2017-02-13
李丽(1991-),女,河北衡水人,硕士研究生,研究方向:代谢组学,E-mail:apple_galaxy@sjtu.edu.cn;通讯作者:闫超,教授,E-mail:chaoyan@sjtu.edu.cn;王彦,副教授,E-mail:wangyan11@sjtu.edu.cn。
10.3969/j.issn.1672-5425.2017.05.014
O657.63
A
1672-5425(2017)05-0061-10
李丽,薛芸,王彦,等.磷脂组学二维检测平台的建立及其在血清中的应用研究[J].化学与生物工程,2017,34(5):61-70.
