基于增强MRI纹理分析区分非产褥期乳腺炎与非肿块样强化病灶乳腺癌
2017-06-01李汉森
李汉森
章 强1ZHANG Qiang
齐海坤1QI Haikun
潘新蕾1PAN Xinlei
谢 晟2XIE Sheng
陈慧军1CHEN Huijun
基于增强MRI纹理分析区分非产褥期乳腺炎与非肿块样强化病灶乳腺癌
李汉森1LI Honsum
章 强1ZHANG Qiang
齐海坤1QI Haikun
潘新蕾1PAN Xinlei
谢 晟2XIE Sheng
陈慧军1CHEN Huijun
目的探讨基于增强MRI纹理分析对区分非产褥期乳腺炎与非肿块样强化病灶乳腺癌的可行性,以期降低非产褥期乳腺炎患者误诊的风险。资料与方法回顾性分析42例非肿块样强化病灶乳腺癌和30例乳腺炎患者的增强MRI图像数据。手动勾画病灶以及正常组织感兴趣区,对每个ROI提取3234个纹理特征,通过稳定性筛查去除对感兴趣区选择敏感的特征,并使用遗传算法和线性判别分析最终提取10个纹理特征对非产褥期乳腺炎、非肿块样强化病灶乳腺癌及正常乳腺组织进行分类。结果使用这10个特征的线性判别分析分类器对三类组织分类的总体准确率为89.6%。其中,对炎-癌分类的敏感度和特异度分别达92.9%和90.0%,说明纹理分析可成功区分非产褥期乳腺炎与非肿块样强化病灶乳腺癌。结论纹理分析能够可靠地区分非产褥期乳腺炎、非肿块样强化病灶乳腺癌及正常乳腺组织,为临床诊断提供可靠的结果。
乳腺肿瘤;乳腺炎;磁共振成像;图像增强;诊断,鉴别
非产褥期乳腺炎是良性乳腺疾病,但在临床诊断过程中较难与非肿块样强化病灶乳腺癌区分[1-5];一旦误诊,患者可能会接受不必要的创伤性治疗[6-7]。因此,临床上准确区分非产褥期乳腺炎和非肿块样强化病灶乳腺癌具有重要意义。已有较多研究利用动态增强MRI(dynamic contrast-enhanced MRI,DCE-MRI)图像进行乳腺病灶的诊断,其主要方法为使用药代动力学模型分析或利用其增强曲线的描述性参数[8-10]。但上述分析方法不仅后处理繁杂,需要大量的分析时间[11];且DCEMRI的增强信息也不足以区分非产褥期乳腺炎与部分种类的乳腺癌,特别是呈现非肿块样强化病灶乳腺癌[4]。纹理特征可定量计算图像中乳腺组织的信号强度分布[11-12]。近期有研究证明MRI图像纹理分析具有区分某些病理组织[11,13-15]及评价治疗效果的能力[6-7,16]。在乳腺成像中,DCE-MRI的纹理分析已被用于区分不同种类的乳腺肿瘤[11,13]。而在非产褥期乳腺炎的DCE-MRI影像中,描述性纹理特征,如多区域性增强或环状增强等非肿块样强化,是其典型图像特征[1,4]。因此,使用DCE-MRI影像的纹理分析有望区分非产褥期乳腺炎和非肿块样强化病灶乳腺癌,但目前鲜有报道。本研究将探索使用DCE-MRI纹理分析区分非产褥期乳腺炎及非肿块样强化病灶乳腺癌的可行性。
1 资料与方法
1.1 研究对象 回顾性分析2013年1月-2015年8月中日友好医院经病理确诊的乳腺疾病患者。纳入条件:乳腺检查中触及肿块、接受过乳腺DCE-MRI检查;排除标准:肿块<2 cm而无法进行纹理分析或病灶呈现乳腺癌典型的明显结节或肿块特征、经2名副主任医师确诊为癌。最终共纳入乳腺疾病患者72例,其中非产褥期乳腺炎30例,浸润性导管癌42例。浸润性导管癌(乳腺癌)患者平均年龄(52.1±10.9)岁;非产褥期乳腺炎(乳腺炎)患者平均年龄(36.0±8.0)岁。所有乳腺癌患者已行肿瘤切除手术并经病理检查确诊。非产褥期乳腺炎患者中,18例已将病灶切除并通过病理检查确诊,另外12例则利用立体定位真空辅助空心针穿刺活检确诊。本研究经中日友好医院伦理委员会批准。
1.2 仪器与方法 42例乳腺癌患者中,8例通过3.0T Siemens Magnetom Avanto磁共振扫描仪8通道乳腺线圈上接受扫描,另外34例通过3.0T GE Healthcare MR750磁共振扫描仪上8通道乳腺线圈接受扫描;而30例乳腺炎患者中,7例通过Siemens扫描仪上接受扫描,另外23例通过GE扫描仪接受扫描。DCE-MRI 扫描采用T1w-SPGR序列检查:TR 4.66 ms, TE 1.65 ms,视野400 mm×325 mm,翻转角 10˚,层数 146,层厚1.6 mm,间隔 0.7 mm,矩阵 448×302。在扫描开始的同时,经静脉以2 ml/s、0.01 mmol/kg注入造影剂钆喷酸葡胺注射液(拜耳公司),注射后用15 ml生理盐水冲刷,扫描时间分辨率为56 s,采集共6期动态增强数据。
1.3 图像处理 由1名副主任医师选取每位患者的DCE-MRI图像中增强峰值的图像以及其中病灶面积最大的MRI图像进行分析(选择时固定窗宽和窗位)[16]。图像导入由MATLAB (2015a,MathWorks Inc.,Natick,MA)编写的程序中。由1名副主任医师利用软件选取病灶轮廓的感兴趣区(ROI),再将此ROI映射到对侧作为对照ROI。在此过程中允许对照ROI进行调整,以保证对照ROI位于正常乳腺组织。因此,每位患者的图像同时生成一个病灶ROI与对照ROI,见图1、2。

图1 女,65岁,左乳浸润性导管癌患者增强MRI图像的ROI选取。红色边界表示手动勾画出的病灶ROI(箭);黄色边界为病灶ROI映射到对侧的正常乳腺组织对照ROI
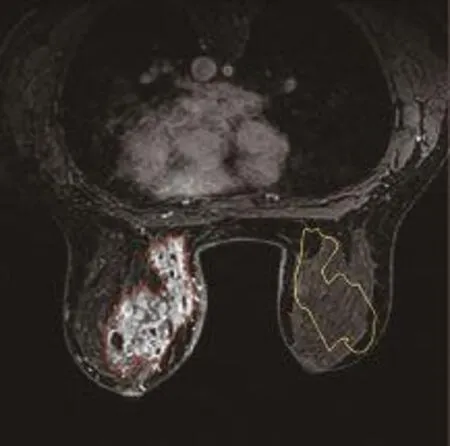
图2 女,26岁,左乳非产褥期乳腺炎患者增强MRI图像的ROI选取。红色边界表示手动勾画出的病灶ROI(箭);黄色边界为病灶ROI映射到对侧的正常乳腺组织ROI
对每个ROI进行特征提取,流程见图3。首先,将每个ROI内的像素作归一化处理[11,14]。然后,每个ROI经过6种不同种类的小波基进行二维小波变换,分解图像的细节特征。这些小波基包括多贝西小波、Symlet小波、Coi fl et小波、离散Meyer小波、双正交小波和反对称双正交小波。每种小波基分别进行两级小波变换,每个小波变换生成4组系数图像,故共生成48组细节系数图像。包括原始图像共计有49组细节系数图像可供纹理特征提取。然后对每组细节系数图像进行5种纹理特征的提取,包括全局特征(13个特征)、灰度共生矩阵特征(GLCM,22个特征)、灰度游程矩阵特征(GLRLM,13个特征)、灰度大小区域矩阵特征(GLSZM,13个特征)及邻域灰度差分矩阵特征(NGTDM,5个特征),共66个纹理特征[12-17]。故每个ROI提取出3234个纹理特征。

图3 纹理特征的提取流程。图像经过小波变换分解为48组系数图像,加上原始ROI作为一组图像,共49组系数图像作特征提取;利用5种特征提取方法对每组系数图像进行计算,共提取出3234个纹理特征
从临床使用的角度,每位医师在ROI范围的选取存在一定的差异。因此,对此差异不敏感的纹理特征在图像分析中更为可靠。针对这一问题,本研究通过对ROI加入噪声模拟ROI选取的差异(见图4,蓝线所示ROI),以此检验所有纹理特征在不同ROI选取情况下的可重复性,并只选择对差异较不敏感的纹理特征进一步分析。对每种ROI,只选择其原始ROI和添加噪声后ROI所得纹理特征的类内相关系数(ICC)最高的500种特征作为稳定特征。最终,本研究只选取所有种类ROI共有的稳定特征进行下一步分析。经此筛选,剩下的稳定特征被归一化,并利用遗传算法和线性判别分析(linear discriminant analysis,LDA)选出10个最优特征。在本研究的遗传算法中,交叉及变异的概率分别为0.9及0.2,而算法终止条件为繁衍100代,代价函数是利用LDA训练分类模型,并利用留一法进行交叉验证计算的分类准确性。
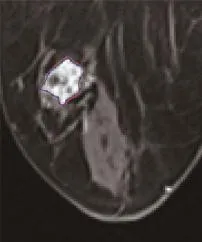
图4 女,59岁,左乳浸润性导管癌患者增强MRI图像上的模拟ROI选取。红色边界表示手动勾画出的病灶ROI(箭);蓝色边界为加入噪声的病灶ROI
1.4 统计学方法 采用SPSS 22.0软件,利用遗传算法所选取的10个纹理特征的LDA分类器对所有两类分类的敏感度、特异度和准确度进行计算,并构建所选取的10个纹理特征单独的受试者工作特性(ROC)曲线和单独使用这些特征的LDA分类器的ROC曲线。
2 结果
经筛选后,最终对ROI选取差别不敏感的纹理特征的分布见表1。在368个对ROI选取差别不敏感的稳定特征(ICC>0.996)中,灰度游程矩阵及灰度大小区域矩阵特征提取方法所产生的稳定特征较多,而灰度共生矩阵方法所产生的稳定特征最少。

表1 对ROI选取差别不敏感的纹理特征分布
经遗传算法对368个稳定特征进行选取,共选出10个最优特征,特征资料见表2。所选择的纹理特征中,有4种不均匀性特征、2种粗糙度特征、2种熵值特征、1种能量特征和1种繁忙度特征。以图像的病理结果为“金标准”,使用上述最优特征LDA分类器的诊断灵敏度、特异度、准确率见表3。其中,使用10个最优特征的LAD三类分类的总准确率达到89.6%,两两分类的敏感度、特异度与准确度均高于90.0%,其中从正常组织中分辨乳腺炎和乳腺癌的敏感度达100%,从乳腺炎中区分乳腺癌的敏感度为92.9%、特异度为90.0%。
所有两两分类的ROC曲线见图5~7。对于最优特征LDA分类器的ROC曲线,在癌-炎分类、癌-对照分类、炎-对照分类的情况下,ROC 曲线下面积(AUC)分别为0.942 (95%CI:0.891~0.993)、0.989 (95%CI:0.969~1.000)、0.988(95%CI:0.969~1.000)。在3个分类情况下,最优特征LDA分类器的AUC均大于分别使用单个特征的ROC的AUC,表明结合使用10个最优特征的LDA分类器具有较高的分类准确性,可在增强MRI图像中区分非产褥期乳腺炎、非肿块样强化病灶乳腺癌与正常乳腺组织。

表2 遗传算法选出的10个纹理特征资料

表3 10个最优特征的交叉验证分类结果
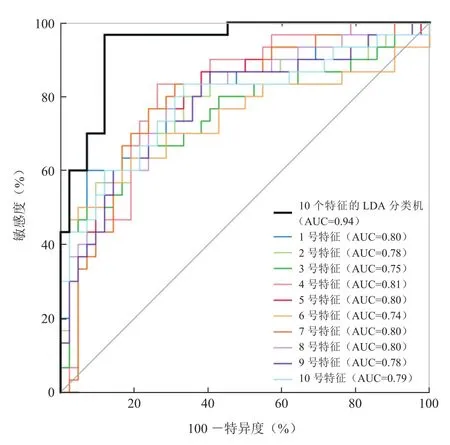
图5 单个特征和使用所有10个特征的LDA分类器从非产褥期乳腺炎中区分非肿块样强化病灶乳腺癌的ROC曲线

图6 单个特征和使用所有10个特征的LDA从非肿块样强化病灶乳腺癌中区分正常乳腺组织的ROC曲线

图7 单个特征和使用所有10个特征的LDA从正常乳腺组织中区分非产褥期乳腺炎的ROC曲线
3 讨论
本研究初步证明了增强MRI影像使用纹理分析以区分非产褥期乳腺炎与非肿块样强化病灶乳腺癌的可行性。本研究发现利用纹理分析提取得到10个纹理特征建立的LDA分类器,三类分类准确率达89.6%,可较好地区分非肿块样强化病灶乳腺癌、非产褥期乳腺炎和健康乳腺组织。该分类器在非肿块样强化病灶乳腺癌与非产褥期乳腺炎的两两分类中,敏感度为92.9%、特异度为90.0%、准确度为91.7%。而此前研究表明,单纯以传统的增强MRI图像中的增强信息区分非产褥期乳腺炎与非肿块样强化病灶乳腺癌十分困难[2,5],其原因为2种乳腺疾病均可在DCE-MRI图像中出现非肿块样高强化;而非产褥期乳腺炎与非肿块样强化病灶乳腺癌在病理方面完全不同。在非产褥期乳腺炎中,炎症引起的分泌可能会造成乳管堵塞,并在乳管周围形成脓肿,故在增强MRI图像中以多区域性增强或集群环状增强的形式出现,与非肿块样强化病灶乳腺癌在图像纹理表现上有所不同[1,4]。因此,本研究中所选出的特征大多为量度病灶信号的不均匀度、粗糙度等纹理,反映了2种疾病组织的病理分布差别,而这些特征成为区分疾病的良好图像指标。
目前,已有研究人员应用DCE-MRI纹理分析对乳腺疾病进行诊断。如Holli等[11]利用DCE-MRI纹理分析判别不同种类乳腺癌及判别乳腺癌与正常组织,其研究结果与本研究中纹理分析可在正常乳腺组织中识别乳腺癌的结论一致。然而,与Holli等[11]的研究相比,本研究进一步证明了纹理分析也能够从正常乳腺组织中区分非产褥期乳腺炎。上述结果进一步证明了DCE-MRI纹理分析可以作为乳腺疾病诊断的多功能工具。
国际上利用增强乳腺MRI的纹理分析进行疾病研究的方法较多。如利用不同时项的图像差[11]、三维纹理特征[13,15]或其他高阶的分类器[7,15-16];但上述研究方法均需要较复杂的后处理,选取ROI亦花费更多时间,且高阶分类器存在不直观等问题,阻碍了其临床应用。本研究利用的分析方法简单可靠。只利用增强峰值的一张图像进行二维的纹理分析,进行简单的ROI选取步骤,无需处理复杂的配准等后处理问题便可自动进行纹理特征提取;使用简单直观的线性LDA分类器即可获得准确的结果。此外,本研究中针对纹理分析结果较容易受到ROI选择不同影响的问题,专门通过对ROI添加随机噪声的形式筛选出对ROI选择不敏感的纹理特征进行分析,保证了研究方法和结果的可靠性。需要注意的是,先前使用纹理分析进行乳腺疾病研究的一些工作由于未研究其纹理特征对ROI选择差异的影响,故使用了大量由灰度共生矩阵方法所产生的特征[11,14]。本研究发现,灰度共生矩阵能够获取的对ROI选择差异不敏感特征较少,提示在今后的研究中,应慎用该种特征提取方法。
总之,本研究使用纹理分析成功区分了非肿块样强化病灶乳腺癌与非产褥期乳腺炎,并可将这2种病灶与正常乳腺组织区分,证明了增强MRI纹理分析在非产褥期乳腺炎诊断中的可行性。本研究中使用的图像分析方法使用简便且可靠性较高,对于临床实际使用有重要意义。本研究的局限性为:①使用的纹理分析工具并非完全自动化。将来如配合自动分割病灶分区的算法,实现对于乳腺MRI的自动化诊断将更具意义;②本研究样本数量有限,在后续研究中应该增加患病样本的数量,以更好地验证本研究的结果。
[1] Liu H, Peng W. Morphological manifestations of nonpuerperal mastitis on magnetic resonance imaging. J Magn Reson Imaging, 2011, 33(6): 1369-1374.
[2] Renz DM, Baltzer PT, Böttcher J, et al. Magnetic resonance imaging of in fl ammatory breast carcinoma and acute mastitis. a comparative study. Eur Radiol, 2008, 18(11): 2370-2380.
[3] 曹英, 王丽萍, 赵晓静, 等. 10 例非产后期乳腺炎X线表现.中国医学影像学杂志, 2005, 13(1): 57-58.
[4] Tan H, Li R, Peng W, et al. Radiological and clinical features of adult non-puerperal mastitis. Br J Radiol, 2013, 86(1024): 20120657.
[5] Gurleyik G, Aktekin A, Aker F, et al. Medical and surgical treatment of idiopathic granulomatous lobular mastitis: a benign in fl ammatory disease mimicking invasive carcinoma. J Breast Cancer, 2012, 15(1): 119-123.
[6] Ahmed A, Gibbs P, Pickles M, et al. Texture analysis in assessment and prediction of chemotherapy response in breast cancer. J Magn Reson Imaging, 2013, 38(1): 89-101.
[7] Wu J, Gong G, Cui Y, et al. Intratumor partitioning and texture analysis of dynamic contrast-enhanced (DCE)-MRI identi fi es relevant tumor subregions to predict pathological response of breast cancer to neoadjuvant chemotherapy. J Magn Reson Imaging, 2016, 44(5): 1107-1115.
[8] Hylton N. Dynamic contrast-enhanced magnetic resonance imaging as an imaging biomarker. J Clin Oncol, 2006, 24(20): 3293-3298.
[9] Si L, Zhai R, Liu X, et al. MRI in the differential diagnosis of primary architectural distortion detected by mammography. Diagn Interv Radiol, 2016, 22(2): 141-150.
[10] 程流泉, 李席如, 刘梅, 等. 多参数MRI的BI-RADS分类对乳腺病变的诊断效能. 中国医学影像学杂志, 2015, 23(3): 176-182.
[11] Holli K, Lääperi AL, Harrison L, et al. Characterization of breast cancer types by texture analysis of magnetic resonance images. Acad Radiol, 2010, 17(2): 135-141.
[12] Aerts HJ, Velazquez ER, Leijenaar RT, et al. Decoding tumour phenotype by noninvasive imaging using a quantitative radiomics approach. Nat Commun, 2014, 5: 4006.
[13] Chen W, Giger ML, Li H, et al. Volumetric texture analysis of breast lesions on contrast-enhanced magnetic resonance images. Magn Reson Med, 2007, 58(3): 562-571.
[14] Waugh SA, Purdie CA, Jordan LB, et al. Magnetic resonance imaging texture analysis classi fi cation of primary breast cancer. Eur Radiol, 2016, 26(2): 322-330.
[15] Woods BJ, Clymer BD, Kurc T, et al. Malignant-lesion segmentation using 4D co-occurrence texture analysis applied to dynamic contrast-enhanced magnetic resonance breast image data. J Magn Reson Imaging, 2007, 25(3): 495-501.
[16] Fox MJ, Gibbs P, Pickles MD. Minkowski functionals: an MRI texture analysis tool for determination of the aggressiveness of breast cancer. J Magn Reson Imaging, 2016, 43(4): 903-910.
[17] Vallières M, Freeman CR, Skamene SR, et al. A radiomics model from joint FDG-PET and MRI texture features for the prediction of lung metastases in soft-tissue sarcomas of the extremities. Phys Med Biol, 2015, 60(14): 5471-5496.
(本文编辑 闻 浩)
读者·作者·编者
医学科技论文摘要撰写要求:摘要应具有独立性和自含性,即不阅读论文全文就能获得必要的信息。结构式摘要由目的、资料与方法、结果、结论4个要素组成。目的中需简要交代研究的前提(问题的提出)、研究目的及其重要性;资料与方法中需简述研究类型(如回顾性研究、前瞻性研究)、人口学(研究对象)或材料、分组、采用的研究方法及观察指标,摘要方法中不需要指明具体使用的统计学方法;结果中针对研究方法及观察指标简要列出主要的、有意义的或新发现的研究结果,指出临床与统计学的意义和价值;结论是针对结果的分析、评价和应用,肯定经过科学分析的研究结果及其获得的某些结论,但不能超出研究结果的范围而过度推论,同时指出这些结论的理论或实用价值。摘要中不列图表,不引用参考文献,英文缩略语首次出现需注明中文全称。中文摘要以350字左右为宜,英文摘要需与中文摘要对应。
Differentiation of Non-puerperal Mastitis from Breast Carcinoma with Non-mass-like Enhancement by Texture Analysis of Contrast-enhanced Magnetic Resonance Imaging
PurposeTo investigate the feasibility of texture analysis of breast contrastenhanced magnetic resonance imaging in differentiating non-puerperal mastitis and breast carcinoma with non-mass-like enhancement in order to prevent misdiagnosis of nonpuerperal mastitis.Materials and MethodsIn this retrospective study, the contrastenhanced MRI images of 42 female patients of invasive ductal carcinoma with non-masslike enhancement and 30 female patients of non-puerperal mastitis were analyzed. 3234 texture features were generated from manually selected region of interest (ROI) of normal breast tissue and breast lesions. By means of genetic algorithm and linear discriminative analysis, 10 texture features were selected based on their stability and accuracy in breast tissue classification.ResultsWith these 10 features, the linear discriminative analysis classi fi ers had sensitivity of 92.9% and speci fi city of 90.0% in classifying two lesions, and accuracy of 89.6% in classifying all three types of tissue. The result showed that texture analysis successfully differentiate non-puerperal mastitis and breast carcinoma with nonmass-like enhancement.ConclusionTexture analysis demonstrates the ability of differentiating invasive ductal carcinoma with non-mass-like enhancement, non-puerperal mastitis and normal breast tissue, and provides reliable results for clinical diagnosis.
Breast neoplasms; Mastitis; Magnetic resonance imaging; Image enhancement; Diagnosis, differential
1. 清华大学医学院生物医学工程系生物医学影像研究中心 北京 100084
2.中日友好医院放射诊断科 北京 100029
陈慧军
Centre for Biomedical Imaging Research, Department of Biomedical Engineering, School of Medicine, Tsinghua University, Beijing 100084
Address Correspondence to:CHEN Huijun
E-mail: chenhj_cbir@mail.tsinghua.edu.cn
国家自然科学基金项目(81371540,81571667)。
R737.9;R445.2
2016-11-24
修回日期:2017-01-20
中国医学影像学杂志
2017年 第25卷 第5期:354-359
Chinese Journal of Medical Imaging
2017 Volume 25 (5): 354-359
10.3969/j.issn.1005-5185.2017.05.008
