光敏剂在光动力治疗中的研究进展
2017-05-24韩晓博郑英虹杨力明
韩晓博,郑英虹,杨力明
(哈尔滨医科大学基础医学院病理生理学教研室,哈尔滨 150081)
光敏剂在光动力治疗中的研究进展
韩晓博,郑英虹,杨力明
(哈尔滨医科大学基础医学院病理生理学教研室,哈尔滨 150081)
对光动力治疗(photodynamic therapy,PDT)中常用的光敏剂进行了综述.光动力治疗自问世以来,已被广泛应用于肿瘤以及非肿瘤疾病的治疗.在光化学反应中,能够被光照激活并把能量传递给反应物,而本身并不发生反应的物质被称为光敏剂.光敏剂作为PDT的一个重要影响因素,其研究进展对于PDT的发展起着非常重要的作用.光敏剂大体分为三代:第一代以血卟啉衍生物为主,第二代以卟啉、卟吩为代表,第三代是在第二代的基础上进行化学基团修饰.经过几十年的发展,光敏剂的化学性质更加稳定,副作用更加小.
光敏剂;光动力治疗;卟啉;酞菁;上转换纳米颗粒
光动力疗法的概念可以追溯到1900年,德国慕尼黑的一位医学生Oscar Raab偶然发现光线照射到与特定染料一起培养的草履虫时会致其死亡,而在黑暗中草履虫却可存活,他猜想这种现象就如进行光合作用的植物一样,是光的能量到达了染料所致[1].1904年, Tappeiner等[2]通过实验发现在有氧条件下光敏剂与光照相结合可以杀死细胞,因此提出一个全新概念——“光动力效应”(photodynamic effect).然而,世界大战及制药工业的发展使研究者暂停了对光动力疗法的探索.现代化的光动力疗法始于20世纪70年代的美国,研究人员发现了一种水溶性的卟啉类混合物——“血卟啉衍生物”(hematoporphyrin derivative,HpD)[3],随后人们又发现了一种更加纯净的物质——光卟啉.目前,光卟啉已在全世界广泛使用,但其存在皮肤光毒性大、吸收峰较小、波长630 nm时利用率低、光线的穿透深度浅[4]等副作用.因此,研发更理想的光敏剂用于光动力治疗疾病,已成为科学家们不懈努力的方向.
光敏剂分为三代:第一代光敏剂以血卟啉衍生物、二血卟啉醚等为代表,开创了光动力治疗疾病的先河,但药物本身具有较多缺陷,例如成分复杂、靶向性差、光毒性大等;第二代光敏剂以卟啉、卟吩、稠环醌、金属酞菁等为代表,克服了第一代光敏剂的众多缺陷,有力地推进了光动力疗法的研究与应用;20世纪末,在第二代光敏剂的基础上,人们通过在第二代光敏剂的结构上添加一些具有生物学特性的化学基团物质比如多聚体和脂质体等,研究出了第三代光敏剂,较大程度地提高了光敏剂对于组织的靶向性.
1 光动力治疗的原理
光动力治疗主要涉及光敏剂、光和氧分子[5],原理如图1所示.首先,光敏剂特异性地聚集在病变组织周围,然后通过合适的光源照射病变组织,光敏剂吸收能量后从基态跃迁至激发态,激发态的光敏剂将能量传递给细胞周围的氧分子,进而发生一系列的光化学反应,产生大量的具有强氧化性的活性氧物质[6],该物质与周围细胞发生反应,引起细胞坏死和凋亡.
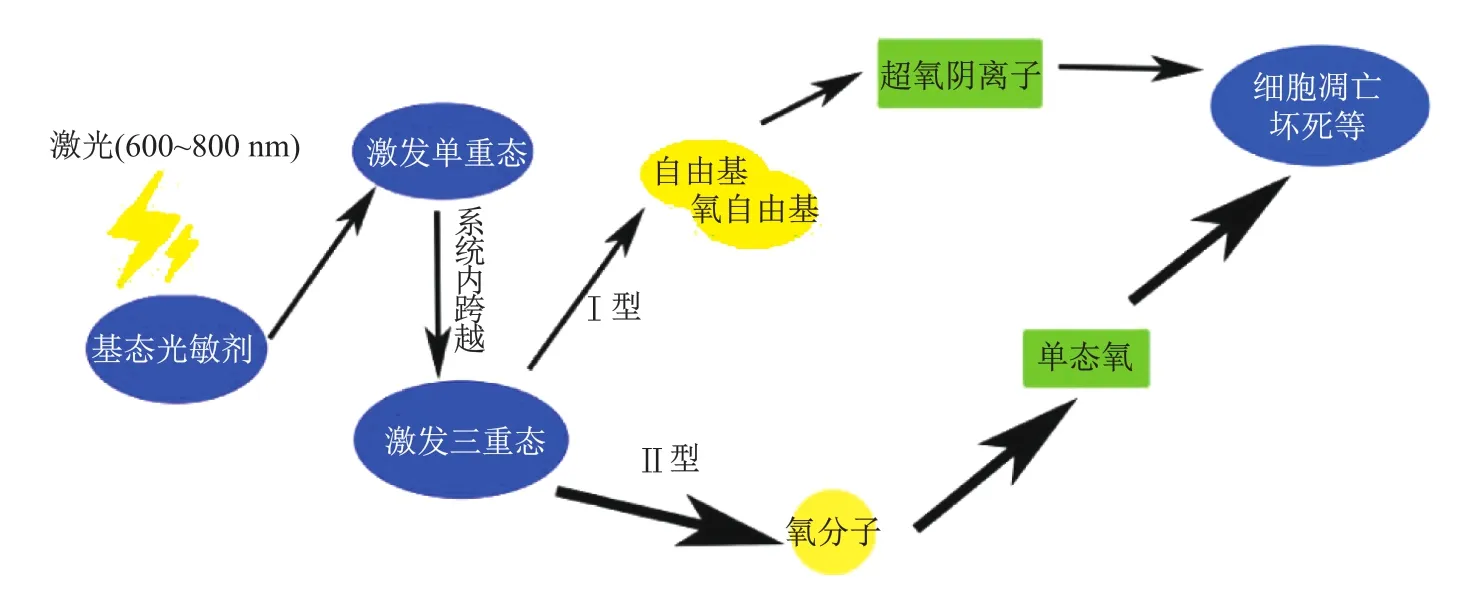
图1 光动力治疗的原理Fig.1 Principle of photodynamic therapy
光敏剂分子是一种单线态的基态,具有两个反方向旋转的电子.当光敏剂吸收的光通过适当的激发能量会导致一个电子被激发进入更高的能量轨道,形成激发单重态.激发单重态的光敏剂非常不稳定,容易失去能量,退回到单线态.然而,这种激发单重态光敏剂可以通过一种称为“系统内跨越”(intersystem crossing)的形式,形成更稳定的激发三重态.相比纳秒级的单重态,三重态更加稳定,拥有微秒级寿命,使光敏剂有充足时间将其能量与氧分子发生碰撞,导致单线态氧形成,这种反应被称作Ⅱ型光化学反应[7].涉及电子的捕获与释放形成自由基正负离子的Ⅰ型光化学反应,也可使激发态光敏剂发生电子转移形成活性氧.这种自由基能够和氧气反应产生超氧自由基(O2−),通过歧化作用形成过氧化氢(H2O2),通过电子的还原形成氧化羟基自由基(HO).通常Ⅱ型光化学反应比Ⅰ型更容易产生活性氧,因此许多光敏剂都被认为是通过Ⅱ型光化学反应来发挥作用的.
2 常见光敏剂
常见光敏剂的结构式及应用如表1所示.
2.1 第一代光敏剂
第一代光敏剂主要是血卟啉衍生物(HpD)的混合制剂,如Photofrin、二血卟啉醚(DHE) 等.血卟啉是一种来自血红蛋白的两性光敏剂.早在1993年,美国的Dougherty就从HpD中提取到具有光敏性的Photofrin[3],随后被加拿大政府批准应用于膀胱癌的光动力治疗,这是首个获得审批进行临床治疗的光敏剂.随后,Photofrin陆续获得欧美、亚洲等多国的批准,应用于肿瘤治疗.
目前,关于HpD的研究成果已经在一些体表肿瘤的治疗中得到成功验证[8],并且对于支气管肺癌等呼吸道肿瘤的治疗效果也相当显著[9].此外,HpD对于上消化道恶性肿瘤的治疗也有不错的疗效,甚至有少数病例达到了临床治愈[10].巴雷特食管是食管癌的一种非常重要的癌前病变,目前HpD已成为首选治疗手段之一[11].此外,HpD对头颈部肿瘤、脑瘤、膀胱癌、胆管癌[12]也有良好的治疗效果,但是治疗膀胱癌后易出现膀胱挛缩[13].尽管第一代光敏剂在临床上取得了显著的疗效,但仍无法回避其成分复杂、皮肤光毒性大、单态氧产量低等缺点.
2.2 第二代光敏剂
与第一代光敏剂相比,第二代光敏剂结构更加单一,靶向性更强,活性氧产量更高,作用更大,利用率显著增强.第二代光敏剂多为卟吩、金属酞菁、稠环醌类等卟啉类化合物的衍生物.
2.2.1 卟啉类衍生物
卟啉类衍生物分为外源性和内源性两种:内源性卟啉以5-氨基酮戊酸(5-aminolevulinic acid,5-ALA)最为典型;外源性卟啉有二氢卟酚、卟啉和叶绿素衍生物等.
(1)5-氨基酮戊酸.5-ALA是卟啉机体代谢的中间产物,可以参与人体内血红素的生物合成.但是5-ALA本身没有光敏性,需要在体内与酶反应生成原卟啉Ⅸ(protoporphyrinⅨ, PpⅨ)才可以发挥作用[14].早在1990年,加拿大学者Kennedy等[15]便将ALA-PDT成功用于皮肤恶性肿瘤的治疗.随后,Frank等[16]在1996年将ALA应用于生殖器尖锐湿疣疾病的治疗,取得了良好的治疗效果.如今,ALA介导的光动力治疗已经广泛应用于肿瘤性与非肿瘤性皮肤病,如银屑病[17]、痤疮[18]、鳞状细胞癌、基底细胞癌[19]、蕈样肉芽肿[20]等.Karrer 等[21]通过临床试验证实,ALA-PDT还可应用于雀斑、皮肤粗糙、面色萎黄等皮肤美容领域. 在ALA-PDT的相关报道中发现,在治疗过程中或在治疗之后,部分患者出现了局部烧灼感、红肿胀痛以及色素沉着等可自行消失的轻微反应,无明显严重反应,且绝大部分患者均能够耐受.因此,随着对PDT疗法更广泛和深入的研究,相信ALA-PDT会有非常广阔的应用前景.
(2)血卟啉单甲醚.血卟啉单甲醚(hematoporphyrin monomethyl ether,HMME)是20世纪90年代初由我国上海第二军医大学的许德余等[22]独立研发的国产新型光敏剂.顾瑛等[23]将HMME首次应用于鲜红斑痣的治疗,取得了良好的效果,部分分型较好的患者甚至可以达到痊愈.随后,王伟等[24]将HMME应用于肺癌的诊断.刘慧龙等[25]将HMME应用于治疗上消化道恶性肿瘤患者,结果表明HMME对上消化道梗阻症状的患者具有特别明显的治疗效果.
(3)叶绿素衍生物.叶绿素为镁卟啉化合物,种类包括叶绿素a、叶绿素b、叶绿素c、叶绿素d、叶绿素f以及原叶绿素和细菌叶绿素等,是一类与光合作用有关的重要色素.叶绿素不
稳定,在酸性条件下,易失去卟啉环中的镁成为脱镁叶绿素.叶绿素类光敏剂主要有脱镁叶绿素a、紫红素等,其中脱镁叶绿酸a-己醚衍生物(2-[1-hexyloxyethyl]-2-devinyl pyropheophorbide-a,HPPH)是叶绿素a的降解产物,具有一个强吸收峰,还有非常高的单态氧产率,被科学家们认为是非常有发展潜力的光敏剂之一.另外,N-天门冬酰基二氢卟吩(monoaspartyl chlorin e6,NPe6)属叶绿素类新型合成光敏剂,在波长664 nm处有一个强吸收峰.在猴实验性脉络膜新生血管(choroidal neovas cularization,CNV)的PDT中,Nakashizuka等[26]发现NPe6能够使新生血管封闭,并且对周围组织不会产生明显损伤.目前NPe6己进入临床试验阶段[27].
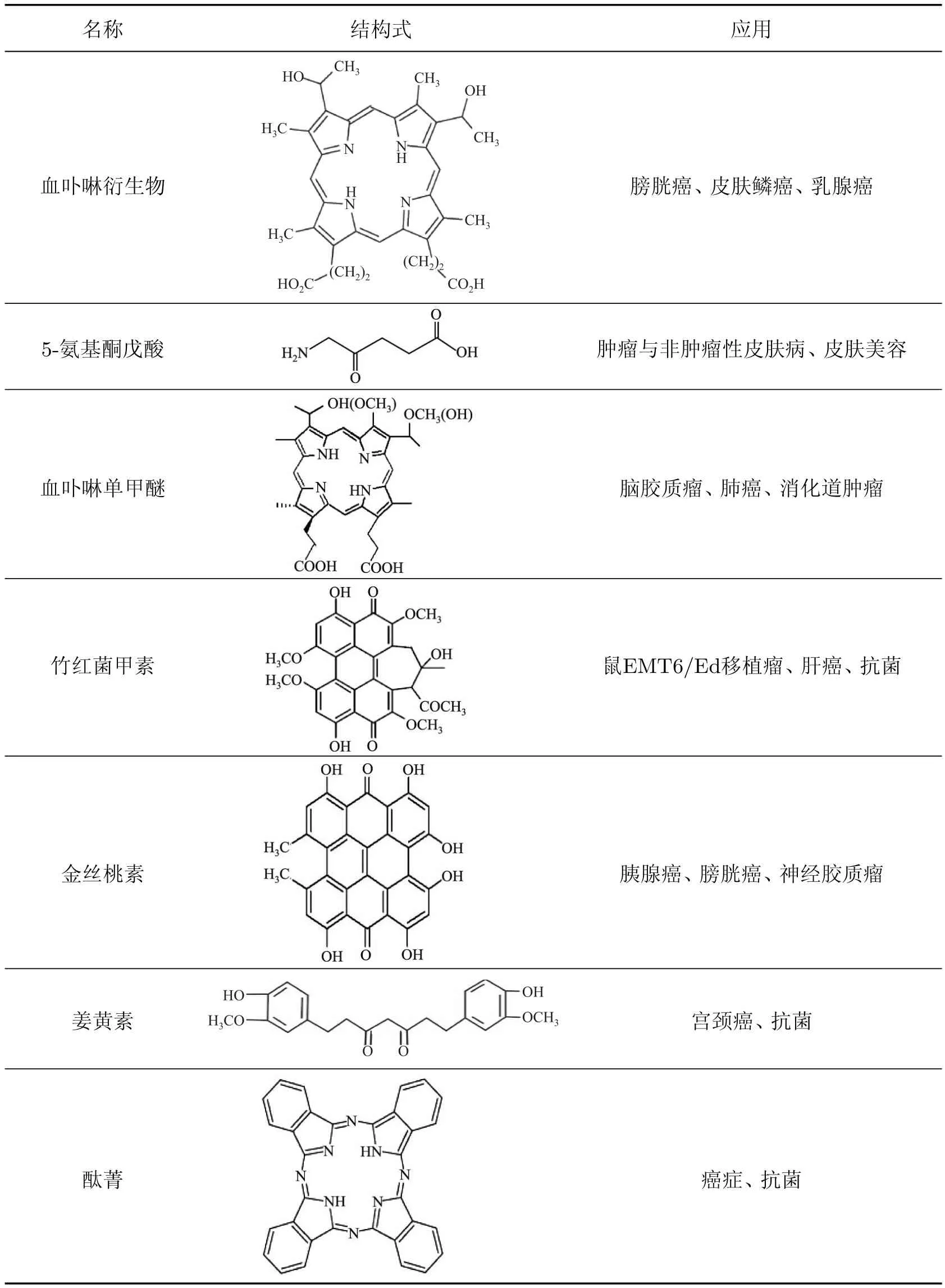
表1 常见光敏剂的结构式及应用Table 1 Structure and application of common photosensitizers
2.2.2 稠环醌类光敏剂
稠环醌类光敏剂是从菌类植物中发现的一种天然光敏剂,这类化合物应用于PDT时可产生单重态氧以及自由基和超氧阴离子,因此兼有Ⅰ型、Ⅱ型两种光敏反应机制.
(1)竹红菌素.竹红菌素(hypocrellins)是从云南箭竹竹红菌中提取的天然光敏剂,它易溶于氯仿、吡啶、丙酮、二甲亚砜,难溶于水.竹红菌素分为竹红菌甲素和竹红菌乙素,在碱性条件下竹红菌甲素可转化成乙素[28].与HpD相比,竹红菌素化学结构单一、活性氧产量多、光毒性低、代谢快,是一类具有较大发展前景的光动力药物[29].Estey等[30]对多种竹红菌素衍生物进行了研究,并对其中3种竹红菌乙素的衍生物进行了临床前的评估[31],发现其能够治愈小鼠的EMT6/Ed移植瘤,对小鼠皮肤却几乎无光毒反应.
(2)金丝桃素.金丝桃素(hypericin)是贯叶连翘中最具生物活性的物质,气味为特有清香,味苦,易溶于水,几乎不溶于其他有机溶剂.金丝桃素用作抗抑郁药已有百年历史.近年来,在抗病毒(包括HIV)、癌症等方面的研究层出不穷[32].Kang等[33]发现金丝桃素可以明显抑制鼠巨噬细胞中的白细胞素12,在荧光条件下抑制作用更突出.Park等[34]发现金丝桃素具有氧依赖性的抗病毒能力,当氧浓度下降时,抗病毒能力急剧下降.此外,已有研究发现,在光照作用下金丝桃素的抗病毒活性增强[35].在光照的介导下,金丝桃素可通过产生单线态氧,发生光化学反应杀死白细胞.后来,研究发现金丝桃素介导的PDT能够治疗胰腺癌[36].金丝桃素还可应用于膀胱癌[37]、淋巴癌[38]、前列腺癌[39]和基体细胞癌[40]等各种肿瘤的治疗[41].
(3)姜黄素.姜黄素(curcumin)是从姜科植物中提取的一种小分子量的物质,为橙黄色结晶粉末,味稍苦,不溶于水,溶于乙醇、丙二醇.已有研究表明,姜黄素具有抗氧化、抗炎作用,对心血管等系统具有积极的药理作用[42].姜黄素本身具有光敏特性,荧光检测姜黄素有两处强吸收峰,最大激发波长为425 nm,最大发射波长为530 nm[43].在光照条件下,姜黄素诱导细胞凋亡的能力比无光照条件更显著[44].另外,姜黄素介导的PDT可以有效抑制宫颈癌H8细胞的增殖,并呈现一种正相关关系.单纯药物对细胞没有明显的作用,在光照达到100 J/cm2的条件下,姜黄素介导的PDT对H8细胞的杀伤作用开始呈现[45].此外,姜黄素还可作为抗菌药光敏剂在牙科学领域用于根除口腔内的病原体[46].
2.2.3 酞菁类光敏剂
酞菁是卟啉的合成衍生物,属于苯并氮杂卟啉的范畴,由4个吡咯单元连接4个N原子形成一个共轭体系.通过引入相应的取代基和金属离子,酞菁的最大吸收峰可以提高到700~800 nm.此外,酞菁稳定的理化性质使其在应用于PDT时,只需要0.1~0.2倍的卟啉剂量,就可达到卟啉的治疗效果.酞菁在体内的药动力学作用迅速,注射1~3 h后即可在肿瘤组织达到峰值,24 h内便可以从体内清除[47].因为一些极性基团的作用,酞菁的光敏反应可由加锌或加铝等金属来加强,磺化作用则使其水溶性增加[48].目前,在俄罗斯等国家和地区,磺化铝酞菁(photosens)已被应用于抗肿瘤和抗感染领域[49].硅酞菁在Ⅰ/Ⅱ期临床研究中也显示出良好的安全性[50].比酞菁多4个苯环的萘酞菁/萘菁,在750~900 nm具有很强的吸收峰,使PDT可治疗组织更深处的肿瘤[51].陈耐生等[52]历时14年研制的具有自主知识产权的创新药物——“福大赛因”(我国第一个全化学合成的锌酞菁抗癌光敏药物)已进入临床试验阶段,并取得了预期的效果.
2.3 第三代及新型光敏剂
第三代光敏剂一般具有分子识别功能[53],可通过某种具有生物学特性的物质与二代光敏剂结合,以提高光敏剂的靶向性.这些物质包括多聚体、脂质体、靶组织特异的抗体和配体等.例如,加拿大学者Mew发现将血卟啉与单克隆抗体相结合对靶细胞具有非常大的杀伤作用[54].酞菁-脂蛋白配合物相比于未配合的酞菁配合物,对肿瘤组织的摄取率无论在离体和在体实验中均有较大的提高[55].
近年来,纳米技术的革命性发展对PDT领域产生了重大影响[56].与常规光敏剂相比较,纳米光敏剂颗粒小、比表面积大、表面反应活性高、活性中心多、催化效率高、吸附能力强.许多纳米结构如金纳米离子、介孔二氧化硅纳米颗粒、碳纳米管、石墨烯、富勒烯[57]、二氧化钛[58]等已经被用于PDT领域[59].
上转换过程是指将吸收的多个低能量的光子转变成高能量发射光子的过程[60].上转换材料是将过渡金属、镧系金属或锕系金属离子掺杂于无机晶体基质中构成的,其中最常用的离子是镧系金属离子,因为镧系金属离子具有多个亚稳能态,有利于上转换过程的发生.上转换材料可吸收近红外光发出的紫外光和可见光.近几年,以上转换纳米颗粒(upconversion nanoparticles,UCNP)为基础的光动力治疗研究发展迅速,其原理是通过UCNP包裹光敏剂,用波长为980 nm的近红外光激发,发出的可见光将光敏剂激活并释放活性氧导致细胞死亡. Lim等[61]用NaYF4:Yb/Er-PEI上转换纳米颗粒对光敏剂酞菁锌(ZnPc)进行包裹,在近红外光的照射下产生大量活性氧与癌细胞发生光化学反应,导致癌细胞死亡,得到了较好的治疗效果.Idris等[62]制备了一种可以与两种光敏剂ZnPc和部花青540(MC540)相匹配的上转换纳米材料,实现了利用单一波长光源同时激发不同光敏剂的治疗手段.这种UCNPs-ZnPc-MC540与单一负载的光敏剂相比产生了更多的单线态氧,有效地减慢了荷瘤小鼠的肿瘤生长速率. Wang等[63]用NaYF4:Yb/Er@PEG对Ce6光敏剂进行装载,实现了治疗成像同步进行.该研究构建了4T1乳腺肿瘤Balb/c鼠模型,通过瘤内注射给药,再给予980 nm激光照射,实现了UCNP-PDT在体的治疗应用.目前由于UCNPs的激发波长为980 nm,而水在该波长也有吸收,使得波长980 nm激光的热效应明显[64],对正常组织会造成损伤.于是,Zhan等[65]使用915 nm激光代替了980 nm激光,降低了由于水的波长造成的激光热效应,减轻了对正常组织的损伤.Zou等[66]利用近红外光(near in frared,NIR)有机染料构建了一种宽激发带的上转换材料.后来,又有研究发现利用Nd3+作为光敏剂离子,可以构建对808 nm响应的UCNPs[67],使其在生物应用方面更加安全.尽管UCNP在光动力应用中仍然存在许多的问题,但是UCNP-PDT的联合疗法以其独特的优势无疑会成为未来研究和发展的一个重要方向.
3 结束语
光动力治疗的发展以其独特的优势取得了长足的进步.光敏剂作为光动力治疗的一个重要因素,已经历了从第一代到第二代、第三代乃至各种新型靶向纳米型光敏剂的发展,在各种肿瘤以及非肿瘤疾病的治疗过程中已被广泛应用,比如对一些腔道、腔体、体表的肿瘤及某些异常增生如消化道肿瘤、皮肤癌等具有非常好的疗效.近些年来,将光敏剂用于动脉粥样硬化等疾病的治疗研究也逐渐增多.理想的光敏剂应符合以下特性:①成分单一,理化性质稳定;②低毒性,副作用小;③靶向性好;④活性氧产量高;⑤对光吸收能力强[68].随着新型光敏剂的涌现,光动力治疗作为一种无创、安全的治疗方法,将会有非常广阔的应用前景,其在疾病治疗中的应用会越来越广泛.
[1]MOAN J,PENG Q.An outline of the hundred-year history of PDT[J].Anticancer Research, 2003,23(5A):3591-3600.
[2]VON TAPPEINER H,JODLBAUER A.Uber die wirkung der photodynamischen(fluorescierenden) stoffe auf protozoen und enzyme[J].Dtsch Arch Klin Med,1904,80:427-487.
[3]ABRAHAMSE H,HAMBLIN M R.New photosensitizers for photodynamic therapy[J].The Biochemical Journal,2016,473(4):347-364.
[4]AGOSTINIS P,BERG K,CENGEL K A,et al.Photodynamic therapy of cancer:an update[J]. CA:Cancer Journal for Clinicians,2001,61(4):250-281.
[5]WONG T W,WANG Y Y,SHEU H M,et al.Bactericidal effects of toluidine blue-mediated photodynamic action on Vibrio vulnificus[J].Antimicrobial Agents and Chemotherapy,2005, 49(3):895-902.
[6]POGUE B W,O’HARA J A,DEMIDENKO E,et al.Photodynamic therapy with verteporfin in the radiation-induced fibrosarcoma-1 tumor causes enhanced radiation sensitivity[J].Cancer Research,2003,63(5):1025-1033.
[7]FOOTE C S.Mechanisms of photosensitized oxidation[J].Science,1968,162(3857):963-970.
[8]ALLISON R,MANG T,HEWSON G,et al.Photodynamic therapy for chest wall progression from breast carcinoma is an underutilized treatment modality[J].Cancer,2001,91(1):1-8.
[9]CORTESE D A,EDELL E S,KINSEY J H.Photodynamic therapy for early stage squamous cell carcinoma of the lung[J].Mayo Clinic Proceedings,1997,72(7):595-602.
[10]刘端祺,刘慧龙,介雅慧,等.光动力学疗法治疗上消化道癌的临床研究[J].中国激光医学杂志, 2007,16(4):223-227.
[11]PANjEHPOUR M,OVERHOLT B F.Porfimer sodium photodynamic therapy for management of Barrett’s esophagus with high-grade dysplasia[J].Lasers in Surgery and Medicine,2006,38(5): 390-395.
[12]ALLISON R R,ZERVOS E,SIBATA C H.Cholangiocarcinoma:an emerging indication for photodynamic therapy[J].Photodiagnosis and Photodynamic Therapy,2009,6(2):84-92.
[13]NSEYO U O,DEHAVEN J,DOUGHERTY T J,et al.Photodynamic therapy(PDT)in the treatment of patients with resistant superficial bladder cancer:a long term experience[J].Journal of Clinical Laser Medicine&Surgery,1998,16(1):61-68.
[14]PENG Q,WARLOE T,BERG K,et al.5-aminolevulinic acid-based photodynamic therapy[J]. Cancer,1997,79(12):2282-2308.
[15]KENNEDY J C,POTTIER R H,PROSS D C.Photodynamic therapy with endogenous protoporphyrinⅨ:basic principles and present clinical experience[J].Journal of Photochemistry and Photobiology B:Biology,1990,6(1):143-148.
[16]FRANK R G,BOS J D.Photodynamic therapy for condylomata acuminata with local application of 5-aminolevulinic acid[J].Genitourinary Medicine,1996,72(1):70-71.
[17]SMITS T,VAN LAARHOVEN A I M,STAASSEN A,et al.Induction of protoporphyrinⅨby aminolaevulinic acid in actinic keratosis,psoriasis and normal skin:preferential porphyrin enrichment in differentiated cells[J].British Journal of Dermatology,2009,160(4):849-857.
[18]MA L,XIANG L H,YU B,et al.Low-dose topical 5-aminolevulinic acid photodynamic therapy in the treatment of different severity of acne vulgaris[J].Photodiagnosis and Photodynamic Therapy,2013,10(4):583-590.
[19]FINK-PUCHES R,SOYER H P,HOFER A,et al.Long-term follow-up and histological changes of superficial nonmelanoma skin cancers treated with topical δ-aminolevulinic acid photodynamic therapy[J].Archives of Dermatology,1998,134(7):821-826.
[20]FERNANDEZ-GUARINO M.Emerging treatment options for early mycosis fungoides[J].Clinical, Cosmetic and Investigational Dermatology,2013,6:61-69.
[21]KARRER S,KOHL E,FEISE K,et al.Photodynamic therapy for skin rejuvenation:review and summary of the literature—results of a consensus conference of an expert group for aesthetic photodynamic therapy[J].Journal Der Deutschen Dermatologischen Gesellschaft,2013,11(2): 137-148.
[22]许德余,殷祥生,陈文晖,等.肿瘤光化学诊治新药癌光啉(PsD-007)的研究[J].中国医药工业杂志, 1989(10):440-446.
[23]顾瑛,李峻亨.血啉甲醚用于光动力疗法治疗鲜红斑痣的初步临床研究[J].中国激光医学杂志, 1996,5(4):201-204.
[24]王伟,李辉,李家泽,等.肺癌组织血卟啉单甲醚激光诱发药物荧光与激光诱发自体荧光的光谱区别[J].中国激光医学杂志,2003,12(4):243-246.
[25]刘慧龙,刘端祺,介雅慧,等.三种光敏剂介导的光动力疗法治疗上消化道肿瘤的疗效比较研究[J].中国激光医学杂志,2011,20(6):359-365.
[26]NAKASHIZUKA T,MORI K,HAYASHI N,et al.Retreatment effect of NPe6 photodynamic therapy on the normal primate macula[J].Retina,2001,21(5):493-498.
[28]刘岩岩,王雪松,张宝文.竹红菌素类光动力药物[J].化学进展,2008,20(9):1345-1352.
[29]ZHENjUN D,LOWN J W.Hypocrellins and their use in photosensitization[J].Photochemistry and Photobiology,1990,52(3):609-616.
[30]ESTEY E P,BROWN K,DIWU Z,et al.Hypocrellins as photosensitizers for photodynamic therapy: a screening evaluation and pharmacokinetic study[J].Cancer Chemotherapy and Pharmacology, 1996,37(4):343-350.
[31]MILLER G G,BROWN K,BALLANGRUD A M,et al.Preclinical assessment of hypocrellin B and hypocrellin B derivatives as sensitizers for photodynamic therapy of cancer:progress update[J]. Photochemistry and Photobiology,1997,65(4):714-722.
[32]梁巧丽,高宏成.金丝桃素的研究进展[J].中草药,1999,30(9):705-708.
[33]KANG B Y,CHUNG S W,KIM T S.Inhibition of interleukin-12 production in lipopolysaccharideactivated mouse macrophages by hpyericin,an active component of hypericum perforatum[J]. Planta Medica,2001,67(4):364-366.
[34]PARK J,ENGLISH D S,WANNEMUEHLER Y,et al.The role of oxygen in the antiviral activity of hypericin and hypocrellin[J].Photochemistry and Photobiology,1998,68(4):593-597.
[35]MIROSSAY L,MIROSSAY A,KOCISOVA E,et al.Hypericin-induced phototoxicity of human leukemic cell line HL-60 is potentiated by omeprazole,an inhibitor of H+K+-ATPase and 5’-(N,N-dimethyl)-amiloride,an inhibitor of Na+/H+exchanger[J].Physiological Research, 1998,48(2):135-141.
[36]LIU C D,KWAN D,SAxTON R E,et al.Hypericin and photodynamic therapy decreases human pancreatic cancer in vitro and in vivo[J].Journal of Surgical Research,2000,93(1):137-143.
[37]KAMUHABWA A R,AGOSTINIS P,D’HALLEWIN M A,et al.Photodynamic activity of hypericin in human urinary bladder carcinoma cells[J].Anticancer Research,1999,20(4):2579-2584.
[38]CHEN B,DE WITTE P A.Photodynamic therapy efficacy and tissue distribution of hypericin in a mouse P388 lymphoma tumor model[J].Cancer Letters,2000,150(1):111-117.
[39]COLASANTI A,KISSLINGER A,LIUZZI R,et al.Hypericin photosensitization of tumor and metastatic cell lines of human prostate[J].Journal of Photochemistry and Photobiology B: Biology,2000,54(2):103-107.
[40]ALECU M,URSACIUC C,HALALAU F,et al.Photodynamic treatment of basal cell carcinoma and squamous cell carcinoma with hypericin[J].Anticancer Research,1997,18(6B):4651-4654.
[41]URSACIUC C,COTROCEANU C,BERENDEI I,et al.Ca+-ATPase activity in normal and tumoral murine lymphoid cells;down regulation by protein kinase inhibitor hypericin[J].Journal of Medicine and Biochemistry,2000,4(2):137-146.
[42]马晓华,梁海曼.姜黄素抗肿瘤作用与诱导肿瘤细胞凋亡的研究概况[J].国外医学(肿瘤学分册), 1999,26(1):21-23.
[43]许川山.中药姜黄素的光谱学特性研究[J].激光杂志,2005,26(4):86.
[44]陈瑞川,苏金华,马胜平,等.光敏化姜黄素诱导胃癌细胞凋亡[J].癌症,2000,19(4):321-324.
[45]贺桂芳,李红艳,徐波,等.姜黄素光动力疗法对人宫颈癌H8细胞的作用[J].中国激光医学杂志, 2013(1):15-20.
[46]LEITE D P V,PAOLILLO F R,PARMESANO T N,et al.Effects of photodynamic therapy with blue light and curcumin as mouth rinse for oral disinfection:a randomized controlled trial[J]. Photomedicine and Laser Surgery,2014,32(11):627-632.
[47]丁兰兰,栗立强,施佳伟,等.酞青在光动力治疗中的应用[J].无机化学学报,2013,29(8):1591-1598.
[48]ROSENTHAL I.Phthalocyanines as photodynamic sensitizers[J].Photochemistry and Photobiology,1991,53(6):859-870.
[49]FILONENKO E V,SOKOLOV V V,CHISSOV V I,et al.Photodynamic therapy of early esophageal cancer[J].Photodiagnosis and Photodynamic Therapy,2008,5(3):187-190.
[50]MILLER J D,BARON E D,SCULL H,et al.Photodynamic therapy with the phthalocyanine photosensitizer Pc4:the case experience with preclinical mechanistic and early clinical—translational studies[J].Toxicology and Applied Pharmacology,2007,224(3):290-299.
[51]LUAN L,DING L,ZHANG W,et al.A naphthalocyanine based near-infrared photosensitizer: synthesis and in vitro photodynamic activities[J].Bioorganic&Medicinal Chemistry Letters, 2013,23(13):3775-3779.
[52]陈耐生,薛金萍,黄金陵.用于光动力治疗抗癌新药“福大赛因”的药学与I期临床研究[C]//中国药学大会暨第十届中国药师周论文集.2010.
[53]田泽丹,许川山,全学模,等.声敏剂与光敏剂的研究进展[J].临床超声医学杂志,2008,10(1): 14-16.
[54]许德余,张浩.光动力治癌新药血卟啉单甲醚(HMME)的研究[J].中国激光医学杂志,1993,2(1): 3-7.
[55]POLO L,VALDUGA G,JORI G,et al.Low-density lipoprotein receptors in the uptake of tumour photosensitizers by human and rat transformed fibroblasts[J].The International Journal of Biochemistry&Cell Biology,2002,34(1):10-23.
[56]STAGGERS N,MC CASKY T,BRAZELTON N,et al.Nanotechnology:the coming revolution and its implications for consumers,clinicians,and informatics[J].Nursing Outlook,2008,56(5): 268-274.
[57]MROZ P,TEGOS G P,GALI H,et al.Photodynamic therapy with fullerenes[J].Photochem Photobiol Sciences,2007,6(11):1139-1149.
[58]BROWN E,ALLEN M,PYLES H,et al.Advancements in using TiO2bionanoconjugates for precision degradation of intracellular biological structures[J].Journal of Biomedical Nanotechnology, 2013,9(4):539-550.
[59]HUANG Y Y,SHARMA S K,DAI T,et al.Can nanotechnology potentiate photodynamic therapy?[J].Nanotechnology Reviews,2012,1(2):111-146.
[60]GAMELIN D R,GUDEL H U.Upconversion processes in transition metal and rare earth metal systems[M]//Transition metal and rare earth compounds.Berlin:Springer-Verlag,2001:1-56.
[61]LIM M E,LEE Y,ZHANG Y,et al.Photodynamic inactivation of viruses using upconversion nanoparticles[J].Biomaterials,2012,33(6):1912-1920.
[62]IDRIS N M,GNANASAMMANDHAN M K,ZHANG J,et al.In vivo photodynamic therapy using upconversion nanoparticles as remote-controlled nanotransducers[J].Nature Medicine,2012, 18(10):1580-1585.
[63]WANG C,CHENG L,LIU Z.Drug delivery with upconversion nanoparticles for multi-functional targeted cancer cell imaging and therapy[J].Biomaterials,2011,32(4):1110-1120.
[64]WANG Y F,LIU G Y,SUN L D,et al.Nd3+-sensitized upconversion nanophosphors:efficient in vivo bioimaging probes with minimized heating effect[J].ACS Nano,2013,7(8):7200-7206.
[65]ZHAN Q,QIAN J,LIANG H,et al.Using 915 nm laser excited Tm3+/Er3+/Ho3+-doped NaYbF4 upconversion nanoparticles for in vitro and deeper in vivo bioimaging without overheating irradiation[J].ACS Nano,2011,5(5):3744-3757.
[66]ZOU W,VISSER C,MADURO J A,et al.Broadband dye-sensitized upconversion of near-infrared light[J].Nature Photonics,2012,6(8):560-564.
[67]JAYAKUMAR M K G,IDRIS N M,HUANG K,et al.A paradigm shift in the excitation wavelength of upconversion nanoparticles[J].Nanoscale,2014,6(15):8441-8443.
[68]ASH D V,BROWN S B.New drugs and future developments in photodynamic therapy[J]. European Journal of Cancer,1993,29(12):1781-1783.
本文彩色版可登陆本刊网站查询:http://www.journal.shu.edu.cn
Advancement of photosensitizers for photodynamic therapy
HAN Xiaobo,ZHENG Yinghong,YANG Liming
(Department of Pathophysiology,School of Basic Medical Sciences, Harbin Medical University,Harbin 150081,China)
This paper reviews the main types of photosensitizers in photodynamic therapy (PDT).PDT has been widely used in the treatment of tumors and non-neoplastic diseases since its invention.In a photochemical reaction,a material is called photosensitizer if it can be activated by light with energy transferred to reactants without reaction.Photosensitizer is an important impact factor in PDT,and its research progress is important in the development of PDT.Photosensitizer has three generations:the first dominated by hematoporphyrin derivative,the second represented by porphyrin and porphin,and the third being modification of the second generation chemical groups.After decades of development,chemical properties of photosensitizer has become stable with less side effects.
photosensitizer;photodynamic therapy;porphyrin;phthalocyanin;upconversion nanoparticles
R 459.9
A
1007-2861(2017)02-0169-10
10.3969/j.issn.1007-2861.2017.01.007
2016-12-26
国家自然科学基金资助项目(81571833,81271734,81000688);黑龙江省自然科学基金资助项目(H2015006)
杨力明(1978—),男,教授,博士,研究方向为光敏剂介导的光动力治疗动脉粥样硬化.
E-mail:cooperationyang@126.com
