甘蓝型油菜烷羟化酶基因MAH1的克隆与表达分析
2017-05-24赵秋棱张双娟李加纳
徐 熠 彭 阳 李 帅 赵秋棱 张双娟 李加纳 倪 郁
甘蓝型油菜烷羟化酶基因的克隆与表达分析
徐 熠**彭 阳**李 帅 赵秋棱 张双娟 李加纳 倪 郁*
西南大学农学与生物科技学院, 重庆 400715
在植物蜡质合成途径中, 中链烷烃羟化酶(mid-chain alkane hydroxylase, MAH) 催化烷烃羟基化形成二级醇, 进一步氧化为酮。本研究以拟南芥P450依赖性酶CYP96A15/MAH1基因为探针, 采用电子克隆与RT-PCR技术, 获得2个甘蓝型油菜的全长编码区序列, 分别命名为和(GenBank登录号分别为KT795344和KT795345)。二者ORF长度均为1491 bp, 无内含子, 核苷酸与氨基酸序列分别有92.4%与90.9%的一致性。根据编码区预测的BnMAH1-1和BnMAH1-2前体蛋白均为包含496个氨基酸残基的多肽链, 具有典型的P450蛋白家族保守结构P415xR417x、K螺旋(E359xxR362)、C末端的血红素结合域(F436xxGxRxCxG445) 以及氧结合带保守区域(A/G)G309x(D/E)T312(T/S)。NCBI BlastN、氨基酸序列多重比对与系统学分析表明, 两者与拟南芥/同源性最高。实时荧光定量PCR表明,与主要在甘蓝型油菜茎、叶、花、及角果中表达, 其中在叶片中的表达量最高, 在根系中的表达量很低, 这与角质层蜡质主要沉积在植株地上部分相一致。和在无蜡粉材料茎、叶片中几乎不表达, 表明蜡质的减少与的转录下调有关。与受SA、MeJA、ACC、ABA、NaCl及干旱胁迫诱导表达, 其中可能在水分胁迫响应中起主要作用。
甘蓝型油菜; 角质层蜡质; 烷羟化酶
植物地上部分表面覆盖的角质层蜡质是植物抵御外界环境胁迫的第一层屏障, 具有多种生理和生态功能, 例如限制植物非气孔性水分散失[1-2]、防止外源病虫害侵入[3-4]、阻挡紫外线辐射[5-6]及降低灰尘、花粉和空气中的污染物在植物表面沉积等[7-8]。开展植物角质层蜡质代谢、运输和相关调控网络的研究, 对通过育种和栽培手段调控角质层以提高植物抗逆性有重要意义。目前在水稻、番茄、亚麻荠等作物中已有一些利用蜡质相关基因提高作物产量和抗旱性的研究报道[9-11]。植物角质层蜡质主要是由碳原子数在20~34之间的超长链脂肪酸(VLCFAs)及其衍生物(包括烷烃、醇、醛、酮、酯等)组成, 其中一级醇、酯类等主要由VLCFAs经酰基还原途径生成, 而烷类、二级醇和酮类等组分主要由VLCFAs经脱羰基途径生成[12]。Kolattukudy等[13]对甘蓝叶片的体外前体物质同位素标记试验证实, 烷烃和二级醇能够转化为酮类物质。拟南芥中, 细胞色素P450依赖性酶CYP96A15可催化烷烃羟基化生成二级醇, 进一步氧化成酮, 因此被称为中链烷烃羟化酶(MAH)[14]。
油菜是全世界广泛种植的一种油料作物, 也是我国第五大作物, 具有典型的角质层结构。通常情况下, 甘蓝型油菜叶和茎表皮均有蜡粉覆盖。甘蓝型油菜光叶突变体中与其他蜡质合成基因表达均下调[15]。白菜型油菜脂质转移蛋白基因在甘蓝型油菜中超表达导致叶片蜡质沉积减少, 并影响细胞分裂和花的发育[16]。MeJA与ACC处理显著诱导甘蓝型油菜中双11角质层蜡质总量与蜡质晶体密度的增加, 蜡质组分中烷类、次级醇类、酮类显著增加[17]。有关油菜蜡质基因功能研究鲜见报道, 本研究克隆甘蓝型油菜中链烷烃羟化酶基因, 并进行生物信息学分析与基因表达分析, 以期为通过育种和栽培手段调控角质层、提高油菜逆境胁迫的耐受性奠定基础。
1 材料与方法
1.1 试验材料和菌种
甘蓝型油菜中双11与无蜡粉材料NoWax, 由西南大学油菜工程中心提供。将其按常规方法种植, 采集中双11根、茎、叶、花、角果, 储存于–80℃, 用于基因组DNA与RNA的提取。采集NoWax材料的茎、叶用于RNA的提取。大肠杆菌()菌株DH5α感受态购自北京全式金生物技术有限公司。
1.2 激素及胁迫处理
采用溶液培养(以1/10的MS溶液配制培养液), 待中双11水培幼苗长至5片真叶时, 分别进行激素、盐胁迫与低温胁迫处理。激素处理是分别用200 μmol L–1水杨酸(SA)、100 μmol L–1茉莉酸甲酯(MeJA)、20 μmol L–1脱落酸(ABA)及200 μmol L–1乙烯合成促进剂1-氨基环丙烷-1-羧酸(ACC)处理6 h。盐胁迫处理是用100 mmol L–1NaCl溶液处理6 h。低温胁迫是幼苗在4℃下培养24 h。干旱胁迫处理是采用盆栽试验, 待幼苗长至5片真叶时连续7 d干旱, 对照组正常浇水。处理结束后, 取上述材料的叶片保存于–80℃, 用于RNA提取。
1.3 基因组DNA、总RNA的提取与cDNA合成
采用CTAB法提取基因组DNA。采用TransZol RNA提取试剂盒(TaKaRa)提取总RNA。用DNase I (TaKaRa)消化去除基因组DNA。依照TransScript First-Strand cDNA Synthesis SuperMix反转录试剂盒(北京全式金生物技术有限公司)进行样品mRNA的反转录。
1.4 电子克隆
以拟南芥为信息探针, 对甘蓝型油菜基因组数据库(http://www.ncbi.nlm.nih.gov/genome/203)进行同源性Blast检索分析。对检索到的甘蓝型油菜相关序列进行人工拼接与计算机软件预测, 获得包括完整ORF在内的相应基因的序列。
1.5 PCR扩增
根据电子克隆序列设计PCR引物BnMAH1- 1F/BnMAH1-1R、BnMAH1-2F/BnMAH1-2R (表1), 以中双11的cDNA与基因组DNA分别为模板扩增, PCR体系含10×PCR缓冲液(Mg2+) 5 μL、2.5 mmol L–1dNTPs 4 μL、10 μmol L–1上下游引物各1.5 μL、5 U μL–1酶0.8 μL、模板2.5 μL、加ddH2O 34.7 μL补足50 μL。其程序为94℃ 2 min; 94℃ 30 s, 55℃ 30 s, 72℃ 1 min, 35个循环; 72℃ 10 min。利用琼脂糖凝胶电泳检测, 回收目的片段, 与载体(pMD-19T Vector)连接, 转化感受态, 筛选阳性克隆并测序。
1.6 生物信息学分析
利用Vector NTI Advance 11. 5软件进行序列比对、翻译及绘制进化树, 在NCBI (http://www.ncbi. nlm.nih.gov/)网站上搜索GenBank Blast, 在http:// bip.weizmann.ac.il/和http://www.expasy.org/进行蛋白质结构、保守域、功能域分析。
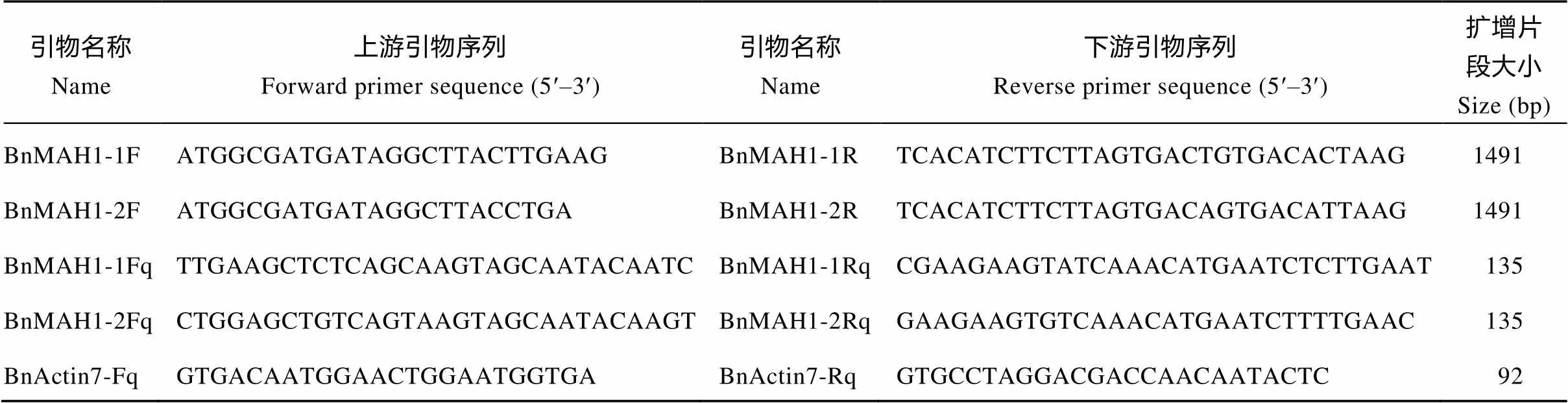
表1 甘蓝型油菜MAH1基因克隆引物与荧光定量PCR引物
1.7 实时荧光定量PCR
根据实际克隆获得的序列设计荧光定量PCR引物BnMAH1-1Fq/BnMAH1-1Rq、BnMAH1-2Fq/ BnMAH1-2Rq (表1), 在qTOWER2.2荧光定量PCR仪(德国耶拿)上扩增。按照ChamQ SYBR qPCR Master Mix试剂盒(Vazyme)说明配制反应体系, 含2×ChamQ SYBR qPCR Master Mix 10.0 μL、10 μmol L–1上下游引物各0.4 μL、cDNA 2.0 μL、ddH2O 7.2 μL。扩增程序为95℃30 s; 95℃ 5 s, 56℃ 30 s, 40个循环。作为内参基因, 设置3个生物学重复, 2个技术重复。
1.8 叶角质层蜡质的提取与组分分析
参考倪郁等[17]方法采集甘蓝型油菜展开叶片,于含氯仿的大试管内浸提1 min, 氯仿中预先加入已知浓度的C24烷作为内标。用氮吹仪蒸干浸提液, 再于70℃下用20 μL BSTFA与20 μL吡啶衍生45 min, 再次用氮吹仪蒸干, 将产物溶于200 μL氯仿中。用气相色谱仪(福立9790II, 浙江)分析测定蜡质组分及含量。气相色谱的毛细管柱长30 m, 直径为0.32 mm, 液膜厚度0.25 μm; 以氮气作为载气; 使用FID (火焰离子化检测仪)为检测器; 柱膜和FID检测器的温度分别为300℃和320℃; 使用的升温程序为初温80℃, 保持0.1 min, 后以15℃ min–1升至245℃, 保持5 min, 再以19℃ min–1升至325℃, 保持12 min。根据FID的峰面积确定蜡质的量, 利用GC-MS (岛津GC2010MS, 日本)鉴定蜡质组分, 参考内标正二十四烷计算各蜡质组分的实际含量(μg cm–2)。利用数字化扫描仪(EPSON V750)和WinFOLIA叶片专业图像分析软件(Regent Instrument Inc, Canada)测定并记录叶面积。每处理4个重复。
1.9 叶表皮蜡质结构的扫描电镜观察
将叶片干燥后用碳导电胶布固定在载物台上, 放入金属离子溅射仪(E1010, Hitachi)内喷镀导电膜, 于扫描电子显微镜(S3000-N, Hitachi)下观察镀金材料的形态。每处理4个重复。
2 结果与分析
2.1 甘蓝型油菜的克隆与序列分析
克隆到的2条序列ORF长度均为1491 bp, 无内含子, 编码496个氨基酸, 被分别命名为(GenBank登录号为KT795344)和(GenBank登录号为KT795345)。二者的核苷酸序列一致性为92.4%, 氨基酸序列一致性为90.9%。GenBank Blast搜索表明,和与拟南芥最同源。将推导的BnMAH1-1与BnMAH1-2蛋白与拟南芥P450家族成员以及亚麻荠() MAH1蛋白进行氨基酸序列多重比对(图1)。BnMAH1-1、BnMAH1-2与拟南芥CYP96A15最同源, 分别有77.7%/85.7%、80.7%/ 88.8%的序列一致性/相似性, 其次是亚麻荠CsMAH1, 序列一致性/相似性为66.8%/77.0%、67.2%/76.8%。系统进化分析(图2)表明, BnMAH1-1与BnMAH1-2首先与拟南芥CYP96A15聚在一起形成一个亚组, 然后与亚麻荠MAH1聚在一起, 之后依次与拟南芥CYP86家族的其他亚家族成员、CYP其他多家族成员聚在一起, 最后与CYP单家族成员聚集。蛋白质序列同源比对发现, BnMAH1-1、BnMAH1-2具有典型的P450蛋白家族保守结构域, 即P415xR417x结构域、K螺旋(E359xxR362)以及C末端的血红素结合域(F436xxGxRxCxG445), 同时还具有高度保守的(A/G)G309x(D/E)T312(T/S)序列, 是一个含苏氨酸(T)的氧结合带保守区域(图1)。
2.2与在甘蓝型油菜中的组织器官特异性表达特征
实时荧光定量PCR结果显示(图3),与主要在甘蓝型油菜茎、叶、花及角果中表达, 其中在叶片中的表达量最高, 其次是在角果和茎中, 而在根系中的表达量最低。的表达量在茎和叶片中高于, 在花和角果中略低于。
参加比对的有拟南芥P450家族成员AtCYP96A15(AT1G57750)、AtCYP86A4(AT1G01600)、AtCYP94C1(AT2G27690)、AtCYP72B1 (AT2G26710)、AtCYP71B2(AT1G13080)及亚麻芥CsMAH1(KJ461887)。图中完全相同、基本相同与相似程度低的氨基酸残基分别用黑色、深灰色与浅灰背景表示, 不相似氨基酸残基无背景色; 下画线加着重号表示的是细胞色素P450酶系中的保守结构域。
The P450 proteins (accession numbers in parentheses) AtCYP96A15 (AT1G57750), AtCYP86A4 (AT1G01600), AtCYP94C1 (AT2G27690), AtCYP72B1 (AT2G26710) and AtCYP71B2 (AT1G13080) from, and MAH1 (KJ461887) fromare aligned. In the panel, identical, conservative, weakly similar and non-similar residues are denoted with the background of dark, dark gray, light gray and white, respectively. In consensus line the conserved residues and domains are underlined and doted.
AtCYP96A15(AT1G57750)、AtCYP86A4(AT1G01600)、AtCYP94C1(AT2G27690)、AtCYP72B1(AT2G26710)、AtCYP71B2(AT1G13080)、AtCYP51A2(AT1G11680)、AtCYP74A(AT5G42650)、AtCYP704B1(AT1G69500)来自拟南芥P450家族, CsMAH1(KJ461887)来自亚麻芥。
AtCYP96A15 (AT1G57750), AtCYP86A4 (AT1G01600), AtCYP94C1 (AT2G27690), AtCYP72B1 (AT2G26710), AtCYP71B2 (AT1G13080), AtCYP51A2 (AT1G11680), AtCYP74A (AT5G42650), and AtCYP704B1 (AT1G69500) are from P450 proteins of, andCsMAH1 (KJ461887) from.
2.3与在有蜡粉与无蜡粉材料中的表达
甘蓝型油菜中双11叶表皮蜡质晶体结构以杆状、颗粒状(小型片状)为主, 而无蜡质材料NoWax叶表面无蜡质晶体结构覆盖(图4)。GC-MS分析结果表明, 与中双11相比, NoWax材料叶角质层蜡质各组分含量以及蜡质总量均显著下降, 其中酮含量下降92.87% (图5)。由图6可知,和在ZS11茎、叶片中均有表达, 而在NoWax材料茎中表达量很低, 在叶片中几乎不表达。
2.4与在不同胁迫处理下的表达
荧光定量PCR结果表明(图7), SA、MeJA、ACC以及ABA均不同程度地诱导和的表达, 其中MeJA、ABA诱导表达上调10倍以上。NaCl及干旱胁迫下,和表达均显著上调, 而低温胁迫下和表达均显著下调。
3 讨论
植物角质层是植物与外界环境的第一接触面, 是植物应对生物和非生物逆境的重要屏障, 其中的角质层蜡质是由堆积在角质层最外层有独特三维结构的表皮蜡质和填充于角质中的内部蜡质组成, 具有多种生理和生态学功能。角质层蜡质主要由VLCFAs、烷烃、一级醇、二级醇、酮、醛、酯等组成。前人利用反向遗传学的方法在拟南芥茎中发现了一个与二级醇和酮合成相关的细胞色素P450依赖性酶CYP96A15, 称之为中链烷烃羟化酶(MAH1)[14]。P450基因是一个古老的超基因家族, 基于蛋白序列的相似性和亲缘关系, 陆生植物P450可分为11簇, 归为单家族簇(CYP51、CYP74、CYP97、CYP710、CYP711、CYP727、CYP746)和多家族簇(CYP71、CYP72、CYP85、CYP86) 2类。拟南芥中发现有272个P450基因, 其中CYP86家族簇包含33个基因, 分别聚类在CYP86、CYP94、CYP96和CYP704家族中[18-19]。拟南芥CYP96家族中包含8个亚家族, 分别为CYP96A、CYP96B、CYP96C、CYP96D、CYP96E、CYP96F、CYP96G和CYP96H, 其中CYP96A亚家族包含15个基因成员, 到目前为止,只有CYP96A15被发现与角质层蜡质合成有关, 最终被鉴定为MAH。本研究以拟南芥基因为探针, 从甘蓝型油菜中克隆了2个MAH1基因和。在核苷酸水平与氨基酸水平上, 这2个基因与拟南芥同源性最高、与亚麻荠其次。多重比对及系统发生树结果表明, BnMAH1-1和BnMAH1-2首先与CYP96A15聚在一起, 其次与CYP86, 再次与其他P450家族成员聚在一起。前人研究表明, 细胞色素的三维结构非常保守, 其中保守的血红素结合域FxxGxRxCxG序列是鉴定P450类蛋白的主要特征[20-21]。和氨基酸序列结构分析表明, 它们在第436至第445个氨基酸处均含有血红素结合域FxxGxRxCxG (图1)。该结构域中存在与铁元素形成硫醇盐离子键的绝对保守的半胱氨酸(C)残基。此外, BnMAH1-1和BnMAH1-2中还含有P450的其他保守结构域P415xR417x、K螺旋(E359xxR362)及氧结合带保守序列(A/G)G309x(D/E)T312(T/S), 它们可能在蛋白质的折叠、组装中起关键作用[18,22]。这些结果表明, 本研究所克隆到的和序列是编码中链烷烃羟化酶的基因序列, 是对应于拟南芥的2个垂直同源基因。
陆生植物地上大部分器官都有角质层蜡质覆盖, 蜡质是植物功能器官的重要结构。本研究结果表明,与基因主要在甘蓝型油菜茎、叶、花、角果中表达, 其中在叶片中的表达量最高, 在根系中表达量很低(图3)。这与角质层蜡质主要沉积在植物地上部分的特性相一致。和在无蜡质材料茎、叶片中几乎不表达, 暗示了蜡质的减少与的转录下调有关。与中双11相比, NoWax材料叶角质层蜡质中包括酮类在内的各组分含量以及蜡质总量均显著下降(图4和图5),而在蜡质合成基因表达方面, 除外, 负责烷类合成的、负责一级醇合成的等的转录水平也都下调。由、、等基因各成员启动子同时发生突变而导致这些蜡质合成基因转录水平下调的可能性几乎为零, 因此很有可能是调控蜡质合成基因表达的上游信号基因发生改变, 进而抑制蜡质合成基因表达。和可能活跃地参与了甘蓝型油菜地上部分, 尤其是叶片角质层蜡质的沉积。
数据柱上*与**分别表示在<0.05或<0.001水平上差异显著。
Asterisk and double asterisks above data bars indicated significance at<0.05and<0.001, respectively according to Student’s-test.
角质层蜡质的沉积除受发育状况的控制外, 还对水分、光强、寒冷、季节变化等环境信号响应[23]。拟南芥叶片角质层蜡质在盐、干旱胁迫以及施用外源ABA后增加[24], 而在黑暗中减少[25]。当玉米四叶期被低温处理7 d时, 其第三片叶角质层蜡含量减少29%[26]。进一步在分子水平上的研究发现, 拟南芥蜡质合成基因、、在盐、水分胁迫下转录水平上调, 而在低温与黑暗条件下转录水平下调[27]。本实验中, NaCl与干旱胁迫显著诱导了和的表达水平上调, 低温胁迫则显著下调了和的表达, 表明是甘蓝型油菜响应逆境胁迫的蜡质基因。
植物在遭受各种生物和非生物胁迫时, 体内激素水平会发生变化以启动和调节某些与逆境适应相关的生理生化过程来诱导抗(耐)逆性的形成。ABA、ETH、SA、JA都是与植物逆境胁迫相关的激素。本试验表明, ABA、SA、MeJA以及ACC不同程度地诱导了和的转录上调, 其中MeJA与ABA的诱导效果最显著。前人研究报道, ABA可诱导独行菜叶片中大于C26的脂肪族物质含量的增加, 其耐旱性随之增强, 这可能是由于ABA对蜡质合成基因的诱导[28]。拟南芥在水分胁迫下, ABA通过上调转录因子MYB96的表达而促进蜡质合成基因、、与的表达, 最终促进角质层蜡质的积累[29]。这些结果表明, 植物激素作为信号分子可以调控蜡质合成基因的表达从而影响蜡质沉积, 最终影响植物对逆境胁迫的响应。本试验中, 干旱胁迫与ABA极大地诱导了的表达上调, 表明可能在响应水分胁迫中起主要作用。
4 结论
克隆了2个甘蓝型油菜中链烷烃羟化酶基因和, 它们是对应于拟南芥/的垂直同源基因;与主要在甘蓝型油菜地上部分组织器官中表达, 在叶片中的表达量最高, 在无蜡粉材料茎、叶片中几乎不表达, 暗示蜡质的减少与的转录下调有关,和可能活跃地参与甘蓝型油菜地上部分, 尤其是叶片角质层蜡质的沉积。与受SA、MeJA、ACC、ABA、NaCl及干旱胁迫诱导表达, 其中可能在水分胁迫响应中起主要作用。
References
[1] Schreiber L, Skrabs M, Hartmann K D, Diamantopoulos P, Simanova E, Santrucek J. Effect of humidity on cuticular water permeability of isolated cuticular membranes and leaf disks., 2001, 214: 274–282
[2] Riederer M, Schreiber L. Protecting against water loss: analysis of the barrier properties of plant cuticles., 2001, 52: 205–208
[3] Ficke A, Gadoury D M, Godfrey D, Dry I B. Host barriers and responses toin developing grape berries., 2004, 94: 438–445
[4] Eigenbrode S D, Rayor L, Chow J, Latty P. Effects of wax bloom variation inon foraging by avespid wasp., 2000, 97: 161–166
[5] Krauss P, Markstädter C, Riederer M. Attenuation of UV radiation by plant cuticles from woody species., 1997, 20: 1079–1085
[6] Ni Y, Xia R E, Li J N. Changes of epicuticular wax induced by enhanced UV-B radiation impact on gas exchange in., 2014, 36: 2481–2490
[7] Kunst L, Samuels A L. Biosynthesis and secretion of plant cuticular wax., 2003, 42: 51–80
[8] Barthhlott W, Neinhuis C. Purity of the sacred lotus, or escape from contamination in biological surface., 1997, 202: 1–8
[9] Zhou X, Jenks M, Liu J, Liu A, Zhang X, Xiang J, Zou J, Peng Y, Chen X. Overexpression of transcription factor OsWR2 regulates wax and cutin biosynthesis in rice and enhances its tolerance to water deficit., 2014, 32: 719–731
[10] Al-Abdallat A M, Al-Debei H S, Ayad J Y, Hasan S. Over-expression ofgene improves drought tolerance by increasing cuticular wax accumulation in tomato., 2014, 15: 19499–19515
[11] Lee S B, Kim H, Kim R J, Suh M C. Overexpression of Arabidopsis MYB96 confers drought resistance invia cuticular wax accumulation., 2014, 33: 1535–1546
[12] Millar A A, Clemens S, Zachgo S, Giblin M, Taylor D C, Kunst L. CUT1, angene required for cuticular wax biosynthesis and pollen fertility, encodes a very-long-chain fatty acid condensing enzyme., 1999, 11: 825–838
[13] Kolattukudy P E, Liu T Y. Direct evidence for biosynthetic relationships among hydrocarbons, secondary alcohols, and ketones in., 1970, 41: 1369–1374
[14] Greer S, Wen M, Bird D, Wu X, Samuels L, Kunst L, Jetter R. The cytochrome P450 enzyme CYP96A15 is the mid-chain alkane hydroxylase responsible for formation of secondary alcohols and ketones in stem cuticular wax of., 2007, 145: 653–667
[15] Pu Y, Gao J, Guo Y, Liu T, Zhu L, Xu P, Yi B, Wen J, Tu J, Ma C, Fu T, Zou J, Shen J. A novel dominant glossy mutation causes suppression of wax biosynthesis pathway and deficiency of cuticular wax in., 2013, 13: 1471–2229
[16] Liu F, Xiong X, Wu L, Fu D, Hayward A, Zeng X, Cao Y, Wu Y, Li Y, Wu G., a lipid transfer protein gene involved in epicuticular wax deposition, cell proliferation and flower development in., 2014, 9: 1–12
[17] 李帅, 赵秋棱, 彭阳, 徐熠, 李加纳, 倪郁. SA、MeJA和ACC处理对甘蓝型油菜叶角质层蜡质组分、结构及渗透性的影响. 作物学报, 2016, 42: 1827–1833 Li S, Zhao Q L, Peng Y, Xu Y, Li J N, Ni Y. Effects of SA, MeJA, and ACC on leaf cuticular wax constituents, structure and permeability in., 2016, 42: 1827–1833 (in Chinese with English abstract)
[18] Durst F, Nelson D R. Diversity and evolution of plant P450 and P450-reductases., 1995, 12: 189–206
[19] Nelson D R, Schuler M A, Paquette S M, Werck-Reichhart D, Bak S. Comparative genomics of rice and: analysis of 727 cytochrome P450 genes and pseudogenes from a monocot and a dicot., 2004, 135: 756–772
[20] Lee D S, Nioche P, Hamberg M, Raman C S. Structural insights into the evolutionary paths of oxylipin biosynthetic enzymes., 2008, 455: 363–368
[21] Schuler M A. Plant Cytochrome P450 monooxygenases., 1996, 15: 235–284
[22] Chen S, Zhou D. Functional domains of aromatase cytochrome P450 inferred from comparative analyses of amino acid sequences and substantiated by site-directed mutagenesis experiments., 1992, 267: 22587–22594
[23] Shepherd T, Wynne Griffiths D. The effects of stress on plant cuticular waxes., 2006, 171: 469–499
[24] Kosma D K, Bourdenx B, Bernard A, Parsons E P, Lü S, Joubès J, Jenks M A. The impact of water deficiency on leaf cuticle lipids of., 2009, 151: 1918–1929
[25] Go Y S, Kim H, Kim H J, Suh M C.cuticular wax biosynthesis is negatively regulated by thegene encoding an AP2/ERF-type transcription factor., 2014, 26: 1666–1680
[26] Gauvrit C, Gaillardon P. Effect of low-temperatures on 2,4-D behaviour in maize plants., 1991, 31: 135–142
[27] Joubès J, Raffaele S, Bourdenx B, Garcia C, Laroche-Traineau J, Moreau P, Domergue F, Lessire R. The VLCFA elongase gene family in: phylogenetic analysis, 3D modelling and expression profiling., 2008, 67: 547–566
[28] Macková J, Vašková M, Macek P, Hronková M, Schreiber L, Šantrůček J. Plant response to drought stress simulated by ABA application: changes in chemical composition of cuticular waxes., 2013, 86: 70–75
[29] Seo P J, Lee S B, Suh M C, Park M J, Go Y S, Park C M. The MYB96 transcription factor regulates cuticular wax biosynthesis under drought conditions in., 2011, 23: 1138–1152
Cloning and Expression Analysis of Alkane Hydroxylase Genefrom
XU Yi**, PENG Yang**, LI Shuai, ZHAO Qiu-Ling, ZHANG Shuang-Juan, LI Jia-Na, and NI Yu*
College of Agronomy and Biotechnology, Southwest University, Chongqing 400715, China
In wax biosynthesis, the mid-chain alkane hydroxylase (MAH) catalyzes the hydroxylation reaction from alkanes to secondary alcohols and further to corresponding ketones. In this study, usingP450-dependent enzyme CYP96A15/ MAH1 gene as a probe, the full-length coding sequences of twogenes,(GenBank accession number KT795344) and(GenBank accession number KT795345), were isolated bycloning and RT-PCR. The ORF lengths ofandwere 1491 bp, and no intron was included.andshared 92.4% and 90.9% of sequence identity at nucleotide and amino acid level, respectively. The predicted BnMAH1-1 and BnMAH1-2 protein contained 496 amino acid residues, with typical P450 protein family conserved domains P415xR417x, K helix (E359xxR362), C-terminal hemopexin-like domain (F436xxGxRxCxG445) and oxygen binding zone (A/G)G309x(D/E)T312(T/S). NCBI BlastN, multiple alignment of amino acid sequence, and phylogenetic analysis showed that they were most homologous toCYP96A15/MAH1. Real-time quantitative PCR showed thatandwere mainly expressed in stem, leaf, flower, and silique. The highest expression level was found in leaf and the lowest was in root, which was consistent with the wax deposition on aerial part of plant. The expression ofandwas barely detected in stem and leaf of wax deficient cultivar, suggesting that the reduced wax deposition is due to the down-regulation oftranscription. The expression ofandwas significantly induced by exogenous application of SA, MeJA, ACC, and ABA and exposure to NaCl and drought, among whichmay play a major role in response to water stress.
; Cuticular wax; Alkane hydroxylase
10.3724/SP.J.1006.2017.00640
本研究由重庆市基础与前沿研究计划项目(cstc2016jcyjA0170)和中央高校基本科研业务费专项资金(XDJK2014B037)资助。
This study was supported by the Chongqing Basic and Advanced Research Project (cstc2016jcyjA0170) and the Fundamental Research Funds for the Central Universities (XDJK2014B037).
(Corresponding author): 倪郁, E-mail: nmniyu@126.com**同等贡献(Contributed equally to this work)
E-mail: 714979637@qq.com, 327825919@qq.com
(收稿日期): 2016-11-04; Accepted(接受日期): 2017-03-01; Published online(网络出版日期): 2017-03-08.
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20170308.1709.002.html
