玉米开花期性状的QTL及杂种优势位点定位
2017-05-24杨慧丽林亚楠张怀胜卫晓轶薛亚东
杨慧丽 林亚楠 张怀胜 卫晓轶 丁 冬 薛亚东,*
玉米开花期性状的QTL及杂种优势位点定位
杨慧丽1林亚楠1张怀胜1卫晓轶2丁 冬1薛亚东1,*
1河南农业大学农学院, 河南郑州450002;2河南省新乡市农业科学院, 河南新乡453003
开花期是玉米进化和适应过程中的重要性状, 明确开花期杂种优势的遗传机制对培育适应不同生态区的优良玉米品种具有重要的意义。本研究利用以许178为受体, 综3为供体构建的包含203个SSSL的单片段代换系群体及其与许178的测交群体, 通过2年3个试点玉米开花期性状(散粉期、吐丝期和散粉至吐丝间隔) QTL和杂种优势位点(HL)分析, 分别鉴定出40个开花期相关性状的QTL和37个开花期相关性状的HL。其中6个QTL和4个HL在3个地点被同时检测到。在所检测到的染色体区段中, 11个区段同时包含调控开花期的QTL和HL。该研究为进一步解析玉米开花期遗传机制和开花期杂种优势的遗传机制提供了基础。
玉米; 单片段代换系; 开花期; QTL; 杂种优势
杂种优势是提高农作物产量、增强抗性、提高品质的一种重要生物学机制, 明确玉米杂种优势形成的遗传机制对优良玉米新品种的选育具有重要意义[1-3]。对不同作物研究发现, 解释某一作物某一性状的杂种优势理论存在差异。在玉米杂种优势研究中, Stuber等[4]最早利用分子标记对产量及其构成因子进行了QTL分析, 鉴定到多数QTL具超显性效应。这种超显性效应在产量及产量构成因子中起着重要作用[5]。Lu等[6]进一步证明玉米籽粒产量杂种优势主要表现为超显性, 而其他性状如株高、籽粒含水量和茎秆倒伏率表现出部分显性效应。Tang等[7]利用“永久F2”群体研究发现在检测到玉米株高的杂种优势位点中, 多数表现超显性效应。利用同样的群体, Tang等[8]对玉米产量及其主要构成因子杂种优势形成的遗传机制分析认为, 单位点水平上的显性效应(杂种优势位点)和两位点水平上加-显互作可以解释玉米杂交种豫玉22产量及产量相关性状的大部分杂种优势。Melchinger等[9]则从理论上证实杂种优势效应可具体到单个QTL, 且在整个遗传背景下能够评估单个QTL间的上位性效应。
除传统的遗传机制研究外, 目前在转录组、蛋白质组学、miRNA调控以及单个基因的克隆与遗传转化方面, 也对杂种优势分子机制进行了探索。Groszmann等[10]认为在基因水平上, 表观遗传产生的差异可能产生杂种优势。Li等[11]发现转录因子LaAP2L1参与了落叶松属杂交种的杂种优势形成, 为选育高产的农作物和能源植物提供了可能。Guo等[12]研究表明转玉米ARGOS1 (ZAR1)基因的超表达, 会增加玉米的生长势、籽粒产量及抗旱性。高表达赤霉素途径相关基因GID1、GAI、GIP、GAMYB可以对株高产生杂种优势[13]。昼夜节律基因CCA1、LHY和TOC1参与拟南芥中杂种优势性状的调节[14]。然而, 仅通过上述几个杂种优势基因的研究显然难以全面理解杂种优势的机制。
开花期是一个复杂的性状, 具有广泛的变异, 拟南芥的开花期由少数主效QTL控制[15], 而玉米中每个QTL对表型变异的贡献率都比较小[16]。通过突变体和同源克隆, 也发现玉米中一些与开花相关的基因, 如不分化基因()[17]、延迟开花基因()[18]、营养生殖转变基因()[19]、光周期相应调节基因()[20]、矮化基因()、类CONSTANS基因()[21]、基因[22]以及基因[23]。对开花期的研究多集中在相关QTL和基因的克隆及开花模型的建立, 对开花期相关性状的杂种优势报道相对较少。番茄中首次克隆了一个开花期相关的杂种优势基因SFT (single flower truss)[24], 进一步研究表明该基因通过对成花途径的剂量感应优化茎尖结构, 引发产量的杂种优势[25]。水稻除与产量相关外, 对开花期的杂种优势也有贡献[26]。由于任何一个性状的杂种优势的表现都是多个性状相互作用和影响的结果, 因此如何将单个性状杂种优势的表现剖分为单基因水平是研究杂种优势遗传机制的关键。本研究利用单片段代换系与许178的测交群体, 通过两年多点的田间鉴定, 对综3与许178特定染色体片段上控制开花期相关构成因子的QTL和杂种优势位点进行了分析。
1 材料与方法
1.1 试验材料
一套包含203个玉米单片段代换系(single segment substitution lines, SSSL)群体是以优良玉米自交系综3为供体亲本、许178为受体亲本, 通过杂交F1与受体亲本连续回交4代, 然后自交, 并结合SSR分子标记辅助选择方法构建而成。SSSL平均代换片段长度47.67 cM, 导入片段总长11 394.22 cM, 覆盖玉米基因组67.56%[27]。2012年冬在海南以SSSL群体为母本, 受体亲本许178为父本, 测交得到对应的203个测交群体。
1.2 试验设计
于2013年夏和2014年夏分别在河南省鹤壁市农业科学院(浚县)、河南省新乡市农业科学院(新乡)和许昌试验田种植203个SSSL群体和对应测交群体, 以及2个亲本, 采取随机区组试验设计, 单行区, 行长4.0 m, 行距0.6 m, 密度为67 500株 hm–2。在每个地点设3次重复。田间管理措施同常规大田生产。
1.3 试验方法
在开花期, 记载散粉期(days to anthesis, DTA)和吐丝期(days to silking, DTS), 并计算散粉至吐丝间隔(anthesis silking interval, ASI)。散粉期是指播种至全区50%以上植株雄穗开始散粉的天数(d); 吐丝期是指播种至全区50%以上植株雌穗花丝吐出的天数(d); 散粉至吐丝间隔是指从散粉期到吐丝期之间的天数(d)。
1.4 数据处理
采用SPSS17.0统计软件, 对203个SSSL群体所调查的性状进行单因素的方差分析和Duncan’s多重比较。如果某一性状与许178在<0.05水平上差异显著, 即认为该单片段代换系代换片段上存在一个QTL, 并估算各个QTL的加性效应值及加性效应百分率[3]。
加性效应值= (单片段代换系的表型值 – 对照的表型值)/2;
贡献率= (加性效应值/对照的表型值)×100%。
利用3个地点的中亲优势值(MP)来检测杂种优势位点(heterotic loci, HL)[28]。
MP= (F1– MP)/MP×100%。
其中, MP = (单片段代换系的表型值+对照的表型值)/2; F1指对应测交群体的表型值。
如果测交群体的某一性状表型值与对应MP在<0.05上差异显著, 即认为该测交群体对应的单片段代换系代换片段上存在一个杂种优势位点[3]。
遗传效应分析根据SSSL及其测交群体的特点而定, 每个HL理论上仅存在一个显性效应(D), 并且可以通过测交群体的表型值计算出该位点上的加性效应(A)。D/A的比率反映了每个HL的遗传效应, D/A的比率<1、=1和>1分别表示部分显性(PD)、显性(D)和超显性(OD)[8]。
2 结果与分析
2.1 开花期相关性状的表型分析
2013年, SSSL群体浚县、新乡和许昌3个地点散粉期的平均值分别为59.9、58.6和62.1 d, 吐丝期的平均值分别为59.6、58.7和61.6 d, ASI的平均值分别为–2.8、0.1和–0.4 d。2014年(表1), SSSL群体3个地点散粉期和吐丝期的平均值均比2013年要高, 但两性状变化幅度在不同地点不同, 使ASI也发生相应的变化。2013年散粉期、吐丝期和ASI的遗传力分别为57.6%、56.5%和52.7%, 2014年相应的遗传力分别为60.6%、61.3%和58.9%。
2.2 开花期相关性状的中亲优势表现
由表2可见, 2013年在浚县、新乡和许昌3个地点, 测交群体散粉期的中亲优势值分别为–4.08%、–1.72%和0.24%, 变异范围分别为–29.12%~5.59%、–5.48%~3.35%和–7.01%~8.59%。测交群体吐丝期的中亲优势值分别为–1.64%、–1.17%和0.66%, 变异范围分别为–17.40%~5.02%、–6.15%~2.85%和–7.63%~7.88%。测交群体ASI的中亲优势值分别为1.31%、0.58%和0.36%。2014年在浚县、新乡和许昌3个地点, 测交群体散粉期的中亲优势值分别为–1.80%、–0.65%和–5.00%, 测交群体吐丝期的中亲优势值分别为–2.54%、–0.72%和–4.34%, 测交群体ASI的中亲优势值变异范围分别为–2.50%~1.50%、–1.33%~1.84%和–1.67%~2.67%。开花期相关性状的中亲优势值均偏低, 说明散粉期、吐丝期和ASI的杂种优势相对较低。
2.3 开花期性状的相关性
由表3可见, 在浚县、新乡和许昌3个地点, 散粉期与吐丝期均呈极显著正相关, 2013年相关系数分别为0.45、0.90和0.94, 2014年相关系数分别为0.87、0.78和0.89。吐丝期与ASI也呈极显著正相关, 且在两年试验中较为稳定, 2013年相关系数分别为0.33、0.29、0.48; 2014年为0.49、0.25、0.22。2013年在浚县和新乡两点, 散粉期与ASI呈极显著负相关(–0.34和–0.59)。2014年在新乡和许昌两点, 散粉期与ASI呈极显著负相关(–0.41和–0.25)。
对中亲优势值的相关性分析结果可以看出, 2013年在浚县、新乡和许昌3个地点, 散粉期与吐丝期均呈极显著正相关, 2013年相关系数分别为0.46、0.86和0.87, 2014年相关系数分别为0.84、0.76和0.88。吐丝期与ASI也呈极显著正相关。2013年在浚县和新乡两点, 2014年在新乡和许昌两点, 散粉期与ASI呈极显著负相关, 变化趋势与表型值一致。
2.4 开花期相关性状的QTL定位
2013年在浚县、新乡和许昌3个地点, 共定位到20个开花期相关性状QTL, 分布在除第7、第8、第10染色体外的其余7条染色体上(表4和图1), 包括8个散粉期QTL、9个吐丝期QTL、3个散粉至吐丝间隔QTL。共有4个散粉期和吐丝期QTL在3个地点被同时检测到, 其贡献率的范围为1.33%– 6.31%, 增效作用均来自综3的加性效应。
和逍遥子(张勇)以及他的年轻团队比起来,我确实有些不一样的东西,比如有创始人的光环,有自己的阐释问题、运营管理的方式方法。但是,他们身上的东西我也没有,比如知识结构的全面性、系统性。
2014年在3个地点共定位到20个开花期相关性状QTL, 其中对散粉期、吐丝期和散粉至吐丝间隔分别定位到8、8和4个QTL, 分布在除第4和第7染色体外的其余8条染色体上。共有1个散粉期QTL ()和1个吐丝期QTL ()在浚县、新乡和许昌3个地点被同时检测到,的贡献率为3.23%、3.35%和3.03%, 增效作用来自许178的加性效应;的贡献率分别为3.60%、2.99%和3.00%, 增效作用来自综3的加性效应。仅有umc1771–umc1990–umc1519片段在不同年份(qDTS92013, qDTS9a2014)间被共同检测到。年份间检测到共有片段较少可能与两年的7、8月份气温变异不一致有关。
2.5 开花期相关性状的杂种优势位点分析
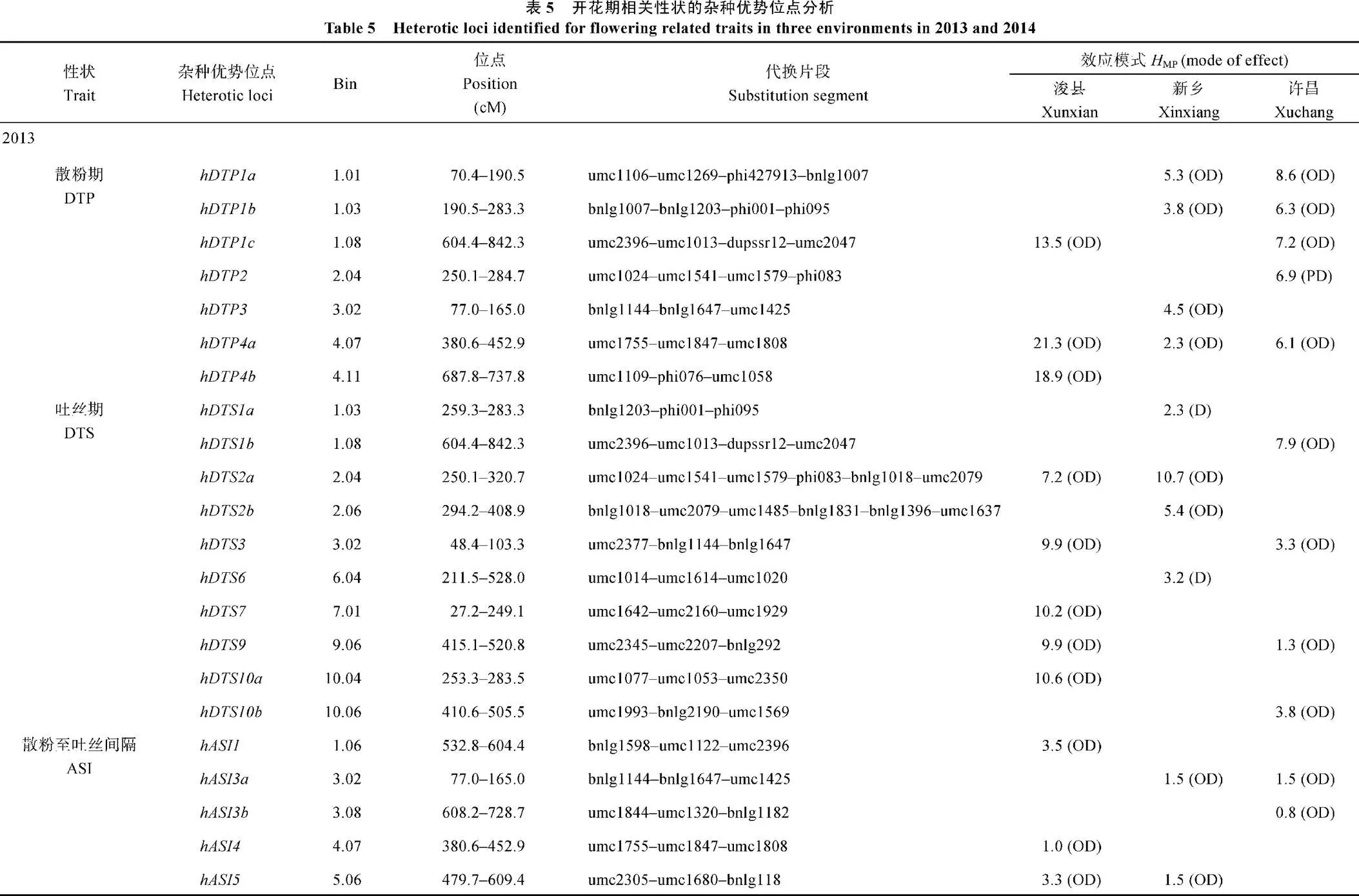
2013年共定位到22个散粉期、吐丝期和散粉至吐丝间隔的HL (表5), 分布在除第8外的其他染色体上, 包括7个散粉期HL、10个吐丝期HL、5个散粉至吐丝间隔HL, 其中有2个HL (9.1%)表现显性效应, 19个HL (86.4%)表现超显性效应, 1个HL (4.5%)表现部分显性效应。散粉期HL在浚县、新乡和许昌3个地点被同时检测到, 其中亲优势的表型贡献率分别为21.3%、2.3%和6.1%, 均表现出超显性效应。
2014年在3个地点共检测到5个散粉期HL、6个吐丝期HL、4个散粉至吐丝间隔HL, 各有1个散粉期、吐丝期和散粉至吐丝间隔HL在浚县、新乡和许昌点被同时检测到。其中中亲优势贡献率分别为11.9%、1.8%和10.6%, 表现超显性效应。中亲优势的贡献率分别为3.8%、2.6%和2.1%, 表现显性效应。中亲优势的贡献率分别为1.5%、1.2%和0.7%, 表现超显性效应。从遗传效应上来看, 有4个HL (26.7%)表现显性效应, 11个HL (73.3%)表现超显性效应。此外, 有2个HL,hDTS1a和hDTS1a在2年间被同时检测到受同一片段bnlg1203–phi001–phi095上的基因控制, 该导入片段同时影响散粉至吐丝间隔的杂种优势。
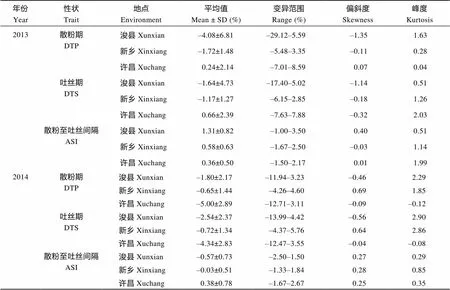
表2 开花期相关性状的中亲优势
缩写同表1。Abbreviations are the same as those given in Table 1.
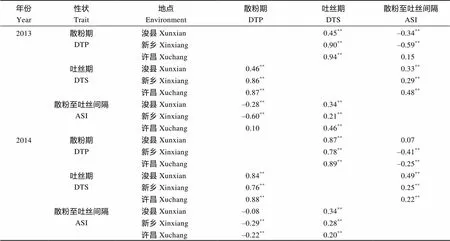
表3 开花期相关性状的相关系数
测交群体中性状表型和中亲优势的相关系数分别列于表中的上部和下部。*和**分别表示显著性达0.05和0.01水平。缩写同表1。
Correlation coefficients for phenotype and mid-parent heterosis of each trait are listed above and below the diagonal.*and**represent significance at the< 0.05 and< 0.01, respectively. Abbreviations are the same as those given in Table 1.
QTL: 数量性状位点; HL: 杂种优势位点; SSSL: 单片段代换系; DTA: 开花期; DTP: 散粉期; DTS: 吐丝期; ASI: 开花至吐丝间隔; KW: 粒宽; ED: 穗粗; RN: 穗行数; GY: 籽粒产量; EL:穗长; KN: 穗粒数; KL: 粒长; KPR: 行粒数; 100KW: 百粒重. 图例中下划线的性状来自于昌7-2导入Lx 9801的群体, 其他性状来自综3导入许178的群体。
QTL: quantitative qrait loci; HL: heterotic loci; SSSL: single-segment substitution line; DTA: days to anthesis; DTP: days to pollination; DTS: days to silking; ASI: anthesis-silking interval; KW: kernel width; ED: ear diameter; RN: row number; GY: grain yield; EL: ear length; KN: kernel number; KL: kernel length; KPR: kernel number per row; 100KW: 100-kernel weight. Traits underlined in the legend were results from SSSL population derived from introgression of Chang 7-2 into Lx 9801, others were from the population of Zong 3 into Xu 178.
在不少导入片段中既鉴定出控制某一性状的QTL, 同时也鉴定出控制杂种优势的位点, 甚至影响多个性状(图1), 如1.03bin的导入片段bnlg1203–phi001–phi095上的基因不但影响散粉期和吐丝期的QTL, 还影响吐丝期和散粉期的HL。而3.02bin的导入片段bnlg1144–bnlg1647–umc1425, 同时检测出控制吐丝至间隔期的QTL和HL。
3 讨论
农作物的产量和重要农艺性状多数表现为典型的数量性状, 因此构建不同的分离群体来进行QTL定位分析已成为研究数量性状的基础。玉米等作物常用的分离群体主要有F2[29]、BC1[30]、DH[31]、RIL[32]等初级作图群体, NIL[33]、IL[34]、SSSL[35]等次级群体。次级群体是在相似的遗传背景上进行QTL定位分析, 与初级作图群体相比消除了大部分遗传背景的干扰及QTL之间的互作, 提高了QTL定位的准确性[36]。Hua等[37]报道了一种用于遗传研究的高度杂合“永久F2”(IF2)作图群体, 群体的遗传结构同F2群体相似, 并且能够被重复利用。与之前的群体相比, 渗透系(IL)具有相对简单的遗传背景, 更有利于检测复杂性状的遗传机制[38]。本研究中利用的SSSL群体, 消除了背景差异和互作作用, 可以显著提高QTL的检测效率。
在杂种优势的遗传分析中, 选择合适的试验材料十分重要。与DH群体和RIL群体的基因组结构不同, 除了一个来自于受体亲本的染色体片段外, SSSL群体的基因组与受体亲本基本上相同。当SSSL群体用受体亲本测交时, SSSL测交群体与受体亲本相比, 仅存在一段染色体区域差异。与受体亲本相比, 如果SSSL测交群体中的一些性状表现出杂种优势, 利用孟德尔遗传模型, 可以直接鉴定出HL[39]。因此, SSSL群体结合其测交群体是进行QTL和HL定位和克隆的理想选择, 并在棉花、水稻和玉米杂种优势研究中得到了广泛应用[3,40-43]。本研究中, 利用SSSL测交群体有效地鉴定出40个玉米开花期性状的QTL及37个杂种优势位点。
基因的加性效应和数量性状的杂种优势效应在杂交种的表型中呈叠加效应, 因此很难精确区分2种基因遗传效应的表型值。前人曾用QTL定位和HL定位的方法对杂种优势的遗传机制进行研究[3,29-37,44]。本研究利用SSSL及其测交群体可以直接区分加性基因和杂种优势的表型值, 可以同时对单个性状进行QTL和HL分析, 并分析QTL和HL的遗传效应。在本研究检测到的37个开花期性状杂种优势位点中,有7个(18.9%)散粉期、吐丝期和ASI与QTL定位结果一致(17.5%), 分别位于第1、第3、第4、第6染色体上, 说明这些HL和QTL可能是同一基因; 而多数HL不具有相同的QTL, 从而在另外一个角度证明了杂种优势基因是真实存在的。此外, 通过与农艺性状[43]及产量性状[45]杂种优势位点比较发现,一些区段不但调控开花期性状的杂种优势, 而且影响产量的杂种优势, 甚至株高、雄穗分枝数的杂种优势也受到同一区段的影响, 如10.04 bin的umc1077–umc2207–bnlg292区段、3.02 bin的bnlg1144–bnlg1647–umc1425区段, 都同时影响多个性状的杂种优势(图1)。在杂种优势利用中最关心的问题是在某一群体中检测到的杂种优势位点能否在其他群体中检测到。Schön等[46]利用不同材料对玉米产量性状的杂种优势研究显示, 控制产量的杂种优势位点的位置在不同群体中高度一致。本研究中,1.08bin的umc1013–dupssr12–umc2047, 3.06bin的umc1954–umc1266, 10.06bin的umc2350等HL区段, 在不同材料构建的SSSL测交群体[41-42]中也被检测到。这些一致性杂种优势位点的结果表明不同杂种优势群或双亲本群中鉴定到的一致性杂种优势位点中所克隆到的杂种优势基因可以在后期杂种优势育种中得到有效的应用。
Schnable和Springer[47]认为杂种优势是多位点互作的结果, 并且对不同的杂交种, 不同性状的杂种优势受不同的位点所控制。因此, 一种作物的不同性状或不同的试验设计很难采用同一个杂种优势遗传机制来解释[48]。在本研究2年3个试点检测到的37个开花期HL中, 6个(16.2%) HL表现显性效应, 30个(81.1%) HL表现超显性效应, 1个(2.7%) HL表现部分显性效应, 说明显性和超显性效应是玉米开花期性状杂种优势形成的重要遗传机制。
4 结论
加性效应是开花期QTL的重要遗传组成, 而显性和超显性则是开花期杂种优势形成的重要遗传机制。本研究共检测到40个开花期相关性状的QTL和37个开花期相关性状的HL, 其中17个QTL和17个HL具有共同的染色体片段, 说明这些基因在不同的状态可发挥不同的调节作用; 在一些染色体片段同时检测到控制多个杂种优势位点, 表明这些性状可能存在相同的杂种优势遗传机制。
References
[1] Birchler J A, Yao H, Chudalayandi S, Vaiman D, Veitia R A. Heterosis., 2010, 22: 2105–2112
[2] Zhou G, Chen Y, Yao W, Zhang C, Xie W, Hua J, Xing Y, Xiao J, Zhang Q. Genetic composition of yield heterosis in an elite rice hybrid., 2012, 109: 15847–15852
[3] Guo X, Guo Y, Ma J, Wang F, Sun M, Gui L, Zhou J, Song X, Sun X, Zhang T. Mapping heterotic loci for yield and agronomic traits using chromosome segment introgression lines in cotton., 2013, 55: 759–774
[4] Stuber C W, Lincoln S E, Wolff D W, Helentjaris T, Lander E S. Identification of genetic factors contributing to heterosis in a hybrid from two elite maize inbred lines using molecular markers., 1992, 132: 823–839
[5] Lariepe A, Mangin B, Jasson S, Combes V, Dumas F, Jamin P, Lariagon C, Jolivot D, Madur D, Fiévet J, Gallais A, Dubreuil P, Charcosset A, Moreau L. The genetic basis of heterosis: multiparental quantitative trait loci mapping reveals contrasted levels of apparent overdominance among traits of agronomical interest in maize (L.)., 2012, 190: 795–811
[6] Lu H, Romero-Severson J, Bernardo R. Genetic basis of heterosis explored by simple sequence repeat markers in a random-mated maize population., 2003, 107: 494–502
[7] Tang J, Ma X, Teng W, Yan J, Wu W, Dai J, Li J. Detection of quantitative trait loci and heterotic loci for plant height using an immortalized F2population in maize., 2007, 52: 477–483
[8] Tang J, Yan J, Ma X, Teng W, Wu W, Dai J, Dhillon B S, Melchinger A E, Li J. Dissection of the genetic basis of heterosis in an elite maize hybrid by QTL mapping in an immortalized F2population., 2010, 120: 333–340
[9] Melchinger A E, Utz H F, Piepho H P, Zeng Z B, Schon C C. The role of epistasis in the manifestation of heterosis: a systems- oriented approach., 2007, 177: 1815–1825
[10] Groszmann M, Greaves I K, Albertyn Z I, Scofield G N, Peacock W J, Dennis E S. Changes in 24-nt siRNA levels in Arabidopsis hybrids suggest an epigenetic contribution to hybrid vigor., 2011, 108: 2617–2622
[11] Li A, Zhou Y, Jin C, Song W, Chen C, Wang C. LaAP2L1, a heterosis-associated AP2/EREBP transcription factor of Larix, increases organ size and final biomass by affecting cell proliferation in arabidopsis., 2013, 54: 1822–1836
[12] Guo M, Rupe M A, Wei J, Winkler C, Goncalves-Butruille M, Weers B P, Cerwick S F, Dieter J A, Duncan K E, Howard R J, Hou Z L, Löffler C M, Cooper M, Simmons C R. Maize ARGOS1 (ZAR1) transgenic alleles increase hybrid maize yield., 2014, 65: 249–260
[13] Zhang Y, Ni Z, Yao Y, Nie X, Sun Q. Gibberellins and heterosis of plant height in wheat (L.)., 2007, 8(1): 40
[14] Ni Z, Kim E D, Ha M, Lackey E, Liu J, Zhang Y, Sun Q, Chen Z J. Altered circadian rhythms regulate growth vigour in hybrids and allopolyploids., 2009, 457: 327–331
[15] Atwell S, Huang Y S, Vilhjálmsson B J, Willems G, Horton M, Li Y, Meng D, Platt A, Tarone A M, Hu T T, Jiang R, Muliyati N W, Zhang X, Amer M A, Baxter I, Brachi B, Chory J, Dean C, Debieu M, de Meaux J, Echker J R, Faure N, Kniskern J M, Jones J D, Michael T, Nemri A, Roux F, Salt D E, Tang C, Todesco M, Traw M B, Weigel D, Marjoram P, Borevitz J O, Bergelson J, Nordborg M. Genome-wide association study of 107 phenotypes in Arabidopsis thaliana inbred lines., 2010, 465: 627–631
[16] Buckler E S, Holland J B, Bradbury P J, Acharya C B, Brown P J, Browne C, Ersoz E, Flint-Garcia S, Garcia A, Glaubitz J C, Goodman M M, Harjes C, Guill K, Kroon D E, Larsson S, Lepak N K, Li H H, Mitchell S E, Pressoir G, Peiffer J A, Rosas M O, Rocheford T R, Romay M C, Romero S, Salvo S, Villeda H S, Silva H S, Sun Q, Tian F, Upadyayula N, Ware D, Yates H, Yu J, Zhang Z W, Kresovich S, McMullen M D. The genetic architecture of maize flowering time., 2009, 325: 714–718
[17] Colasanti J, Yuan Z, Sundaresan V. The indeterminate gene encodes a zinc finger protein and regulates a leaf-generated signal required for the transition to flowering in maize., 1998, 93: 593–603
[18] Muszynski M G, Dam T, Li B, Shirbroun D M, Hou Z, Bruggemann E, Archibald R, Ananiev E V, Danilevskaya O N. Delayed flowering1 encodes a basic leucine zipper protein that mediates floral inductive signals at the shoot apex in maize., 2006, 142: 1523–1536
[19] Salvi S, Sponza G, Morgante M, Tomes D, Niu X, Fengler K A, Meeley R, Ananiev E V, Svitashev S, Bruggemann E, Li B, Hainey C F, Radovic S, Zaina G, Rafalski J A, Tingey S V, Miao G H, Phillips R L, Tuberosa R. Conserved noncoding genomic sequences associated with a flowering-time quantitative trait locus in maize., 2007, 104: 11376–11381
[20] Coles N D, McMullen M D, Balint-Kurti P J, Pratt R C, Holland J B. Genetic control of photoperiod sensitivity in maize revealed by joint multiple population analysis., 2010, 184: 799–812
[21] Miller T A, Muslin E H, Dorweiler J E. A maize CONSTANS- like gene,, exhibits distinct diurnal expression patterns in varied photoperiods., 2008, 227: 1377–1388
[22] Bomblies K. Pleiotropic effects of the duplicate maize FLORICAULA/LEAFY genesandon traits under selection during maize domestication., 2005, 172: 519–531
[23] Meng X, Muszynski M G, Danilevskaya O N. The FT-Like ZCN8 gene functions as a floral activator and is involved in photoperiod sensitivity in maize., 2011, 23: 942–960
[24] Krieger U, Lippman Z B, Zamir D. The flowering genedrives heterosis for yield in tomato., 2010, 42: 459–463
[25] Jiang K, Liberatore K L, Park S J, Alvarez J P, Lippman Z B. Tomato yield heterosis is triggered by a dosage sensitivity of the florigen pathway that fine-tunes shoot architecture., 2013, 9(12): e1004043
[26] Xue W Y, Xing Y Z, Weng X Y, Zhao Y, Tang W J, Wang L, Zhou H J, Yu S B, Xu C G, Li X H, Zhang Q F. Natural variation inis an important regulator of heading date and yield potential in rice., 2008, 40: 761–767
[27] 张向歌. 基于玉米单片段代换系测交群体的植株性状杂种优势分析. 河南农业大学硕士学位论文, 河南郑州, 2014 Zhang X G. Analysis of Heterotic Loci for Plant Architecture Characters Using the Testcross Population of SSSLs in Maize. MS Thesis of Henan Agricultural University, Zhengzhou, China, 2014 (in Chinese with English abstract)
[28] 潘家驹. 作物育种学总论. 北京: 中国农业出版社, 1994 Pan J J. Crop Breeding. Beijing: China Agriculture Press, 1994 (in Chinese)
[29] Yu S B, Li J X, Xu C G, Tan Y F, Gao Y J, Li X H, Zhang Q, Maroof M A S. Importance of epistasis as the genetic basis of heterosis in an elite rice hybrid., 1997, 94: 9226–9231
[30] Causse M A, Fulton T M, Cho Y G, Ahn S N, Chunwongse J, Wu K, Xiao J, Yu Z, Ronald P C, Harrington S E, Second G, McCouch S R, Tanksley S D. Saturated molecular map of the rice genome based on an interspecific backcross population., 1994, 138: 1251–1274
[31] Zhu L, Chen J, Li D, Zhang J, Huang Y, Zhao Y, Song Z, Liu Z. QTL mapping for stalk related traits in maize (L.) under different densities., 2013, 12: 218–228
[32] Li Q C, Li Y X, Yang Z Z, Li Y. QTL mapping for plant height and ear height by using multiple related RIL populations in maize., 2013, 39: 1521–1529 (in Chinese with English abstract)
[33] Koester R P, Sisco P H, Stuber C W. Identification of quantitative trait loci controlling days to flowering and plant height in two near isogenic lines of maize.1993, 33: 1209–1216
[34] Zhang S, Feng L, Xing L, Yang B, Gao X, Zhu X, Zhang T, Zhou B. New QTLs for lint percentage and boll weight mined in introgression lines from two feral landraces into Gossypium hirsutum acc TM-1., 2016, 135: 90–101
[35] Lu M Y, Li X H, Shang A L, Wang Y M, Xi Z Y. Characterization of a set of chromosome single-segment substitution lines derived from two sequenced elite maize inbred lines., 2011, 56: 399–407
[36] 毛克举. 玉米染色体单片段代换系的构建与株型和开花期性状的QTL定位. 河南农业大学硕士学位论文, 河南郑州, 2013 Mao K J. Construction of Single Segment Substitution Lines in Maize and QTL Mapping for Flowering Time-related Traits. MS Thesis of Henan Agricultural University, Zhengzhou, China, 2013 (in Chinese with English abstract)
[37] Hua J, Xing Y, Wu W, Xu C, Sun X, Yu S, Zhang Q. Single-locus heterotic effects and dominance by dominance interactions can adequately explain the genetic basis of heterosis in an elite rice hybrid., 2003, 100: 2574–2579
[38] Qi H H, Huang J, Zheng Q, Huang Y Q, Shao R X, Zhu L Y, Zhang Z X, Qiu F Z, Zhou G C, Zheng Y L, Yue B. Identification of combining ability loci for five yield-related traits in maize using a set of testcrosses with introgression lines., 2013, 126: 369–377
[39] Liu G, Zhu H, Zhang G, Li L, Ye G. Dynamic analysis of QTLs on tiller number in rice (L.) with single segment substitution lines., 2012, 125: 143–153
[40] 王智权, 江玲, 尹长斌, 王晓玲, 雷建国, 肖宇龙, 刘喜, 刘世家, 陈明亮, 余传元, 万建民. 水稻产量相关农艺性状杂种优势位点的定位. 中国水稻科学, 2013, 27: 569–576 Wang Z Q, Jiang L, Yin C B, Wang X L, Lei J G, Xiao Y L, Liu X, Liu S J, Chen M L, Yu C Y, Wan J M. QTL mapping of heterotic loci for yield-related traits in rice., 2013, 27: 569–576 (in Chinese with English abstract)
[41] 郭战勇, 吕盼晴, 张向歌, 孙高阳, 王洪秋, 李卫华, 付志远, 汤继华. 利用单片段代换系的测交群体定位玉米籽粒性状杂种优势位点. 中国农业科学, 2016, 49: 621–631 Guo Z Y, Lyu P Q, Zhang X G, Sun G Y, Wang H Q, Li W H, Fu Z Y, Tang J H. Identification of heterotic loci for kernel-related traits using a maize introgression lines test population., 2016, 49: 621–631 (in Chinese with English abstract)
[42] 彭倩, 薛亚东, 张向歌, 李慧敏, 孙高阳, 李卫华, 谢慧玲, 汤继华. 利用单片段代换系测交群体定位玉米产量相关性状的杂种优势位点. 作物学报, 2016, 42: 482–491 Peng Q, Xue Y D, Zhang X G, Li H M, Sun G Y, Li W H, Xie H L, Tang J H. Identification of heterotic loci for yield and ear traits using t CSSL test population in maize., 2016, 42: 482–491 (in Chinese with English abstract)
[43] Wei X, Wang B, Peng Q, Wei F, Mao K, Zhang X, Sun P, Liu Z, Tang J. Heterotic loci for various morphological traits of maize detected using a single segment substitution lines test-cross population. Mol Breed [Internet], 2015, [cited 2016 March 8] 35(3) Available from: http://link.springer.com/10.1007/s11032-015- 0287-4
[44] 李卓坤, 谢全刚, 朱占玲, 刘金良, 韩淑晓, 田宾, 袁倩倩, 田纪春. 基于QTL 定位分析小麦株高的杂种优势. 作物学报, 2010, 36: 771–778 Li Z K, Xie Q G, Zhu Z L, Liu J L, Han S X, Tian B, Yuan Q Q, Tian J C. Analysis of plant height heterosis based on QTL mapping in wheat., 2010, 36: 771–778 (in Chinese with English abstract)
[45] Wei X, Lu X, Zhang Z, Xu M, Mao K, Li W, Wei F, Sun P, Tang J. Genetic analysis of heterosis for maize grain yield and its components in a set of SSSL testcross populations. Euphytica [Internet], 2016, [cited 2016 June 4] Available from: http://link. springer.com/10.1007/s10681-016-1695-1
[46] Schön C C, Dhillon B S, Utz H F, Melchinger A E. High congruency of QTL positions for heterosis of grain yield in three crosses of maize., 2010, 120: 321–332
[47] Schnable P S, Springer N M. Progress toward understanding heterosis in crop plants., 2013, 64: 71–88
[48] Shen G, Zhan W, Chen H, Xing Y. Dominance and epistasis are the main contributors to heterosis for plant height in rice., 2014, 215/216: 11–18
Mapping of QTLs and Heterotic Loci for Flowering Time-related Traits in Maize
YANG Hui-Li1, LIN Ya-Nan1, ZHANG Huai-Sheng1, WEI Xiao-Yi2, DING Dong1, and XUE Ya-Dong1,*
1College of Agronomy, Henan Agricultural University, Zhengzhou 450002, China;2Xinxiang Academy of Agricultural Sciences, Xinxiang 453003, China
Flowering is an important trait in maize evolution and adaptation. Dissecting the genetic basis of heterosis of flowering will promote the selection for elite hybrids adapted to different ecosystems. In this study, a panel of 203 single segment substitution lines (SSSLs) and its testcross population derived from an elite inbred line Xu 178 as recipient parent and inbred line Zong 3 as donor parent, were applied for mapping flowering time-related traits in maize. Flowering time-related traits, including days to anthesis (DTA), days to silk (DTA) and anthesis-to-silking interval (ASI), were scored in the two populations at three locations in two years. A total of 40 quantitative trait loci (QTLs) and 37 heterosis loci (HLs) for flowering-related traits were detected. Of them, six QTLs and four HLs were detected at the three locations simultaneously. Of all detected chromosomal regions, there were 11 regions in which the genes affected both flowering time-related QTLs and HLs.
Maize; Single segment substitution line; Flowering time; QTL; Heterosis
10.3724/SP.J.1006.2017.00678
本研究由国家自然科学基金项目(31271732)和国家重大基础研究发展计划(973计划)项目(2014CB138203)资助。
This study was supported by the National Natural Science Foundation of China (31271732) and the National Key Basic Research Program (2014CB138203).
(Corresponding author): 薛亚东, E-mail: yadongxue@aliyun.com, Tel: 0371-63558122
E-mail: yanghuili000@126.com
(收稿日期): 2016-06-04; Accepted(接受日期): 2016-11-02; Published online(网络出版日期): 2016-11-25.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20161125.1201.006.html
