无乳链球菌LIP蛋白的截短表达及免疫保护性研究
2017-05-24刘鸿艳张耀光张松林沈志强马永彪
刘鸿艳,张耀光,张松林,沈志强,马永彪
(1.西南大学生命科学学院,淡水鱼类资源与生殖发育教育部重点实验室,水产科学重庆市市级重点实验室,重庆 400715;2.山东省滨州畜牧兽医研究院,山东滨州 256600;3.山东省滨州海洋环境监测站,山东滨州 256600)
无乳链球菌LIP蛋白的截短表达及免疫保护性研究
刘鸿艳1,3,张耀光1,张松林2,沈志强2,马永彪2
(1.西南大学生命科学学院,淡水鱼类资源与生殖发育教育部重点实验室,水产科学重庆市市级重点实验室,重庆 400715;2.山东省滨州畜牧兽医研究院,山东滨州 256600;3.山东省滨州海洋环境监测站,山东滨州 256600)
为评价罗非鱼源无乳链球菌(Streptococcusagalactiae)BX2012株脂蛋白(lipoprotein)的免疫原性及其对奥利亚罗非鱼(Oreochromisaureus)和大菱鲆(Scophthalmusmaximus)的保护效果,以无乳链球菌脂蛋白基因序列(GenBank序列号:CP000114.1,SAK_0321)的B细胞线性抗原表位区设计特异性引物进行扩增,构建重组表达载体,将截短表达的脂蛋白制备成亚单位疫苗,同时制备灭活疫苗进行免疫比对。结果显示:重组表达载体pET-32a-LIP342在BL21(DE3)中获得了良好的可溶性表达,分子质量约为30 kDa,纯化使LIP342纯度由41.75%提至87.23%;Western blotting分析显示,LIP342可被兔抗无乳链球菌高免血清特异性识别;LIP342在目前已知不同种属来源或不同血清型的无乳链球菌分离株中同源性为90.35%~100%,在罗非鱼源分离株中同源性为100%;无乳链球菌LIP342蛋白和灭活疫苗均可显著提升奥利亚罗非鱼和大菱鲆血清抗体水平,而LIP342诱导的血清抗体水平均显著高于灭活疫苗;经0.1 mL 1×109cfu/mL的无乳链球菌攻毒后,LIP342蛋白和灭活疫苗对供试鱼的累积存活率均显著高于PBS对照组。结果表明,高度保守的LIP342具有较好的免疫原性,可作为无乳链球菌亚单位疫苗候选因子。
无乳链球菌(Streptococcusagalactiae);脂蛋白;截短表达;免疫保护;奥利亚罗非鱼(Oreochromisaureus);大菱鲆(Scophthalmusmaximus)
作为牛乳腺炎重要病原菌[1]和新生儿首要致病、致死菌[2]的无乳链球菌(Streptococcusagalactiae),近年来却引起了多种鱼类的爆发性感染和死亡,全球每年因无乳链球菌病造成的渔业损失均高达100亿美元[3],罗非鱼产业受该菌危害最为严重。无乳链球菌还存在种间交叉传播和人-兽-鱼共患的危险[4],而且人类对鱼类的消费,可显著增加人类受无乳链球菌感染的风险[5]。因此,安全、稳定、高效的无乳链球菌疫苗已成为人类医学、畜牧业和水产养殖业共同关注的焦点。但无乳链球菌含有10种血清型,各血清型间无交叉免疫作用[6],限制了灭活疫苗的应用。解决此问题的关键是寻求高度保守的抗原蛋白,以制备具有交叉免疫作用的疫苗。脂蛋白(Lipoprotein,LIP蛋白)是一类具有多种功能的膜蛋白,是细菌重要的毒力因子,能够激发强烈的免疫反应[7],可作为开发具有交叉免疫作用疫苗的候选因子。
本研究选取无乳链球菌脂蛋白在大肠杆菌(Escherichiacoli)中进行截短表达,以Western boltting分析其免疫原性,并与弗氏不完全佐剂结合,同时制备无乳链球菌灭活疫苗,比较研究二者对奥利亚罗非鱼(Oreochromisaureus)和大菱鲆(Scophthalmusmaximus)血清抗体水平的诱导情况和免疫保护效果,力求同时从淡水、海水鱼角度和暖水、冷水性鱼角度考量LIP342蛋白的免疫效果,为罗非鱼、大菱鲆的规模化健康养殖和经济效益的提升提供支撑,并为鱼源无乳链球菌亚单位疫苗的研究和应用提供支持,对渔业规模化生产、水产品质量提升、生态环境保护和人类公共健康有重要意义。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
罗非鱼源无乳链球菌BX2012株和原核表达质粒pET-32a(+)由山东省滨州畜牧兽医研究院预防兽医学与动物生物技术重点开放实验室提供。限制性核酸内切酶BamHⅠ和SalⅠ购自美国NEB公司,大肠杆菌BL21(DE3)感受态细胞购于宝生物工程(大连)有限公司。
1.1.2 血清与抗体
兔抗罗非鱼源无乳链球菌BX2012株高免血清由山东省滨州畜牧兽医研究院预防兽医学与动物生物技术重点开放实验室提供,兔抗罗非鱼免疫球蛋白多克隆抗体购自南京钟鼎生物技术有限公司,兔抗大菱鲆免疫球蛋白多克隆抗体由农业部海洋渔业可持续发展重点实验室(中国水产科学研究院黄海水产研究所)馈赠,辣根过氧化物酶标记的羊抗兔免疫球蛋白多克隆抗体IgG(H+L)购自美国Earthox公司。
1.1.3 供试鱼
奥利亚罗非鱼购自山东省淡水渔业研究院的国家级罗非鱼良种场,体重(42±8.52) g,养殖用水为曝气处理的自来水,水温(25±1) ℃;大菱鲆购自中国水产科学研究院下营增殖实验站,体重(64±10.38) g,养殖用水为市售海水晶经纯化水稀释而成的人工海水,盐度(23±1)‰,水温(17±1) ℃。每日按照鱼体重2%投喂饲料,暂养1周,供试鱼健康即可进行正式试验。
1.2 方法
1.2.1 引物设计与基因扩增
利用生物信息学技术分析GenBank中人源无乳链球菌脂蛋白基因序列(GenBank 序列号:CP000114.1,SAK_0321)的B细胞线性抗原表位区,截取31-144 aa区间(共计342 bp)设计特异性引物:上游引物为5′-GGGGGATCCTCAAACGAAGTAAAAAATAGCA-3′(下划线部分为BamHⅠ酶切位点),下游引物为5′-GGGGTCGACTTTATGTATATACGGCTTATTTAGC-3′(下划线部分为SalⅠ酶切位点),由宝生物工程(大连)有限公司合成。
利用试剂盒提取罗非鱼源无乳链球菌BX2012株基因组DNA进行PCR扩增,反应体系为:5×Buffer 4 μL,DNA模板2 μL,上下游引物(2 μmol/L)各5.0 μL,Taq0.2 μL,DMSO 0.6 μL,补加超纯水至20 μL。反应条件:98 ℃预变性30 s,98 ℃变性10 s、56 ℃退火30 s、72 ℃延伸45 s,共30个循环,最后72 ℃延伸10 min。1%琼脂糖凝胶电泳分离PCR产物后,用美国Omega试剂盒回收目的片段。
1.2.2 重组表达载体的构建与酶切鉴定
利用限制性核酸内切酶BamHⅠ和SalⅠ将目的片段定向克隆在pET-32a(+)的相应位点上,转化至受体菌BL21(DE3)中,然后涂种于含氨苄青霉素(100 μg/mL)的LB平板上。挑取阳性重组菌落,经37 ℃过夜培养后,抽提质粒,以BamHⅠ和SalⅠ进行酶切鉴定。鉴定正确的重组载体命名为pET-32a-LIP342,并送生工生物工程(上海)股份有限公司测序。
1.2.3 同源序列分析
以NCBI的BLAST在线系统(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列相似性搜索,用综合序列分析软件CLC Main Workbench7.6.2进行同源性分析,并以最大似然法(Maximum likelihood,ML)构建遗传进化树。
1.2.4 蛋白的表达与纯化
将包含阳性重组质粒pET-32a-LIP342的BL21(DE3)菌种划线接种于含氨苄青霉素(100 μg/mL)的LB平板上,37 ℃过夜培养后挑取单菌落接种于5 mL的LB培养液中,180 r/min振荡培养过夜后,按1∶100的比例接种于10 mL的LB培养液中,180 r/min振荡培养至OD600 nm=0.6时,加入IPTG至终浓度为1.0 mmol/L;37 ℃诱导4 h,取1 mL菌液于4 ℃条件下12 000 r/min离心1 min,在沉淀中加入50 μL的PBS缓冲液(pH 7.4)和10 μL的5×SDS上样缓冲液,100 ℃水浴变性10 min后进行12% SDS-PAGE分析。
pET-32a-LIP342经IPTG诱导进行大量表达,超声波破碎后取上清,利用His-Trap FF亲和层析柱,在KTApurifier 100蛋白纯化系统上进行纯化,经12% SDS-PAGE分析,用Quantity One 4.62软件检验纯度,小量分装后存储于-80 ℃备用。
1.2.5 Western blotting检测
纯化的LIP342蛋白经12% SDS-PAGE电泳后,用Trans-Blot SD将目的条带电转移至PVDF膜,PBS-T缓冲液(pH7.4)洗膜,用5%脱脂奶粉4 ℃封闭30 min,PBS-T洗涤,以兔抗罗非鱼源无乳链球菌BX2012株高免血清(1∶500)为一抗,室温孵育30 min,PBS-T洗涤,以HRP标记的羊抗兔IgG(1∶2 000)为二抗,室温孵育30 min,PBS-T洗涤,用DAB显色液显色10 min。
1.2.6 疫苗配制
将LIP342蛋白用0.01 mol/L的PBS(pH7.4)调整浓度为1 mg/mL,再与弗氏不完全佐剂(Sigma公司)等体积乳化,制成LIP342亚单位疫苗,浓度为500 μg/mL。置于4 ℃条件下保存备用。将罗非鱼源无乳链球菌BX2012株接种于BHI肉汤培养基,37 ℃静置培养24 h,加入终浓度0.5%的甲醛溶液,37 ℃静置48 h后,将浓度为109cfu/mL的菌液与等体积弗氏不完全佐剂乳化,制成灭活疫苗,浓度为5.0×108cfu/mL。PBS亦与等体积佐剂完全混匀用以对照。经BHI固体培养基培养,检验疫苗的无菌性;每种疫苗分别注射奥利亚罗非鱼和大菱鲆各10尾,每尾0.1 mL,观察其对鱼体是否存在毒副作用。通过无菌性和安全性检验的疫苗即可使用。
1.2.7 免疫与攻毒
两种鱼各设LIP342免疫组和灭活疫苗免疫组,另各设2个对照组,即PBS对照组和阴性对照组。罗非鱼每组50尾,大菱鲆每组40尾,以4 μL/g鱼体重的剂量进行一次性胸腔注射,即LIP342蛋白免疫剂量为2 μg/g鱼体重,PBS对照组和阴性对照组分别注射同等剂量PBS。
免疫后第4周,开始进行攻毒试验,奥利亚罗非鱼每组攻毒40尾,大菱鲆每组攻毒30尾,LIP342免疫组、灭活疫苗免疫组和PBS对照组每尾腹腔注射0.1mL 1×109cfu/mL 的无乳链球菌活菌悬液,阴性对照组0.1 mL的0.5%甲醛溶液;观察14 d,记录各组发病与死亡情况,计算相对保护率(Relative percentage survival,RPS),计算公式为:RPS=(1-免疫组死亡率/对照组死亡率)×100%。
1.2.8 血清抗体水平检测
分别在奥利亚罗非鱼和大菱鲆免疫的第0、7、14、21、28、35、42 d采集血清,每组每次随机取6尾供试鱼尾静脉取血,按间接ELISA法测定血清抗体水平:LIP342蛋白包被浓度为10 ng/μL,每孔100 μL,4 ℃过夜,PBS-T洗涤,5%BSA 100 μL封闭0.5 h,PBS-T洗涤,加入100 μL待检血清样品(1∶40),37 ℃孵育0.5 h,PBS-T洗涤,加入100 μL兔抗罗非鱼免疫球蛋白多克隆抗体或兔抗大菱鲆免疫球蛋白多克隆抗体(1∶1 000),37 ℃孵育0.5 h,PBS-T洗涤,加入100 μL HRP标记的羊抗兔IgG(1∶5 000),37 ℃孵育0.5 h,PBS-T洗涤,加100 μL TMB底物显色液显色5 min,加50 μL 2 mol/L的H2SO4终止反应;酶标仪OD450 nm处读数。
1.2.9 数据分析
用SPSS18.0软件对代表抗体水平的OD450 nm数值以Duncan多重比较进行单因素方差分析(One-Way ANOVA),当P<0.05时为差异显著。各组抗体水平以平均值±标准差(Means±SD)形式表示。攻毒后试验鱼的生存率采用Kaplan Meier法评估,以log rank test进行显著性分析,当P<0.05时为差异显著。
2 结果
2.1 LIP342的扩增及重组表达载体的鉴定
经PCR扩增,琼脂糖凝胶电泳检测到约342 bp的条带;构建的重组表达载体pET-32a-LIP342经BamHⅠ和SalⅠ双酶切,出现了约342 bp的目的条带,与预期相符(图1)。pET-32a-LIP342测序结果已提交GenBank,序列号为KU759324。
2.2 蛋白表达、纯化与Western blotting分析
经IPTG诱导后,重组表达载体pET-32a-LIP342在上清和包涵体均获得了表达;对可溶性表达的蛋白进行纯化后,LIP342蛋白纯度由41.75%提高至87.23%;Western blotting结果显示,LIP342蛋白能与兔抗罗非鱼源无乳链球菌BX2012株高免血清发生特异性结合。SDS-PAGE结果显示,重组蛋白大小在30 kDa左右,与预测结果一致(图2)。
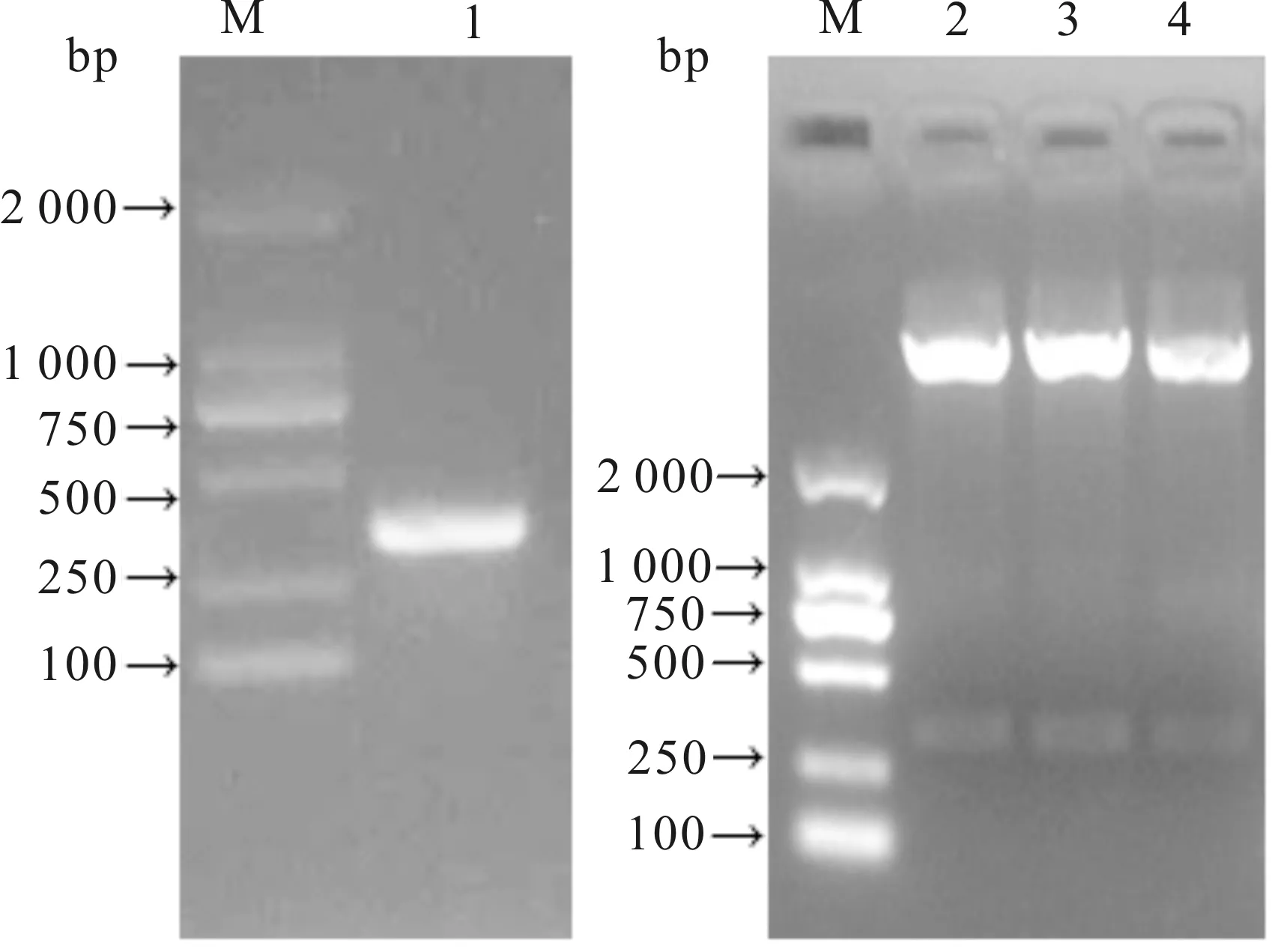
图1 PCR扩增和pET-32a-LIP342酶切鉴定结果Fig.1 PCR amplification and identification of pET-32a-LIP342 M:蛋白分子标准(DL2000);1:PCR扩增产物; 2-4:pET-32a-LIP342经BamHⅠ和SalⅠ酶切
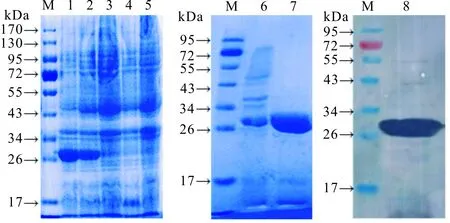
图2 LIP342蛋白表达、纯化与Western blotting分析Fig.2 Expression, purification and Western blotting of LIP342 M:蛋白质分子标准;1,IPTG诱导后的pET-32a-LIP342包涵体;2,IPTG诱导后的pET-32a-LIP342上清; 3,未诱导的pET-32a-LIP342;4,IPTG诱导后的pET-32a;5,未诱导的pET-32a;6,纯化前的LIP342; 7,纯化后的LIP342;8;LIP342的Western blotting。
2.3 同源性分析
在GenBank中检索到16条与LIP342具有相似性的序列,LIP342在不同种属来源(人、牛、骆驼和罗非鱼)和不同血清型(Ia、III、IV、V和未知)无乳链球菌分离株中的同源性为90.35%~100%,在罗非鱼源分离株中的同源性为100%。蛋白序列在不同分离株中存在13处变异,其中的11项发生于法国人源AL766843和加拿大人源CP007632,另外2处发生于巴西人源CP010319。ML进化树显示法国人源AL766843和加拿大人源CP007632聚为一支;在余下的15个分离株中,巴西人源CP010319单为一支;LIP342和余下的13株亲缘较近,成为一支(图3)。
2.4 抗体检测
与PBS对照组和阴性对照组相比,LIP342免疫组和灭活疫苗免疫组奥利亚罗非鱼在接受免疫后,抗体水平从第1周开始显著提升,并持续升高到第4周,随后因攻毒而显著下降。从第2周开始,LIP342免疫组抗体水平一直显著高于灭活疫苗免疫组(图4)。
LIP342免疫组和灭活疫苗免疫组的大菱鲆血清抗体水平分别从第1周和第2周开始显著提升,均持续升高到第4周,随后因攻毒而显著下降。LIP342免疫组大菱鲆抗体水平一直显著高于灭活疫苗免疫组(图5)。
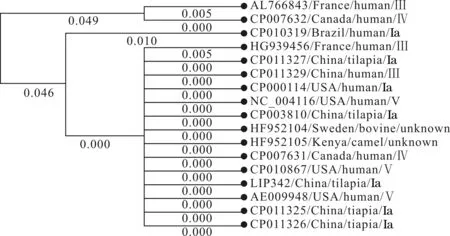
图3 LIP342的遗传进化分析Fig.3 Genetic evolution analysis of LIP342 among different strains
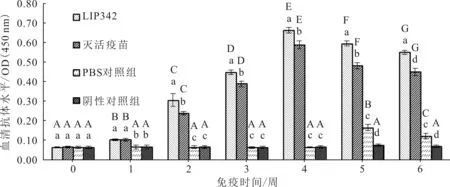
图4 各组奥利亚罗非鱼血清抗体水平变化Fig.4 Serum antibody levels of O.aureus
不同大写字母表示不同免疫时间,组内抗体水平差异显著;不同小写字母表示同一时间,组间抗体水平差异显著。图5同
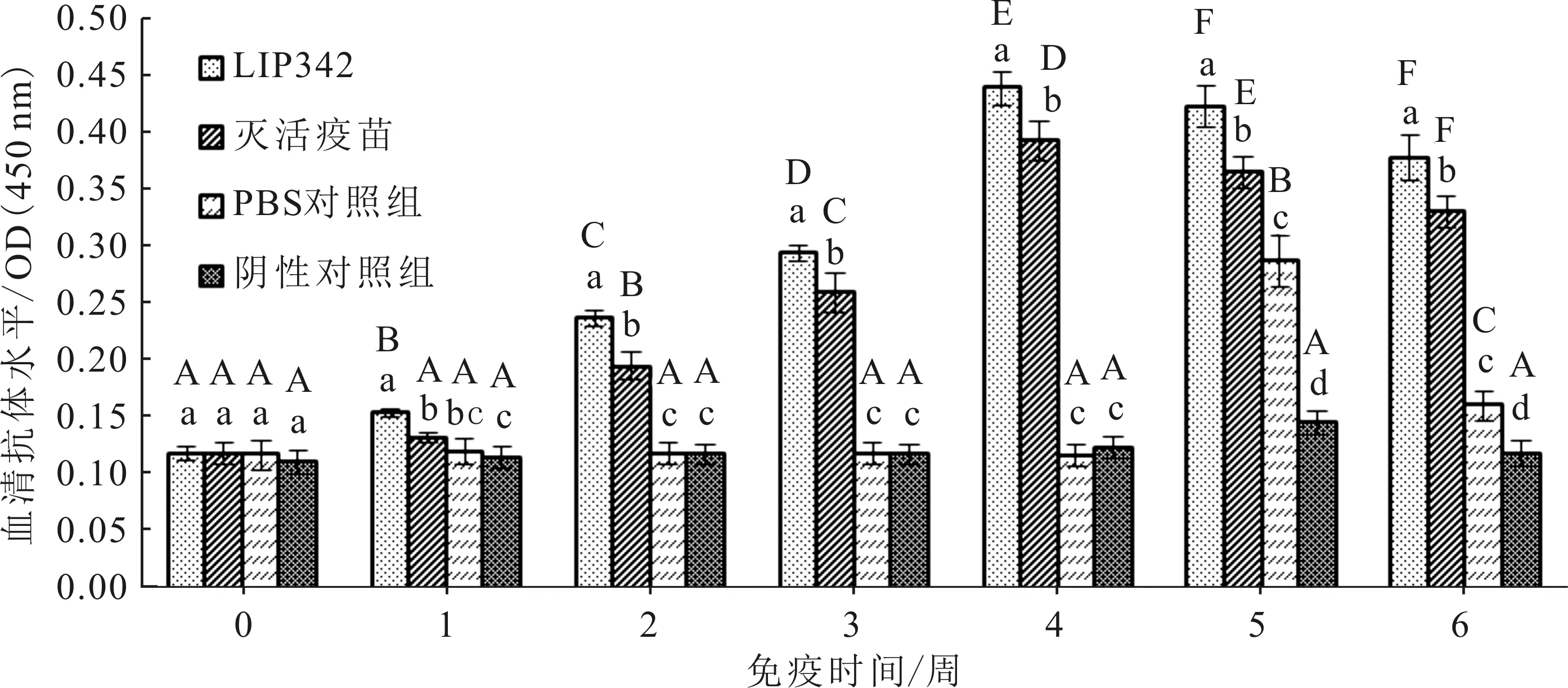
图5 各组大菱鲆血清抗体水平变化
Fig.5 Serum antibody levels ofS.maximus
2.5 攻毒试验
在免疫后的第4周,以0.1 mL 1×109cfu/mL的无乳链球菌活菌分别对奥利亚罗非鱼和大菱鲆进行攻毒,被攻毒的各组试验鱼在14 d内均出现了不同程度的发病甚至死亡现象,阴性对照组无死亡现象。注射疫苗后仍患病的供试鱼临床症状同PBS对照组相同,出现了眼球红肿或白浊性突出、体色发黑、肠道积水、肝脏脆化变大、胆囊肿大等典型症状。采集濒死鱼眼球、肝脏等病灶,经细菌培养和LIP342基因扩增,确定攻毒后的发病及死亡现象为该菌所致。
Kaplan-Meier生存检验结果显示,除去阴性对照组,LIP342免疫组奥利亚罗非鱼和大菱鲆的累积生存率均为最高,其次为灭活疫苗免疫组,二者累积生存率显著高于PBS对照组(图6、7)。LIP342蛋白对奥利亚罗非鱼和大菱鲆的RPS分别为75.0%和77.3%,均高于灭活疫苗(RPS分别为62.5%和54.5%)(图8)。
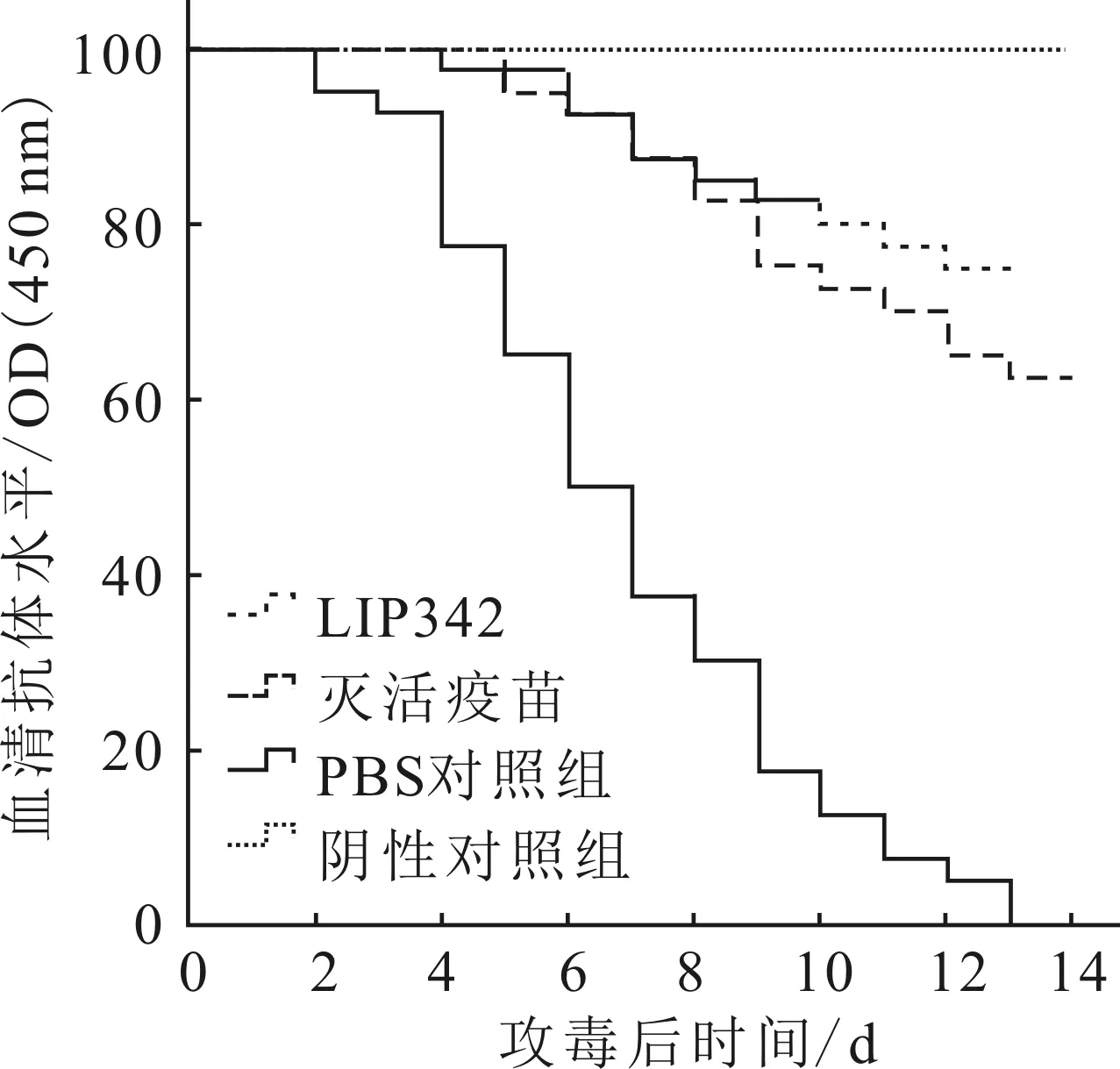
图6 奥利亚罗非鱼Kaplan-Meier生存曲线Fig.6 Kaplan-Meier survival curves of O.aureus
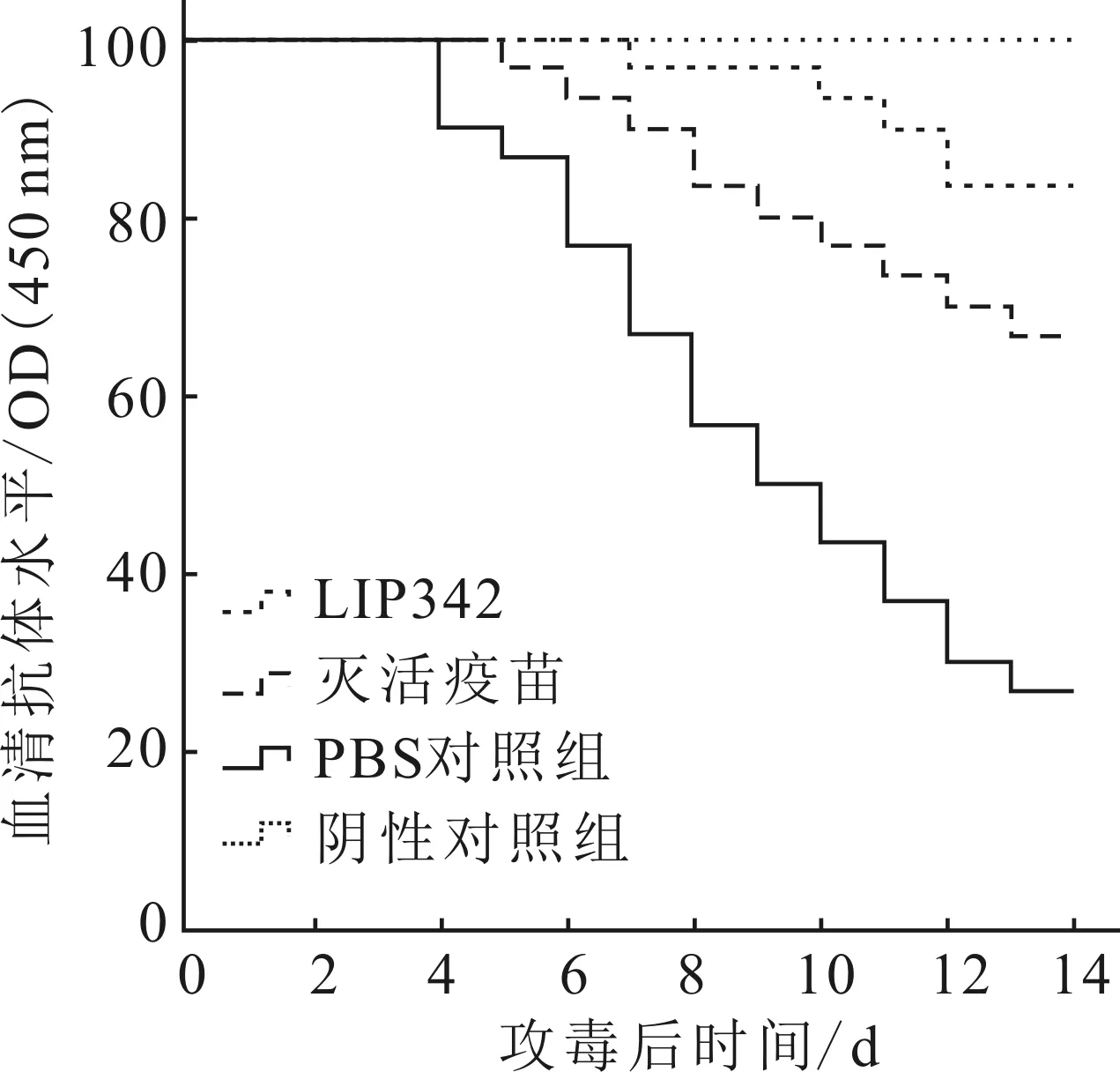
图7 大菱鲆Kaplan-Meier生存曲线Fig.7 Kaplan-Meier survival curves of S.maximus
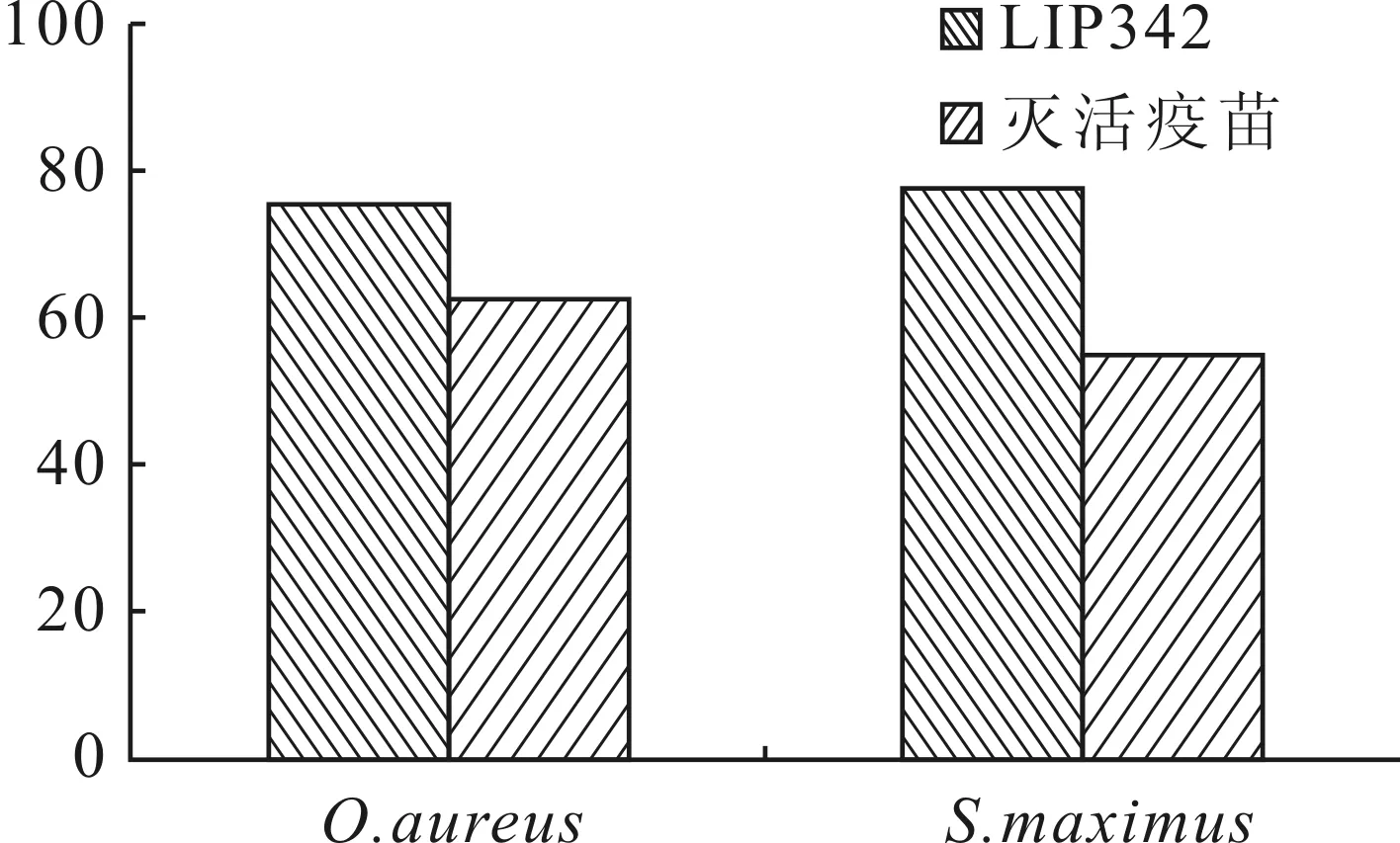
图8 各免疫组的相对保护率Fig.8 Relative percentage survivals of vaccined groups
3 讨论
鱼类链球菌病从2001年开始在中国以散发形式出现,受感染的罗非鱼死亡率为5%~15%[8];从2009年开始,无乳链球菌已替代海豚链球菌(S.iniae),成为我国以罗非鱼为代表的鱼类链球菌病的首要致病菌[9],发病率高达20%~50%,死亡率达50%~70%,甚至更高[10];到2011年该菌已波及95%以上的罗非鱼养殖场,死亡率高达30%~80%[11];此后,受感染的种类和地区日渐增多,发病规格亦日趋小型化[12]。但与海豚链球菌相比,无乳链球菌对鱼类的半致死浓度更低[13],可耐受的药物种类更少[14],药物防治难度更大。而且无乳链球菌含有多种致病性蛋白因子、毒力因子、超抗原(superantigen,SAg)和免疫逃避因子,易引起菌体的变态反应[15],如不同于以往的β-溶血性、CAMP阳性无乳链球菌菌株,我国广东已出现γ-溶血性、CAMP阴性的罗非鱼源菌株[16],并且该菌的一大特点是各血清型间无交叉免疫作用[6],因此传统的灭活疫苗和减毒活疫苗因效力、安全性等问题使得应用受限,致使无乳链球菌病不易防控。脂蛋白家族成员具有养分摄取、信号转导、粘附到宿主细胞、接合、孢子繁殖、形成耐药性、转运、蛋白质胞外折叠等功能,直接参与细菌的定殖、感染、免疫逃避和调控,影响宿主机体先天性免疫和获得性免疫系统[7,17]。脂蛋白家族成员约占无乳链球菌蛋白质组的2%,有些成员是该菌重要的毒力因子[18],也是研发无乳链球菌疫苗的良好候选目标[19]。脂蛋白大多暴露于细胞表面,属于表面蛋白[17],表面蛋白制备的疫苗对无乳链球菌具有很好的交叉保护作用[20],还可能在无乳链球菌感染的各个阶段起到免疫作用[15],因此针对血清型众多、抗原成分复杂的无乳链球菌,具有免疫原性的保守脂蛋白具有开发安全、高效、实用疫苗的巨大优势。
Pereira等[21]利用生物信息学比对分析GenBank收录的包括人、牛、骆驼和罗非鱼源的无乳链球菌基因组,预测出了一些高度保守、可作为疫苗靶标的抗原蛋白,LIP342即为其中之一。构建的重组表达载体pET-32a-LIP342在BL21(DE3)感受态细胞中获得了良好的可溶性表达。Westren blotting检验结果显示LIP342蛋白具有较好的免疫反应原性。无乳链球菌LIP342制备的亚单位疫苗和灭活疫苗均能够刺激奥利亚罗非鱼和大菱鲆显著提高血清抗体水平(P<0.05),并有效抵御1×109cfu/mL无乳链球菌的强毒攻击(P<0.05)。生物信息学分析、Western blotting检验和免疫保护试验结果验证了LIP342蛋白的免疫保护能力和研发价值,这同Pereira等[21]预测结果一致。LIP342蛋白诱导奥利亚罗非鱼和大菱鲆产生的血清抗体水平显著高于灭活疫苗(P<0.05),并表现出了较好的累积生存率和RPS,从免疫保护效果而言,可作为无乳链球菌灭活疫苗替代品的候选因子。近年来,无乳链球菌致名贵海水养殖鱼类大菱鲆突眼病爆发频繁[22]。无乳链球菌LIP342蛋白和灭活疫苗对大菱鲆具有良好的免疫效果,填补了大菱鲆无乳链球菌疫苗的报道空白,为其他海水鱼类无乳链球菌病的防控提供参考。
已被证实一些高度保守的无乳链球菌抗原蛋白具有非常好的交叉免疫作用,如Sip蛋白[20]和Rib蛋白[23]可抗无乳链球菌多种血清型菌株,GapC蛋白更可交叉免疫无乳链球菌、停乳链球菌(S.dysgalactiae)和乳房链球菌(S.uberis)[24],这是无乳链球菌高度保守的抗原蛋白作为疫苗研发的一大优势。LIP342在不同物种来源或不同血清型无乳链球菌分离株中的同源性为90.35%~100%,在罗非鱼源分离株中的同源性为100%,证明了该蛋白的高度保守性。由此推测,除奥利罗非鱼和大菱鲆以外,LIP342对其他易感染无乳链球菌的鱼类甚至牛等哺乳动物可能具有相似或相同的免疫保护功能。此外,罗非鱼源无乳链球菌BX2012株为Ia血清型,LIB342蛋白对其他血清型无乳链球菌的免疫效果有待进一步研究。
[1] Wang D G, Liu Y H. Development of primer sets for loop-mediated isothermal amplification that enables rapid and specific detection ofStreptococcusdysgalactiae,StreptococcusuberisandStreptococcusagalactiae[J]. Int J Environ Res Public Health, 2015, 12(6): 5735-5742.
[2] Edmond K M, Kortsalioudaki C, Scott S, et al. Group B streptococcal disease in infants aged younger than 3 months: systematic review and meta-analysis[J]. Lancet, 2012, 379(9815): 547-556.
[3] 邵 辰,易 弋,黎 娅,等.罗非鱼无乳链球菌巢式PCR检测方法的建立[J].淡水渔业,2016,46(2):40-44.
[4] Delannoy C M, Crumlish M, Fontaine M C, et al. HumanStreptococcusagalactiaestrains in aquatic mammals and fish[J]. BMC Microbiol, 2013, 13(1): 41.
[5] Rajendram P, Kyaw M W, Leo Y S, et al. Group B streptococcus sequence type 283 disease linked to consumption of raw fish, Singapore[J]. Emerg Infect Dis, 2016, 22(11): 1974-1977.
[6] Suanyuk N, Kong F, Ko D, et al. Occurrence of rare genotypes ofStreptococcusagalactiaein cultured red tilapiaOreochromissp. and nile tilapiaO.niloticusin Thailand-relationship to human isolates? [J]. Aquaculture, 2008, 284(1-4): 35-40.
[7] Hutchings M I, Palmer T, Harrington D J, et al. Lipoprotein biogenesis in Gram-positive bacteria: knowing when to hold 'em, knowing when to fold' em[J]. Trends Microbiol, 2009, 17(1):13-21.
[8] 柴家前,丁巧玲,王振龙,等.罗非鱼链球菌的分离鉴定[J].中国预防兽医学报,2002,24(1):18-20.
[9] Chen M, Li L P, Wang R, et al. PCR detection and PFGE genotype analyses of streptococcal clinical isolates from tilapia in China[J]. Vet Microbiol, 2012, 159(3-4): 526-530.
[10] 卢迈新.罗非鱼链球菌病研究进展[J].南方水产,2010,6(1):75-79.
[11] 李莉萍,王 瑞,黄 婷,等.广东、海南、福建3省罗非鱼链球菌病流行菌株PCR鉴定和PFGE基因型分析[J].西南农业学报,2013,26(5):2133-2140.
[12] 程 波,李 乐,康 铜,等.中国罗非鱼质量安全现状调查分析[J].中国渔业质量与标准,2014,4(6):9-15.
[13] Cai X H, Peng Y H, Wang Z C, et al. Characterization and identification of streptococci from golden pompano in China[J]. Dis Aquat Organ, 2016, 119(3): 207-217.
[14] 柒壮林.广西罗非鱼链球菌的分离鉴定、药敏试验与病理学研究[D].南京:南京农业大学,2012:9-26.
[15] Lindahl G, StåLhammar C M, Areschoug T. Surface proteins ofStreptococcusagalactiaeand related proteins in other bacterial pathogens[J]. Clin Microbiol Rev, 2005, 18(1): 102-127.
[16] 黎 娅,罗福广,左 跃,等.罗非鱼源γ溶血性无乳链球菌的分离鉴定[J].淡水渔业,2014,44(4):63-66,76.
[17] Kovacs-Simon A, Titball R W, Michell S L. Lipoproteins of bacterial pathogens[J]. Infect Immun, 2010, 79(2):548-561.
[18] Sutcliffe I C, Harrington D J. Putative lipoproteins ofStreptococcusagalactiaeidentified by bioinformatic genome analysis[J]. Antonie van Leeuwenhoek, 2004, 85(4): 305-315.
[19] Leng C H, Liu S J , Chen H W , et al. Recombinant bacterial lipoproteins as vaccine candidates[J]. Expert Rev Vaccines, 2015, 14(12): 1-10.
[20] Brodeur B R, Boyer M, Charlebois I, et al. Identification of group B streptococcal Sip protein, which elicits cross-protective immunity[J]. Infect Immun, 2000, 68(10): 5610.
[21] Pereira U P, Soares S C, Blom J, et al. In silico prediction of conserved vaccine targets inStreptococcusagalactiaestrains isolated from fish, cattle, and human samples[J]. Genet Mol Res, 2013, 12(3): 2902-2912.
[22] 许乐乐,倪张丽,李永芹.无乳链球菌致大菱鲆凸眼及腹水案例分析[J].当代水产,2014,(1):69-70.
[23] StåLhammar-Carlemalm M, Areschoug T, Larsson C, et al. Cross-protection between group A and group B streptococci due to cross-reacting surface proteins[J]. J Infect Dis, 2000, 182(1): 142-149.
[24] Song B F, Yang X J, Sun H N, et al. Immunogenicity of amino acids 1-150 ofStreptococcusGapC displayed on the surface ofEscherichiacoli[J]. Microb Pathog, 2017, 105: 288-297.
(责任编辑:邓 薇)
Truncated expression of one lipoprotein ofStreptococcusagalactiaeand its immunoprotection
LIU Hong-yan1,3, ZHANG Yao-guang1, ZHANG Song-lin2, SHEN Zhi-qiang2,MA Yong-biao2
(1.SchoolofLifeSciences,SouthwestUniversity,KeyLaboratoryofFreshwaterFishReproductionandDevelopment(MinistryofEducation),KeyLaboratoryofAquaticScienceofChongqing,Chongqing400715,China;2.ShandongBinzhouAnimalScience&VeterinaryMedicineAcademy,Binzhou256600,Shandong,China;3.BinzhouMarineEnvironmentalMonitoringStationofShandongProvince,Binzhou256600,Shandong,China)
The antigenicity and immunoprotection toOreochromisaureusandScophthalmusmaximusof lipoprotein inStreptococcusagalactiaeBX2012 strain isolated from tilapia were analyzed. Specific primers were designed according to B cell linear epitopes of lipoprotein gene sequence (GenBank ID: CP000114.1,SAK_0321 ) predicted by bioinformatics software. The recombinant expression plasmid was structured. Subunit vaccine of lipoprotein after truncated expression and purification was made and researched compared with inactivated vaccine. The results showed that pET-32a-LIP342 prokaryotic expression plasmid was constructed successfully, and soluble recombinant protein with molecular mass of 30 kDa was expressed efficiently in BL21 (DE3). The purity of LIP342 after purification was increased from 41.75% to 87.23%. Homology of LIP342 from all known species or different serotypesS.agalactiaeisolates was 90.35%~100%, and 100% among tilapia isolates. LIP342 was distinguished specifically by high immune serum of rabbit anti-S.agalactiaein Western blotting test. Serum antibody levels and cumulative survival rates after challenged of tilapia and turbot immunized by LIP342 and inactivated vaccine were significantly higher than that of PBS control group. What’s more, serum antibody levels of tilapia and turbot induced by LIP342 was significantly higher than that of inactivated vaccine. So, LIP342 was proved as a conserved antigen with good immunogenicity and a subunit vaccine candidate to fish againstS.agalactiae.
Streptococcusagalactiae; lipoprotein; truncated expression; immunoprotection;Oreochromisaureus;Scophthalmusmaximus
2017-03-28
2017-04-13
重庆市重大应用开发项目(CSTC2014yykfc80001)
刘鸿艳(1980- ),女,博士研究生,专业方向为水产养殖。E-mail:hongyanfish@163.com
张耀光。E-mail:zhangyg@swu.edu.cn
S942.5
A
1000-6907-(2017)03-0025-08
