长丰鲫c型溶菌酶基因的克隆及其在细菌感染条件下的表达分析
2017-05-24姚佳俊梁宏伟罗相忠邹桂伟
姚佳俊,李 忠,梁宏伟,罗相忠,王 丹,邹桂伟
(1.华中农业大学水产学院,武汉 430070;2.中国水产科学研究院长江水产研究所,武汉 430223)
长丰鲫c型溶菌酶基因的克隆及其在细菌感染条件下的表达分析
姚佳俊1,2,李 忠2,梁宏伟2,罗相忠2,王 丹2,邹桂伟2
(1.华中农业大学水产学院,武汉 430070;2.中国水产科学研究院长江水产研究所,武汉 430223)
为了解c型溶菌酶基因与长丰鲫(ChangFengCarassiusauratus)的抗菌效应关系,本研究利用同源克隆方法获得长丰鲫c型溶菌酶基因cDNA全长序列。结果显示:c型溶菌酶基因全长698 bp,包括5′端非翻译区60 bp,3′端非翻译区200 bp,开放阅读框438 bp,编码145个氨基酸。长丰鲫c型溶菌酶基因在肾脏组织中表达量最大,在脾脏、肠道、心脏和脑中大量表达,在肝脏和鳃中表达量相对较低,在皮肤和肌肉中几乎不表达。长丰鲫在感染迟钝爱德华氏菌、嗜水气单胞菌和金黄色葡萄球菌后,在肝脏、肾脏、脾脏和鳃等组织中基因表达量均发生显著变化,出现不同程度的上调。感染迟钝爱德华氏菌后,在脾脏中的上调幅度最大,其次为鳃、肝脏和肾脏;感染嗜水气单胞菌后,在脾脏中上调程度最大,其次是鳃;感染金黄色葡萄球菌后,在脾脏中上调幅度最大。在肝脏和肾脏中,经金黄色葡萄球菌刺激后c型溶菌酶基因的上调幅度最高;在脾脏和鳃中,经嗜水气单胞菌感染后c型溶菌酶基因上调幅度最高。三种刺激后,c型溶菌酶基因升高幅度的不同,说明不同刺激使鱼体组织产生的应激反应能力不同。
长丰鲫(ChangFengCarassiusauratus);c型溶菌酶基因;克隆;表达分析;抗细菌效应
溶菌酶根据其来源与氨基酸序列差异可分为6类:鸡蛋清溶菌酶、鹅溶菌酶、细菌溶菌酶、无脊椎动物溶菌酶、植物溶菌酶和噬菌体溶菌酶[1]。其中,c型溶菌酶在脊椎动物与无脊椎动物中均有存在[2]。目前在圆鲆(Bothusassimilis)、塞内加尔鳎(Soleasenegalensis)、牙鲆(Paralichthysolivaceus)、鲤(Cyprinuscarpio)和斑马鱼(Barchydanioreriovar)等鱼类中均有研究报道[3,4]。
溶菌酶在鱼类非特异免疫研究中具有重要作用,溶菌酶通过破坏细菌细胞壁中的N-乙酰胞壁酸和N-乙酰氨基葡糖之间的β-1,4糖苷键,使细胞壁不溶性粘多糖分解成可溶性糖肽,导致细胞壁破裂,从而使革兰氏阳性细菌溶解;也可以通过与一些阳离子乳铁蛋白、防御素、抗菌肽等协同作用,溶解革兰氏阴性细菌的外壁脂多糖[5]。研究表明:草鱼(Ctenopharyngodonidellus)和塞内加尔鳎c型溶菌酶在各组织均有表达,其中草鱼头肾中表达量最高,塞内加尔鳎皮肤和鳃的表达量较高。菱鲆(Scophthalmusrhombus)c型溶菌酶在肝脏和胃中的表达量较高[4,6-7]。斑点叉尾(IetalurusPunetaus)和牙鲆经爱德华氏菌刺激后,脾脏和头肾等组织中c型溶菌酶基因表达量均升高[8,9],淇河鲫(QiheCarassiusauratus)经嗜水气单胞菌刺激后,c型溶菌酶基因在肝脏和脾脏中表达量上升,在鳃中的表达量先上升后下降[10],研究结果表明鱼类受到外界刺激时,c型溶菌酶基因会引起机体产生非特异性免疫反应。
长丰鲫(ChangFengCarassiusauratus)是我国第一个通过全国水产原种和良种审定委员会审定的四倍体异育银鲫新品种(品种登记号:GS-04-001-2015)。作为一个养殖新品种,其对细菌性疾病的抵抗力如何也是一个十分重要的性能指标。因此,本研究以长丰鲫为实验对象,对长丰鲫c型溶菌酶进行了基因克隆,从分子水平上研究其结构和功能,分析在感染细菌条件下肝脏、肾脏、脾脏和鳃中的表达变化特征,研究长丰鲫的抗细菌效应,为探讨长丰鲫抗细菌性疾病能力提供一定的理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验鱼
实验鱼均为健康无病无伤的长丰鲫(150±0.5) g,取自中国水产科学研究院长江水产研究所荆州基地窑湾试验场。
1.1.2 实验鱼处理
随机将实验鱼分为三个实验组和一个对照组,每组60尾,暂养两周。根据预实验结果,对实验鱼进行迟钝爱德华氏菌、嗜水气单胞菌和金黄色葡萄球菌的感染实验,注射浓度分别为2.2×106, 6.0×107,4.5×105cfu/mL,150 μL,对照组注射等量0.9%的生理盐水,维持水温(28±2) ℃,持续增氧。实验开始前,随机选取5尾鱼取皮肤,肌肉,肝脏,肾脏,脾脏,鳃,脑,心脏和肠等组织用于 c型溶菌酶基因的组织表达分析,实验开始后0、6、12、24、48、72、96、120 h取肝脏、肾脏、脾脏、鳃等组织迅速放入液氮中,用于后续研究。
1.1.3 实验菌株
迟钝爱德华氏菌、嗜水气单胞菌和金黄色葡萄球菌菌种均由中国水产科学研究院长江水产研究所鱼类病害研究室提供。
1.1.4 实验试剂与仪器
Trizol Reagent购自Invitrogen公司; PrimeScriptTMRT Reagen Kit with gDNA Eraser、PMD®18-T Vector system和SYBR®Premix Ex TaqTMII购自大连宝生物工程有限公司(Takara); Agarose Gel DNA Fragment Recovery Kit购自北京百泰克生物有限公司(Bioteke); SMART RACE cDNA Amplication Kit购自美国Clontech公司;Trans5á化学感受态细胞购自北京金式金生物(TransGen Biotech)。荧光定量PCR仪为Qiagen公司生产的Rotor-Gene 6200 system,紫外分光光度计为UNICO公司的UV-3802紫外分光光度计,凝胶成像系统为Syngene公司的G:BOX。
1.1.5 引物
根据GenBank中已知物种c型溶菌酶基因 cDNA序列设计引物c lzm 1扩增c型溶菌酶基因中间片段,设计引物c lzm 3和c lzm 5扩增c型溶菌酶基因的3′端和5′端。c-q-lzm 1为定量表达的特异性引物;β-actin 1为定量表达的内参引物,根据NCBI数据库中鲫(C.auratus,GenBank:AB039726.2) β-actin基因序列设计。以上引物均采用Primer 5.0设计,由武汉擎科创新生物技术有限公司合成。引物序列见表1。

表1 实验所用引物Tab.1 Primers used for the experiment
1.2 实验方法
1.2.1 总RNA提取与cDNA合成
使用Trizol Reagent试剂并根据其说明书提取总RNA,紫外分光光度计测定RNA浓度及纯度;凝胶电泳检测RNA的完整性;以总RNA为模板,使用PrimeScriptTMRT Reagen Kit with gDNA Eraser试剂并按照说明书合成cDNA。
1.2.2 3′RACE和5′RACE扩增
按照SMART RACE cDNA Amplication Kit (Clontech)说明书,采用引物c lzm 3和c lzm 5及试剂盒提供的通用引物扩增c型溶菌酶基因的3′端和5′端。PCR产物经电泳检测、回收、连接、转化后,挑单克隆菌落送武汉擎科创新生物科技有限公司测序。
1.2.3 序列分析
用ContigExpress软件对已获得序列进行拼接,用DNAMAN软件对所得序列进行氨基酸序列比对,用Clustal W 和 MEGA 5.0软件对氨基酸序列进行多序列比较和聚类分析。
1.2.4 长丰鲫c型溶菌酶基因 mRNA表达的半定量PCR检测
利用引物c-q-lzm 1和β-actin 1进行PCR扩增,电泳检测c型溶菌酶基因在皮肤、肌肉、肝脏、肾脏、脾脏、脑、鳃、心脏、肠等组织中的表达情况。
1.2.5 实时荧光定量PCR分析
利用引物c-q-lzm 1和β-actin 1检测 c型溶菌酶基因在健康长丰鲫各组织及细菌感染后长丰鲫肝脏、肾脏、脾脏和鳃中的表达情况。反应体系为20 μL:SYBR®Premix Ex TaqTMII 10 μL,上、下游引物(10 μmol/L)各0.8 μL,cDNA模板1 μL,加ddH2O至20 μL。反应条件:95 ℃ 30 s;95 ℃ 5 s,56 ℃ 30 s,72 ℃ 30 s,40个循环。每个样品重复三次实验以减少误差,用 2-ΔΔCt分析方法对数据进行分析,具体方法参考文献[12]。
1.2.6 统计分析
采用SPSS22.0软件进行数据处理,实验结果用Means±Standard error (SE)形式表示, Duncan’s多重比较进行单因素方差分析,显著性差异为P<0.05。
2 结果
2.1 长丰鲫c型溶菌酶基因序列分析
长丰鲫c型溶菌酶基因全长698 bp,包括5′端非翻译区60 bp,3′端非翻译区200 bp,开放阅读框438 bp,编码145个氨基酸。有真核细胞加尾信号(ATTAAA)和Poly(A)尾巴[13](图1)。

图1 长丰鲫c型溶菌酶基因cDNA全长序列及推导的氨基酸序列Fig.1 Nucleotide sequence of the ChangFeng C.auratus c-type lysozyme cDNA and its deduced amino acids sequence “□”表示起始密码子和终止密码子;灰色区域表示加尾信号
2.2 长丰鲫c型溶菌酶基因的同源性分析和系统进化树构建
使用DNAMAN软件将GenBank中已知一些物种和长丰鲫的c型溶菌酶氨基酸序列进行比对。结果表明c型溶菌酶基因氨基酸序列在分子进化过程中较保守,与鲤形目鱼类有较高的同源一致性,其中,与鲫、异育银鲫(C.auratusgibelio)、鲤鱼相似度最高分别为99%、98%、90%,与青鱼(Mylopharyngodonpiceus)、草鱼、斑马鱼等鲤形目鱼类同源性在80%左右,与其他物种如人(Homosapiens)、牦牛(Bosgrunniens)、原鸡(Gallusgallus)等哺乳动物和鸟类的同源性则相对较低,在40%~50%之间(图2)。

图2 长丰鲫与其它物种c型溶菌酶基因氨基酸多序列比对Fig.2 Multiple alignments of the deduced amino acid of c-type lysozyme with other species黑色表示氨基酸序列一样,灰色表示氨基酸序列相对保守,数字表示不同序列氨基酸的位置。
使用MEGA5.0软件中的Neighbor-Joining(NJ法)构建长丰鲫c型溶菌酶基因氨基酸序列系统进化树,进一步可以看出:长丰鲫c型溶菌酶基因与鲫鱼和异育银鲫的亲缘关系最近,与鲤形目的鱼类聚为一支;人、树鼩(Tupaiachinensis)、家鼠(Musmusculus)、灰仓鼠(Cricetulusmigratorius)的c型溶菌酶基因聚为一支;原鸡和绿领原鸡(Gallusvarius)、青鳉(Oryziaslatipes)、猕猴(Macacamulatta)、大猩猩(Gorillagorilla)、牦牛、绵羊(Ovisaries)和山羊(Caprahircus)聚为一支(图3)。
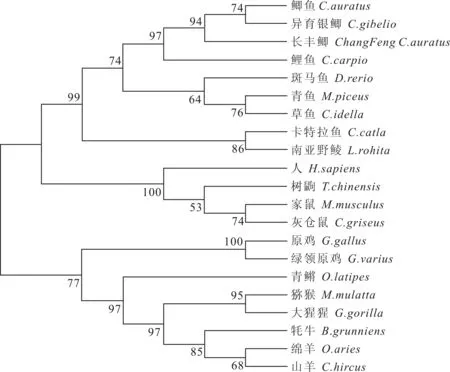
图3 c型溶菌酶基因的系统进化树
Fig.3 Phylogenetic tree of vertebrate c-type lysozyme
2.3 长丰鲫c型溶菌酶基因组织表达分析
用半定量和实时荧光定量PCR两种方法检测c型溶菌酶基因在长丰鲫皮肤、肌肉、脾脏、肾脏、肝脏、鳃、心脏、肠和脑等组织中的表达情况(图4和图5)。两种方法检测的结果基本一致,c型溶菌酶基因在肾脏中表达量最高,在脾脏、肠道、心脏和脑中大量表达,在肝脏和鳃中表达量相对较低,在皮肤和肌肉中几乎不表达。
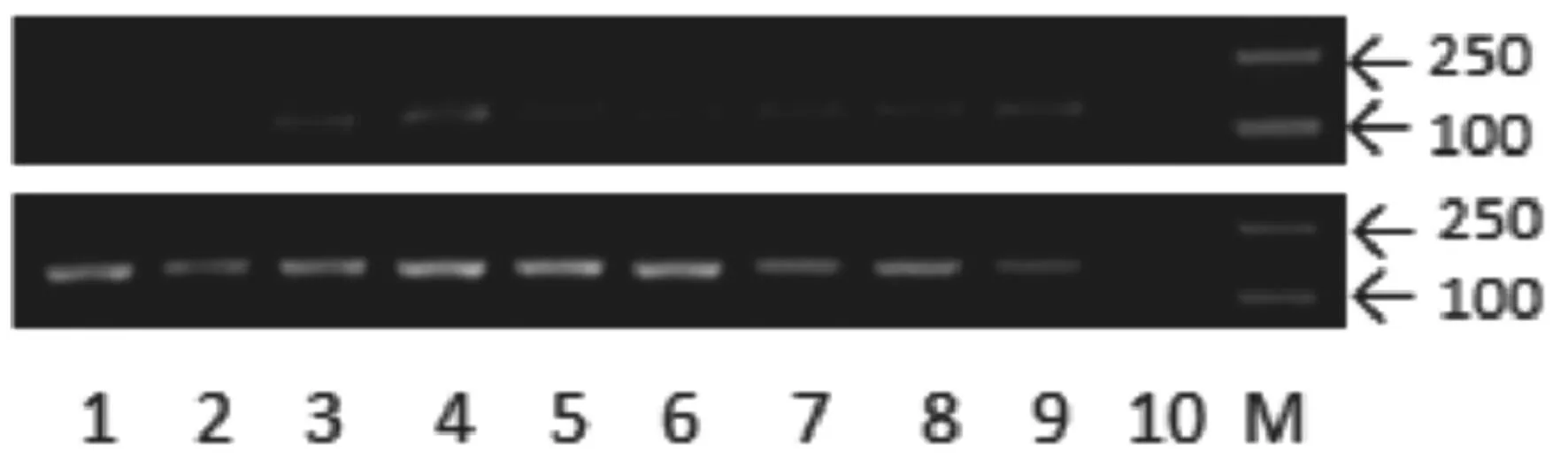
图4 c型溶菌酶基因在不同组织中的表达 (RT-PCR检测)Fig.4 Tissue distribution of c-type lysozyme mRNA in ChangFeng Carassius auratus (with RT-PCR)
图中1、2、3、4、5、6、7、8、9、10、M分别代表皮肤、肌肉、脾脏、肾脏、肝脏、鳃、肠、心脏、脑、对照组和marker。对照组为阴性对照,即加样时只添加了引物,没有加cDNA模板。
2.4 细菌感染对长丰鲫组织c型溶菌酶基因的表达影响
由图6可以看出:长丰鲫在感染迟钝爱德华氏菌、嗜水气单胞菌和金黄色葡萄球菌后,在肝脏、肾脏、脾脏和鳃等组织中基因表达量均发生显著变化,出现不同程度的上调。感染迟钝爱德华氏菌后,在脾脏中的上调幅度最大,为对照组的27倍,其次为鳃、肝脏和肾脏;感染嗜水气单胞菌后,在脾脏中表达量最大,其次是鳃,分别为对照组的160倍和82倍;感染金黄色葡萄球菌后,在脾脏中上调幅度最大,为对照组的15倍。在肝脏和肾脏中(图6 A,B),经金黄色葡萄球菌刺激后c型溶菌酶基因的上调幅度最高;在脾脏和鳃(图6 C,D)中,经嗜水气单胞菌感染后c型溶菌酶基因上调幅度最高。三种细菌感染后不同组织c型溶菌酶基因表达不同,暗示不同细菌使鱼体组织产生不同的应激反应能力。

图5 c型溶菌酶基因在不同组织中的表达 (荧光定量PCR检测)Fig.5 Tissue distribution of c-type lysozyme mRNA in ChangFeng Carassius auratus (with real-time quantitative PCR)
skin,muscle,spleen,kidney,liver,gill,intestines,heart,brain,Control分别表示皮肤、肌肉、脾脏、肾脏、肝脏、鳃、肠、心脏、脑和对照组。
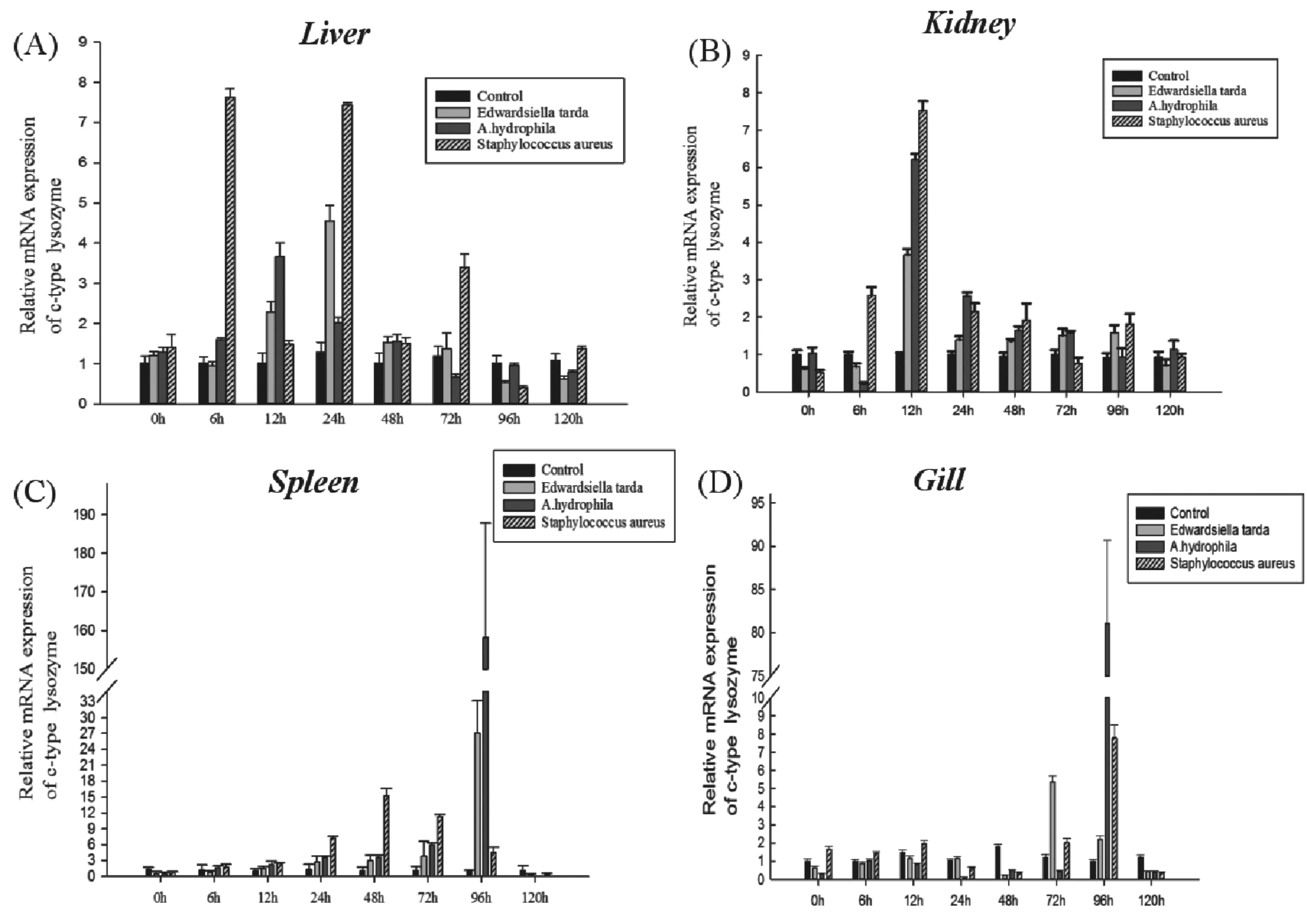
图6 注射细菌条件下c型溶菌酶基因在肝脏(A)、肾脏(B)、脾脏(C)和鳃(D)中的表达Fig.6 Effect of bacteria injection on c-type lysozyme mRNA levels in liver(A),kidney(B),spleen(C) and gill(D)0、6、12、24、48、72、96、120 h表示鱼体感染细菌时间。设置三个实验平行组, 每个采样点每个实验平行组各取5条鱼,每个组织样品重复三次。
3 讨论
3.1 长丰鲫c型溶菌酶基因cDNA序列分析
鱼类c型溶菌酶cDNA 全长约为600~700 bp[10],文昌鱼(Branchiostomalanceolatum)c型溶菌酶cDNA全长651 bp,编码140个氨基酸[13];草鱼c型溶菌酶cDNA全长685 bp,编码145个氨基酸[6];淇河鲫c型溶菌酶cDNA全长679 bp,编码145个氨基酸[10]。图1显示长丰鲫c型溶菌酶cDNA全长698 bp,编码145个氨基酸。鱼类的亲缘关系越近,溶菌酶的同源性越高,长丰鲫和鲫、异育银鲫同为鲤科鱼类,氨基酸序列相似性显示长丰鲫和鲫、异育银鲫的c型溶菌酶基因同源性分别为99%和98%,在进化树上三者的亲缘关系最近,长丰鲫与其他鲤形目鱼类如鲤、斑马鱼、青鱼、草鱼的c型溶菌酶基因氨基酸同源性分别为90%、81%、80%、79%,推测c型溶菌酶基因在鲤形目鱼类长期进化过程中是高度保守的,但是长丰鲫与其他物种如人、牦牛等哺乳动物和鸟类的同源性相对较低,在40%~50%之间,由此推测鲤形目鱼类的c型溶菌酶基因在进化过程中具有相对独立性。
在多数生物中c型溶菌酶仅存在一种,但随着生物的进化,一些物种中存在多种c型溶菌酶。如在盘鲍(Haliotisdiscusdiscus)和大西洋鲑(Salmosalar)中均有两种c型溶菌酶[14,15],澳大利亚罗非鱼(Oreochromisaureus)中有三种c型溶菌酶[16],在反刍动物中有多达十种的溶菌酶[17],这些多类型溶菌酶在生物机体内有着不同的功能作用。长丰鲫中是否存在多种c型溶菌酶,还有待进一步研究。
3.2 组织表达分析
鱼类c型溶菌酶基因的表达具有种属和组织特异性,不同鱼类及不同组织的表达量均有差异。如淇河鲫c型溶菌酶在肾脏和头肾中表达量较高,分别是肝脏的188.6倍和316.7倍[10]。牙鲆c型溶菌酶在头肾、后肾、脾脏中具有较高表达量[19];点带石斑鱼(Epinepheluscoioides)c型溶菌酶基因主要在血、鳃、头肾中表达量较高[18]。长丰鲫c型溶菌酶在检测的组织中均有表达,且在肾脏中的表达量高于其它组织,推测是由于鱼体内溶菌酶的产生与哺乳动物相似,主要由单核细胞和嗜中性粒细胞产生,少量由巨噬细胞生成,在鱼体血流量较丰富的肾脏、脾脏等组织中,这些单核细胞、嗜中性粒细胞等将分泌溶菌酶进入这些组织[9]。因此,长丰鲫 c型溶菌酶在肾脏中高表达,说明肾脏可能在免疫防御中具有重要作用。
3.3 细菌感染对c型溶菌酶基因表达的影响
迟钝爱德华氏菌、嗜水气单胞菌、金黄色葡萄球菌在自然界中广泛存在。本实验中,长丰鲫在接受不同病原刺激时,c型溶菌酶基因在不同组织中均呈现出不同程度的上调,这与斑点叉尾[8]、牙鲆[9]细菌感染后的结果相似,说明c型溶菌酶基因具有抵御细菌入侵的功能;在不同组织中出现高峰的时间、升幅与高水平表达量维持时间等均有所不同,这与草鱼[6]、淇河鲫[10]的研究结果相似,推测长丰鲫c型溶菌酶基因在不同组织中存在不同的表达调控机制,不同时间点在不同组织中采取不同的调节方式进行表达,从而维持机体稳定。三种细菌刺激后长丰鲫c型溶菌酶基因表达升高量不同,这与淇河鲫的研究结果类似[10],说明不同刺激可能使鱼体产生的非特异性免疫反应和不同组织中c型溶菌酶的应激反应能力不同,这也可能是革兰氏阳性菌和革兰氏阴性菌所引起的差异,但具体作用机制有待进一步研究。
不同细菌刺激下c型溶菌酶基因表达变化说明c型溶菌酶可能具有一定的防御功能,它可以抵御外界病原菌的入侵,以增强机体的抗病、抗感染能力。该研究结果为我们进行抗病品种选育积累了一定的数据基础。
[1]Bachali S,Jager M,Hassanin A, et al. Phylogenetic analysis of invertebrate lysozymes and the evolution of lysozyme function [J].J Mol Evol,2002,54(5):652-664.
[2]贾向志,李 元,马文煜.溶菌酶的研究进展[J].生物技术通讯,2002,13(5):374-377.
[3]Liu F,Wen Z.Cloning and expression pattern of the lysozyme C gene in Zebrafish [J].Mech Dev,2002,113(1):69-72.
[4]Fernández T M A,Porta J,Manchado M,et al.c/Lysozyme from Senegalese sole (Soleasenegalensis):cDNA cloning and expression pattern [J].Fish Shellfish Immunol,2008,25(5):697-700.
[5]Callewaert L,Michiels C W.Lysozymes in the animal kingdom [J].J Biosci,2010,35(1):127-160.
[6]Ye X,Zhang L,Tian Y,et al.Identification and expression analysis of the g-type and c-type lysozymes in grass carpCtenopharyngodonidellus[J].Dev Comp Immunol,2010,34(5):501-509.
[7]Jiménez C R M,Infante C,Martin A B,et al.Molecular characterization,phylogeny,and expression of c-type and g-type lysozymes in brill (Scophthalmusrhombus) [J].Fish Shellfish Immunol,2008,25(1):57-65.
[8]Wang R,Feng J,Li C,etal. Four lysozymes (one c-type and three g-type) in catfish are drastically but differentially induced after bacterial infection [J].Fish Shellfish Immunol,2013,35(1):136-145.
[9]Minagawa S,Hikima J,Hirono I,etal. Expression of Japanese flounder c-type lysozyme cDNA in insect cells [J].Dev Comp Immunol,2001,25(5):439-445.
[10]王美娟.淇河鲫c型和g型溶菌酶基因克隆及表达分析[D].河南新乡:河南师范大学,2015.
[11]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CTmethod [J].Methods,2001,25(4):402-408.
[12]钱 曦,华雪铭,黄旭雄,等.异育银鲫c型溶菌酶全长cDNA序列的生物信息学分析及其组织表达分析[J].中国生物化学与分子生物学报,2008,24(4):337-347.
[13]Liu M,Zhang S,Liu Z,etal. Characterization,organization and expression of AmphiLysC,an acidic c-type lysozyme gene in amphioxus BranchiostomaBelcheriTsingtauense[J].Gene,2006,367:110-117.
[14]Umasuthan N,Bathige S,Kasthuri S R,etal. Two duplicated chicken-type lysozyme genes in disc abalone Haliotis discus discus:molecular aspects in relevance to structure,genomic organization,mRNA expression and bacteriolytic function [J].Fish Shellfish Immunol,2013,35(2):284-299.
[15]Ng S H S,Artieri C G,Bosdet I E,etal. A physical map of the genome of Atlantic salmon,Salmo salar [J].Genomics,2005,86(4):396-404.
[16]禹绍国,叶 星,张莉莉,等.奥利亚罗非鱼3种C型溶菌酶基因的克隆及其序列分析[J].农业生物技术学报,2010(1):66-74.
[17]Irwin D M,Wilson A C.Multiple cDNA sequences and the evolution of bovine stomach lysozyme [J].J Biol Chem,1989,264(19):11387-11393.
[18]Wei S,Huang Y,Cai J,etal. Molecular cloning and characterization of c-type lysozyme gene in orange-spotted grouper,Epinephelus coioides [J].Fish Shellfish Immunol,2012,33(2):186-196.
[19]Schnyder J,Baggiolini M.Secretion of lysosomal hydrolases by stimulated and nonstimulated macrophages [J].J Exp Med,1978,148(2):435-450.
(责任编辑:张潇峮)
Molecular cloning and expression analysis of c-type lysozyme gene inChangFeng Carassius auratus during bacterial infection
YAO Jia-jun1,2,LI Zhong2,LIANG Hong-wei2,LUO Xiang-zhong2,WANG Dan2,ZOU Gui-wei2
(1.CollegeofFisheries,HuazhongAgriculturalUniversity,Wuhan430070,China;2.YangtzeRiverFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Wuhan430223,China)
To understand the biological role of c-type lysozyme in the ChangFengC.auratus,in this study,c-type lysozyme is cloned by homology cloning strategy from ChangFengCarassiusauratus.The results showed that the full length cDNA sequence of c-type lysozyme is 698 bp,including a 438 bp open reading frame with a coding potential for a 145-amino acid protein,a 60 bp 5′-untranslated region and a 200 bp 3′- untranslated region.c-type lysozyme mRNA was expressed ubiquitously in the tissues examined and abundantly expressed in kidney,It had a large number of expression In the spleen,intestine,heart and brain,but in the liver and gills the expression was relatively low,almost no expression in the skin and muscle.After intraperitoneal injection withEdwardsiellatarda,AeromonashydrophilaandStaphylococcusaureusrespectively,the mRNA levelsofc-typelysozyme was more or less rapidly upregulated in liver,kidney,spleen and gill.After intraperitoneal injection withEdwardsiellatarda,higher degree of the mRNA levels of c-type lysozyme was largest in spleen,followed by gills,liver and kidney;After intraperitoneal injection withAeromonashydrophila,escalation of the mRNA levels of c-type lysozyme was largest in spleen,followed by gills;After intraperitoneal injection withStaphylococcusaureus,up-regulation of the mRNA levels of c-type lysozyme was largest in spleen.In liver and kidney,the uptake rate of the c-type lysozyme gene was the highest when stimulated byStaphylococcusaureus.But in spleen and gill,the up-scaling of the mRNA levels of c-type lysozyme gene was the highest when stimulated byAeromonashydrophila.After the stimulation of three bacteria,higher degree of the mRNA levelsofc-typelysozyme was different,It showed different stimulus may make different stress reaction ability in the fish tissue.
ChangFengCarassiusauratus;c-type lysozyme;clone;expression;antibacterial effect
2017-01-18;
2017-03-27资助项目:“十二五”国家科技支撑计划项目(2012BAD26B02)资助[Supported by Key Projects of the National Science & Technology (2012BAD26B02)]
姚佳俊(1990- ),女,硕士研究生,专业方向为鱼类遗传育种。E-mail:1518657804@qq.com
邹桂伟。E-mail:Zougw@yfi.ac.cn
S917.4
A
1000-6907-(2017)03-0033-08
