栝楼桂枝颗粒对谷氨酸诱导大鼠肾上腺嗜铬细胞瘤细胞兴奋性毒性损伤的影响
2017-05-24张玉琴孙承韬李煌徐伟褚克丹林羽
张玉琴,孙承韬,李煌,徐伟,褚克丹,林羽
栝楼桂枝颗粒对谷氨酸诱导大鼠肾上腺嗜铬细胞瘤细胞兴奋性毒性损伤的影响
张玉琴,孙承韬,李煌,徐伟,褚克丹,林羽
福建中医药大学药学院,福建福州 350122
目的 观察栝楼桂枝颗粒对谷氨酸诱导大鼠肾上腺嗜铬细胞瘤细胞(PC12)兴奋性毒性损伤的影响,并初步探讨其作用机制。方法 采用谷氨酸诱导PC12兴奋性毒性损伤造模。将细胞随机分为正常组、谷氨酸组和栝楼桂枝颗粒低(200 μg/mL)、中(400 μg/mL)、高(800 μg/mL)剂量组,MTT法和LDH法检测PC12活力;Caspase-3活性检测法、Annexine V/PI双染色法检测细胞凋亡,Western blot和RT-PCR分别检测Bcl-2、Bax蛋白和mRNA表达。结果 与谷氨酸组比较,MTT法栝楼桂枝颗粒各剂量组PC12活力升高,LDH法栝楼桂枝颗粒各剂量组细胞活力降低;Annexine V/PI双染色法栝楼桂枝颗粒各剂量组PC12凋亡率降低;Caspase-3活性检测法栝楼桂枝颗粒各剂量组Caspase-3活性降低;RT-PCR及Western blot检测栝楼桂枝颗粒各剂量组Bax表达降低、Bcl-2表达升高。结论 栝楼桂枝颗粒对谷氨酸诱导PC12兴奋性毒性损伤有一定的保护作用,其保护作用与其抗细胞凋亡作用有关。
栝楼桂枝颗粒;谷氨酸;肾上腺嗜铬细胞瘤细胞;细胞凋亡
随着世界老龄化的加剧,脑卒中成为发展中国家高致残率、高死亡率、高发病率的一种疾病,给人类健康造成了巨大的威胁。栝楼桂枝颗粒(处方源于栝楼桂枝汤)为福建省第二人民医院院内制剂,临床用于治疗脑卒中后痉挛性偏瘫。临床观察显示,栝楼桂枝汤可明显改善中风后患者运动功能、痉挛状态及日常生活活动能力[1]。体内外研究也表明,栝楼桂枝汤具有抗氧化、抗炎及抗兴奋性氨基酸毒性损伤的作用[2-7]。本研究在前期实验的基础上,采用谷氨酸诱导大鼠肾上腺嗜铬细胞瘤细胞(PC12)兴奋性毒性损伤为模型,观察其对模型大鼠的影响,并初步探讨其作用机制,为临床应用提供一定的实验依据。
1 实验材料
1.1 细胞
高分化大鼠PC12,北京北纳创联生物技术研究所。
1.2 药物及制备
栝楼桂枝颗粒,福建省第二人民医院药剂科提供,无菌条件下用含1%胎牛血清1640培养基配制成1 mg/mL的母液,使用时稀释成不同浓度的工作液。
1.3 主要试剂与仪器
谷氨酸,Sigma公司;噻唑蓝(MTT),Sigma公司;Annexin V/PI凋亡试剂盒,南京凯基生物科技发展有限公司;乳酸脱氢酶(LDH)试剂盒,上海碧云天生物技术公司;Caspase-3 Assay Kit,Molecular Probes;兔抗大鼠Bcl-2、Bax和β-actin抗体,Cell Signalling公司;辣根过氧化酶标记羊抗兔IgG,厦门鹭隆生物科技发展有限公司;RevertAidTMFirst strand cDNA Synthsis Kit,Fermenta公司;Power SYBR®Green PCR Master Mix,Life Sciences公司。凝胶成像仪,美国伯乐公司;PCR扩增仪,美国伯乐公司;7900型荧光定量PCR仪,ABI公司。
2 实验方法
2.1 细胞增殖检测
将对数期PC12接种至96孔板(2×104个/孔),将细胞随机分为正常组、谷氨酸组和栝楼桂枝颗粒低、中、高剂量组,每组6孔,实验重复3次。培养24 h后,栝楼桂枝颗粒低、中、高剂量组分别加入200、400、800 μg/mL栝楼桂枝颗粒药液,24 h后加入谷氨酸(终浓度为15 mmol/L),继续培养6 h后,每孔加入10 µL浓度为5 mg/mL MTT,继续培养4 h后,吸弃培养上清液,每孔加100 µL DMSO溶解甲瓒结晶,室温震摇5 min,完全溶解后,于酶标仪570 nm处测定光密度(OD)。计算细胞存活率(实验组OD值÷正常组OD值×100%)。
2.2 细胞活力检测
分组、给药方法同“2.1”项,24 h后加入谷氨酸(终浓度为15 mmol/L),继续培养6 h后,取细胞上清液,LDH法检测PC12活力,严格按照试剂盒说明书进行操作。于波长450 nm处测定OD值,计算细胞活力。细胞活力(U/L)=(测定管OD值-对照管OD值)÷(标准管OD值-空白管OD值)×标准品浓度(0.2 mmol/L)×1000。
2.3 细胞凋亡检测
分组、给药方法同“2.1”项,24 h后加入谷氨酸(终浓度为15 mmol/L),继续培养6 h后,收集细胞,向细胞沉淀中加入Binding Buffer 500 µL,重悬细胞。混匀后,加入5 µL Annexin V-FITC,混合均匀,加入5 µL PI溶液,轻轻混合均匀,室温下避光孵育15 min,1 h内流式细胞仪分析细胞凋亡。
2.4 Caspase-3活性检测
分组、给药方法同“2.1”项,24 h后加入谷氨酸(终浓度为15 mmol/L),继续培养6 h后,收集细胞,加入50 µL预冷的Cell Lysis Buffer,冰上孵育30 min,5000 r/min离心5 min,吸取上清液置于新的离心管,置于冰上待用,BCA法测定样品蛋白含量。用Cell Lysis Buffer稀释一定量的蛋白至50 µL,加入96孔板,再加入50 µL 2×底物工作液(含DTT 0.495 µmol,Z-DEVD-R110 0.012 5 µmol),室温孵育30~60 min,待颜色发生明显变化时,于酶标仪波长405 nm处测定OD值。计算蛋白含量标准化校正后A值[(测定孔OD值-无酶孔OD值)×待测样品蛋白浓度],以正常组Caspase-3活性为1,以每个样本的校正A值除以正常组校正A值的商计算各组Caspase-3相对活性(处理组校正A值÷正常组校正A值)。
2.5 Bax、Bcl-2 mRNA表达检测
2.5.1 总RNA提取 Trizol法提取总RNA,微量紫外分光光度计检测A260、A280,取A260/A280在1.8~2.0样品进行实验,并计算总RNA浓度。
2.5.2 实时PCR检测 根据浓度计算2 µg样本RNA体积,按照RevertAidTMFirst strand cDNA Synthsis Kit试剂盒说明书配制20 µL的反转录体系。轻柔混匀,低速离心,于PCR仪进行反转录反应,反转录获得cDNA。各目的基因引物由上海生工生物工程有限公司合成,目的基因引物序列见表1。按照试剂盒配制20 µL的扩增体系:Power SYBR Green PCR Master Mix(2×)10 µL,引物各2 µL,cDNA 1 µL,Nuclease-free water 1 µL。Real-time PCR检测以β-actin为内参基因,计算谷氨酸组和给药组相对于正常组目的基因的表达量,最终结果用相对表达量2-ΔΔct表示。
2.6 Bcl-2、Bax蛋白表达检测
采用Western blot检测。用含1%PMSF的蛋白裂解液提取蛋白,并按BCA蛋白测定说明书对每组蛋白含量进行测定,样品经12%凝胶电泳分离、转膜、封闭,将膜与溶于封闭液中一抗4 ℃孵育过夜。将膜浸入二抗稀释液,室温孵浴1 h 洗涤,在暗室内将ECL显影液加到膜的蛋白面,静置1 min,充分显色后,曝光,凝胶成像仪显影、拍照,应用凝胶图像分析软件分析各目的蛋白相对表达量,β-actin为内参基因,并计算目标蛋白与内参的比值。

表1 基因引物序列
3 统计学方法
采用SPSS17.0统计软件进行分析。实验结果以±表示,组间比较用方差分析。<0.05表示差异有统计学意义。
4 结果
4.1 栝楼桂枝颗粒对谷氨酸诱导损伤PC12增殖的影响
MTT法显示,谷氨酸组较正常组PC12活力明显下降(<0.05),栝楼桂枝颗粒高、中剂量组PC12活力较谷氨酸组明显升高(<0.05),见图1。LDH法显示,谷氨酸组较正常组PC12活力明显升高(<0.05),栝楼桂枝颗粒各剂量组PC12活力较谷氨酸组变化不明显,见图2。
4.2 栝楼桂枝颗粒对谷氨酸诱导损伤PC12凋亡的影响
与正常组比较,谷氨酸组PC12凋亡率升高;与谷氨酸组比较,栝楼桂枝颗粒各剂量组PC12凋亡率降低,见图3。

注:与正常组比较,#P<0.05;与谷氨酸组比较,*P<0.05

注:与正常组比较,#P<0.05

注:A.正常组;B.谷氨酸组;C.栝楼桂枝颗粒低剂量组; D.栝楼桂枝颗粒中剂量组;E.栝楼桂枝颗粒高剂量组
4.3 栝楼桂枝颗粒对谷氨酸诱导损伤PC12 Caspase-3活性的影响
与正常组比较,谷氨酸组PC12 Caspase-3活性明显升高(<0.01);与谷氨酸组比较,栝楼桂枝颗粒各剂量组PC12 Caspase-3活性明显降低(<0.05)。结果见表2。

表2 各组PC12 Caspase-3活性比较(±s,%)
注:与正常组比较,##<0.01;与谷氨酸组比较,*<0.05
4.4 栝楼桂枝颗粒对谷氨酸诱导损伤PC12 Bcl-2、Bax mRNA表达的影响
与正常组比较,谷氨酸组PC12 Bcl-2基因表达降低、Bax基因表达明显升高(<0.05,<0.01);与谷氨酸组比较,栝楼桂枝颗粒各剂量组PC12 Bax基因表达降低、Bcl-2基因表达升高,栝楼桂枝颗粒高剂量组差异明显(<0.05)。结果见图4。

注:与正常组比较,#P<0.05,##P<0.01;与谷氨酸组比较,*P<0.05
4.5 栝楼桂枝颗粒对谷氨酸诱导损伤PC12 Bcl-2、Bax蛋白表达的影响
与正常组比较,谷氨酸组PC12 Bcl-2、Bax蛋白表达明显降低(<0.01);与谷氨酸组比较,栝楼桂枝颗粒各剂量组PC12 Bax、Bcl-2蛋白表达增强,栝楼桂枝颗粒高剂量组差异明显(<0.01)。结果见图5。
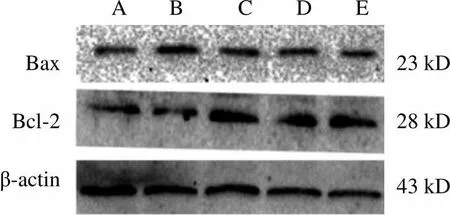
A B C D E BaxBcl-2β-actin23 kD28 kD43 kD
注:A.正常组;B.谷氨酸组;C.栝楼桂枝颗粒低剂量组; D.栝楼桂枝颗粒中剂量组;E.栝楼桂枝颗粒高剂量组
注:与正常组比较,##<0.01;与谷氨酸组比较,**<0.01
图5 各组PC12 Bcl-2、Bax蛋白表达比较(±,=6)
5 讨论
栝楼桂枝颗粒处方来源于张仲景《金匮要略》,由天花粉、白芍、桂枝、甘草、生姜、大枣6味药组成。方中天花粉清热生津而润燥养筋、舒缓筋脉;同时以桂枝汤为基础方,刚柔相济,开阖相佐,发汗解肌、温经通脉、助阳化气、散寒止痛。诸药配伍,结构严谨,邪正兼顾,阴阳并补,气血双调,柔润筋脉,缓痉之急,能够解肌和营、生津柔筋,临床用于治疗脑卒中后痉挛性偏瘫。
脑卒中发生机制是一个复杂的级联反应过程,其中谷氨酸诱导细胞产生兴奋性或氧化应激损伤的过程包括多种信号传导途径的参与,其机制比较复杂。研究表明,抗凋亡蛋白Bcl-2基因家族和Caspase蛋白酶家族在细胞凋亡过程中发挥着重要的作用[8]。Bcl-2是一种抗凋亡的基因,Bcl-2过度表达可有效降低神经元的损伤,其原因可能与线粒体膜的稳定与完整有关[9]。当无凋亡因素存在时,它和Bax共同维持细胞膜的完整性,抑制线粒体凋亡。受到凋亡刺激时,Bcl-2与Bax生成二聚体释放Bax,导致细胞凋亡。因此,Bcl-2/Bax比值对于细胞凋亡至关重要[10]。富苏等[11]发现通络化痰胶囊能下调缺血半暗带Bax表达,促进Bcl-2表达,减少细胞凋亡水平,促进脑缺血损伤大鼠的神经功能的恢复。本实验通过Western Blot检测Bax、Bcl-2蛋白表达,发现栝楼桂枝颗粒能上调Bcl-2的表达,提高Bcl-2/Bax比值,表明栝楼桂枝颗粒可起到抗凋亡的作用,且RT-PCR的结果进一步验证了其抗凋亡作用。
作为半胱氨酸蛋白酶家族中一员,Caspase-3在凋亡细胞死亡级联过程中起着重要作用[12]。它是凋亡细胞通路中的下游蛋白,可以一定的氨基酸序列剪接成多种活性的关键蛋白,在哺乳动物细胞凋亡过程中起着重要作用[13]。无论是fas配体途径活化Caspase-8,还是线粒体途径过程中活化Caspase-9,都能导致Caspase-3激活,引起Caspase-3级联反应,最终导致细胞凋亡[14]。体内研究结果表明,高浓度谷氨酸能够激活细胞内Caspase-3蛋白的表达,参与谷氨酸诱导的PC12凋亡[15]。
Caspase-3可以催化底物Z-DEVD-R110分解出R110,发出荧光,一旦Caspase-3发生剪切,就可以使无荧光的底物产生荧光,且Caspase-3的活性与荧光呈正相关。本实验结果表明,谷氨酸处理细胞后,Caspase-3相对活性显著升高,表示细胞发生凋亡。而加入栝楼桂枝颗粒后,Caspase-3相对活性显著降低,凋亡通路受到抑制,表明栝楼桂枝颗粒能抑制谷氨酸引起的细胞凋亡,起到一定的保护作用。
综上,栝楼桂枝颗粒能降低PC12 Caspase-3活性,提高Bcl-2/Bax比值,对谷氨酸诱导PC12损伤有保护作用,其机制可能与抗细胞凋亡有关。但这只是部分调节凋亡相关基因研究,具体是否通过调节炎症因子等其他途径实现其保护作用,有待进一步研究其多层次、多基因的神经保护作用。
[1] 陈瑛玲,陈立典,陶静.栝楼桂枝汤治疗中风后肢体痉挛的临床研究[J].中医临床研究,2013,5(4):7-9.
[2] 毛敬洁,李钻芳,黄佳,等.栝楼桂枝汤醇提物对氧化应激PC12细胞内NrF2和HO-1 mRNA表达的影响[J].世界中西医结合杂志,2013,8(6):563-566.
[3] HU H X, LI Z F, ZHU X Q, et al. Gua Lou Gui Zhi Decoction suppresses LPS-induced activation of the TLR4/NF-κB pathway in BV-2 murine microglial cells[J]. International Journal of Molecular Medicine, 2013,31:1327-1332.
[4] HU H X, LI Z F, ZHU X Q, et al. Gua Lou Gui Zhi Decoction inhibits LPS-induced microglial cell motility through the MAPK signaling pathway[J]. International Journal of Molecular Medicine,2013,32:1281-1286.
[5] CHEN X W, LI H, HUANG M Q, et al. Effect of Gua Lou Gui Zhi Decotion on focal cerebral ischemia-reperfusion injury through regulating the expression of excitatory amino acid and their receptors[J]. Molecular Medicine Reports,2014,10:248-254.
[6] HUANG J, TAO J, XUE X H, et al. Gua Lou Gui Zhi Decoction exerts neuroprotective effects on post-stroke spasticity via the modulation of tamate levels and AMPA receptor expression[J]. International Journal of Molecular Medicine,2013,31:841-848.
[7] 李钻芳,林如辉,毛静洁,等.栝楼桂枝汤对谷氨酸诱导的BV-2细胞损伤的保护作用[J].福建中医药大学学报,2013,23(5):14-17.
[8] YOULE R J, STRASSER A. The Bcl-2 protein family:opposing activites that mediate cell death[J]. Nat Rev Cell Biol,2008,8:47-59.
[9] BRECKENRIDGE D G, XUE D. Regulation of mitochondrail memebrance permeabilization by Bcl-2 family proteins and caspases[J]. Curr Opin Cell Biol,2004,16:647-652.
[10] SARI S, HASHEMI M, MAHDIAN R, et al. The effect of pentoxifylline on Bcl-2 gene expression changes in hippocampus after ischemia-reperfusion in Wistar rats by a quatitative RT-PCR method[J]. Iran J Pharm Res,2013,12:595-601.
[11] 富苏,韩经丹,周杰,等.通络化痰胶囊对脑缺血损伤大鼠神经细胞凋亡及Bcl-2、Bax的影响[J].中国实验方剂学杂志,2013,19(8):242-246.
[12] THORNBERRY N A, LAZEBNIK Y.Caspases:Enemies within[J]. Science,1998,281:1312-1316.
[13] HEUNG Z H, LEUNG M C, YIP H K, et al. A neuroprotective herbal mixture inhibits caspase-3 independent apoptosis in retinal ganglion Cells[J]. Cell Mol Neurobiol,2008,28:137-155.
[14] CARUSO C, BOTTINO M C, PAMPILLO M, et al. Glutamate induces apoptosis in anterior pituitary cells through group Ⅱ metabotropic glutamae receptor[J]. Endocrinology,2004,145:4677- 4684.
[15] WANG X C, ZHU G Q, YANG S, et al. Paeonol prevents excitotoxicity in rat pheochromocytoma PC12 cells via downregulation of ERK activation and inhibition of apoptosis [J]. Planta Medicine,2011, 77:1695-1701.
EffectsofGranules on Excitatory Toxic Damage of PC12 Induced by Glutamate
ZHANG Yu-qin, SUN Cheng-tao, LI Huang, XU Wei, CHU Ke-dan, LIN Yu
Objective To investigate the effectsofGranules on excitatory toxic damage of PC12 induced by glutamate; To primarilyexplore the involved protective mechanism ofGranules. MethodsExcitatory toxic damage of PC12 induced by glutamate was used to establish models. Cells were divided into normal group, glutamate group, andGranules low- (200 μg/mL), medium- (400 μg/mL) and high-dose (800 μg/mL) groups. MTT and LDH assay methods were used to detect PC12 activity; Caspase-3 activity detection method and Annexine V/PI double staining method were used to detect cell apoptosis; Western blot and RT-PCR were used to detect Bcl-2, Bax protein and mRNA expression. Results Compared with glutamate group, MTT showed that allGranules groups could improve PC12 activity, and LDH showed that cell activity in allGranules groups decreased; Annexine V/PI double staining method showed that allGranules groups could decrease the PC12 apoptosis; Caspase-3 activity detection method showed thatallGranules groups could decrease the activity of Caspase-3; Western blot and RT-PCRshowed that allGranules groups could reduce Bax expression and increase Bcl-2 expression.ConclusionGranuleshavecertainprotective effectson excitatory toxic damage of PC12 induced by glutamate, which may be related to its anti-apoptotic activity.
Granules; glutamate; PC12; cell apoptosis
10.3969/j.issn.1005-5304.2017.06.010
R285.5
A
1005-5304(2017)06-0039-05
国家自然科学基金(81674046);福建省教育厅新世纪人才项目(2015年)
林羽,E-mail:yulam@fjtcm.edu.cn
(2016-09-19)
(修回日期:2016-10-13;编辑:华强)
