长果颈黄芪根中抑制α-葡萄糖苷酶活性成分研究
2017-05-22肖朝江
邱 琳,肖朝江,董 相,姜 北*
(1.大理大学药物研究所,云南大理 671000;2.大理大学药学与化学学院,云南大理 671000)
长果颈黄芪根中抑制α-葡萄糖苷酶活性成分研究
邱 琳1,2,肖朝江1,2,董 相1,2,姜 北1,2*
(1.大理大学药物研究所,云南大理 671000;2.大理大学药学与化学学院,云南大理 671000)
目的:对长果颈黄芪(Astragalus englerianus)根化学成分进行研究,并对分离得到的化合物进行α-葡萄糖苷酶抑制活性测试。方法:利用Rp-18、Sephadex LH-20、硅胶等分离手段对长果颈黄芪根部分的甲醇提取物进行分离纯化,通过现代波谱学技术对相关化合物进行结构鉴定,并以4-硝基酚-α-D-吡喃葡萄糖苷(PNPG)为底物的酶抑制剂筛选模型对各样品进行α-葡萄糖苷酶抑制活性实验。结果:从该植物根甲醇提取物的乙酸乙酯部位分离得到6个化合物,分别鉴定为:十六烷酸单甘油酯(1)、2,4'-二羟基-4-甲氧基二氢查耳酮(2)、胡萝卜苷(3)、5α,6β-二羟基胡萝卜苷(4)、(3R)-vestitol-7-O-glucoside(5)、(2S,3S,4R,8E)-2-[(2'R)-2'-羟基-二十四烷酰胺]-8-十八烯-1,3,4-三醇(6)。α-葡萄糖苷酶抑制活性结果显示,化合物2具有显著抑制活性,IC50显著小于阳性对照阿卡波糖;化合物5及其苷元(3R)-vestitol也显示一定的抑制活性。结论:化合物1~6均为首次从长果颈黄芪根中分离得到,其中黄酮类成分对α-葡萄糖苷酶具有较好的抑制活性。
长果颈黄芪;根;化学成分;α-葡萄糖苷酶;抑制活性
长果颈黄芪(Astragalus englerianus)为我国特有的豆科黄芪属植物,主要分布于云南、西藏东南部等地区,生于海拔2 000~3 700 m的山坡林缘。民间药用记载该植物根入药,有滋肾补脾、止汗利水、消肿化脓之效〔1-2〕。为了解该植物的化学成分与生物活性,本研究团队曾对该植物进行过系统的研究,分离得到了一系列结构类型多样的活性成分〔3-4〕。由于黄芪属植物多具有血糖调节作用,为该研究的后续工作,近来我们对长果颈黄芪地下部分甲醇提取物乙酸乙酯部位进行了α-葡萄糖苷酶抑制活性成分研究,从中分离鉴定了6个化合物,分别为:十六烷酸单甘油酯(1)、2,4'-二羟基-4-甲氧基二氢查耳酮(2)、胡萝卜苷(3)、5α,6β-二羟基胡萝卜苷(4)、(3R)-vestitol-7-O-glucoside(5)、(2S,3S,4R,8E)-2-[(2'R)-2'-羟基-二十四烷酰胺]-8-十八烯-1,3,4-三醇(6)。见图1。活性测试结果显示,化合物2对α-葡萄糖苷酶有很好的抑制活性,IC50显著小于阳性对照阿卡波糖,化合物5及其苷元(3R)-vestitol也显示一定的抑制活性。本研究为长果颈黄芪的开发利用提供了初步的基础性研究依据。
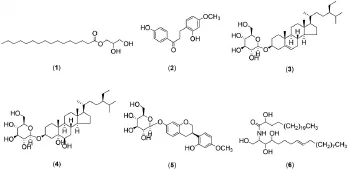
图1 化合物1~6的结构
1 仪器与材料
1.1实验材料实验用植物样品于2011年11月采自云南省大理市苍山东坡,由中国科学院昆明植物研究所向春雷博士鉴定为长果颈黄芪Astragalus englerianus Ulbr.,植物标本(编号:20100928-1b)现存放于大理大学药物研究所姜北教授研究组〔3〕。
1.2仪器与试剂Bruker Avance III-400核磁共振波谱仪(TMS为内标);旋转蒸发仪R-210(BUCHI);BioTek Synergy HT酶标仪(BioTek Instruments Inc.);RP-18(40~75μm,日本Fuji公司);Sephadex LH-20(Amersham Biosciences);柱色谱硅胶与薄层色谱硅胶GF254(青岛海洋化工厂);α-Glucosidase from rice(G9259-100UN)和4-Nitrophenylα-D-glucopyrano⁃side(N1377-1G)均购于Sigma公司;阿卡波糖(北京百灵威科技有限公司);氯仿、丙酮、甲醇等试剂均为工业级有机溶剂,经重蒸后使用;其余试剂均为分析纯;供试样品(3R)-vestitol由本研究组前期研究中分离得到〔5〕。
2 实验方法
2.1提取分离长果颈黄芪干燥根(6.1 kg)粉碎后用甲醇室温冷浸提取6次,减压浓缩所得总浸膏用适量水混悬后依次用乙酸乙酯、正丁醇分配数次;乙酸乙酯部分减压浓缩得浸膏100 g,与适量粗硅胶(80~100目)混合拌样后经200~300目硅胶柱色谱,氯仿-丙酮混合溶剂梯度洗脱(1:0至0:1),经TLC(薄层色谱法)检测合并相同流分得10个组分(A~J)〔3〕。组分D经Sephadex LH-20(氯仿:甲醇= 1:1)柱层析以及硅胶柱层析(石油醚-乙酸乙酯)得到化合物1(22.6 mg)。组分E经硅胶柱层析(氯仿-甲醇),Sephadex LH-20(氯仿:甲醇=1:1)柱层析和Rp-18(甲醇-水)柱层析得到化合物2(41.1 mg)、3(277.0 mg)和4(34.3 mg)。组分F经大孔树脂(甲醇-水)、Sephadex LH-20(氯仿:甲醇=1:1)柱层析以及反复硅胶柱层析(氯仿-丙酮、氯仿-甲醇)的方法得到化合物5(121.4 mg)、6(56.0 mg)。
2.2α-葡萄糖苷酶抑制活性的测定α-葡萄糖苷酶抑制活性测定的反应体系参照MA等〔6〕的方法,并略有改进:分别配制100 mmol/L PBS缓冲液(pH 7.0)、2 mmol/L PNPG溶液(PBS溶解)、0.3 U/mL α-葡萄糖苷酶溶液(PBS溶解)以及0.2 mol/L Na2CO3溶液;测试样品根据预试验结果用DMSO(二甲基亚砜)配置成合适的初始浓度,共设置5个浓度梯度,采用倍比稀释法稀释成测试浓度;取96孔板,每孔加40μL的PNPG溶液和5μL样品溶液,震板30 s后加入5μL的α-葡萄糖苷酶溶液,在37℃恒温水浴20 min,加入50μL的Na2CO3溶液终止反应,冷却至室温后在酶标仪下以405 nm为测定波长,630 nm为参比波长测定吸收值并按下式计算抑制率。实验一式5份,同时设置空白对照(DMSO)和阳性对照(阿卡波糖)。
抑制率%=[(△A空白-△A样品)/△A空白]×100%;△A=样品组OD值-背景组OD值
2.3数据处理方法采用SPSS 7.0统计软件对活性测试结果进行数据分析。
3 实验结果
3.1结构鉴定化合物1:白色粉末。1H NMR(400 MHz,CD3OD)δ:2.37(2H,t,J=7.42 Hz,H-2),1.62(2H,brs,H-3),1.29(16H,brs,H-4~15),4.16(1H,dd,J=11.4,4.4 Hz,H-1'a),4.07(1H,dd,J=11.4,6.3 Hz,H-1'b),3.85(1H,m,H-2'),3.57(1H,d,J=5.9 Hz,H-3'a),3.31(1H,d,J=5.7 Hz,H-3'b),0.90(3H,t,J=6.2 Hz,Me-16);13C NMR(100 MHz,CD3OD)δ:175.8(s,C-1),35.2(t,C-2),33.2(t,C-3),30.2~30.3(t,C-4~14),23.9(t,C-15),14.8(q,C-16)。上述数据与文献〔7〕报道的碳、氢谱数据基本一致,取标准品十六烷酸单甘油酯点板对照,其Rf值与斑点颜色均与标准品一致,故确定化合物1为十六烷酸单甘油酯。
化合物2:浅黄色粉末。1HNMR(400 MHz,CDCl3)δ:7.87(2H,d,J=8.8 Hz,H-2',6'),6.84(1H,d,J=8.4 Hz,H-6),6.84(2H,d,J=8.8 Hz,H-3',5'),6.50(1H,d,J=2.6 Hz,H-3),6.44(1-H,dd,J=8.4,2.6 Hz,H-5),3.73(3H,s,H-OCH3),3.34(2H,t,J=5.6Hz,H-α),2.92(2H,t,J=5.6 Hz,H-β);13CNMR(100 MHz,CDCl3)δ:120.3(s,C-1),155.3(s,C-2),102.8(d,C-3),159.6(s,C-4),107.1(d,C-5),131.1(d,C-6),128.9(s,C-1'),131.1(d,C-2',C-6'),115.5(d,C-3',C-5'),161.2(s,C-4'),201.2(s,C=O),40.2(t,C-α),22.9(t,C-β),55.3(q,OCH3)。上述数据与文献〔8〕报道的波谱数据基本一致,故确定化合物2为2,4'-二羟基-4-甲氧基二氢查耳酮。
化合物3:白色粉末。1H NMR(400 MHz,C5D5N)δ:5.36(1H,d,J=4.3 Hz,H-6),5.03(1H,d,J=7.7 Hz,H-1'),4.58(1H,dd,J=12.2,2.5 Hz,H-6'a),4.43(1H,dd,J=12.2,5.2 Hz,H-6'b),4.29(1H,d,J=6.8 Hz,H-4'),0.93(1H,d,J=6.6 Hz,Me-21),0.89(3H,s,Me-19),0.85,0.81 and 0.79(each 3H,overlap,Me-26,27 and 29),0.67(3H,s,Me-18);13C NMR(100 MHz,C5D5N)δ:37.9(t,C-1),30.8(t,C-2),78.9(d,C-3),40.6(t,C-4),141.2(s,C-5),122.4(d,C-6),32.7(t,C-7),32.6(d,C-8),50.8(d,C-9),37.4(s,C-10),21.8(t,C-11),39.8(t,C-12),42.9(s,C-13),57.3(d,C-14),24.9(t,C-15),29.1(t,C-16),56.7(d,C-17),12.5(q,C-18),19.7(q,C-19),36.9(d,C-20),19.5(q,C-21),34.7(t,C-22),26.9(t,C-23),46.5(d,C-24),29.9(d,C-25),20.5(q,C-26),19.9(q,C-27),23.9(t,C-28),12.7(q,C-29),103.1(d,C-1'),75.8(d,C-2'),78.6(d,C-3'),72.0(d,C-4'),79.1(d,C-5'),63.3(t,C-6')。上述数据与文献〔9〕报道的波谱数据一致,故确定化合物3为胡萝卜苷。
化合物4:白色粉末。1H NMR(400 MHz,C5D5N)δ:4.88(1H,d,J=7.5 Hz,H-1'),4.38(1H,dd,J=12.1,2.3 Hz,H-6'a),4.29(1H,dd,J=12.1,4.8 Hz,H-6'b),4.25(1H,t,J=9.0 Hz,H-4'),4.16(1H,t,J=8.9 Hz,H-3'),4.11(1H,brs,H-6),2.98(1H,dd,J=12.1,4.5 Hz,H-4a),2.58(1H,m,H-4b),1.33(3H,s,Me-19),0.96(3H,m,Me-21),0.87(3H,m,Me-27),0.80(3H,m,Me-26),0.66(3H,s,Me-18);13C NMR(100 MHz,C5D5N)δ:33.3(t,C-1),31.9(t,C-2),75.9(d,C-3),39.3(s,C-4),76.2(s,C-5),76.5(d,C-6),36.4(d,C-7),31.6(t,C-8),46.2(d,C-9),39.3(t,C-10),23.2(t,C-11),41.4(t,C-12),43.4(t,C-13),57.2(d,C-14),25.1(d,C-15),30.0(d,C-16),56.9(d,C-17),12.4(q,C-18),17.4(q,C-19),37.2(s,C-20),19.4(q,C-21),34.7(t,C-22),27.3(t,C-23),46.2(t,C-24),30.1(t,C-25),19.9(q,C-26),20.5(t,C-27),23.9(t,C-28),12.7(C-29),102.9(d,C-1'),75.3(d,C-2'),76.9(d,C-3'),72.5(d,C-4'),77.9(d,C-5'),63.3(t,C-6')。上述数据与文献〔10〕报道的波谱数据基本一致,故确定化合物4为5α,6β-二羟基胡萝卜苷。
化合物5:针状结晶(甲醇)。1H NMR(400 MHz,CD3OD)δ:6.95(1H,d,J=8.5 Hz,H-6'),6.94(1H,d,J=8.4 Hz,H-5),6.59(1H,dd,J=8.4,2.4 Hz,H-5'),6.53(1H,d,J=2.4 Hz,H-3'),6.36(1H,dd,J=8.4,2.5 Hz,H-6),6.33(1H,d,J=2.5 Hz,H-8),4.81(1H,d,J=7.4 Hz,H-1''),4.20(1H,ddd,J=10.3,3.4,1.9 Hz,H-2a),3.96(1H,d,J=10.3 Hz,H-2b),3.86(1H,d,J=1.9 Hz,H-6'),3.70(3H,s,-OMe),3.86(1H,d,J=4.8 Hz,H-5''),2.94(1H,dd,J=15.8,10.8 Hz,H-4a),2.80(1H,ddd,J=15.8,5.3,1.9 Hz,H-4b);13C NMR(100 MHz,CD3OD)δ:71.1(t,C-2),33.0(d,C-3),31.4(t,C-4),131.2(d,C-5),110.1(d,C-6),158.3(s,C-7),105.6(d,C-8),156.3(s,C-9),117.9(s,C-10),121.1(s,C-1'),157.2(s,C-2'),102.4(d,C-3'),160.8(s,C-4'),105.7(d,C-5'),128.8(d,C-6'),55.6(q,-OMe),102.4(d,C-1''),74.9(d,C-2''),78.0(d,C-3''),71.3(d,C-4''),78.1(d,C-5''),62.5(t,C-6'')。上述数据与文献〔11〕报道的波谱数据基本一致,故确定化合物5为(3R)-vestitol-7-O-glucoside。
化合物6:白色粉末。1H NMR(400 MHz,C5D5N)δ:8.60(1H,d,J=9.0 Hz,NH),5.54(2H,m,H-8,9),5.13(1H,m,H-2),4.64(1H,dd,J=7.8,3.8 Hz,H-2'),4.53(1H,dd,J=10.8,4.6 Hz,H-1a),4.44(1H,dd,J=10.8,4.9 Hz,H-1b),4.35(1H,dd,J=6.9,4.4 Hz,H-3),4.30(1H,m,H-4),1.16~2.36(m,H-11~17,5'~23'),0.88(6H,t,J= 7.0 Hz,H-18,24');13C NMR(100 MHz,C5D5N)δ:61.8(t,C-1),52.7(d,C-2),76.6(d,C-3),72.6(d,C-4),33.6(t,C-5),26.5(t,C-6),32.8(t,C-7),130.4(d,C-8),130.6(d,C-9),33.1(t,C-10),29.3-29.8(t,C-11~15),31.9(t,C-16),22.7(t,C-17),14.1(q,C-18),175.0(s,C-1'),72.2(d,C-2'),35.5(t,C-3'),25.6(d,C-4'),29.3-29.8(t,C-5'~21'),31.9(t,C-22'),22.7(t,C-23'),14.1(q,C-24')。上述数据与文献〔12〕报道的波谱数据基本一致,并取标准品点板对照,以3个不同的溶剂系统分别展开,其Rf值与斑点颜色均与标准品一致,故确定化合物6为(2S,3S,4R,8E)-2-[(2'R)-2'-羟基-二十四烷酰胺]-8-十八烯-1,3,4-三醇。
3.2受试样品的α-葡萄糖苷酶抑制活性的测定结果
对长果颈黄芪根甲醇提取物、提取物乙酸乙酯萃取部位、化合物1~6及化合物5的苷元(3R)-vestitol进行α-葡萄糖苷酶的抑制活性检测,其中甲醇提取物、乙酸乙酯部分初始浓度为5 mg/L,各单体化合物初始浓度为1 mg/L,在初始浓度下仍未显示出对α-葡萄糖苷酶有抑制活性,则认为该化合物没有活性。实验结果表明:类属于黄酮的化合物2活性最好,化合物5的苷元(3R)-vestitol次之,化合物5活性较弱,其余化合物均没有显示对α-葡萄糖苷酶有抑制活性,相关试验结果见表1。
4 讨论
本实验从长果颈黄芪中分离得到的6个化合物,结构类型涉及黄酮、甾体、酰胺和酯类成分等。α-葡萄糖苷酶抑制活性测试结果显示,仅黄酮类化合物具有抑制活性,而酯类、甾体类及酰胺都不具有α-葡萄糖苷酶抑制活性。同时,化合物5的α-葡萄糖苷酶抑制活性明显弱于相应苷元(3R)-vestitol,说明其结构中的酚羟基被糖基化后会降低化合物对α-葡萄糖苷酶的抑制作用,这与文献〔13〕报道相一致。化合物2为二氢查耳酮类化合物,TSUJIHARA等研究发现同类化合物根皮苷及其衍生物具有抑制钠糖转运通道(SGLT)活性〔14〕。这类化合物可以通过抑制SGLT活性,促进尿糖代谢,从而达到降低血糖的目的。本实验研究结果进一步显示二氢查耳酮类化合物也可与α-葡萄糖苷酶的活性位点相结合,从而达到抑制其活性的目的。
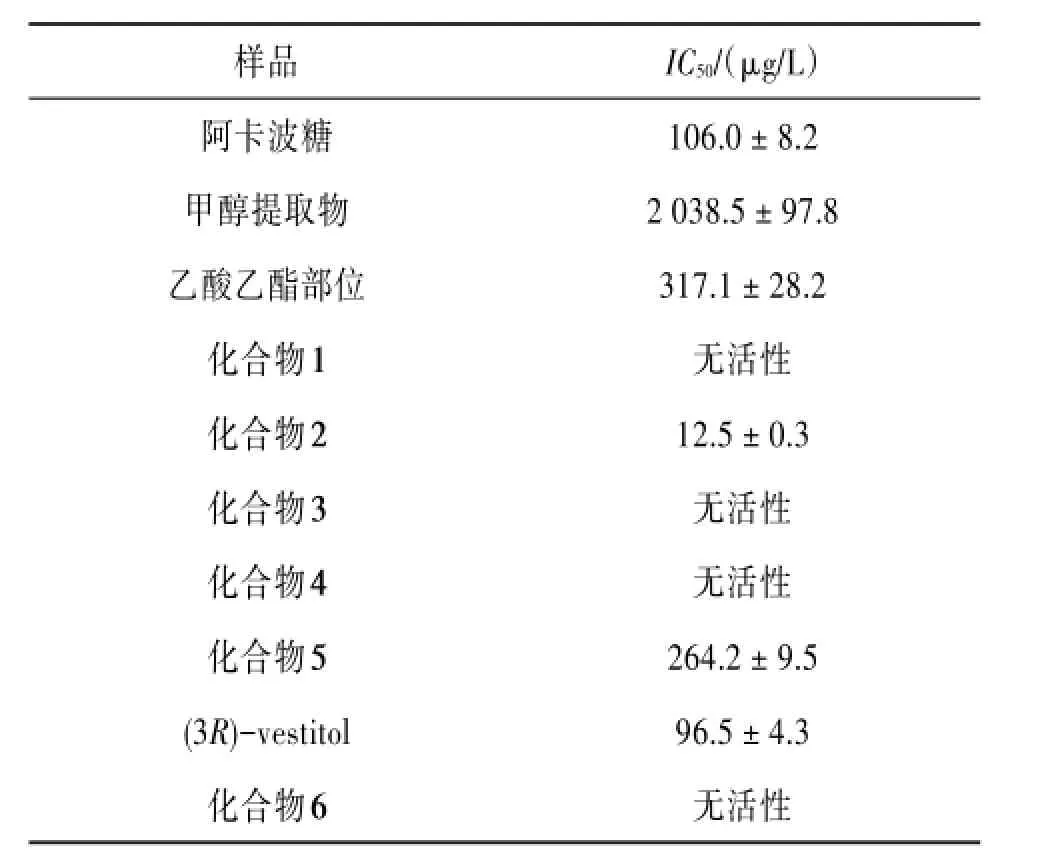
表1 受试样品的α-葡萄糖苷酶抑制活性试验结果(n=5)
〔1〕《中国植物志》编辑委员会.中国植物志:第42卷〔M〕.北京:科学出版社,2004.
〔2〕中国科学院昆明植物研究所.云南植物志:第10卷〔M〕.北京:科学出版社,2006.
〔3〕XIAO C J,LIN Q,WEI X U,et al.Chemical constituents from roots of Astragalus englerianus and their anti-oxida⁃tive activities〔J〕.Chinese Traditional&Herbal Drugs,2015,46(1):22-27.
〔4〕XIAO C J,ZHANG Y,QIU L,etal.A new schistosomicidal and antioxidative phenylpropanoid from Astragalus engleri⁃anus〔J〕.J Asian Nat Prod Res,2015,17(7):772-777.
〔5〕肖朝江,邱琳,徐伟,等.长果颈黄芪化学成分和抗氧化活性研究〔J〕.中草药,2015,46(1):22-27.
〔6〕MA C M,HATTORI M,DANESHTALAB M,et al.Chloro⁃genic acid derivatives with alkyl chains of different lengths and orientations:potent alpha-glucosidase inhibitors〔J〕.J Med Chem,2008,51(19):6188-6194.
〔7〕李雯,王国才,张晓琦,等.中药壁虎化学成分研究〔J〕.中国中药杂志,2010,35(18):2412-2415.
〔8〕刘星,王蓓,高嫄,等.龙血竭不同类型酚性成分的分离及紫外光谱特征〔J〕.天然产物研究与开发,2013,25(8):1060-1066.
〔9〕朱小迪,李永慈,王建忠,等.黄心卫矛化学成分的分离与鉴定〔J〕.中成药,2011,33(1):107-110.
〔10〕LI S H,ZHAN H J,YAO P,et al.Non-taxane compounds from the bark of Taxus yunnanensis〔J〕.J Asian Nat Prod Res,2002,4(2):147-154.
〔11〕HATANO T,TAKAGI M,ITO H,etal.Acylated flavonoid glycosides and accompanying phenolics from licorice〔J〕. Phytochemistry,1998,47(2):287-293.
〔12〕黄朝辉,徐康平,周应军,等.黄花倒水莲化学成分研究〔J〕.天然产物研究与开发,2005,17(3):298-300.
〔13〕FENG C G,LING C,XIA L.Progress on research ofαglucosidase inhibitor from herbal medicines〔J〕.Chinese Journalof New Drugs,2005,14(6):669-672.
〔14〕TSUJIHARA K,HONGU M,SAITO K,et al.Na(+)-glu⁃cose cotransporter inhibitors as antidiabetics.I.Synthesis and pharmacological properties of 4'-dehydroxyphlorizin derivatives based on a new concept〔J〕.Chem Pharm Bull,1996,44(6):1174-1180.
Study on the Compoundswithα-Glucosidase Inhibitory Activity from Roots of Astragalus englerianus
Qiu Lin1,2,Xiao Chaojiang1,2,Dong Xiang1,2,Jiang Bei1,2*
(1.Institute of Materia Medica of DaliUniversity,Dali,Yunnan 671000,China;2.College of Pharmacy and Chemistry, Dali University,Dali,Yunnan 671000,China)
Objective:To study the chemical components of Astragalus englerianus,and to explore the active compounds ofαglucosidase's inhibiting from the roots of Astragalus englerianus.Methods:The compounds were isolated and purified by Rp-18, Sephadex LH-20 and silica gel column chromatography.Their structures were identified by modern spectroscopy techniques. Theα-glucosidase's inhibiting experiment was performed by using enzyme inhibitor screening model with 4-nitrophenolα-D-glucopyranoside(PNPG)as the substrate.Results:Six compounds were isolated from ethyl acetate fraction of methanol extract of the roots of A.englerianus and identified as 1-O-hexadecanolenin(1),2,4'-dihydroxy-4-methoxy dihydrochalcone(2), daucosterol(3),5α,6β-dihydroxy-daucosterol(4),(3R)-vestitol-7-O-glucoside(5),and(2S,3S,4R,8E)-2-[(2'R)-2-hydroxytetracosanoylamino]-1,3,4-octadecanetriol-8-ene(6).All of these compounds were examined for theirα-glucosidase inhibitory activities.As a result,compound 2 showed significantly activity with the lower IC50than the positive control,acarbose. Compound 5 and its aglucon,(3R)-vestitol also showed some inhibitory activity.Conclusion:Allofthe compounds were isolated from the roots of A.englerianus for the first time,and the flavonoids showed the betterα-glucosidase inhibitory activity than the other compounds.
Astragalus englerianus;root;compounds;α-glucosidase;inhibitory activity
R932
A
2096-2266(2017)04-0001-05
10.3969/j.issn.2096-2266.2017.04.001
(责任编辑 李 杨)
国家自然科学基金资助项目(31170313)
2016-08-16
2016-12-23
邱琳,硕士研究生,主要从事天然产物研究.
*通信作者:姜北,教授,博士.
