电针对吗啡戒断大鼠不同脑区FosB基因表达的影响*
2017-05-19刘铁镌
刘铁镌,常 江,卫 哲
1.哈尔滨医科大学附属第一医院(哈尔滨 150001), 2.哈尔滨市道里区群力家园社区卫生服务中心(哈尔滨 150001),3.浙江丽水学院医学与健康学院(丽水323000)
·基础研究·
电针对吗啡戒断大鼠不同脑区FosB基因表达的影响*
刘铁镌1,常 江2,卫 哲3△
1.哈尔滨医科大学附属第一医院(哈尔滨 150001), 2.哈尔滨市道里区群力家园社区卫生服务中心(哈尔滨 150001),3.浙江丽水学院医学与健康学院(丽水323000)
目的:观察电针对吗啡戒断大鼠戒断症状及不同脑区内FosB基因表达的影响。方法:采用逐日增量背部皮下注射盐酸吗啡注射液,末次注射后3 h给予纳洛酮快速戒断建立吗啡戒断大鼠模型,随后治疗组采用电针穴位干预。戒断后1、3、7d,分别采用戒断症状评分表评定各组大鼠戒断症状,应用RT-PCR测定大鼠前额叶皮质、伏隔核内FosB基因的表达水平。结果:戒断后各组症状评分显示:与空白组比较,戒断后1、3、7d模型组与电针组评分均明显升高(P<0.01),而随戒断时间增加模型与电针组评分均逐渐下降;与模型组比较,戒断后1、3、7d电针组戒断评分均明显降低(P<0.01);实时荧光定量PCR结果表明:戒断后1、3、7d电针组大鼠伏隔核FosB mRNA表达较模型组显著下降(P<0.01),且呈先快后慢的趋势;前额叶皮质内FosB mRNA表达较模型组下降(P<0.05),但呈先慢后快的趋势。结论:电针可以逐渐改善吗啡戒断后大鼠戒断症状,同时下调不同脑区内FosB mRNA的表达,且其表达变化规律在奖赏环路不同脑区内存在差异。
吗啡等成瘾物质导致的毒品问题是在世界范围内被广泛关注的焦点。近年来,电针疗法因其具有调理脏腑气血、平衡体内阴阳与促进内源性神经递质释放等作用,成为药物成瘾治疗、戒断后焦虑、学习记忆能力下降等认知功能康复的重要干预手段[1-2]。然而,脑内奖赏环路相关分子参与电针疗法调控作用的具体机制尚未完全明确。随着对成瘾机制研究的深入,人们发现很多与情感、记忆相关的重要脑区参与了药物成瘾尤其是精神依赖的形成,并诱发复吸[3]。研究显示:前额叶皮层( Prefrontal cortex,PFC)、伏隔核(Nucleus accumbens, NAc)不仅参与了成瘾的过程[4-5],同时调节和控制着成瘾后认知、行为和情绪的变化[6]。FosB mRNA为编码FosB(FBJ murine osteosarcoma viral oncogene homolog B)蛋白的基因,是参与细胞增殖、分化与转化的重要调控因子。现已证实该基因编码的蛋白及其剪接异构体可通过神经突触可塑性的变化参与药物成瘾过程,并发挥关键作用[7]。本研究拟通过电针手段干预吗啡戒断大鼠,观察戒断后不同时期的症状及成瘾相关脑区内FosB mRNA表达的变化,为电针干预药物成瘾机制的实验研究提供新的思路。
材料与方法
1 材料与仪器
1.1 实验动物:本实验所用动物为雄性 SD 大鼠54只,由黑龙江中医药大学实验动物中心提供的,体重为(180±20) g。所有大鼠适应性喂养 1 周,室内温度、湿度分别为 22℃、75%左右。
1.2 实验仪器:KWD808Ⅱ脉冲治疗仪;QL-902涡旋振荡仪(海门市其林贝尔仪器制造有限公司);Centrifuge 5415D离心机(Eppendorf);NANODROP 2000分光光度计(Thermo scientific);ABI7500荧光定量PCR仪(Applied Biosystems)。
1.3 实验试剂:盐酸吗啡注射液(10mg/ml,沈阳第一制药厂,批号:H21022436);盐酸纳洛酮注射液(1ml/1mg吉林敖东药业集团股份有限公司,批号:H20066624);超纯RNA提取试剂盒(Cat# CW0581,CWbio.Co.Ltd);HiFi-MMLV cDNA第一链合成试剂盒(Cat# CW0744,CWbio.Co.Ltd);UltraSYBR Mixture(With ROX) (Cat# CW0956,CWbio.Co.Ltd);DNase 1(Cat# CW2090,CWbio.Co.Ltd);5x RNA Loading Buffer(Cat# CW0611A,CWbio.Co.Ltd )。
2 实验方法
2.1 实验分组:采用 transform 法设定随机化方案,将54只大鼠分为空白组、模型组、电针组,每组各18只,每组再分为戒断1、3、7d三个亚组,各6只。
2.2 造模方法:参照文献[8]对模型组、电针组大鼠进行逐日递增量背部皮下注射盐酸吗啡注射液,连续5d,剂量分别为( 20,30,40,50,50 mg/kg),2次/d (8am,4pm)。空白组以相同体积、相同时间注射生理盐水。吗啡末次注射后3h给予纳洛酮腹腔注射 (3 mg/kg) 快速戒断。
2.3 戒断症状量表评分:各组大鼠分别于造模后1、3、7 d进行戒断症状量表评分。按照改良的柳田司知法进行,将各组大鼠放置在3000 ml烧杯中,观察15 min内大鼠戒断症状及1 h后体重丢失情况。戒断症状包括:湿狗样抖动、齿颤、上睑下垂、流泪、流涎、竖毛、激惹、腹泻、跳跃及体重减轻,其中可数症状如湿狗样抖动、跳跃次数及体重减轻依照发作次数评分,其他症状分别按照持续时间及严重程度分级评分,最后将各项评分加和得到最终戒断评分的分数。
2.4 各组处理:造模后每日于各组大鼠评分后进行分组处置。电针组大鼠捆绑固定,针刺肾俞与足三里穴,连接电针治疗仪,采用疏密波,频率2/100 Hz,连接同侧肾俞与足三里穴,电流强度以大鼠的下肢轻微抖动为度,每次15 min,每日1 次,连续治疗7 d。空白组和模型组在相同时间相同方法捆绑固定。
2.5 实验取材:各组大鼠分别于造模后1、3、7 d分组处置结束后断头,开颅,完整取出全脑组织,分离PFC及NAc脑区,液氮保存。
2.6 RT-PCR法测定PFC及NAc脑区的FosB基因表达水平:采用超纯RNA提取试剂盒提取组织样本中总RNA。使用琼脂糖凝胶电泳检测RNA的完整性;使用DNaseⅠ试剂盒进行消化处理以保证纯度。引物设计:FosB(F:5’ -ACGCCTGGAGTTTGTCCTGGTG-3’ R:5’ - CCGTCTTCCTTAGCGGATGTTGA-3’产物大小126bp);GAPDH(F:5’ - TGGAGTCTACTGGCGTCTT-3’ R:5’ - TGTCATATTTCTCGTGGTTCA-3’产物大小138bp)。应用试剂盒进行反转录及扩增。扩增程序为:95°10min,(95℃15sec,60℃60sec)45个循环。用相对定量 2-△△Ct法计算各个样品的基因相对表达量[9]。

结 果
1 电针对吗啡戒断后不同时间点戒断症状的影响 见表1。戒断后各组症状评分显示:与空白组比较,戒断后1、3、7 d模型组与电针组评分均明显升高(P<0.01),而随戒断时间增加模型与电针组评分均逐渐下降;与模型组比较,戒断后1、3、7 d电针组戒断评分均明显降低(P<0.01)。
2 电针对造模后1、3、7 d各组大鼠PFC、NAc脑区FosB mRNA 表达水平的影响 见图1。戒断后大鼠PFC及NAc脑区内FosB mRNA表达均下降。与空白组(设定为1. 00) 相比,戒断后1、3、7d电针组大鼠伏隔核FosB mRNA表达较模型组显著下降(P<0.01),且呈先快后慢的趋势;前额叶皮质内FosB mRNA表达较模型组下降(P<0.01),但呈先慢后快的趋势。

表1 各组大鼠不同时间戒断症状评分比较(分)
注:与空白组比较,*P<0.01;与造模后1d比较,#P<0.01;与模型组比较,△P<0.01
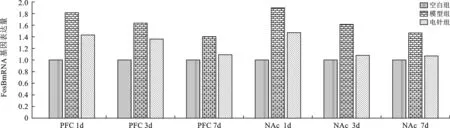
图1 各组大鼠吗啡戒断后不同脑区FosB mRNA表达的变化
讨 论
吗啡是一种典型的阿片类药物,长期应用机体会对阿片类物质产生代偿性适应,并涉及多种神经递质及其受体发生改变,可导致严重的戒断症状并诱发复吸[10]。研究表明:当人类脑部的奖赏系统在药物或情绪、环境刺激等影响下发生障碍时,会导致相关脑区内调控因子如FosB家族为代表的转录调控基因的变化,因此上述基因有望成为此类病症的潜在的治疗靶点[11]。目前较为明确的奖赏环路脑区包括PFC、NAc以及海马等[12-13],在阿片类药物的作用下,上述脑区通过多巴胺的作用被激活,从而对奖赏环路造成持续性的刺激,诱发突触改变导致药物成瘾的发生,并可大致戒断后的复吸。研究显示:因成瘾所导致的FosB等成瘾相关基因表达变化还可以遗传至子代导致出生后伏隔核等相关脑区内基因的高表达[14]。
本研究发现:电针作用于肾俞与足三里两穴,不仅可以逐渐改善戒断症状评分,同时还可有效调节不同脑区FosB mRNA的表达,可使戒断后大鼠脑内PFC与NAc脑区内呈现不同规律的调节变化。上述变化与医药治疗戒断疗效相一致[15],可能是其发挥效果的物质基础之一。在NAc区,当成瘾戒断后该区域内的FosB基因表达上调,而电针干预后显著下降,随着干预时间的延长,下调幅度明显减慢。而PFC区的FosB基因表达也得到了电针的调节,呈现下降趋势,但在干预早期即1-3d内呈缓慢下降的趋势,后期迅速下调。以上结果的出现可能与电针在戒断后不同时期所发挥的作用相关,早期以减轻躯体症状为主,当躯体症状得到改善后,逐渐增强了调控负责情绪与执行能力脑区内基因表达的作用。以上结果提示电针可有效干预戒断症状,同时下调不同脑区内FosB mRNA的表达,且其表达变化规律在奖赏环路不同脑区内存在差异。
[1] 李菊萍,吴鎏桢.电针治疗阿片依赖的Meta分析[J].中国药物依赖性杂志, 2014,23(1):28-35.
[2] 孙远征,刘铁镌,卫 哲,等.电针对吗啡戒断大鼠杏仁核内N-甲基-D-天门冬氨酸受体亚单位NR2B蛋白及基因表达的影响[J].针刺研究,2015,40(3):210-214.
[3] Blaine SK,Sinha R.Alcohol,stress and glucocorticoids: From risk to dependence and relapse in alcohol use disorders[J].Neuropharmacology,2017,17:30036-30039.
[4] Mons N,Beracochea D.Behavioral neuroadaptation to alcohol: from glucocorticoids to histone acetylation[J].Frontiers in Psychiatry,2016,7:165.
[5] Wearne TA,Parker LM,Franklin JL,etal.GABAergic mRNA expression is differentially expressed across the prelimbic and orbitofrontal cortices of rats sensitized to methamphetamine:Relevance to psychosis[J]. Neuropharmacology,2016 ,111:107-118.
[6] Pang G,Wu X,Tao X,etal.Blockade of serotonin 5-HT2A receptors suppresses behavioral sensitization and naloxone-precipitated withdrawal symptoms in morphine-treated mice[J].Front Pharmacol,2016,7:514.
[7] Ruffle JK.Molecular neurobiology of addiction: what's all the (△)FosB about[J]. American Journal of Drug & Alcohol Abuse,2014,40(6):1-10.
[8] Ledent C,Valverde O,Cossu G,etal. Unresponsiveness to cannabinoids and reduced addictive effects of opiates in CB1receptor knockout mice[J]. Science, 1999, 283(5400):401-404.
[9] 纪 冬,辛绍杰.实时荧光定量 PCR 的发展和数据分析[J].生物技术通讯,2009,20(4):598-600.
[10] 李佳辉,刘绮璐,高中洋,等.神经兴奋性对小鼠学习记忆能力的影响[J].陕西医学杂志, 2013,42(9):1112-1113.
[11] Vialou V,Thibault M,Kaska S,etal.Differential induction of FosB isoforms throughout the brain by fluoxetine and chronic stress[J]. Neuropharmacology, 2015,99:28-37.
[12] 万兆新,罗 琼,杨 静,等.边缘系统介导的情感和记忆机制在耳鸣急转慢过程中的作用[J].陕西医学杂志,2013,42(5):626-627.
[13] 席 悦,李文娟,张巧俊,等.帕金森病模型大鼠内侧前额叶皮质5-HT-3受体表达的变化[J].陕西医学杂志,2013,42(4):387-390.
[14] Zhao C,Eisinger BE,Driessen TM,etal. Addiction and reward-related genes show altered expression in the postpartum nucleus accumbens[J].Frontiers in Behavioral Neuroscience,2014,8(8):388.
[15] 王晓军,徐 斌,李继文,等.贴敷茶对戒烟疗效观察[J].陕西中医,2013, 34(4):430-433.
(收稿:2016-09-20)
Effect of electroacupuncture on the expression of Fos B mRNA in different brain regions during Morphine withdrawal in rats
Liu Tiejuan, Chang Jiang, Wei Zhe.
The First Affiliated Hospital of Harbin Medical University (Harbin 150001)
Objective: To observe rats’ withdrawal symptom and the expression of FosBmRNA in relative brain regions by electroacupuncture during Morphine withdrawal. Methods: Establish the Morphine dependent SD rat model. We adopted hypodermic injection by Morphine in back day by day, and injected naloxone in order to rapid withdrawal after the last injection of three hours. We treated the rats with electroacupuncture, and used withdrawal symptom scale to testing rats’ withdrawal symptom. The expression of FosB mRNA in PFC, and NAC of rats were measured by RT-PCR. Results: The withdrawal scores in electroacupuncture group was abbreviated obviously (P<0.01). The expression of FosB mRNA in NAC decreased in the electroacupuncture group (P<0.01), the changes of expression were rapid at first,and then becoming slow. Meanwhile, the expression of FosBmRNA in PFC were also decreased but the changes of expression were slow at first,and then becoming rapid. Conclusion: Electroacupuncture can improve the withdrawal symptoms and reducing the expression of FosBmRNA in the relative brain regions. But, the regulation mode was different.
Morphine dependence/therapy Substance withdrawal syndrome/therapy Genes/metabolism Animals,laboratory Rats
*国家自然科学基金青年基金资助项目(81503639)
哈尔滨医科大学创新科学研究资助项目(2016LCZX49)
吗啡依赖/治疗 物质戒断综合征/治疗 基因/代谢 动物,实验 大鼠
R749.61
A
10.3969/j.issn.1000-7377.2017.05.001
黑龙江省自然科学基金面上项目(H2016070)
△通讯作者
