南繁区稻瘟病菌遗传多样性和群体遗传结构的AFLP分析
2017-05-19朱名海皮磊舒灿伟周而勋
朱名海 皮磊 舒灿伟 周而勋
(华南农业大学农学院广东省微生物信号与作物病害防控重点实验室,广州510642;*通信联系人,E-mail:exzhou@scau.edu.cn)
南繁区稻瘟病菌遗传多样性和群体遗传结构的AFLP分析
朱名海 皮磊 舒灿伟 周而勋*
(华南农业大学农学院广东省微生物信号与作物病害防控重点实验室,广州510642;*通信联系人,E-mail:exzhou@scau.edu.cn)
【目的】为了明确南繁区稻瘟病菌(Magnaporthe oryzae)的遗传分化情况,【方法】采用AFLP分子标记技术对南繁核心区(三亚、乐东和保亭)和非核心区(琼中、屯昌和定安)共60个稻瘟病菌菌株的遗传多样性和群体遗传结构进行了比较分析。【结果】聚类分析表明,几乎所有菌株都聚在同一个谱系里,并且该谱系没有明显的亚群;群体遗传结构分析表明,核心区群体的多态性位点百分率、Shannon信息指数和基因流分别为87.89%、0.2738和4.2897,高于非核心区群体的81.37%、0.2703和3.5892;然而,核心区群体的Nei基因多样性指数和基因分化系数分别为0.1657和0.1044,低于非核心区群体的0.1662和0.1223。【结论】这些结果表明核心区和非核心区菌株都存在丰富的遗传多样性,不同群体间均存在较多的基因交流,但遗传变异均主要来自群体内;相比之下,核心区菌株的遗传多样性和遗传分化程度较高。
南繁区;稻瘟病菌;遗传多样性;群体遗传结构;AFLP
南繁区,即国家南繁育种基地,位于我国海南岛,是指科研人员利用海南省(琼)的三亚市、陵水县、乐东县和保亭县(南繁核心区)以及琼中县、屯昌县和定安县(南繁非核心区)等地区优异的光温条件和生物生态资源进行作物品种的繁育工作的地区,是我国最具影响力的农业科技试验基地,有“中国种业科技硅谷”之美誉[1,2]。
稻瘟病是一种常见的世界性水稻真菌病害,在水稻的各个生长阶段均能发生,菌源、水稻品种抗性、栽培管理和气候条件等因素是影响该病发生和危害的主要因素,如遇抗性差的品种且条件适宜,病情会迅速蔓延,严重时减产率超过50%,甚至导致绝收[3,4]。稻瘟病的病原菌是稻巨座壳菌[Magnaporthe oryzae(Hebert)Barr,无性态为稻梨孢Pyricularia oryzae Cav.],该菌是一种单倍体丝状子囊菌,能够侵染包括水稻在内的众多禾本科植物。当前,培育抗病品种是防治稻瘟病最经济有效且绿色环保的手段,但由于稻瘟病菌的种群结构具有复杂性和易变性,致使很多抗病品种在大面积种植多年后失去抗性[5,6]。因此,对该菌进行遗传多样性研究,了解其演变规律和分布动态,对抗病品种的合理选育和利用具有重要指导意义。
自分子标记技术出现以来,各种类型的标记技术在稻瘟病菌(M.oryzae)遗传多样性研究上发挥了巨大的应用价值,主要有RFLP[7]、RAPD[8]、SSR[9]、AFLP[10-12]以及rep-PCR[13]指纹技术等。其中,AFLP是一种既可靠又高效的分子标记技术,具有多态性高、DNA用量少、检测效率高、重复性高、对DNA模板浓度变化不敏感等优点[14,15]。Taheri等[10]采用AFLP分子标记技术对收集自伊朗的55个稻瘟病菌和乌拉圭的32个稻瘟病菌的遗传变异情况进行了比较分析,结果发现伊朗菌株和乌拉圭菌株的遗传相似系数大于78%,证明两地菌株之间存在基因交流现象。Masoud等[11]利用AFLP DNA指纹图谱对分离自伊朗水稻和其他杂草上的梨孢菌(Pyricularia spp.)进行了亲缘关系和系统发育分析,结果发现AFLP标记可以将分离自不同寄主的菌株区分开来;其中,分离自狗尾草(Setaria sp.)的菌株与分离自水稻的菌株亲缘关系最近,分离自马唐(Digitaria sp.)的菌株则表现出最大的遗传变异;此外,不同寄主的菌株之间仅存在低水平的基因交流,遗传多样性丰富且复杂。
农作物品种在南繁过程中,大陆与海南岛之间的水稻种子或无性繁殖材料调运频繁,进岛种子或无性繁殖材料上所携带的病原真菌对南繁区稻瘟病菌的遗传变异及其与病原真菌致病性的关系造成什么样的影响,至今尚未见到相关的研究报道。因此,本研究以分离自南繁核心区和非核心区的稻瘟病菌为研究材料,对其进行了遗传多样性研究,旨在了解南繁区稻瘟病菌遗传本质上的差异,为南繁区稻瘟病的防治提供依据,对于制定正确的防治策略具有重要的指导义。
1 材料与方法
1.1 实验材料
供试的稻瘟病菌菌株于2014-2015年采自海南省南繁区6个县(市)的籼稻,保存于华南农业大学真菌研究室。全部60个供试菌株均为单孢菌株,并经形态和分子鉴定为稻瘟病菌。菌株详情见表1。
1.2 菌丝收集及DNA抽提
将稻瘟病菌在PDA平板上活化后转接到150 mL酵母粉葡萄糖培养基(0.6 g酵母粉,2.25 g葡糖糖,纯水定容至150 mL,高温高压灭菌),28℃下摇菌培养5~7 d后抽滤收取菌丝。DNA的抽取采用真菌DNA小量抽提试剂盒。
1.3 AFLP分析
AFLP分析的步骤和方法参照Vos等[14]的方法进行,有少许改动。
1.3.1 基因组DNA的酶切和连接
限制性内切酶EcoRⅠ,MseⅠ和T4连接酶均购自NEB公司,酶切体系为15 μL,DNA模板量为300.0 ng,37℃下酶切3.5 h;连接体系为25 μL,MseⅠ接头和EcoRⅠ接头的浓度分别为5 μm/L和50 μm/L,16℃下连接过夜。

表1 南繁核心区和非核心区稻瘟病菌的详细情况Table 1.The details of Magnaporthe oryzae in the core and non-core regions of South China Crop Breeding Area.
1.3.2 预扩增和选择性扩增
PCR所用的预扩增体系为25 μL,其中,连接产物5 μL,10 μm/L EcoRⅠ和MseⅠ预扩增引物各1 μL,混匀后进行常规PCR;选择性扩增体系为25 μL,其中,预扩增20倍稀释产物2.5 μL,10 μm/L EcoRⅠ和MseⅠ选择性扩增引物各1 μL,混匀后进行降落PCR(touch-down PCR)。
习近平总书记在全国高校思想政治工作会议上发表的重要讲话中指出:“做好高校思想政治工作,要因事而化、因时而进、因势而新。要遵循思想政治工作规律,遵循教书育人规律,遵循学生成长规律,不断提高工作能力和水平[2]”。习近平总书记的讲话,是新媒体环境下加强对大学生思想行为正确引领的重要指南。
1.3.3 变性聚丙烯酰氨凝胶电泳及银染检测
6%变性聚丙烯酰胺凝胶在80 W恒功率下电泳2 h,采用Sanguinetti等[16]的方法(略有改动)进行银染检测,胶板晾干后拍照保存。
1.4 数据处理
根据扩增带的有无对电泳图谱进行读取,取得“0/1”数据矩阵表;用NTSYSpc 2.1软件进行聚类分析;用POPGENE32 1.32软件计算相关的遗传多样性指标:多态性位点百分率(PPL)、Nei基因多样性指数(H)、Shannon信息指数(I)、群体总基因多样性(Ht)、群体内基因多样性(Hs)、基因分化系数[Gst, Gst=(Ht-Hs)/Ht]、基因流[Nm,Nm=0.5×(1-Gst)/Gst]、遗传一致性(In)和遗传距离(D)。
2 结果与分析
2.1 不同引物组合对稻瘟病菌DNA扩增的多态性
从64对随机引物组合中筛选出9对条带较丰富且多态性较高的引物组合用于AFLP分析,分别为E2/M1、E2/M2、E3/M4、E3/M5、E4/M5、E4/M6、E4/M8、E5/M1和E5/M4。扩增片段的长度多为100~500 bp,共扩增出413条条带,平均每对引物组合可检测到45.89条条带;其中411条具有多态性,平均每对引物组合可检测到45.67条多态性条带,多态性条带百分率为99.52%(表3,图1)。
2.2 遗传多样性分析
由菌株的聚类分析图可看出,在相似系数为0.74处,可将这些菌株分为4个谱系。谱系Ⅰ包含P18、P29、P34、P40和P51共5个菌株,这些菌株来自乐东、保亭、琼中和屯昌;谱系Ⅱ和谱系Ⅲ分别只包含乐东的P15菌株和P16菌株;谱系Ⅳ包括南繁区各地区余下的53个菌株(图2)。

图1 引物组合E5/M4扩增的稻瘟病菌AFLP分析结果Fig.1.AFLP results for Magnaporthe oryzae with the primer combination E5/M4.
由图2还可发现,南繁区各地的菌株基本都聚在同一个谱系里,该谱系没有明显的亚群,证明核心区菌株和非核心区菌株在亲缘关系上很接近,但菌株个体间又存在着丰富的遗传多样性。
2.3 遗传结构分析
在种群水平上对南繁核心区和非核心区稻瘟病菌样品的“0/1”数据矩阵按群体进行群体结构分析。由表4可知,南繁区稻瘟病菌群体总的多态性位点百分率为99.52%,其中,核心区群体的多态性位点百分率为87.89%,非核心区群体的为81.37%。6个群体的多态性位点百分率为30.99%~80.39%,按由高到低的顺序依次为:乐东>琼中>定安>保亭>三亚>屯昌。南繁区稻瘟病菌群体总的Shannon信息指数为0.2821,其中,核心区群体的为0.2738,也稍高于非核心区的0.2703。6个群体间的Shannon信息指数范围为0.1283~0.3156,按由高到低的顺序依次为乐东>琼中>定安>保亭>三亚>屯昌。南繁区稻瘟病菌群体总的Nei基因多样性指数为0.1701,其中,核心区群体的为0.1657,稍低于非核心区群体的0.1662,6个群体的Nei基因多样性指数范围为0.0815~0.2025,按由高到低的顺序依次为琼中>乐东>定安>保亭>三亚>屯昌。以上各项遗传多样性参数的比较分析结果表明,南繁核心区和非核心区稻瘟病菌群体的遗传多样性存在一定的差异,但差异不大。
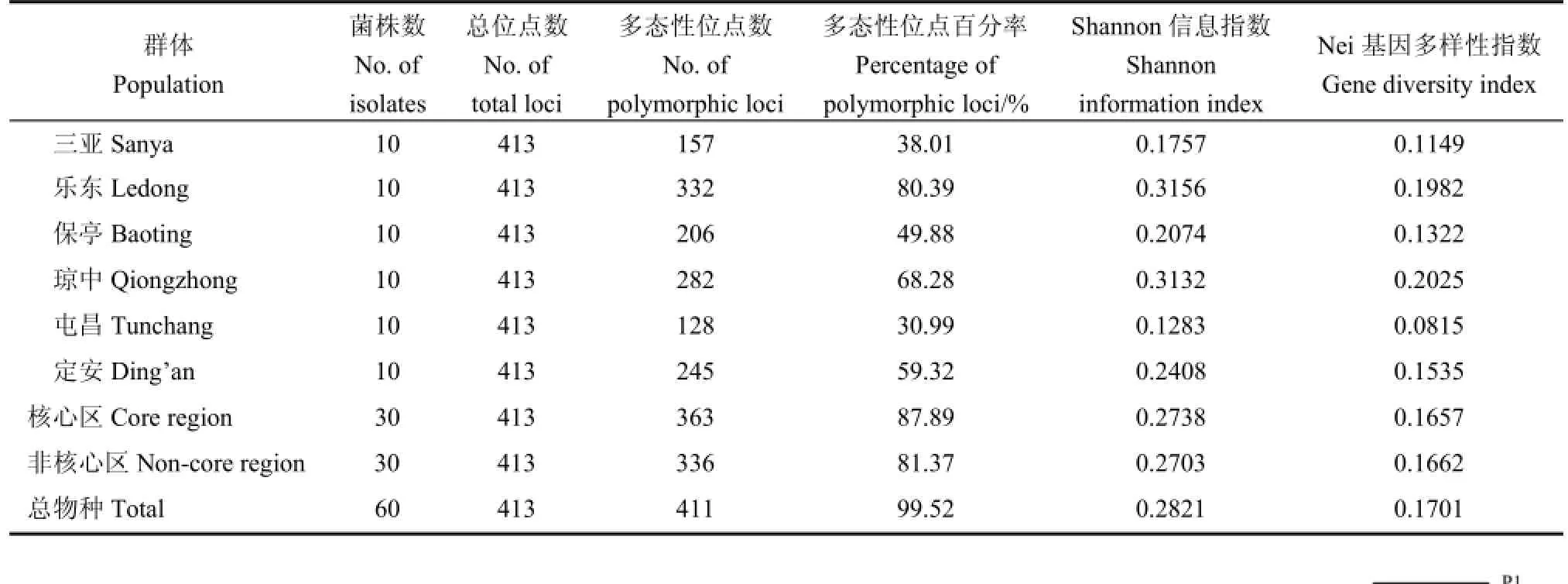
表4 南繁核心区和非核心区稻瘟病菌不同群体的遗传多样性分析Table 4.Genetic diversity analyses of different Magnaporthe oryzae populations in the core and non-core regions of South China Crop Breeding Area.
由表5可知,南繁区稻瘟病菌群体总的基因分化系数为0.1348,其中,核心区稻瘟病菌群体的基因分化系数为0.1044,非核心区稻瘟病菌群体的为0.1223;南繁区稻瘟病菌群体总的基因流为3.2092,其中,核心区稻瘟病菌群体的基因流为4.2897,非核心区稻瘟病菌群体的为3.5892。这些结果表明核心区稻瘟病菌群体间的基因交流水平相对非核心区要高些,群体间的遗传分化相对更小些,但两大区群体间的基因交流均较多,遗传变异都主要发生在群体内。
由表6可知,遗传一致性最高(遗传距离最小)的群体为乐东和定安,遗传一致性最低(遗传距离最大)的群体为琼中和屯昌。
由图3可知,在遗传一致性为0.9710时,核心区的乐东群体和非核心区的琼中群体、定安群体聚为一组,核心区的三亚群体、保亭群体、非核心区的屯昌群体分别聚为一组,进一步证明南繁核心区和非核心区稻瘟病菌群体的遗传分化程度较一致。
3 讨论
本研究一共筛选出9对引物组合用于南繁核心区和非核心区60个稻瘟病菌菌株的AFLP分析,不同引物的多态性条带百分率介于97.56%~100.00%,多态性条带百分率为99.52%,说明这些菌株间存在非常丰富的遗传多样性。

图2 南繁核心区和非核心区稻瘟病菌的聚类分析结果Fig.2.Clustering results of M.oryzae in the core and non-core regions of South China Crop Breeding Area.

表5 南繁核心区和非核心区稻瘟病菌群体的遗传分化和基因流Table 5.Genetic differentiation and gene flow of different populations of Magnaporthe oryzae from the core and non-core regions of South China Crop Breeding Area.

表6 南繁核心区和非核心区稻瘟病菌群体的遗传一致性和遗传距离Table 6.Genetic identity and genetic distance of different Magnaporthe oryzae populations from the core and non-core regions of South China Crop Breeding Area.
南繁核心区和非核心区稻瘟病菌的聚类分析表明,南繁区各地的稻瘟病菌菌株基本都聚在同一个谱系里,并且没有明显的亚群,进一步证明了南繁区稻瘟病菌菌株间存在较广泛的基因交流,核心区菌株和非核心区菌株在亲缘关系上很接近,但各菌株间又存在丰富的遗传多样性,也说明了稻瘟病菌菌株具有高度的变异性。这与很多研究结果高度一致。如刘振华等[17]采用Pot2-Rep-PCR分子指纹技术对2010-2011年间采自云南省五大稻区的455个稻瘟病菌菌株进行遗传结构分析,分析结果表明云南省各稻瘟病菌群体间具有丰富的遗传多样性;张亚玲等[18]也采用Pot2-Rep-PCR分子指纹技术对采自黑龙江省和吉林省的49个稻瘟病菌菌株进行遗传结构分析,结果同样发现这些稻瘟病菌种群在DNA水平上存在丰富的遗传多样性。
南繁核心区和非核心区稻瘟病菌群体的遗传多样性指数分析表明,核心区群体的遗传分化程度与非核心区的基本一致,推测出现这种现象可能是由南繁区复杂的水稻品种来源以及稻瘟病菌孢子的高度迁移能力造成的。
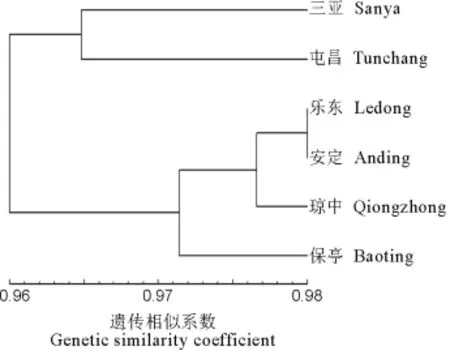
图3 基于Nei遗传一致性的南繁核心区和非核心区稻瘟病菌群体聚类图Fig.3.Clustering analyses of Magnaporthe oryzae from the core and non-core regions of South China Crop Breeding Area based on Nei's genetic consistency.
南繁核心区和非核心区稻瘟病菌群体间的遗传分化结果表明,南繁区稻瘟病菌群体间存在较高的基因交流现象,菌株间的遗传变异主要发生在群体内,群体间的遗传变异很小;并且核心区群体和非核心区群体间的基因交流水平相当,差异不大,证明南繁核心区和非核心区稻瘟病菌群体间的遗传漂变作用较大。王玲等[19]采用SSR分子标记技术分析四川绵阳、营山、雅安、北川和武胜5个稻瘟病菌群体的遗传结构也得到了相似的结论,结果表明5个地理群体间存在高水平的遗传分化,各群体间存在不同程度的基因交流(基因流水平为0.472~4.347),并且绝大多数遗传变异(81.17%)来自于群体内,仅有18.83%的变异发生在群体间。
南繁核心区和非核心区稻瘟病菌群体间的遗传一致性和遗传距离分析进一步证明南繁核心区稻瘟病菌群体和非核心区群体间的遗传分化程度较为一致,说明核心区和非核心区稻瘟病菌群体的遗传分化与其地理距离之间没有直接的相关性。
[1]陈冠铭,李劲松,曹兵.发挥南繁资源优势促进种业科技创新.安徽农学通报,2012,18(1):27-29. Chen G M,Li J S,Cao B.Make the most of resources’advantages of Hainan national multiplication,promoting Sci-Tech innovations of seed industry.Anhui Agric Sci Bull,2012,18(1):27-29.(in Chinese with English abstract)
[2]陈冠铭,李劲松,林亚琼.国家南繁功能价值与发展机遇研究分析.种子,2012,31(3):69-71. Chen G M,Li J S,Lin Y Q.Research and analysis on the functionalvalueanddevelopmentopportunitiesof Hainan national breeding and multiplication.Seed,2012, 31(3):69-71.(in Chinese with English abstract)
[3]赵文生.水稻稻瘟病发病规律与防治措施.科技创新与应用,2012(1):187. Zhao W S.The occurrence and control of rice sheath blight.Technol Innov Applic,2012(1):187.(in Chinese with English abstract).
[4]李小闯.稻瘟病的危害与综合防治.农技服务,2010, 27(12):1585-1586. Li X C.The damage and integrated control of rice blast. AgricTechnolServ,2010,27(12):1585-1586.(in Chinese with English abstract)
[5]ZhangH,ZhengX,ZhangZ.TheMagnaporthe grisea species complex and plant pathogenesis.Mol Plant Pathol,2015,17(6):796-804.
[6]Miah G,Rafii M Y,Ismail M R,Puteh A B,Rahim H A, Asfaliza R,Latif M A.Blast resistance in rice:A review of conventional breeding to molecular approaches.Mol Biol Rep,2013,40(3):2369-2388.
[7]沈瑛,袁筱萍,王艳丽.分子探针在稻瘟病流行病学中的应用研究.西南农业大学学报,1998,20(5):401-408. Shen Y,Yuan X P,Wang Y L.Molecular probes for epidemiological studies of the rice blast fungus.J Southwest Agric Univ,1998,20(5):401-408.(in Chinese with English abstract)
[8]Séré Y,Onasanya A,Afolabi A,Mignouna H D,Akator K.Genetic diversity of the blast fungus,Magnaporthe grisea(Hebert)Barr,in Burkina Faso.Afric J Biotechnol, 2007,6(22):2568-2577.
[9]Choi J,Kim H,Lee Y H.Comparative analysis of the Korean population of Magnaporthe oryzae by multilocus microsatellitetyping.PlantPatholJ,2013,29(4): 435-439.
[10]Taheri P,Irannejad A.Genetic structure of various Magnaporthe oryzae populations in Iran and Uruguay. Aus Plant Pathol,2014,43(3):287-297.
[11]Masoud N G,Gholamreza S J,Mohammad J M. Characterizationandphylogeneticanalysisof Magnaporthe spp.strains on various hosts in Iran.Ir J Biotechnol,2014,12(3):71-81.
[12]Takan J P,Chipili J,Muthumeenakshi S,Talbot N J, Manyasa E O,Bandyopadhyay R,Sere Y,Nutsugah S K, Talhinhas P,Hossain M,Brown A E.Magnaporthe oryzae populations adapted to finger millet and rice exhibit distinctive patterns of genetic diversity,sexuality and hostinteraction.Mol Biotechnol,2012,50(2): 145-158.
[13]Chen Q H,Wang Y C,Zheng X B.Genetic diversity of Magnaporthe grisea in China as revealed by DNA fingerprint haplotypes and pathotypes.J Phytopathol, 2006,154(6):361-369.
[14]Vos P,Hogers R,Bleeker M,Reijans M,Lee T V D, Hornes M,Fritjers A,Pot J,Peleman J,Kuiper M, ZabeauM.AFLP:AnewtechniqueforDNA fingerprinting.NucleicAcidsRes,1995,23(21): 4407-4414.
[15]李珊,赵桂仿.AFLP分子标记及其应用.西北植物学报,2003,23(5):830-836. Li S,Zhao G F.AFLP molecular marker and its application.Acta Bot Boreali-Occ Sin,2003,23(5): 830-836.(in Chinese with English abstract)
[16]Sanguinetti C J,Dias N E,Simpson A J.Rapid silver staining and recovery of PCR products separated on polyacrylamidegels.Biotechniques,1994,17(5): 914-921.
[17]刘振华,李晓菲,王园媛,陈涛,王云月.云南省稻瘟病菌群体遗传结构研究.云南农业大学学报:自然科学版,2013,28(1):9-15. Liu Z H,Li X F,Wang Y Y,Chen T,Wang Y Y. Investigationonpopulationgeneticstructureof Magnaporthe grisea in Yunnan.J Yunnan Agric Univ: Nat Sci,2013,28(1):9-15.(in Chinese with English abstract)
[18]张亚玲,王宝玉,台莲梅,豫虎,郑雯,邓本良,靳学慧.黑龙江省和吉林省稻瘟病菌种群多样性研究.黑龙江八一农垦大学学报,2014,26(1):1-4,31. Zhang Y L,Wang B Y,Tai L M,Yu H,Zheng W,Deng B L,Jin X H.Study of populationstructure of Magnaporthe oryzae from rice in Heilongjiang and Jilin. J Heilongjiang Bayi Agri Univ,2014,26(1):1-4,31.(in Chinese with English abstract)
[19]王玲,左示敏,张亚芳,陈宗祥,潘学彪,黄世文.四川省稻瘟病菌群体遗传结构分析.中国水稻科学,2015, 29(3):327-334. Wang L,Zuo S M,Zhang Y F,Chen Z X,Pan X B, Huang S W.Genetic structure of rice blast pathogen Magnaporthe oryzae in Sichuan Province.Chin J Rice Sci,2015,29(3):327-334.(in Chinese with English abstract)
AFLP Analyses of Genetic Diversity and Population Genetic Structure of Magnaporthe oryzae from South China Crop Breeding Area
ZHU Minghai,PI Lei,SHU Canwei,ZHOU Erxun*
(Guangdong Province Key Laboratory of Microbial Signals and Disease Control,College of Agriculture,South China Agricultural University,Guangzhou 510642,China;*Corresponding author,E-mail:exzhou@scau.edu.cn)
【Objective】In order to clarify the genetic differentiation of Magnaporthe oryzae in South China Crop Breeding Area in Hainan Province,【Method】the genetic diversity and population genetic structure of 60 Magnaporthe oryzae isolates collected from the core region(Sanya,Ledong and Baoting)and non-core region(Qiongzhong,Tunchang and Ding’an)of South China Crop Breeding Area were comparatively analyzed using amplified fragment length polymorphism(AFLP)technique.【Result】The cluster analysis showed that almost all isolates were clustered in one group,and there was no obvious subgroup.The analysis of population genetic structure showed that the percentage of polymorphic loci(PPL),Shannon’s information index(I)and gene flow(Nm)in the core population were 87.89%,0.2738 and 4.2897,respectively,higher than those of non-core population whose PPL,I and Nm were 81.37%,0.2703 and 3.5892,respectively.However,Nei’s gene diversity index(H)and genetic differentiation coefficient(Gst)in the core population were 0.1657 and 0.1044,lower than those of non-core population whose H and Gstwas 0.1662 and 0.1223.【Conclusion】These results showed that there were rich genetic diversity in both isolates of core and non-core regions and wide gene flow existed among these populations,but the genetic variation was mainly within the population.In contrast,the genetic diversity and the degree of genetic differentiation in the isolates of core region were relatively larger.
South China Crop Breeding Area;Magnaporthe oryzae;genetic diversity;population genetic structure; AFLP
S435.111.4+1
:A
:1001-7216(2017)03-0320-07
2016-10-20;修改稿收到日期:2016-11-30。
国家公益性行业(农业)科研专项(201403075)。
