水稻齿叶矮缩病毒Pns10蛋白在水稻原生质体内的表达
2017-05-19张洁陈晓敏吴锦鸿朱重庆丁新伦吴祖建
张洁陈晓敏吴锦鸿 朱重庆 丁新伦 吴祖建
(福建农林大学植物病毒研究所/福建省植物病毒学重点实验室,福州350002;#共同第一作者;*通讯联系人,E-mail:wuzujian@126.com)
水稻齿叶矮缩病毒Pns10蛋白在水稻原生质体内的表达
张洁#陈晓敏#吴锦鸿 朱重庆 丁新伦 吴祖建*
(福建农林大学植物病毒研究所/福建省植物病毒学重点实验室,福州350002;#共同第一作者;*通讯联系人,E-mail:wuzujian@126.com)
【目的】水稻齿叶矮缩病毒(Rice ragged stunt virus,RRSV)Pns10蛋白在介体昆虫细胞内可形成类似病毒原质(viroplasm)的内含体,是RRSV侵染介体所必需。然而Pns10蛋白在水稻寄主中是否具有类似功能及其表达情况如何未见报道。【方法】利用大肠杆菌系统表达Pns10蛋白,免疫家兔制备多克隆抗体;通过水稻原生质体病毒侵染体系,利用免疫荧光技术分析Pns10蛋白在水稻原生质体内的分布情况,利用实时定量PCR技术和Western blot技术分别检测Pns10 RNA和Pns10蛋白在水稻原生质体内的积累情况。【结果】将Pns10基因克隆到Gateway系统原核表达载体pDEST17中,IPTG诱导表达成功后,制备融合蛋白抗血清。Western blot检测显示,该抗血清可检测感病水稻叶片中的Pns10蛋白。病毒侵染水稻原生质体后,Pns10蛋白可形成类似病毒原质的内含体;Pns10 RNA在病毒接种8 h后开始积累,24 h后达到最大值,随后开始下降;Pns10蛋白在24 h后开始表达,之后维持较高水平,60 h后略有下降。【结论】成功获得了Pns10抗血清;Pns10在水稻原生质体内成功表达,可形成类似病毒原质的内含体,并且Pns10 RNA的表达先于其蛋白的表达。
水稻齿叶矮缩病毒;水稻原生质体;Pns10抗体;Pns10 RNA;Pns10蛋白
植物呼肠孤病毒(Reoviruses)主要有3个属,即植物呼肠孤病毒属(Phytoreovirus)、斐济病毒属(Fijivirus)和水稻病毒属(Oryzavirus)[1]。水稻齿叶矮缩病毒(Rice ragged stunt virus,RRSV)是水稻病毒属的成员,在我国南方和越南等地给水稻生产造成了严重损失[2,3]。RRSV主要由褐飞虱(Nilaparvatalugens)以持久性方式传播,但不经卵和水稻种子传播[4,5]。RRSV可侵染水稻、小麦、玉米、大麦、燕麦等多种植物,主要表现为病株浓绿矮缩,分蘖增多,叶尖旋卷,叶缘有锯齿状缺刻,叶鞘和叶片基部有长短不一的线状脉肿等。
RRSV基因组包含10条双链RNA(doublestranded RNA,dsRNA),分别为S1~S10[6],它们编码7种结构蛋白(P1、P2、P3、P4A、P5、P8B和P9)和3种非结构蛋白(Pns6、Pns7和Pns10)[3,7]。其中,P2、P3、P4A、P5分别为假定的尿苷转移酶、外壳刺突蛋白、假定的RNA依赖的RNA聚合酶(RdRP)、加帽酶等[1,8-10],P8是主要外壳蛋白[8],P9是刺突蛋白,参与介体传毒[11]。非结构蛋白中,Pns6具有沉默抑制子功能,并参与病毒在寄主植物中的运动[12,13];Pns7作为一个NTP结合蛋白[14],可能参与病毒在介体昆虫体内的扩散[15];Pns10具有ATPase的活性[16],并与介体昆虫中病毒原质的形成及病毒复制相关[17]。
植物细胞培养技术的不断发展、完善,为植物病毒分子生物学的研究提供了强有力的手段。植物原生质体在病毒的侵染、复制、基因组功能和病毒与寄主细胞间的互作研究中发挥了重要的作用,也成为植物病毒研究的良好体系。烟草花叶病毒(Tobacco mosaic virus,TMV)和烟草脆裂病毒(Tobacco rattle virus,TRV)侵染烟草原生质体检测到病毒粒体的积累[18,19],水稻草矮病毒(Rice grassy stunt virus,RGSV)、水稻条纹病毒(Rice stripe virus, RSV)等病毒也在水稻原生质体内成功表达[20-22]。本课题组利用水稻原生质体病毒侵染体系,对RRSV非结构蛋白Pns7和结构蛋白P8的表达进行了具体分析[23,24]。在之前研究的基础上,本研究从RRSV非结构蛋白Pns10入手,制备Pns10抗血清,采用免疫荧光技术、实时定量PCR及Western blot检测技术,研究Pns10基因在病毒侵染水稻原生质体后的表达情况,旨在为揭示RRSV致病性、病毒与寄主互作关系提供一定的理论依据。
1 材料与方法
1.1 材料
植物材料:感染RRSV的水稻病株由本实验室于田间种植保存;粳稻品种日本晴(Oryza sativa L. japonica cv.Nipponbare)种子由本实验室保存。
菌株和载体:大肠杆菌DH5α菌株和Rosetta菌株为本实验室保存。Gateway系统载体pDONR221和pDEST17由福建农林大学魏太云教授课题组馈赠。
主要试剂:Trizol、重组酶(Gateway BP Clonase Enzyme Mix、LR Clonase Enzyme Mix,Invitrogen公司);反转录试剂盒(Promega公司);蛋白质标记(GeneStar公司);IPTG、碱性磷酸酶标记的羊抗兔、BCIP/NBT(Sigma公司);PVDF膜(Amersham Pharmacia Biotech公司);DNA通用试剂盒及质粒提取试剂盒(Omega公司);聚合酶(2×Es Taq MasterMix,含染料,北京康为世纪公司);KOD高保真酶、荧光定量PCR试剂(TOYOBO公司);纤维素酶(Cellulose onozuka R-10)和离析酶(Macerozyme R-10,北京拜耳迪生物技术有限公司)。
1.2 方法
1.2.1 Pns10蛋白的原核表达
根据Pns10的基因序列设计全长引物(RRSVPns10-F:5′-GGGGACAAGTTTGTACAAAAAAGC AGGCTTC ATGCCTTTCGTGCAATTCCC-3′; RRSV-Pns10-R:5′-GGGGACCACTTTGTACA AGAAAGCTGGGTCCTCTGCGTCATCACCAAA GT-3′,其中5′端下划线标示Gateway载体重组序列)。Trizol法提取病叶总RNA,利用下游特异性引物RRSV-Pns10-R反转录合成cDNA,然后利用RRSV-Pns10-F/RRSV-Pns10-R进行高保真PCR扩增。将目的片段按照试剂盒说明跟中间载体pDONR221进行BP重组反应,转化大肠杆菌DH5α菌株,经PCR鉴定并序列测定无误后,将重组质粒按照试剂盒说明跟终载体pDEST17进行LR重组反应,获得表达载体pDEST17-Pns10,转化大肠杆菌DH5α菌株,保存备用。提取pDEST17-Pns10重组质粒,转化大肠杆菌Rosetta菌株,PCR筛选后,参照文献[24]的方法进行IPTG诱导表达。
1.2.2 Pns10抗血清的制备
将正确诱导表达的菌液进行大量诱导,通过12.5%SDS-PAGE电泳后,用预冷的0.25 mmol/L KCl显色溶液浸泡5~10 min,切取含有目的蛋白的凝胶并研磨乳化,免疫新西兰大白兔。免疫注射5次,初次免疫使用弗氏完全佐剂,间隔一周再次免疫使用弗氏不完全佐剂,最后加强免疫后一周进行取血,37℃放置1 h,4℃冰箱中过夜使得血浆凝结,6 000 r/min离心20 min收集血清于-80℃保存备用。
1.2.3 Western blot检测抗体及病毒蛋白的表达
参照文献[24]的方法对制备的抗血清进行检测。
RRSV接种水稻原生质体后,不同时间点(接种后16、24、32、48、60、72 h)取样,以等质量原生质体为样本提取总蛋白,然后进行Western blot检测病毒蛋白的表达量。
1.2.4 PEG法病毒侵染原生质体
病毒提取方法参照文献[25],称取1 g感染RRSV的水稻病叶,在灭菌的培养皿中用70%酒精消毒,无菌水清洗3次;将水稻病叶剪碎后放入灭菌的研钵中,加入石英砂和1 mL His-Mg溶液(0.1 mol/L L-Histidine,0.01 mol/L MgCl2,pH 6.2)研磨成浆;4℃、2000 r/min下离心5 min,去除石英砂和杂质;取上清液4℃、5000 r/min下离心20 min,收集上清即为RRSV粗提液。测定浓度后,取10 μg粗提液接种于100 μL水稻原生质体中(约含1×106个细胞)。参照文献[24]的方法进行水稻原生质体的制备及PEG介导的病毒侵染。
1.2.5 激光共聚焦观察Pns10的表达
玻片用0.05%多聚赖氨酸包被3~4 h,PBS(pH 7.2)洗3次后风干;将样本原生质体均匀滴加到玻片上;5 min后加入96%乙醇固定20 min;PBS清洗玻片3次;加入5%BSA(溶于PBS,pH 7.2)封闭45 min;PBS洗涤玻片3次;加入1~5µg/mL荧光一抗(荧光抗体标记方法参照贾东升[25]),避光室温孵育1 h;PBS清洗玻片;Leica荧光共聚焦显微镜下观察。
1.2.6 实时定量PCR检测目的基因的表达量
采用绝对定量PCR试验。将含有RRSV目的基因片段的质粒(pDONR-Pns10)作为标准品,梯度稀释后作为模板进行实时荧光定量PCR,以标准品浓度的稀释倍数为横坐标,以Ct循环数为纵坐标建立目的基因的标准曲线。取病毒侵染不同时间点(接种后8、16、24、32、48、60 h)的原生质体,Trizol法提取其总RNA,测定浓度后,取1 μg总RNA反转录成cDNA,利用引物qPns10-F(5′-GGTTGATG CCACAGGTAA-3′)和qPns7-R(5′-TAAGCAGAAA GGGACAGG-3′)进行实时荧光定量PCR,将反应后得到的Ct值代入标准曲线线性方程最终可得出样本中的拷贝数,从而比较不同时间目的基因表达量的差异。每次试验3次重复。
2 结果与分析
2.1 Pns10表达载体的构建
提取感病水稻总RNA,利用设计的特异引物进行RT-PCR扩增Pns10全长891 bp(不包含终止密码子)序列。通过两步Gateway重组反应,获得重组表达载体pDEST17-Pns10(图1)。
2.2 Pns10重组蛋白的表达
将pDEST17-Pns10载体转化大肠杆菌Rosetta菌株后,IPTG诱导进行原核表达。SDS-PAGE电泳结果显示,加上His标签的大小及Gateway重组序列,目的蛋白大约为38 kD,表达正确(图2),并且与阴性对照相比诱导表达明显。
2.3 Pns10抗血清的制备
以诱导表达的Pns10目的蛋白为抗原,进行抗血清的制备。Western blot检测结果显示,感病水稻样品中仅检测到32 kD左右的目的条带,与预测的Pns10蛋白大小一致,而未发现其他条带;同时健康水稻对照也未出现任何条带,说明该抗血清具有一定的特异性(图3)。
图1 pDEST17-Pns10表达载体的菌液PCR鉴定Fig.1.PCR analysis of the bacterium harboring the pDEST17-Pns10 expression vector.
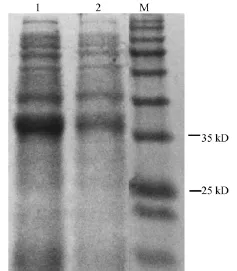
图2 SDS-PAGE分析大肠杆菌Rosetta菌株Pns10表达Fig.2.SDS-PAGE analysis of the expression of Pns10 protein in Escherichia coli Rosetta strain.
2.4 免疫荧光标记Pns10在水稻原生质体内的表达
RRSV接种水稻原生质体后,48 h取样,进行免疫荧光标记。共聚焦显微镜观察结果显示,Pns10在细胞内形成颗粒状内含体。结果表明,RRSV病毒粒子成功侵染了水稻原生质体并可形成类似病毒原质组分(图4)。
2.5 实时定量PCR检测水稻原生质体中Pns10 RNA的表达
RRSV接种水稻原生质体后,不同时间分别取样,检测Pns10 RNA在原生质体中的表达量。结果显示,病毒接种8 h后,即可检测到Pns10 RNA的积累,随后呈上升趋势,24 h左右RNA表达量达到最大值,16~48 h表达量维持较高水平(图5)。

图3 Western blot检测Pns10抗血清Fig.3.Analysis of the antiserum against Pns10 by Western blot.

图4 共聚焦显微镜检测Pns10在病毒侵染水稻原生质体后的表达Fig.4.Analyzing the Pns10 expression in rice protoplasts 48 h post virus inoculation by confocal microscope.
2.6 Western blot检测RRSV侵染后水稻原生质体中Pns10蛋白的表达
RRSV接种水稻原生质体后,不同时间分别取相同质量的原生质体样本,提取其蛋白,经Western blot检测病毒Pns10蛋白的表达情况。结果显示,Pns10蛋白在病毒接种后24 h左右开始表达,60 h左右表达量达到最大,随后开始下降(图6)。
3 讨论
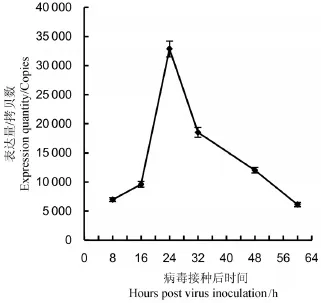
图5 实时定量PCR检测Pns10 RNA在病毒侵染水稻原生质体后不同时间段的表达Fig.5.Analyzing the RNA expression of Pns10 gene in rice protoplasts at different time post virus inoculation by real-time quantitative RT-PCR.
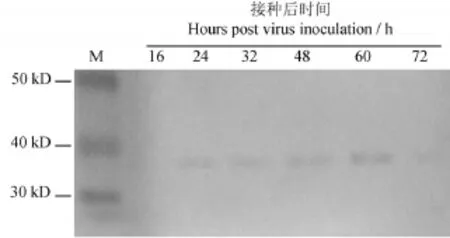
图6 Western blot分析Pns10蛋白在病毒侵染水稻原生质体后不同时间段的表达Fig.6.Analyzing the expression of Pns10 protein in rice protoplasts at different time post virus inoculation by Western blot.
原生质体为植物病毒研究提供了一种有效手段[18-24]。本研究中,实时定量PCR和Western blot检测技术发现,RRSV接种水稻原生质体后,Pns10RNA在8 h左右开始表达,Pns10蛋白在24 h左右开始表达,结果证实了RNA表达早于蛋白的表达。与之前我们的研究结果相比,RRSV侵染水稻原生质体后,两个非结构蛋白Pns10和Pns7 RNA表达动态保持一致[24],而外壳蛋白P8 RNA表达略有延迟,但同比最大值,P8 RNA的绝对定量更高[23]。从整体的趋势来看,各基因的表达量都是先上升后下降,与他人的研究结果保持一致[21,22]。前期的上升符合病毒指数增长的特征,后期的下降说明病毒在原生质体内的复制受到了限制,这与原生质体细胞活性下降也有一定关系。
呼肠孤病毒科(Reoviridae)的病毒在侵染细胞中经常形成特定的复制场所,被称作病毒原质(viroplasms)或病毒工厂(viral factories)或病毒内含体(viral inclusion bodies),由病毒编码的蛋白参与形成,不同的病毒参与形成病毒原质的蛋白不同。水稻矮缩病毒(Rice dwarf virus,RDV)的Pns6、Pns11和Pns12蛋白在介体叶蝉体内参与了病毒原质的形成[26,27];水稻黑条矮缩病毒(Rice black-streaked dwarf virus,RBSDV)的P9-1蛋白在感病玉米植株和介体灰飞虱体内都能形成病毒原质的组分[28],在拟南芥原生质体中瞬时表达P9-1蛋白也能观察到类似病毒原质的组分[29];水稻瘤矮病毒(Rice gall dwarf virus,RGDV)的Pns9蛋白在病毒原质形成过程中起重要作用[30,31]。本研究利用水稻原生质体结合免疫荧光技术,结果发现,Pns10在细胞内形成类似病毒原质的点状内含体,这与Jia等[17]的研究结果一致,表明Pns10极有可能也参与寄主水稻中病毒原质的形成和病毒的复制。Jia等[17]研究发现,在非寄主昆虫细胞Sf9中,Pns10可招募Pns6到病毒原质中,共同参与病毒的复制和装配,寄主水稻中是否具有类似功能还需进一步验证。
谢辞:特别感谢福建农林大学植物病毒研究所的毛倩卓老师在共聚焦显微镜技术上的指导!
[1]BoccardoG,MilneRG.PlantReovirusGroup. CMI/AAB Descriptions of Plant Viruses,no.294.Kew, UK:Commonwealth Microbiology Institute/Association of Applied Biology,1984.
[2]Hoang A T,Zhang H M,Yang J,Chen J P,Hébrard E, Zhou G H,Vinh V N,Cheng J A.Identification, characterization,anddistributionofSouthernrice black-streaked dwarf virus in Vietnam.Plant Dis,2011, 95:1063-1069.
[3]郑璐平,谢荔岩,连玲丽,谢联辉.水稻齿叶矮缩病毒的研究进展.中国农业科技导报,2008,10(5):8-12. Zheng L P,Xie L Y,Lian L L,Xie L H.Research progress on Rice ragged stunt virus(RRSV).J Agric Sci Tech China,2008,10(5):8-12.(in Chinese with English abstract)
[4]林奇英,谢联辉,陈宇航.水稻齿叶矮缩病毒寄主范围的研究.植物病理学报,1984,14(4):247-248. Lin Q Y,Xie L H,Chen Y H.Study of host range of Rice ragged stunt virus.Acta Phytopathol Sin,1984,14(4): 247-248.(in Chinese)
[5]谢联辉,林奇英.锯齿叶矮缩病毒在我国水稻上的发现.科学通报,1980,13:611-613. Xie L H,Lin Q Y.Discovery of ragged stunt disease on rice in China.Chin Sci Bull,1980,13:611-613.(in Chinese)
[6]Kawano S,Shikata E,Senboku T.Purification and morphology of Rice ragged stunt virus.J Fac Agric Hokk Univ,1983,61:209-218.
[7]Hibino H,Roechan M,Sudarisman S,Tantera D M.A virus disease of rice(Kerdil hampa)transmitted by brown planthopper Nilaparvata lugens Stal in Indonesia.Bogor: Central Research Institute of Agriculture,1977,35:1-15.
[8]Hagiwara K,Minobe Y,Nozu Y,Hibino H,Kimura I, Omura T.Component proteins and structures of Rice ragged stunt virus.J Gen Virol,1986,67,1711-1715.
[9]SupyaniS,HillmanBI,SuzukiN.Baculovirus expression of the 11 mycoreovirus-1 genome segments and identification of the guanylyltransferase-encoding segment.J Gen Virol,2007,88:342-350.
[10]Upadhyaya N M,Ramm K,Gellatly J A,Li Z, Kositratana W,Waterhouse P M.Rice ragged stunt oryzavirus genome segment S4 could encode an RNA dependent RNA polymerase and a second protein of unknown function.Arch Virol,1998,143:1815-1822.
[11]Zhou G,Lu X,Lu H,Lei J,Chen S,Gong Z.Rice Ragged Stunt Oryzavirus:Role of the viral spike protein in transmission by the insect vector.Ann Appl Biol,1999, 135:573-578.
[12]Wu J,Du Z,Wang C,Cai L,Hu M,Lin Q,Wu Z,Li Y, Xie L.Identification of Pns6,a putative movement protein of RRSV,as a silencing suppressor.Virol J,2010, 7:335.
[13]Wu Z,Wu J,Adkins S,Xie L,Li W.Rice ragged stunt virus segment S6-encoded nonstructural protein Pns6 complements cell-to-cell movement of Tobacco mosaic virus-based chimeric virus.Virus Res,2010,152(1-2): 176-179.
[14]Spear A,Sisterson M S,Stenger D C.Reovirus genomes from plant-feeding insects represent a newly discovered lineage within the family Reoviridae.Virus Res,2012, 163:503-511.
[15]郭年梅,韩庆梅,毛倩卓,贾东升,魏太云.水稻齿叶矮缩病毒非结构蛋白Pns7形成伸出昆虫细胞膜的纤维丝状结构[EB/OL].北京:中国科技论文在线.http://www.paper.edu.cn/releasepaper/content/201212-47 2.[2012-12-19]. Guo N M,Han Q M,Mao Q Z,Jia D S,Wei T Y. Nonstructural protein Pns7 of Rice ragged stunt virus induces the formation of filament structures growing from insect cell surface[EB/OL].Beijing:Sciencepaper Online.http://www.paper.edu.cn/releasepaper/content/ 201212-472.[2012-12-19](in Chinese with English abstract)
[16]邵朝纲.水稻齿叶矮缩病毒的分子生物学研究及新城疫病毒检测新技术.上海:中国科学院研究生院,2004. Shao C G.Molecular biological studies on RRSV& DNV-analysis-softwaredevelopment.Shanhai: University of Chinese Academy of Sciences,2004.(in Chinese with English abstract)
[17]Jia D,Guo N,Chen H,Akita F,Xie L,Omura T,Wei T. Assembly of the viroplasm by viral non-structural protein Pns10 is essential for persistent infection of Rice ragged stunt virus in its insect vector.J Gen Virol,2012,93(10): 2299-2309.
[18]Kubo S,Harrison B D,Robinson D J,Mayo M A. Tobacco rattle virus in tobacco mesophyll protoplasts: infection and virus multiplication.J Gen Virol,1975, 27(3):293-304.
[19]Takebe I,Otsuki Y.Infection of tobacco mesophyll protoplasts by Tobacco mosaic virus.Proc Natl Acad Sci USA,1969,64:843-848.
[20]林丽明,吴祖建,金凤媚,谢荔岩,谢联辉.水稻草矮病毒在水稻原生质体中的表达.微生物学报,2004, 44(4):530-532. Lin L M,Wu Z J,Jin F M,Xie L Y,Xie L H.Expression of Rice grassy stunt virus in rice protoplasts.Acta Microbiol Sin,2004,44(4):530-532.(in Chinese with English abstract)
[21]明艳林.水稻条纹病毒在水稻原生质体内的复制与表达.福州:福建农林大学,2001. Ming Y L.The replication and expression of Rice stripe virus in rice protoplast.Fuzhou:Fujian Agriculture and Forestry University,2001.(in Chinese with English abstract)
[22]Yang W,Wang X,Wang S,Yie Y,Tien P.Infection and replication of a planthopper transmitted virus-Rice stripe virus in rice protoplasts.J Virol Meth,1996,59:57-60.
[23]陈晓敏,宛柏杰,吴锦鸿,林文武,吴祖建,张洁.水稻齿叶矮缩病毒P8蛋白的抗体制备及其在水稻原生质体内的表达动态.中国科技论文,2016,11(6):670-674. Chen X M,Wan B J,Wu J H,Lin W W,Wu Z J,Zhang J. Preparation of polyclonal antibody against P8 protein of Rice ragged stunt virus and its expression dynamic trends in rice protoplast.China SciencePaper,2016,11(6): 670-674.(in Chinese with English abstract)
[24]张洁,陈晓敏,宛柏杰,吴锦鸿,林文武,吴祖建.水稻齿叶矮缩病毒非结构蛋白Pns7在水稻原生质体内的表达动态.植物病理学报,2017,47(1):61-67. Zhang J,Chen X M,Wan B J,Wu J H,Lin W W,Wu Z J. ExpressiondynamicsofRiceraggedstuntvirus nonstructuralproteinPns7inriceprotoplast.Acta Phytopathol Sin,2017,47(1):61-67.(in Chinese with English abstract)
[25]贾东升.SRBSDV和RRSV在介体飞虱体内的侵染机理.福州:福建农林大学,2013. Jia D S.Infection mechanisms of SRBSDV and RRSV in vector planthoppers.Fuzhou:Fujian Agriculture and Forestry University,2013.(in Chinese with English abstract)
[26]Chen Q,Chen H,Jia D,Mao Q,Xie L,Wei T. Nonstructural protein Pns12 of Rice dwarf virus is a principal regulator for viral replication and infection in its insect vector.Virus Res,2015,210:54-61.
[27]Wei T,Shimizu T,Haqiwara K,Kikuchi A,Moriyasu Y, Suzuki N,Chen H,Omura T.Pns12 protein of Rice dwarf virus is essential for formation of viroplasms and nucleation of viral-assembly complexes.J Gen Virol, 2006,87(2):429-438.
[28]Isogai M,Uyeda I,Lee B C.Detection and assignment of proteins encoded by Rice black streaked dwarf Fijivirus S7,S8,S9 and S10.J Gen Virol,1998,79:1487-1494.
[29]Zhang C,Liu Y,Liu L,Lou Z,Zhang H,Miao H,Hu X, Pang Y,Qiu B.Rice black streaked dwarf virus P9-1,an α-helical protein,self-interacts and forms viroplasms in vivo.J Gen Virol,2008,89:1770-1776.
[30]Akita F,Miyazaki N,Hibino H,Shimizu T.Viroplasm matrix protein Pns9 from Rice gall dwarf virus forms an octameric cylindrical structure.J Gen Virol,2011,92(9): 2214-2221.
[31]Zheng L,Chen H,Liu H,Xie L,Wei T.Assembly of viroplasms by viral nonstructural protein Pns9 is essential for persistent infection of Rice gall dwarf virus in its insect vector.Virus Res,2015,196:162-169.
Expression of Pns10 Protein of Rice ragged stunt virus in Rice Protoplasts
ZHANG Jie#,CHEN Xiaomin#,WU Jinhong,ZHU Chongqing,DING Xinlun,WU Zujian*
(Institute of Plant Virology,Fujian Agriculture and Forestry University/Key Laboratory of Plant Virology of Fujian Province,Fuzhou 350002,China;#These authors contributed equally to this work;*Corresponding author,E-mail:wuzujian@126.com)
【Objective】Pns10 of Rice ragged stunt virus(RRSV)forms viroplasm-like inclusion bodies which are essential for virus infection to vector insects.However,the expression pattern and function of Pns10 in rice remain unknown.【Method】Polyclonal antibody against Pns10 protein was prepared by immunizing rabbits with a bacterially expressed Pns10;the cellular distribution of Pns10 protein in rice protoplasts was observed with an immunofluorescence microscopy;the accumulation of Pns10 RNA in rice protoplasts infected by RRSV was quantified with real-time quantitative RT-PCR and that of the Pns10 protein was investigated using Western blot.【Result】Pns10 ORF was cloned into the Gateway prokaryotic expression vector pDEST17 and its expression was induced by IPTG.Polyclonal antiserum against the Pns10 was obtained and it can react with the Pns10 protein from the naturally RRSV-infected rice by Western blot detecting.Pns10 formed viroplasm-like inclusion bodies in protoplasts.The Pns10 RNA was first detected at 8 h post RRSV inoculation.The accumulation of Pns10 RNA peaked at 24 h post virus inoculation but began to decline thereafter.The Pns10 protein was first detected at 24 h post virus inoculation.A high level of Pns10 protein was maintained until 60 h post virus inoculation.【Conclusion】Antiserum against RRSV Pns10 protein was obtained.Pns10 was expressed and viroplasm-like inclusion bodies formed in rice protoplasts.In addition,the expression of Pns10 RNA was earlier than that of the Pns10 protein.
Rice ragged stunt virus;rice protoplast;Pns10 antibody;Pns10 RNA;Pns10 protein
Q786;S435.111.4+9
:A
:1001-7216-(2017)03-0232-06
2016-11-08;修改稿收到日期:2016-12-13。
高等学校博士学科点专项科研基金资助项目(20133515120004);国家自然科学基金资助项目(31301640);福建教育厅科技项目(JA13103)。
