犬β-防御素cBD103的原核表达和纯化
2017-05-18包银莉秦海斌宋珍华贺星亮高一龙
朱 骞,包银莉,秦海斌,宋珍华,贺星亮,温 海,高一龙
(1.公安部南京警犬研究所,警犬技术公安部重点实验室,江苏南京 210012;2.南京农业大学动物医学院,江苏南京 210095)
犬β-防御素cBD103的原核表达和纯化
朱 骞1,包银莉2,秦海斌1,宋珍华1,贺星亮1,温 海1,高一龙1
(1.公安部南京警犬研究所,警犬技术公安部重点实验室,江苏南京 210012;2.南京农业大学动物医学院,江苏南京 210095)
将犬β-防御素103(canine β-defensin 103,cBD103)基因亚克隆至原核表达载体pET-32a(+),构建重组表达质粒pET-cBD103,转化大肠埃希菌BL21感受态细胞,IPTG诱导表达后,利用Ni-NTA亲和层析纯化该蛋白,并用肠激酶酶切融合蛋白,SDS-PAGE鉴定表达产物和纯化产物。结果表明,质粒pET-cBD103经PCR及双酶切鉴定证明构建正确,大肠埃希菌中成功表达出目的蛋白,蛋白大小约为24 ku,以可溶性表达为主。经过纯化和酶切,得到大小8 ku的cBD103,与预期大小一致。该研究在大肠埃希菌中表达了目的蛋白,为下一步大规模制备cBD103奠定了基础。
犬β-防御素103;原核表达;纯化
皮肤黏膜上皮是机体与微生物直接接触的第一道屏障,可以通过与微生物细胞膜上的阴离子成分作用破坏细胞膜[1],从而隔离或杀灭所接触到的微生物。由于动物机体在激发体液免疫时存在一定的潜伏期,因此,动物机体主要依靠天然免疫机制来抵抗病原微生物的早期感染。黏膜上皮细胞可以产生并分泌抗病原微生物活性的物质,β-防御素(β-defensin,BD)就是其中重要的一类抗菌肽。对防御素的重组表达,国内外有很多相关的研究。Valor等在昆虫细胞中表达了人β-防御素1(human β-defensin 1,hBD-l)用以试验研究[2]。彭力等研究了人β-防御素2(human β-defensin 2,hBD-2)在大肠埃希菌[3-4]及人β-防御素3(human β-defensin 3,hBD-3)在大肠埃希菌中的表达[5],均表现出良好的生物活性。有研究将小鼠β-防御素3(mouse β-defensin 3,mBD-3)连接到真核载体pcDNA3.1,转染到MDCK细胞,成功表达出有活性的防御素[6]。目前关于犬β-防御素(canine β-defensin,cBD)的研究较少。通过基因组分析,并与其他哺乳动物的BD序列比对,显示cBD基因家族包含43个成员[7]。最近发现犬β-防御素1(canine β-defensin 1,cBD1)和犬β-防御素103(canine β-defensin 103,cBD103)在健康犬的皮肤有表达[8],而犬β-防御素122(canine β-defensin 122,cBD122)和犬β-防御素127(canine β-defensin 127,cBD127)仅仅在一些皮肤样品能检测到。从犬睾丸组织克隆了犬β-防御素1(canine β-defensin 1,cBD-1), 犬β-防御素2(canine β-defensin 2,cBD-2), 犬β-防御素3(canine β-defensin 3,cBD-3)的全基因序列,并合成了成熟肽。cBD显示了广谱抗菌活性,对革兰阳性菌(单核细胞增生利斯特菌和金黄色葡萄球菌,最小抑菌浓度(minimal inhibitory concentration,MIC)分别为6 μg/mL和100 μg/mL),革兰阴性菌(大肠埃希菌、肺炎克雷伯菌和淋球菌,MIC分别为20 μg/mL~50 μg/mL、20 μg/mL和50 μg/mL)均有作用,原位杂交显示3种cBD在犬睾丸高度表达,但有其组织特异性[9]。说明cBD-1,cBD-2,cBD-3在公犬的生殖系统天然免疫中起着重要的作用。除此之外,关于其他的cBD几乎没有报道。
根据已经发现的4种cBD,用real-time PCR检测其在犬呼吸道mRNA表达水平,结果cBD1、cBD103和犬β防御素108(canine β-defensin 108,cBD108)在犬气管上皮细胞有表达。体外培养原代气管上皮细胞,用脂多糖处理或者感染犬呼吸道冠状病毒,导致cBD103和cBD108表达减少,而感染犬副流感病毒导致cBD1和cBD108表达减少。cBD103在犬上呼吸道表达量最高,体外证明对波氏杆菌有较强的抑制作用。说明cBD103可能对犬上呼吸道感染起到治疗作用[10]。Santoro D等体外研究发现,在几种防御素里,cBD103抗葡萄球菌、绿脓杆菌和酵母菌效果最好[11]。
为此,本研究旨在应用原核系统表达cBD103蛋白,为下一步大规模制备cBD103蛋白奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒 大肠埃希菌(Escherichiacoli)DH5α、BL21、pET-32a(+)载体由警犬技术公安部重点实验室保存。
1.1.2 主要试剂 反转录酶(AMV)、RNA酶抑制剂、rTaq、EcoRⅠ、XhoⅠ、DNA Marker DL5000、T4 DNA连接酶、质粒抽提试剂盒、DNA回收试剂盒为Takara公司产品;肠激酶为Sigma公司产品;氨苄青霉素、IPTG、X-gal均为北京索莱宝(Solarbio)科技有限公司产品;其他试剂均为国产或进口分析纯。
1.2 方法
1.2.1 目的基因合成 参照GenBank公布的cBD103基因(序列号NM-001129980.1)编码序列,根据大肠埃希菌密码子偏好,由金斯瑞生物科技有限公司优化与合成,连接到PUC57载体。质粒送上海美吉生物医药科技有限公司测序,目的基因约204 bp。
1.2.2 引物的设计与合成 根据cBD103基因编码序列与表达载体pET-32a(+)酶切位点,在目的基因两端设计一对引物,在5'和3'端分别加上EcoRⅠ和XhoⅠ酶切位点,引物由大连宝生物工程有限公司合成。引物使用浓度为10 μmol/μL。 上游引物:5′-CCGGAATTCATGCGTATCTACTATCTG-3′; 下游引物:5′-CCGCTCGAGTTACTTTTTGCGGCGGCA-3′。
1.2.3 重组原核表达载体的构建及鉴定 将PUC-cBD103和原核表达载体pET-32a(+)分别用EcoRⅠ和XhoⅠ双酶切,产物经10 g/L琼脂糖电泳后用胶回收试剂盒回收目的片段,T4 DNA连接酶连接,将连接产物转化大肠埃希菌DH5α感受态细胞,涂布于LB平板(含100 μg/mL氨苄青霉素),挑选菌落培养提质粒,用EcoRⅠ和XhoⅠ双酶切及PCR扩增鉴定阳性克隆。阳性质粒送上海美吉生物医药科技有限公司测序。
1.2.4 融合蛋白的诱导表达 将测序正确的重组表达质粒pET32a-cBD103转入大肠埃希菌表达菌株BL21感受态细胞中,并筛选阳性克隆,挑取单克隆菌株扩大培养至菌液OD600为0.6左右,加入终浓度1 mmol/L的IPTG,28℃诱导6 h。取样进行SDS-PAGE电泳。
1.2.5 纯化及酶切 根据Ni-NTA柱试剂盒提供的方法,将诱导后的菌液进行纯化。将纯化产物进行SDS-PAGE电泳检测。
肠激酶50μL酶切反应体系:20 μg融合蛋白于1U肠激酶于酶切缓冲液中,25℃孵育12 h,SDS-PAGE检测酶切效果。
2 结果
2.1 合成基因的PCR扩增结果
PUC-cBD103质粒PCR结果,可见大小为204 bp的目的条带,与预期大小相符(图1)。测序结果也与目的基因一致。

M.DNA标准DL 5 000;1.cBD103基因的PCR产物M.DNA Marker DL 5 000; 1.PCR products of cBD103
2.2 cBD103原核表达载体的鉴定
构建重组表达载体,经EcoRⅠ和XhoⅠ双酶切,可见大小为204 bp的目的条带(图2)。对重组质粒进行PCR鉴定,结果扩增出一条204 bp左右的条带(图3)。将重组质粒命名为pET-cBD103。
2.3 重组蛋白诱导表达
蛋白诱导表达SDS-PAGE电泳检测发现融合蛋白以可溶形式和包涵体两种形式存在。优化表达条件,将诱导温度降低到28℃,发现可溶性表达增多。将诱导表达的菌液处理后进行SDS-PAGE电泳,由图4可见,在24 ku处有一条明显的蛋白带。
2.4 重组蛋白的纯化和酶切
因可溶性目的蛋白中含有大量杂质,利用Ni柱,将获得的蛋白溶液进行亲和层析。PBS透析过夜后酶切。由图5可见,纯化后蛋白纯度明显增加,酶切后也出现与目的蛋白大小相同的条带。
3 讨论
目前,使用抗生素是治疗细菌感染的主要方法,但由于细菌对抗生素产生耐药性,其治疗效果越来越差。面对严峻的抗生素耐药性问题,人们不断研制新抗生素或通过改造原有抗生素来对付耐药性菌,然而,抗生素研制的速度远远不及耐药菌产生的速度,并且从本质上并没有超越原有抗生素的杀菌机制。防御素是生物体产生的一种阳离子小肽,分为α-防御素、β-防御素、θ-防御素等[12]。其中,β-防御素主要在皮肤、黏膜上皮等组织产生[13-14],是正常机体抵抗外界病原微生物入侵的第一道防线,可以替代抗生素而发挥更广谱的抗菌作用。

M.DNA标准DL 5 000;1~3.重组质粒酶切产物

M.DNA标准DL 5 000;1~4.重组质粒PCR产物
研究表明,β-防御素具有广谱抗菌活性,能有效杀灭革兰阴性菌和革兰阳性菌。通过检测hBD-1、hBD-2和hBD3对牙周病细菌伴放线杆菌、中间普氏菌的抗菌活性,发现hBD-1、hBD-2和hBD3对这些细菌均有抗菌活性,hBD3最低浓度1.25mg/mL可引发细 菌去极化,导致细菌死亡[15]。体内用线性聚乙烯亚胺将表达大鼠β-防御素2(rat β defensin 2,rBD-2)的质粒注射到肺脏,48 h之后用含铜绿假单胞菌的海藻酸盐胶珠感染大鼠,结果发现过度表达rBD-2组存活率明显增加,感染后3 d和7 d肺脏细菌载量下降,肺脏病理学变化较对照组轻微,多形核中性粒细胞浸润增加;感染后3 d,细胞因子蛋白表达显著提高,而在感染后7 d,其表达却戏剧性地下降。证明rBD-2能够有效预防肺脏铜绿假单胞菌感染[16]。用RNA干扰技术沉默羊β-防御素2(sheep β-defensin 2,sBD-2)和羊β-防御素3(sheep β-defensin 3,sBD-3),用铜绿假单胞菌感染羊,发现角膜细菌载量明显提高,多形核中性粒细胞浸润增加。表明sBD有抗铜绿假单胞菌感染的作用[17]。用pcDNA3.1(+)载体融合表达鼠β-防御素1(mouse β-defensin 1,mBD1)和mBD3,体内和体外均能够抑制A型流感病毒的复制[18]。
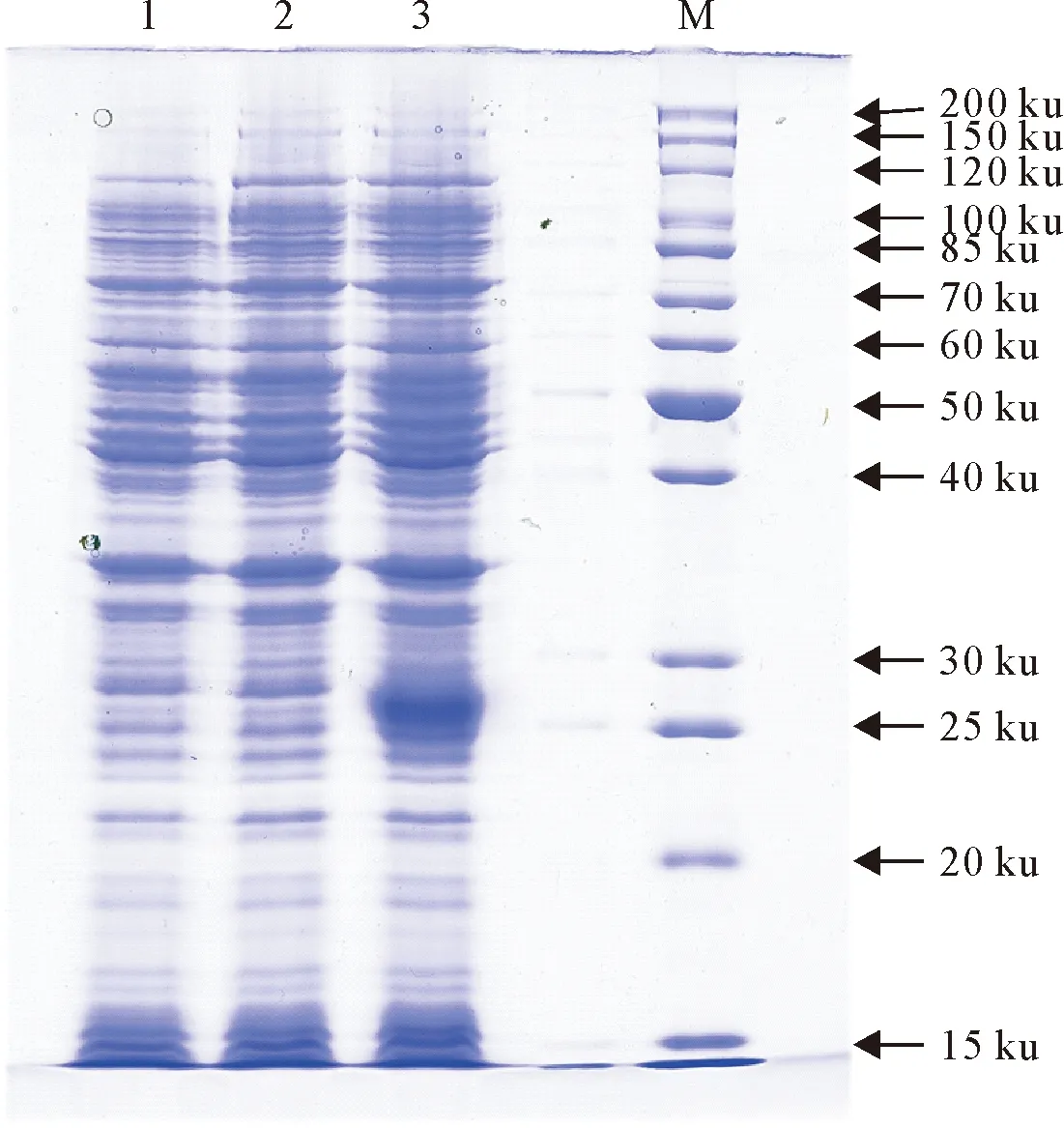
M.蛋白分子质量标准;1~2.未诱导重组菌表达产物;3.诱导表达蛋白

M.蛋白分子质量标准;1.上清;2~6、8.纯化蛋白;7.酶切产物
采用重组表达的方法可大量获得cBD103,以满足其抗菌机制研究及开发新型药物的需求,但由于cBD103具有抗菌活性,同时相对分子量较小,在细菌体内容易被降解,因此不宜用于原核直接表达。融合标签蛋白进行原核表达或在真核载体表达是目前解决问题的办法。本试验用原核表达系统成功表达了重组cBD103。重组蛋白经SDS-PAGE电泳检测,在24 ku处有特异性条带,为融合蛋白的目的条带。对蛋白表达条件优化,发现28℃诱导更利于可溶性表达,使蛋白的纯化过程更加简单。采用肠激酶特异性地切除标签蛋白后获得具有天然氨基酸序列的cBD103。
[1] Toke Q.Antimicrobial peptide:new candidates in the fightagainst bacterial infections[J].Biopolymers,2005,80:717-735.
[2] Valore E V,Park C H,Quayle A J,et al.Human beta-defensin-1:an antimicrobial peptide of urogenital tissues[J].J Clin Invest,1998,101(8):1633-1642.
[3] Xu Z,Peng L,Zhong Z,et al.High-level expression of a soluble functional antimicrobial peptide,human beta-defensin 2,inEscherichiacoli[J].Biotechnol Progress,2006,22(2):382-386
[4] Peng L,Xu Z,Fang X,et al.Preferential codons enhancing the expression level of human beta-defensin-2 in recombinantEscherichiacoli[J].Protein Peptide Let,2004,11(4):339-344.[5] Huang L,Xu Z,Zhong Z,et al.Enhanced expression and primary purification of soluble HBD3 fusion protein inEscherichiacoli[J].Appl Biochem Biotechnol,2007,142(2):139-147.
[6] Jiang Y,Wang Y,Kuang Y,et al.Expression of mouse beta-defensin-3 in MDCK cells and its anti-influenza-virus activity[J].Arch Virol,2009,154(4):639-647.
[7] Patil A A,Cai Y,Sang Y,et al.Cross-species analysis of the mammalian β-defensin gene family:presence of syntenic gene clusters and preferential expression in the male reproductive tract[J].Physiol Genomics,2005,23,5-17.
[8] Candille S I,Kaelin C B,Cattanach B M,et al.A-defensin mutation causes black coat color in domestic dogs[J].Science,2007,318,1418-1423.
[9] Sang Y M,Ortega T,Blecha F,et al.Molecular cloning and characterization of three β-defensins from canine testes[J].Infect Immun,2005,5:2611-2620.
[10] Erles K,Brownlie J.Expression of β-defensins in the canine respiratory tract and antimicrobial activity against Bordetella bronchiseptica[J].Vet Immunol Immunopathol,2009.doi:10.1016/j.vetimm.2009.10.025.
[11] Santoro D,Maddox C W.Canine antimicrobial peptides are effective against resistant bacteria and yeasts[J].Vet Dermatol,2014,25(1):35-e12
[12] 卢 顺,向 敏.哺乳动物防御素生物学研究进展[J].中国兽医杂志,2014,50(2):61-64.
[13] Valore E V,Park C H,Quayle A J,et al.Humanβ-defensin-l,an antimicrobial peptide of urogenital tissues[J].J Clin Invest,1998,101:1633-1642.
[14] Harder J,Bartels J,Chrisrophers E.A peptide antibiotic from human skin[J].Science,1997,387:861.
[15] Nuding S,Fellermann K,Wehkamp J,et al.A flow cytometric assay to monitor antimicrobial activity of defensins and cationic tissue extracts[J].J Microbiol Meth,2006,65(2):335-345.
[16] Hu Q,Zuo P,Shao B,et al.Administration of nonviral gene vector encoding rat beta-defensin-2 ameliorates chronicPseudomonasaeruginosalung infection in rats[J].J Gene Med,2010,12(3):276-286.
[17] Wu M,McClellan S A,Barrett R P,et al.Beta-defensins 2 and 3 together promote resistance toPseudomonasaeruginosakeratitis[J].J Immunol,2009,183(12):8054-8060.
[18] Li W,Feng Y,Kuang Y,et al.Construction of eukaryotic expression vector with mBD1-mBD3 fusion genes and exploring its activity against influenza A virus[J].Viruses,2014,6(3):1237-1252.
Prokaryotic Expression and Purification of Canine β-defensin 103
ZHU Qian1,BAO Yin-li2,QIN Hai-bin1,SONG zhen-hua1,HE Xing-liang1,WEN Hai1,Gao Yi-long1
(1.NanjingPolicedogResearchInstituteofMPS,PolicedogTechnologyKeyLaboratoryofMPS,Nanjing,Jiangsu,210012,China; 2.CollegeofVeterinaryMedicine,NanjingAgriculturalUniversity,Nanjing,Jiangsu,210095,China)
The canine β-defensin 103 (cBD103) gene was subcloned to pET-32a(+) vector,and the constructed recombinant plasmid pET-cBD103 was transformed to competentE.coliBL21 for expression under induction of IPTG.The expressed product was purified by nickel ion affinity chromatography and identified by SDS-PAGE.Results of both PCR and enzyme digestion analysis proved that recombinant pET-cBD103 was constructed correctly.The expressed protein,with a relative molecular mass of 24 ku,mainly existed in a soluble form.After purification and restriction enzyme digestion,a protein band about 8 ku was detected,and consistent with the purpose bands.The cBD103 protein was successfully expressed inE.coli,which laid a foundation for further preparation of cBD103 protein and clinical test.
canine β-defensin 103; prokanyotic expression;purification
2016-09-27
江苏省自然科学基金面上项目(BK2010099);公安部应用创新计划项目(2010YYCXNJJQ151)
朱 骞(1980-),女,江苏扬州人,硕士,主要从事动物分子生物学研究。
S852.42
A
1007-5038(2017)05-0026-04
