犬圆环病毒实时荧光定量PCR检测方法的建立
2017-05-18孙文超解长占赵冠宇曹慧慧张红云韦显凯韩继成温树波肖朋朋鲁会军金宁一
孙文超,解长占,赵冠宇,曹 亮,郑 敏,曹慧慧,张红云,韦显凯,韩继成,温树波,肖朋朋,靖 杰,张 萍,鲁会军,金宁一
(1.广西大学动物科技学院,广西南宁 53001;2.广西动物疫病预防控制中心,广西南宁 530001;3.军事医学科学院军事兽医研究所,吉林长春 130122;4.广西玉林市动物疫病预防控制中心,广西玉林 537000)
犬圆环病毒实时荧光定量PCR检测方法的建立
孙文超1,3,解长占3,赵冠宇3,曹 亮3,郑 敏2*,曹慧慧1,2,张红云4,韦显凯2,韩继成3,温树波3,肖朋朋3,靖 杰3,张 萍3,鲁会军3,金宁一3
(1.广西大学动物科技学院,广西南宁 53001;2.广西动物疫病预防控制中心,广西南宁 530001;3.军事医学科学院军事兽医研究所,吉林长春 130122;4.广西玉林市动物疫病预防控制中心,广西玉林 537000)
犬圆环病毒(DogCV)是圆环病毒科新发现的圆环病毒,旨在建立犬圆环病毒实时荧光定量PCR检测方法。试验用PCR方法克隆犬圆环病毒ORF2基因保守区域,构建标准阳性质粒pClon007-ORF2。以标准阳性质粒pClon007-ORF2为模板对荧光定量PCR反应体系进行优化。结果表明,所建立的方法Ct值与标准品在4.67×109copies/μL~4.67×103copies/μL范围内呈良好的线性关系,相关系数为0.998,斜率为-3.445。该方法检测灵敏度为4.67×101copies/μL。该方法对狂犬病病毒、犬细小病毒、犬瘟热病毒、犬副流感病毒、犬腺病毒2型等犬常见病原的检测均无交叉反应;所有稀释度标准品模板均在83.35℃出现窄的特异性熔解峰。临床样品检测表明,所建立的实时荧光定量PCR对犬圆环病毒的阳性检测率为12.50%(4/32)。
犬圆环病毒;SYBR GreenⅠ;实时荧光定量 PCR
犬圆环病毒(Dog circovirus,DogCV)于2012年美国首次报道[1],随后研究发现该病毒是犬坏死性血管炎和肉芽肿性淋巴结炎的病原体。病犬以呕吐、出血性腹泻等为主要症状[2-3]。犬圆环病毒是圆环病毒科圆环病毒属成员,为无囊膜的单股DNA病毒[4],基因组约为2 063 bp。该病毒具有2个主要的阅读框(ORF),分别编码复制酶Rep蛋白和衣壳Cap蛋白。
目前动物病毒流行病学调查应用最多的是普通PCR方法,但普通PCR存在无法对病毒核酸进行定量分析、灵敏性也较荧光定量PCR差,而诸如免疫组化、原位杂交等方法存在操作复杂、耗时长等缺点。实时荧光定量PCR (real-time PCR)技术不仅可以将样品中的病毒核酸进行定量分析,而且具有操作简单、重复性好等优点[5]。目前针对犬圆环病毒流行毒株的分离鉴定、遗传进化等研究较少。本文建立的DogCV real-time PCR 检测方法,为DogCV快速诊断、病毒持续性感染动态分析及防治效果评价等方面的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 病毒与细胞 犬圆环病毒;狂犬病病毒(Rabies virus,RV)、犬细小病毒(Canine parvovirus,CPV)、犬瘟热病毒(Canine distemper virus,CDV)、犬副流感病毒(Canine parainfluenza virus,CPIV)、犬腺病毒2型(Canine adenovirus type 2,CAV-2)均由军事兽医研究所病毒学与免疫学实验室保存。
1.1.2 样品采集 32份犬血清来自广西壮族自治区玉林市,由广西动物疫病预防控制中心采集,并在-80℃保存。
1.1.3 主要仪器与试剂 NANODROP2000分光光度计,ABI Prismr 7500型荧光定量PCR仪,SYBR Green I real-time PCR Master Mix购自普洛麦格公司;血液/组织/细胞基因组提取试剂盒购自天根生化科技(北京)有限公司;pClon007载体购自北京擎科新业生物有限公司。
1.2 方法
1.2.1 引物的设计与合成 根据GenBank DogCV JZ98/2014 (登录号:KT946839.1)基因序列,利用Primer5.0软件设计特异性的引物,针对ORF2基因的保守区域的引物ORF2F/ORF2R和real-time PCR引物P1/P2,引物由吉林省库美生物工程有限公司合成。
1.2.2 标准质粒的制备 提取DogCV基因组,通过PCR方法扩增保守区序列基因ORF2。目的基因纯化后克隆到pClon007载体,转化工程菌DH5α,经酶切鉴定正确阳性质粒,由吉林省库美生物有限公司进行测序,并命名为pClon007-ORF2。利用核酸蛋白检测核酸浓度和纯度。根据质粒浓度计算得到重组质粒拷贝为4.67×1010copies/μL。对重组质粒进行10的倍比稀释,取10-1~10-9个稀释度的重组质粒作为标准品模板。
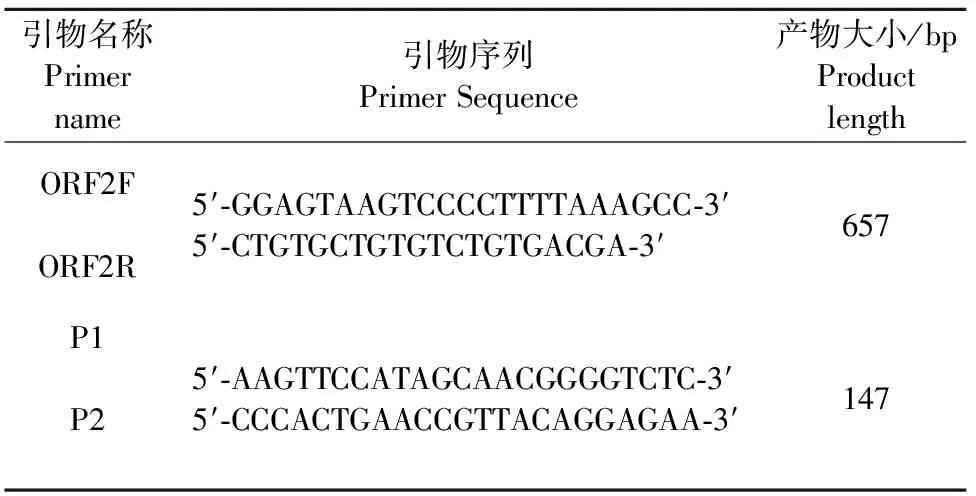
表1 Real-time PCR引物
1.2.3 实时荧光定量PCR方法的优化 根据稀释好的模板,分别对引物浓度、循环数和退火温度等进行优化,通过比较熔解曲线、Ct值等判定出最适合的引物浓度、退火温度等。
1.2.4 标准曲线的建立 将10倍梯度稀释的7个梯度(10-1~10-7)的标准质粒DNA为模板进行real-time PCR反应。选取不同稀释度模板的Ct值为横坐标,拷贝数的对数为纵坐标,建立标准曲线。
1.2.5 灵敏度试验 将标准质粒做10倍系列稀
释,以不同稀释度的标准质粒DNA为模板进行real-time PCR反应,以检测该方法能够检出标准质粒的最小拷贝数,同时设置阴性对照。
1.2.6 特异性试验 以狂犬病病毒(RV)、犬腺病毒2型(CAV-2)、犬瘟热病毒(CDV)、犬副流感病毒(CPIV)、犬细小病毒(CPV)等核酸为模板,进行real-time PCR反应分析其特异性。并设置阴性对照。
1.2.7 重复性试验 以5个梯度(4.67×108copies/μL~4.67×104copies/μL)的标准质粒为模板,进行real-time PCR反应。分别以标准质粒为模板进行组内和组间差异分析,分析试验的重复性,计算组间和组内的变异系数。
1.2.8 犬血清检测 采用优化的反应体系和条件进行临床样品的检测。根据DNA提取试剂盒说明书提取病毒基因组DNA,用本试验建立的real-time PCR方法和常规PCR方法对样品进行检测,比较两种方法的阳性检出率。
2 结果
2.1 目的基因的克隆及鉴定
利用ORF2F/ORF2R PCR扩增ORF2基因,克隆到pClon007载体构建重组质粒pClon007-ORF2。利用引物P1/P2对所构建的质粒进行PCR扩增,得到一条146 bp左右的DNA片段。将酶切pClon007-ORF2鉴定正确的质粒送吉林省库美生物工程有限公司测序,测序结果与目的片段序列完全一致。
2.2 Real- time PCR 反应条件的确定
通过对反应的引物物浓度、退火温度和循环数进行优化,最终确定real-time PCR反应总体积为20 μL,其中上、下游引物(10 pmol/L)各1 μL,2×SYBR Green荧光PCR反应液10 μL,质粒模板1 μL,补超纯水至20 μL。同时设阴性对照。反应程序为:95℃ 5 min;95℃ 15 s,60℃ 30 s,72℃ 30 s,扩增40个循环。
2.3 标准曲线的建立
将标准质粒pClon007-ORF2 10倍系列稀释后,进行real-time PCR扩增。结果显示,标准曲线Ct值和标准DNA浓度间呈现良好的线性关系(图2),斜率为-3.445,截距为41.861,相关系数为0.998。
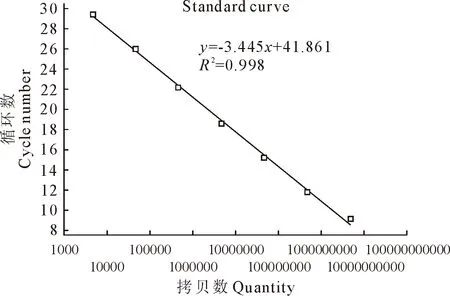
图2 标准质粒pClon007-ORF2的real-time PCR标准曲线
2.4 灵敏度试验
以10倍系列稀释的10个梯度的质粒DNA为模板,对标准品进行real-time PCR。结果显示,当PCR体系中含有4.67×101copies/ μL (PCR)标准质粒DNA时,仍能产生特异性扩增(图3)。阴性对照未出现特异性扩增。

图3 Real-time PCR的敏感性分析
2.5 特异性
以狂犬病病毒(RV)、犬细小病毒(CPV)、犬瘟热病毒(CDV)、犬副流感病毒(CPIV)、犬腺病毒2型(CAV-2)基因组为模板,用建立的real-time PCR进行扩增反应,验证方法的特异性。结果显示,均未出现特异性扩增(图4)。

图4 Real-time PCR的特异性分析
2.6 重复性检测
将不同稀释度的标准品pClon007-ORF2进行real-time PCR,用统计学软件分析扩增结果,表明建立的real-time PCR方法组间和组内都具有良好的重复性,组间变异系数在0.584%~1.14%之间,组内变异系数在0.338%~1.642%之间。阴性对照无特异性扩增。
2.7 熔解曲线分析
本实验利用优化的条件进行real-time PCR,标准品各浓度均在83.35℃处出现单一的特异性峰,波峰单一,无引物二聚体及未出现非特异性的扩增(图5)。
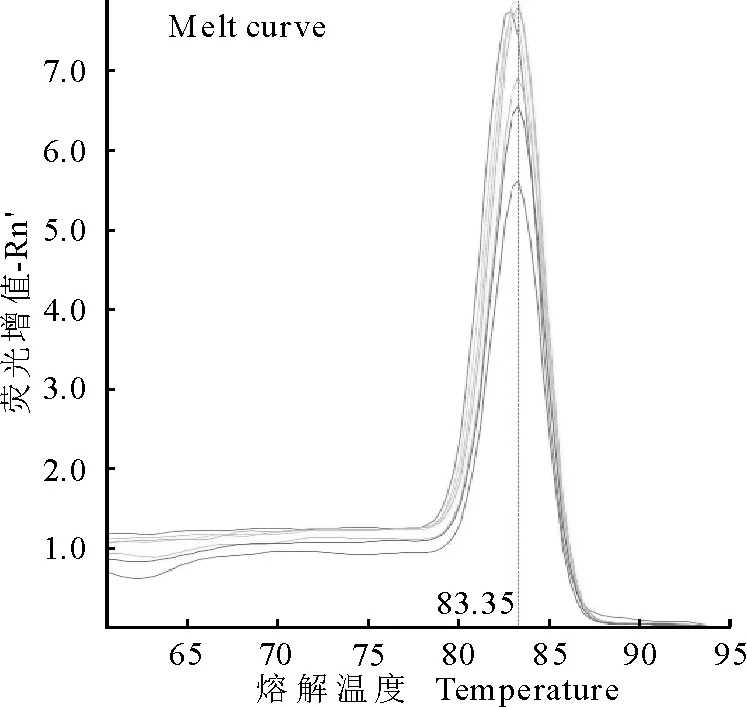
图5 Real-time PCR的熔解曲线
2.8 临床样品检测结果
应用建立的real-time PCR方法检测32份犬血清,共检测出阳性样品4份,阳性率约为12.50%,而本实验建立的常规PCR[6]鉴定出阳性样品3份,阳性率9.36%,说明所建立的SYBR GreenⅠ real-time PCR检测方法的灵敏度更高一些。
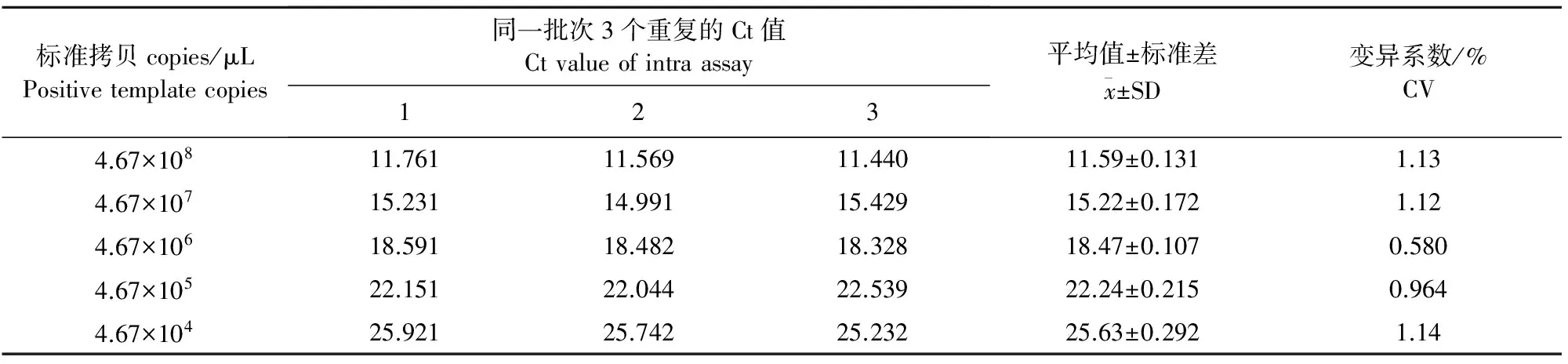
表2 实时荧光定量PCR检测DogCV的组间统计

表3 荧光定量PCR检测DogCV的组内统计

图6 Real-time PCR临床样品检测
3 讨论
实时荧光定量PCR方法作为一种新技术,在动物传染病中已被成功地应用猪圆环病毒2型、日本脑炎、禽流感等检测及流行病学调查[7]。本研究采用的是实时荧光定量PCR方法中的染料法,相比较探针法需要设计出序列特异的引物且价格低廉。引物二聚体和非特异性扩增可以通过熔解曲线排除干扰[8]。实时荧光定量方法与普通PCR相比较可以实时监控整个PCR过程,该方法自动程度高,比较直观的进行定量分析,同时也可以解决交叉污染等问题[9]。而普通PCR存在污染和假阳性问题,操作过程中因灵敏度不够造成漏检等问题[10]。
犬圆环病毒作为新发现的一种哺乳动物圆环病毒,被认为是犬的腹泻、呕吐和出血性肠炎的致病因子。台湾Hsu HS等对2012年-2014年间收集的207只腹泻犬和160只健康犬粪便样本进行检测,发现58只腹泻犬(28.0%)和19只健康犬(11.9%)检测出犬圆环病毒阳性[11],腹泻犬感染DogCV的阳性率要比健康犬阳性率高。
Linlin L等[2]建立的PCR方法发现腹泻犬与犬圆环病毒共感染率为68%(13/19),通过原位杂交技术和投射电镜技术检查4只狗的脾脏和淋巴结发现血管损伤和组织细胞炎症。ORF2基因为DogCV的衣壳蛋白,是主要的抗原基因,也是PCR鉴别诊断的首选基因。本研究针对GenBank DogCV JZ/98株ORF2基因序列设计引物,通过反应条件优化建立了DogCV的检测real-time PCR方法。结果表明方法的灵敏度高达到4.67×101copies/ μL,与狂犬病病毒、犬细小病毒、犬瘟热病毒、犬副流感病毒、犬腺病毒2型无交叉反应,标准曲线Ct值和标准DNA浓度间呈现良好的线性关系,斜率为-3.445,截距为41.861,相关系数为0.998,组间变异系数在0.584%~1.14%之间,组内变异系数在0.338%~1.642%之间。用本研究建立的DogCV的real-time PCR对32份犬血清进行DogCV检测,检出的阳性样品4份,其灵敏度高于普通PCR,可用于犬圆环病毒病快速诊断和流行病学调查。
[1] Kapoor A,Dubovi J,Henriquez-Rivera J A,et al.Complete genome sequence of the first canine circovirus[J].J Virol, 2012,86(12):7018.
[2] Li L,McGraw S,Zhu K,et al.Circovirus in tissues of dogs with vasculitis and hemorrhage[J].Emerg Infect Dis, 2013,19(4):534-541.
[3] Decaro N,Martella V,Desario C,et al.Genomic characterization of a circovirus associated with fatal hemorrhagic enteritis in dog,Italy[J].PLoS One, 2014,9(8):e105909.
[4] Lian H,Liu Y,Li N,et al.Novel circovirus from mink,China[J].Emerg Infect Dis, 2014,20(9):1548-1550.
[5] Thaiwong T,Wise A G,Maes RK,et al.Canine circovirus 1 (CaCV-1) and canine parvovirus 2 (CPV-2):Recurrent dual infections in a papillon breeding colony[J].Vet Pathol,2016,53(6):1204-1209.
[6] 孙文超,曹慧慧,郑 敏,等.犬圆环病毒全基因组克隆与序列分.[J].病毒学报,2016(04):429-435.
[7] Zhou H,Chen S,Qi Y,et al.Development and validation of a SYBR Green real-time PCR assay for rapid and quantitative detection of goose interferons and proinflammatory cytokines[J].Poult Sci,2015,94(10):2382 - 2387.
[8] Saragih S A,Takemoto S,Hisamoto Y,et al.Quantitative real-time PCR (qPCR)--based tool for detection and quantification ofCordycepsmilitarisin soil[J].J Invertebr Pathol, 2015,124:70-72.
[9] Perez L J,Diaz de Arce H,Tarradas J,et al.Development and validation of a novel SYBR Green real-time RT-PCR assay for the detection of classical swine fever virus evaluated on different real-time PCR platforms[J].J Virol Meth, 2011,174(1-2):53-59.
[10] Markota A,Seme K,Golle A,et al.SeptiFast real-time PCR for detection of bloodborne pathogens in patients with severe sepsis or septic shock[J].Coll Antropol, 2014,38(3):829-833.
[11] Hsu H S,Lin T H,Wu H Y,et al.High detection rate of dog circovirus in diarrheal dogs[J].BMC Vet Res,2016,12(1):116.
Development of a Real-time PCR Method for Detection of Dog Circovirus
SUN Wen-chao1,3,XIE Chang-zhan3,ZHAO Guang-yu3,CAO Liang3,ZHENG Min2,CAO Hui-hui1,2,ZHANG Hon-gyun4,WEI Xian-kai4,HAN Jic-heng3,WEN Shu-bo3,XIAO Peng-peng3,JIN Jie,ZHANG Ping3,LU Hui-jun3,JIN Ning-yi3
(1.CollegeofAnimalScienceandTechnology,GuangxiUniversity,Nanning,Guangxi,530004,China;2.GuangxiCenterforAnimalDiseaseControlandPrevention,Nanning,Guangxi,530001,China;3.InstituteofMilitaryVeterinaryMedicine,TheAcademyofMilitaryMedicalSciences,Changchun,Jilin,130122,China; 4.YulinCenterforAnimalDiseaseControlandPrevention,Yulin,Guangxi,537000,China)
Dog circovirus was found as a member of the family Circoviridae.This study was to establish a real-time fluorescence quantitative PCR method which can detect dog circovirus quickly and accurately in clinic.The conserved region of the ORF2 gene of dog circovirus was amplified by PCR and cloned into pClon007 vector.The pClon007-ORF2 plasmid DNA was used as template to optimize assay condition of developing a SYBR Green I real-time PCR for detection of dog circovirus.The standard curve produced a good linear relationship between Ct value and initial amounts of total DNA at a range of 4.67×109-4.67×103copies per microlitre,and the correlation coefficient and slope were 0.998 and -3.445 respectively.The sensitivity of this method was 4.67×101copies/μL.The specificity assay showed no amplification of RABV,CPV,CDV,CPIV,CAV-2.All standards are specific narrow melting peak at 83.35℃.The positive rates were 12.50%(4/32) of samples from Guangxi.
Dog circovirus; SYBR Green I; real-time PCR
2016-09-07
广西自然科学基金项目(2012GXNSFAA053073)
孙文超(1987-),男,山东泰安人,博士,主要从事分子病毒学研究。*通讯作者
S852.659.2
A
1007-5038(2017)05-0006-05
